多重耐药铜绿假单胞菌Ⅰ类整合酶基因研究*
孙慧清
(泰山医学院附属泰安医院,山东 泰安 271000)
铜绿假单胞菌(Pa)为条件致病菌,近年来已成为医院感染的主要病原菌之一[1]。其多重耐药已是临床抗感染化疗的难题。近年国内外学者从细菌中已检出Ⅰ型整合酶基因的菌株。Pa菌的Ⅰ型整合酶基因(intⅠ1)国内已有报道[2,3]。该研究探讨临床分离的MRPA耐药性及Ⅰ类整合酶基因存在状况及特点,为临床合理应用抗生素治疗Pa感染性疾病提供参考。
1 材料与方法
1.1菌株来源 68株MRPA来自我院2006年1月—2007年5月临床各类标本,这些菌株主要来自重症监护病房。
1.2菌株鉴定及药敏试验 全部菌株使用法国梅里埃ATB细菌鉴定仪鉴定菌种。采用K—B纸片扩散法和微量稀释法测定对庆大霉素(GEN)、亚胺培南(IMP)、哌拉西林(PIP)、头孢吡肟(FEP)、头孢他啶(CAZ)、美罗培南(MEM)、氨曲南(ATM)、阿米卡星(AK)、左氧氟沙星(LEV)、奈替米星(NET)、头孢曲松(CRO)、环丙沙星(CIP)、头孢哌酮/舒巴坦(SCF)、哌拉西林/他唑巴坦(TZP)、头孢哌酮(CFP)、妥布霉素(TOB)等16种抗生素进行药物敏感性检测,并根据美国临床实验室标准化委员会(NCCLS)2004年版要求进行抗菌药物敏感性判断。质控菌株:铜绿假单胞菌ATCC27853购于山东省临床检验中心。如果亚胺培南、环丙沙星、头孢他啶或头孢吡肟或氨曲南、奈替米星等4种药物达到3种或以上耐药就为多重耐药株[6]。
1.3Ⅰ类整合酶基因检测 引物参照[4]用PCR法,采用蛋白酶K消化法提取细菌DNA。基因扩增引物、TaqDNA酶和dNTPs由大连宝生物工程有限公司提供。PCR扩增引物序列见表1。
1.4PCR扩增 PCR体系(50 μl):10×缓冲液5 μl,dNTPs mixture(2.5 mmol/L) 4 μl,引物(25 μmol/L)1 μl, 模板各1 μl, Taq酶0.5 μl 。反应条件:93℃预变性2 min, 94℃变性60 s, 55℃退火60 s, 72℃延伸60 s,重复35个循环,最后一个72℃延长至5 min。
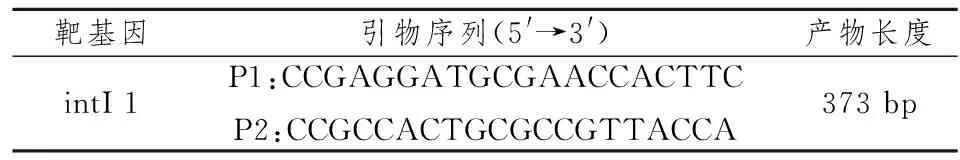
表1 PCR扩增引物序列
2 结 果
2.1抗菌药物敏感性试验结果 68株MRPA对16种抗菌药物的敏感性,见表2。
2.21型整合酶基因检测结果 68株MRPA菌株intI 1基因均阳性,阳性率100%。intI 1 PCR产物电泳图,见图1 。
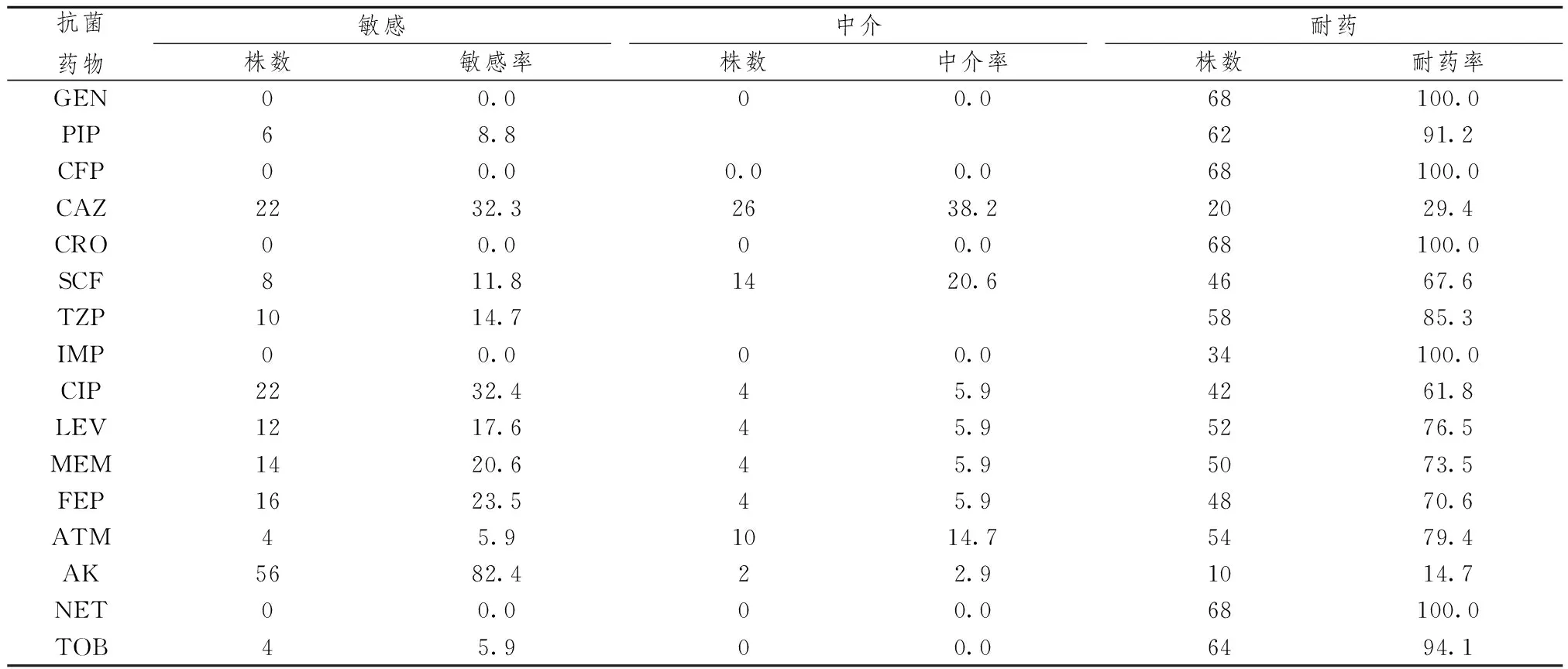
表2 68株MDRPA对16种抗菌药物的药敏率(%)
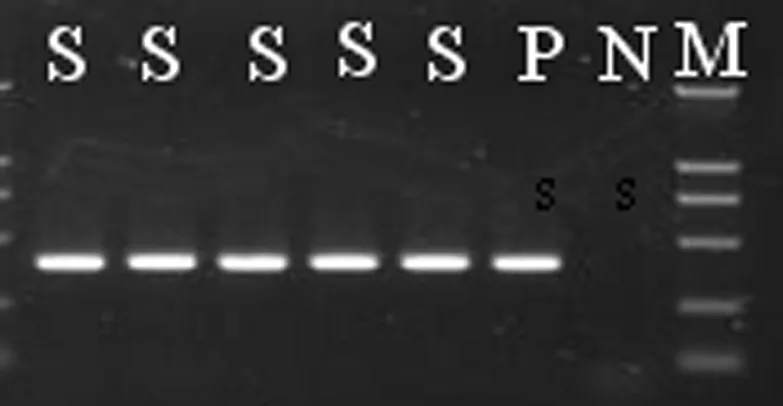
图1 intI 1基因PCR电泳图
3 讨 论
铜绿假单胞菌广泛分布于自然界,是医院感染最常见的革兰阴性杆菌之一,在临床的抗感染治疗过程中,容易对临床常用的抗生素产生耐药性,且耐药机制复杂。Ⅰ型整合子是造成Pa耐药传播的重要原因[5]。整合子是一种基因片段,具有位点特异性重组功能的基因决定子,能识别并俘获移动性基因盒,基因盒是整合子上所携带的基因片段,常携带耐药基因。整合子对耐药基因的捕获和扩散导致了临床上多重耐药菌株进化。在整合子介导的耐药机制中,Ⅰ类整合子起着非常重要的作用。本研究68株MRPA中, intI 1基因均阳性,阳性率达100%。表明多重耐药铜绿假单胞菌携带Ⅰ类整合酶基因阳性率很高。68株MRPA对阿米卡星和头孢他啶的耐药率分别为14.7%和29.4%,对其他抗菌药物耐药率分别在61.8%~100%之间,呈高比例耐药。随着研究的深入发现没有接触过抗生素的病原菌也会出现对抗生素的抗性,直到Hall等[6]发现了整合子。整合子是一个与耐药基因水平传播有关的新的可移动基因元件,整合子在细菌耐药性传播中起非常重要的作用,其中Ⅰ类整合子是造成铜绿假单胞菌耐药传播的重要原因[7],一旦细菌对新抗生素产生抗性基因,这些抗性基因就能够通过整合子的传递,形成对新抗生素的普遍抗性[8]。因此应合理使用抗生素,延缓细菌耐药性的产生是我们今后关注的重点。
参考文献:
.[1] 徐延模,杨薇,赵和平.6543例住院患者医院感染的临床调查分析[J].中华医院感染学杂志,2002,12(1):27-28.
[2] 付建荣,刘 群. 磺胺耐药基因、Ⅰ类整合酶基因研究[J].中华医院感染学杂志,2006,16(8):844-845.
[3] 周月清,陆开来.鲍氏不动杆菌耐消毒剂-磺胺基因、Ⅰ类整合酶基因及氨基糖苷类修饰酶基因研究[J].中华医院感染学杂志,2005,15(7):728-731.
[4] 王继东,钱小毛,都敏.大肠埃希菌连续分离株耐药性与三类整合酶基因的研究[J]. 中华医院感染学杂志,2006,6(6):520-522.
[5] Rowe-Maguns DA, Guerout AM, Mazel D. Bacterrial resistance evolution by recruitment of super-integron gene cassettes[J]. Mol microbial,2002, 43(6): 1657-1669.
[6] HallRM, Collis CM. Antibiotic resistance in gram-negtive bacteria:the role of gene cassettes and integrons.DrugResist[J].Updates, 1998,1(6): 109-119.
[7] Rowe-Magnus DA,Mazel D, The role of integrons in antibiotic risistance gene capture[J]. Int J Med Microbiol, 2002,292(2):115-125.
[8] 许红涛 陈东科 张秀珍. 多重耐药铜绿假单孢菌中Ⅰ类整合子的研究[J].中华检验医学杂志, 2005,28(7):721-723.

