SYBR Green I荧光定量 PCR鉴定简单异尖线虫方法的建立
龚艳清 郑洋妹 陈信忠
(1.厦门出入境检验检疫局 福建厦门 361026;2.福建农林大学动物科学学院)
1 前言
异尖线虫属于蛔目 (Ascaridida)异尖科 (Anisakidae),主要包括 4个属的线虫:即异尖线虫属(Anisakis)、伪地新线虫属 (Pseudoterranova)、对盲囊线虫属 (Contracaecum)和宫脂线虫属 (Hysterothylacium)。简单异尖线虫是我国海鱼异尖线虫寄生的优势种,孙世正[1]的调查显示南海和渤海鱼类简单异尖线虫的感染都相当高,其中南海 88个鱼种中检出率为 60.2%,渤海 20个鱼种中检出率为 55%;马宏伟等[2]对渤海鱼类异尖科线虫幼虫感染的专项调查显示简单异尖线虫幼虫的检出率为 63.4%;张莉[3]对渤海鱼类感染简单异尖线虫的调查显示其幼虫的检出率为 53.1%。
目前对异尖线虫幼虫的鉴定主要依靠形态学观察和血清免疫学方法。由于异尖线虫种类多,寄生于人体和鱼类的幼虫虫体细小,很多种间形态差异不明显,因此,依据传统的解剖形态学观察很难鉴别虫种。血清学方法包括皮内试验、间接血凝试验、荧光抗体试验以及酶联免疫吸附试验 (EL ISA)等。异尖线虫病与其他寄生虫病一样,抗原的提纯很难且易变性失活,相近种间的交叉反应很难消除,特异性和敏感性较差,因此免疫学方法还需要进一步的研究。近年来国内外学者应用 PCR方法对多种异尖线虫幼虫进行检测和鉴定,取得良好效果,但电泳时所用的核酸染料溴化乙锭 (EB)是强致癌性物质,对人体健康有很大的危害。SYBR Green I是一种结合于双链 DNA小沟中的结合染料,与双链 DNA结合后,其荧光大大增强,且其荧光强度的增加与双链 DNA的数量成正比。利用该特点建立的 SYBR Green I实时荧光定量 PCR技术已成为动物病原检测的重要方法,它成本低,不需设计探针,具有操作简便、结果直观、敏感性高、特异性强、重复性好等优点,目前已用于细菌[4]、病毒[5]、寄生虫[6]的检测,但未见用该方法检测异尖线虫的报道。本文应用 SYBR Green I实时荧光定量 PCR技术,对我国沿海海鱼中常见的简单异尖线虫幼虫进行研究并建立了快速鉴定方法。
2 材料与方法
2.1 材料
2.1.1 虫体来源
简单异尖线虫 (A.sim plex s.str)及其 ITS重组质粒 (AS-ITS-pG M)、典型异尖线虫 (A.typica)、针蛔线虫 (R.trichiuri)、对盲囊线虫 (Contracaccum sp.)由本实验室保存。
2.1.2 主要试剂和仪器
总 DNA抽提试剂盒:购自上海 Sangon生物工程有限公司;Taq DNA聚合酶、dNTP:购自 Promega公司;SYBR Green I PCR反应混合液:ROCHE公司产品;引物:由上海生物工程有限公司合成;荧光定量 PCR仪 7300型:美国 AB I公司。
2.1.3 引物设计和合成
根据简单异尖线虫 ITS-2保守序列设计特异性引物,AS-F:5,-GAG GGT CGA ATT ACG GTG AA-3,;AS-R:5’-AAC CGC TCG TCA TAT TGT CC -3,,预计扩增简单异尖线虫片段为114bp。
2.2 方法
2.2.1 线虫总 DNA的提取
取保存在 75%酒精中的单条虫体用蒸馏水反复冲洗后,研碎,DNA提取按 DNA抽提试剂盒说明操作。
2.2.2 普通 PCR
采用 50μL反应体系。在 PCR反应管中加入DNA模板 5μL、10×Tag酶缓冲液 5μL、25 mmol/L MgCl2 5μL、2.5mmol/L dNTP 4μL、20μmol/L 引物AS-F/AS-R各 1μL,5U Tag酶 0.5μL,加 DEPC处理水至 50μL。低速离心,使混合物集中在反应管的底部,然后将反应管置于 PCR扩增仪中。扩增条件为:先 95℃预变性 5 min,然后 95℃变性 30 s、56℃退火 30 s、72℃延伸 30s,扩增 30个循环 ,最后72℃ 10 min,4℃保存。
2.2.3 序列的分析与比较
将 PCR产物送至上海生物工程有限公司进行测序,并根据 Genbank/NCB I数据库,用 BLAST软件对扩增出的异尖线虫的基因序列与基因库相应的基因序列进行同源性比较。
2.2.4 SYBR Green I PCR检测
采用 20μL反应体系。在 PCR反应管中加入DNA模板 2μL、SYBR Green I PCR反应混合液10μL,引物 AS-F/AS-R各 0.3μL,加灭菌双蒸水至 20μL。低速离心,使混合物集中在反应管的底部,然后将反应管置于荧光定量 PCR仪中。反应条件为:先 50℃ 2 min,95℃ 10 min;然后 95℃ 15 s,60℃1 min,40个循环。为了分析 SYBR Green I PCR扩增特异性,应对扩增产物进行熔解曲线分析 ,条件为 :95℃15 s,60℃30 s,95℃15 s。
2.2.5 引物浓度的优化
将合成的引物稀释成 20μmol/L、10μmol/L、5μmol/L和 1μmol/L 4个稀释度 ,然后按 2.2.4的方法进行 SYBR Green I PCR反应。
2.2.6 灵敏度试验及标准曲线的建立
以 10倍倍比稀释后的AS-ITS-pG M为模板,按 2.2.4的方法分别进行实时荧光定量测定,再利用随机软件进行分析,建立标准曲线。
2.2.7 SYBR Green I实时荧光定量 PCR特异性试验
用建立起来的 SYBR Green I实时荧光定量PCR对典型异尖线虫、针蛔线虫、对盲囊线虫和简单异尖线虫进行扩增,同时设立阴性对照,观察该反应的特异性。虽异尖线虫还包括 A.physeteris,A.ziphidarum等 7个种,但在台湾海峡的水产品中笔者只检测和收集到了典型异尖线虫、针蛔线虫、对盲囊线虫和简单异尖线虫这 4个种。
2.2.8 重复性与稳定性检测
为验证荧光定量 PCR检测结果的重复性与稳定性,对阳性标准品进行重复试验。
2.2.9 样品鉴定
取 7份经 PCR-RFLP鉴定为简单异尖线虫的样品,用本研究建立的 SYBR Green I PCR法进行鉴定。
3 结果与分析
3.1 普通 PCR结果
如图 1所示,用AS-F/AS-R引物扩增简单异尖线虫核酸,电泳后在 114bp处有一条明亮的条带,与预计大小一致。

图 1 普通 PCR电泳结果
3.2 扩增产物序列比较
所测序列与基因库中所列的 Anisakis simplex DNA序列均有 99%以上的同源性。
3.3 SYBR Green I实时荧光定量 PCR引物浓度的优化结果
从图 2分析,简单异尖线虫的引物浓度为20μmol/L时,Ct值均较小,荧光阈值高,扩增曲线较为理想,因此将 20μmol/L引物浓度选择为最佳工作浓度。
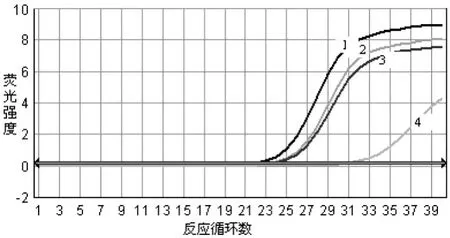
图 2 引物浓度优化
3.4 灵敏度试验和标准曲线
3.4.1 灵敏度试验
由图 3可知,简单异尖线虫 SYBR Green I实时荧光定量 PCR最低检出量为 101拷贝 /μL的阳性模板。

图 3 灵敏性试验结果
3.4.2 标准曲线
以稀释后的标准品为模板进行定量 PCR反应,简单异尖线虫在 106拷贝 /μL~102拷贝 /μL范围内有较好的线性关系,浓度过高或过低都会对曲线的形成造成误差。从电脑自动生成的简单异尖线虫的 SYBR Green I PCR标准曲线 (见图 4)可知,其斜率为 -3.521,截距为 5.596,相关系数 R2=0.999,从而得出模板浓度 (x)与循环阈值 (Ct)之间的线性关系曲线公式为:Ct=-3.521 lgx+5.596;从仪器读取待测样品的 Ct值,代入公式就可以计算出其初始浓度。
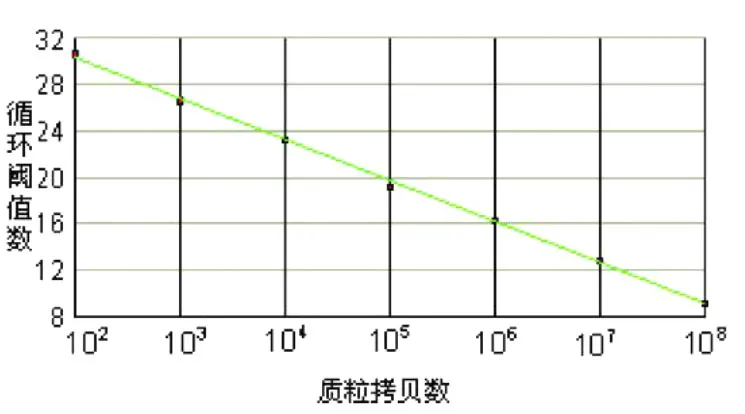
图 4 荧光定量 PCR标准曲线
3.5 熔解曲线分析
熔解曲线峰值的一致性,检测产物的特异度,是结果是否准确可信的重要参考指标。从图 5的熔解曲线图可以看出,各样本的峰值基本一致,简单异尖线虫的均为 76.8℃左右,未见杂峰信号出现,说明 PCR参数选择适当,产物特异性较好,非特异产物对结果影响较小,从而为定量打下基础。
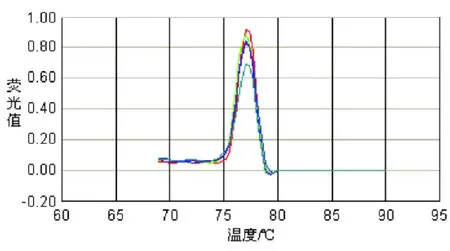
图 5 PCR扩增产物的熔解曲线
3.6 实时荧光定量 PCR重复性与稳定性试验
以稀释后的 AS-ITS-pG M,20μL体系在同样反应条件下每个稀释度连续 3次进行 SYBR Green I荧光 PCR,结果见图 6。图 6显示每次检测之间的误差不到 1个循环,扩增效率稳定,说明本试验建立的简单异尖线虫 SYBR Green I PCR方法具有较高的可重复性,可保证不同样品间检测结果的可靠性和稳定性。

图 6 重复性试验结果
3.7 特异性试验结果
从图 7可以看出,用 SYBR Green I PCR鉴定简单异尖线虫的特异性,结果只与简单异尖线虫反应,与典型异尖线虫、针蛔线虫、对盲囊线虫无交叉反应,空白对照孔无荧光响应,表明本方法具有良好的检测特异性。
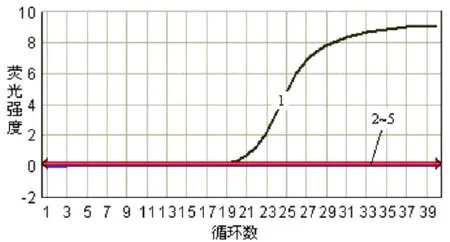
图 7 特异性试验扩增曲线图
3.8 样品鉴定
对 7份从不同鱼种经 PCR-RFLP鉴定为简单异尖线虫的样品进行鉴定,阳性对照为 106拷贝/μL的简单异尖线虫阳性标准品,阴性对照为鸡的肌肉组织核酸提取物。结果 (见图 8)显示样品 1~7均为阳性,与 PCR-RFLP检测结果一致。
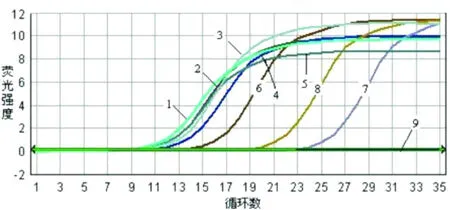
图 8 简单异尖线虫样品鉴定结果
4 讨论
由于异尖线虫病在全球已呈扩散趋势,且简单异尖线虫为我国常见异尖线虫的优势种,因此,建立一种快速鉴别鉴定方法非常必要。本研究选取简单异尖线虫保守的 ITS-2序列设计一对引物,建立的简单异尖线虫 SYBR Green I实时荧光定量PCR快速鉴定方法能够用于简单异尖线虫的鉴别检测,并且与常规 PCR方法相比,具有操作简便、质量控制好、特异性更高、定量更准确、重复性更好;无需 PCR后处理,反应全程闭管操作,大大降低了交叉污染的危险性等优点。此方法对于简单异尖线虫的监控检测有着重要的实用价值,适于实验室对大量样品的检测和分子流行病学调查以及分子生物学等方面的研究。
[1] 孙世正.南海、渤海鱼类简单异尖线虫幼虫感染的调查[J].中国寄生虫学与寄生虫病杂志,1996,14(3):173~176.
[2] 马宏伟,姜泰京,全福实,等.渤海鱼类和头足类异尖科线虫幼虫感染情况调查[J].延边大学医学学报,2001,24(2):105~114.
[3] 张莉.渤海鱼类简单异尖线虫幼虫感染的初步调查[J].沧州师范专科学校学报,2002,18(3):41~47.
[4] 任月,袁杰利,卢行安,等.粪便中肠球菌 SYBR GreenI荧光定量 PCR检测方法的建立[J].中国微生态学杂志,2007,19(6):499~501.
[5] 李明凤,魏战勇,王学斌,等.猪细小病毒 SYBR Green I实时定量 PCR检测方法的建立[J].浙江农业学报,2009,21(3):220~224.
[6] 李安平,黄克和,王权,等.微小隐孢子虫和安氏隐孢子虫SYBR Green real time PCR检测方法的建立[J].中国兽医科学,2009,39(06):510~515.

