9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮的合成与表征
王翔,杨绪红
(1.凯里学院环境与生命科学学院,贵州 凯里556000;2.咸宁学院化学与生命科学学院,湖北 咸宁437100)
9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮的合成与表征
王翔1,杨绪红2
(1.凯里学院环境与生命科学学院,贵州 凯里556000;2.咸宁学院化学与生命科学学院,湖北 咸宁437100)
在优化条件下,用NaH、n-BuLi、THF、芴、溴、二溴代烃、二酮为原料,通过溴代反应合成了新型的含芴发光材料前体9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮(DBBFOD);产物的收率为56%,纯度>99%,其结构经1H NMR、13C NMR、MS和元素分析确证.
芴;9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮;发光材料中间体;取代反应
自1996年Pei等[1]将聚芴应用于电致发光领域以来,聚芴及其衍生物由于具有较高的光致发光效率,且易于进行结构修饰,从而受到材料化学家的广泛关注[2].聚芴的前体芴类化合物具有刚性平面结构,宽的能隙、高的发光效率和结构易于修饰等特点.特别是β-二酮化合物,是一类重要的有机合成中间体,其分子内酮式-烯醇式之间的异构化转变赋予其许多独特的光化学和配位化学性质;同时,也是一类最典型的金属螯合剂之一,与芴基结合后可以增强分子的电子传输能力,与稀土在发光和激光领域具有潜在的应用价值[3].本文中设计在芴的9-位与稀土元素及过渡金属配位后将会改善配合物的发光性能,调节峰位,引入烷基的基础上再引入β-二酮,以期用于合成含金属配合物发光材料的前体9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮(合成路线如图1所示),其结构经1H NMR、13C NMR、MS和元素分析确证.
1 实验部分
1.1 试剂与仪器 仪器:核磁共振氢谱(1H NMR)用Bruker AM-300型300MHz核磁共振仪(Bruker公司,瑞士)测定,样品以氘代氯仿(CDCl3)为溶剂,四甲基硅烷(TMS:(CH3)4Si)作内标;核磁共振碳谱(13C NMR)用Bruck AM-300(75.5MHz)型核磁共振仪测定,样品以CDCl3为溶剂,TMS作内标;质谱(MS)用 HP-5989A型质谱仪(惠普公司,美国)测定;高分辨质谱(HRMS)用Finnigan MAT 8430型质谱仪(Thermo Fisher公司,美国)测定;循环水式真空泵SHZ-D(Ⅲ)型(巩义市英峪予华仪器厂,中国);旋转蒸发仪Büchi Rotavapor R-200(德国);磁力搅拌器 Heidilph MR 3001(德国);Vario EⅢ元素分析仪(美国);硅胶(200~300目).

图1 目标化合物合成路线
试剂:芴,1,4-二溴代丁烷,正丁醇,液溴,乙酰丙酮,正丁基锂(1.6mol/L),氢化钠(60%),甲苯、二氯甲烷,石油醚,四氢呋喃(THF),乙醚,无水硫酸钠,氯化铵,亚硫酸钠,浓盐酸等,溶剂均纯化处理后使用[4],其余试剂为市售分析纯直接用于反应.
1.2 实验方法
1.2.1 中间体的合成
a:9-正丁基-9-H-芴(1)的合成 合成方法参照文献[5-6],合成9-正丁基-9-H-芴无色液体14.1g,产率93%.1H NMR(CDCl3,300MHz,)δ:7.67(d,J=1.8Hz,1H),7.64(s,1H),7.42(d,J=0.9 Hz,1H),7.40(s,1H),7.28~7.17(m,4H),3.87(t,J=5.7Hz,1H),1.94~1.87(m,2H),1.20~1.04(m,4H),0.76~0.70(m,3H);13C NMR (CDCl3,75.5MHz)δ:147.76,141.30,126.96,124.47,119.93,47.64,32.97,27.98,23.20,14.08;MS-EIm/z(%):222(M+,32.00),166(20.22),165(100.00).
b:2,7-二溴-9-正丁基-9-H-芴(2)的合成 合成方法参照文献[7].把2g(9mmol)化合物(1)溶于15 mL二氯甲烷并置入用锡箔纸包好的50mL两口烧瓶中,氩气保护,0℃下缓慢加入0.9mL(22.5 mmol)的液溴,恒温反应2h.反应完毕,把反应液倒入装有5mL饱和亚硫酸钠的50mL烧杯中,除去未反应的液溴,用二氯甲烷萃取,无水硫酸钠干燥、浓缩,粗产物先用纯石油醚洗去杂质后改用二氯甲烷柱层析,得到白色固体3.1g,收率90%.1H NMR(CDCl3,300MHz)δ:7.58(d,J=0.9Hz,2H),7.48(s,1H),7.45(d,J=1.8Hz,2H),7.42(d,J=1.2Hz,2H),3.87(t,J=6.3Hz,1H),1.99~1.89(m,2H),1.10~1.05(m,2H),0.81(t,J=7.2Hz,3H);13C NMR(CDCl3,75 MHz)δ:149.33,139.13,130.27,127.69,121.20(d,J=2.6Hz),47.53,32.50,27.65,22.97,13.95;MS-EIm/z(%):378(M+,49.21),163(52.25),220(100.00);HRMS-EI(m/z):calcd.for C17H16Br2,377.961 9;found,377.961 3.c:2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴(3)的合成 在优化条件下合成了2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴.其反应步骤为:在氩气保护下,依次将化合物(2)2.09g(6.03mmol),1,4-二溴丁烷7.05mL(60.3mmol),30%的氢氧化钠溶液20mL和季铵盐(C4H9)4NBr(TABA)0.2g(0.6mmol)加入50mL的单口烧瓶中,80℃下反应24h.待反应完全后,浓盐酸调至中性,二氯甲烷(50mL×30)萃取,干燥浓缩.二氯甲烷/石油醚=1/4洗脱剂柱层析分离得到白色固体2.49g,收率81%,mp:90~91℃.1H NMR(CDCl3,300MHz)δ:7.54(d,J=1.2Hz,1H),7.51(d,J=1.2Hz,1H),7.47(d,J=2.1Hz 2H),7.45(d,J=1.8Hz,2H),3.16(t,J=7.1Hz,2H),1.98~1.90(m,4H),1.65~1.60 (m,2H),1.12~1.05 (m,2H),0.75~1.53(m,7H);13C NMR (CDCl3,75 MHz)δ:152.02,139.10,130.44,121.64,121.29,55.45,39.97,39.23,32.93,25.81,22.93,22.49,13.78.MS-EIm/z(%):512(M+,41.19),300(42.21),176(100.00).HRMS-EI(m/z):calcd.for C21H23Br3,511.935 0;found,511.936 7.
1.2.2 目标化合物9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮(Ⅰ)的合成 在优化条件下合成9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮(Ⅰ).其操作步骤为:在氩气保护下,依次将20mL THF、60%NaH 0.48g(12mmol)加入到100mL三口烧瓶中,控温0℃下缓慢加入乙酰丙酮1.17g(11.73 mmol),滴毕继续反应0.5h.随后缓慢加入1.6mol/L丁基锂7.4mL(11.84mmol),滴毕继续反应0.5h.再缓慢加入化合物(3)2g(3.91mmol)的5mL THF溶液,滴毕继续反应1h,升温至室温下反应2h.反应结束,缓慢加入饱和的NH4Cl溶液18mL,调pH=1,乙醚 (50mL×3)萃取,无水硫酸钠干燥浓缩,乙醚/石油醚=1/4柱层析得到白色固体1.12g,收率56%,mp:44~45℃.
2 结果与讨论
2.1 实验条件的优化 在合成中间体(2)、(3)与目标化合物时,均要求在氩气保护下完成,我们在研究反应体系时发现,如果不用保护气体系将会变得很复杂,说明在惰性介质中可以抑制某些副反应的发生,从而提高目标化合物的产率.在合成目标化合物时,两种碱性试剂60%NaH和丁基锂是分步加入的,目的是控制产物的选择性;60%NaH在THF中是进攻乙酰丙酮的甲基氢可获得乙酰丙酮C-离子,丁基锂与中间体(3)支链上的溴进行交换可获得C+离子,二者结合可得含有两个羰基目标化合物;一锅加入体系将变得很复杂.

表1 合成2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴的反应影响因素
在合成2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴时,我们对该反应的催化剂及其用量、温度进行了探讨,其结果见表1.
由表1可见,随着氢氧化钠浓度的增加,产物产率先增加后降低,当浓度为30%时产物的收率最大(表1中8号,76%).这可能是由于氢氧化钠浓度低时影响C-的生成;但当氢氧化钠浓度过大时会促使二卤代烃的水解而影响产物的得率.从选用的三种催化剂来看,发现使用(C4H9)4N+Br-对反应催化效果最好(表1中3号,60%),随着催化剂用量的减少,产物收率增加,当物质的量之比大于10∶1时,收率反而降低,因此底物与催化剂物质的量之比为10∶1时是最佳用量(表1中11号,81%);升温和降温对反应均有影响,通过反复的实验发现80℃是反应的最佳温度.在该优化条件下合成了2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴.
利用相同的方法反复实验得出合成9-(2,7-二溴-9-正丁基-9-H-芴)壬烷-2,4-二酮 DBBFOD(Ⅰ)的最佳反应条件为:氩气保护,NaH∶乙酰丙酮∶丁基锂∶2,7-二溴-9-(4-溴丁基)-9-正丁基-9-H-芴≈4∶4∶4∶1(物质的量的比),在THF溶液中0℃反应1h后升温至室温继续反应2h,处理后得到白色固体.
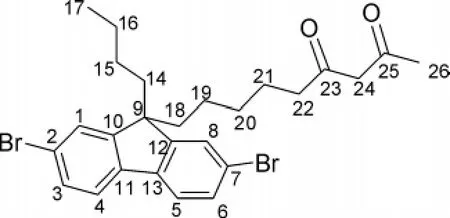
图2 DBBFOD(Ⅰ)结构
2.2 DBBFOD(Ⅰ)结构(见图2)的表征1H NMR (CDCl3,300MHz)δ:0.62(t,J=6.4Hz,3H,C17H3),0.83~0.81(m,2H,C16H2),1.08~0.98 (m,8H,C15,19,20,21H2),1.28(s,3H,C26H3),2.03~1.87(m,6H,C14,18,22H2),3.43(s,0.4H,酮式 C24H2),5.30 (s,0.8H,═C24H),7.47~7.38(m,6H,芴 C1,3,4,5,6,8-H),13.11(s,0.8H,═C24OH);13C NMR(CDCl3,75.5MHz)δ:13.9(C17),23.2(C21),25.1(C16),25.9(C19),29.4(C15),38.0(C20),40.0(C26),43.5(C18),55.6(C14),57.9(C22),99.7(C9),121.5(C24),126.2 (C2,7),130.3(C4,5),139.1(C3,6),152.4(C1,8),191.3 (C11,13),193.9(C10,12),202.2(C25),204.2(C23);MS-EIm/z(%):534(M+,57.82),323(59.54),176(75.42),85(100.0);HRMS-EI(m/z):calcd.for C26H30O2Br2,532.061 3;found,532.061 5.Anal.calcd for C26H30Br2O2:C 58.44,H 5.66,Br 29.91,O 5.99;found C 58.39,H 5.89,Br 29.51,O 6.21.

图3 DBBFOD互变异构现象
1H NMR分析结果显示,Ⅰ存在酮式-烯醇式互变异构现象,原烯醇式六元环存在两种互变异构(见图3).3.43处的单峰对应酮式结构的a—H,5.30处的单峰对应烯醇式结构中的b—H,13.11处的宽峰对应烯醇式结构中的c—H.由a—H与b—H的积分面积可知在CDCl3溶液中,Ⅰ主要以烯醇式结构存在,只含有少量酮式结构,这与报道过的β-二酮化合物相吻合[8-9].
3 结论
在优化条件下,通过取代反应合成了3个中间体和一种新型的蓝光材料的前体长链β-二酮化合物DBBFOD.采用1H NMR、13C NMR、MS和元素分析对其结构进行了表征.研究结果表明,DBBFOD在CDCl3溶液中主要以烯醇式结构存在,是一种重要的金属离子螯合剂.为聚芴类电致发光材料底物的拓展奠定一定的基础.
[1]Pei Q B,Yang Y.Efficient photoluminescence and electroluminescence from a soluble polyfluorene[J].J Am Chem Soc,1996,118(31):7416-7419.
[2]Tang C,Liu F,Xu H,et al.Polyfluorene and Its derivatives as electroluminescent materials[J].Progress in Chemistry,2007,19(10):1553-1556.
[3]Zhao Q,Jiang C,Shi M,et al.Synthesis and photophysical,electrochemical,and electrophosphorescent properties of a aeries of iridium (Ⅲ)complexes based on quinoline derivatives and differentβ-diketonate ligands[J].Organometallics,2006,25:3631-3634.
[4]Perrin D D,Armarego W L F,Perin D R.Purification of laborator chemicals[M].New York:Pergamon Press,1980.105-115.
[5]Kurt L.S.,Ernest I B.The Base-catalyzed alkylation of fluorene with alcohols[J].J Am Chem Soc,1955,77:6030-6034.
[6]林原斌,刘展鹏,陈红飚.有机中间体的制备与合成[M].北京:科学出版社,2006,20-31.
[7]Ego C,Marsitzky D,Becker S,et al.Attaching perylene dyes to polyfluorene:three Simple,efficient methods for facile color tuning of light-emitting polymers[J].J Am Chem Soc,2003,125:437-441.
[8]Bassett A P,Magennis S W,Glover P B,et al.Highly Luminescent,trip le2and quadrup le2stranded,dinuclear Eu,Nd and Sm (Ⅲ)lanthanide comp lexes based on bis2diketonate ligands[J].J Am Chem Soc,2004,126:9413-9417.
[9]Katritzky A R,Wang Z Q,Wang M Y,et al.Preparation ofβ-keto esters andβ-diketones by C-acylation/deacetylation of acetoacetic esters and acetonyl ketones with 1-acylbenzotriazoles[J].J Org Chem,2004,69:6617-6620.
Synthesis and characterizations of 9-(2,7-dibromo-9-butyl-9-H-fluorene)nonane-2,4-ketone
WANG Xiang1,YANG Xuhong2
(1.School of Environment and Life Science,Kaili University,Kaili 556000,China;2.Deparment of Chemistry and Life Science,Xianning College,Xianning 437100,China)
In optimum reaction conditions,an foremolecular substitution reaction of flourene、bromine、dibromoalkane、diketone、NaH and n-BuLi has been carried out in THF.The 9-(2,7-dibromo-9-butyl-9-H-fluorene)nonane-2,4-ketone(DBBFOD)a new type luminescent material intermediate was synthesized for the first time and identified by1H NMR、13C NMR、MS techniques and elemental analysis.The product of yield reached 56%and purity was higher than 99%.
fluorene;9-(2,7-dibromo-9-butyl-9-H-fluorene)nonane-2,4-diketone;luminescent material intermediate;substitution reaction.
O657.3
A
1000 -2375(2011)03- 0275-04
2011 01- 08
凯里学院教授专项课题项目(JS201004)和贵州省教育厅自然科学基金青年课题项目(20090079)资助
王翔(1972 ),女,教授,E-mail:gzhwx0828@126.com
(责任编辑 胡小洋)

