CeO2∶Eu3+纳米晶的溶剂热合成及其发光性能
黄明初,刘国聪,,李海斌,,尹志民
(1. 中南大学 材料科学与工程学院 有色金属材料科学与工程教育部重点实验室,长沙 410083;2. 玉林师范学院 化学系,玉林 537000;3. 长沙理工大学 物理与电子科学学院,长沙 410067)
CeO2是一种具有面心立方萤石(CaF2)结构的稀土氧化物,具有很好的化学稳定性和较高的介电常数(e=26),其晶格常数(0.5411 nm)与 Si的(0.5431 nm)相差不大,而且具有优越的储放氧功能及高温快速氧空位扩散能力, 可广泛用于发光材料[1]、催化剂[2]、紫外线吸收材料[3]、化学机械抛光材料[4]、氧敏材料[5]、电子陶瓷[6]、固体氧化物电池材料[7]等领域。近年来,合成CeO2纳米材料的方法较多。如:化学机械法[8]、微乳法[9]、声化学法[10]、均相沉淀法[11]、溶胶−凝胶法[12]、水热合成法[13]、微波引诱燃烧法[14]等。不过,这些方法多数集中于 CeO2纳米材料的机械抛光和催化性能等领域,而对其光学性能的研究还不够深入,且大部分合成产品的颗粒较大,团聚现象严重,十分不利于产品的工业应用。工业上要求以 CeO2为基体的荧光粉、抛光粉、陶瓷粉、催化剂等具有粒径分布窄、晶化程度高的特点。此外,CeO2良好的光学透明性和较高的折射率虽然促进了以 CeO2为基体的光学材料的合成和应用,但产品尺寸调控和性能优化一直存在巨大的挑战[15−17]。
一些研究表明,发光材料的基质和掺杂离子对稀土离子的发光性质有重要影响[18−20]。Eu3+是发光性能较好的一种稀土离子, 它发射的 610 nm 红色荧光的单色性好、量子效率高。目前,对稀土离子掺杂CeO2纳米晶的可控合成及其发光性能研究甚少。因此,寻求一种尺寸和形貌可控的 CeO2∶Eu3+纳米晶的合成方法以及深入探讨掺杂稀土Eu3+对基体 CeO2的敏化作用的研究具有重要的理论意义和应用价值。
本文作者以硝酸铈、硝酸铕、氨水为反应物,以聚乙烯吡咯烷酮(PVP)为抑制剂和分散剂,通过溶剂热技术制备出晶粒小于 100 nm且分散性良好的CeO2∶Eu3+纳米晶,并分析 CeO2∶Eu3+的光学性能,以及退火温度对CeO2∶Eu3+纳米晶的荧光强度的影响。
1 实验
1.1 药品及仪器
实验药品:Ce(NO3)3·6H2O(AR)、NH3·H2O(AR),氧化铕(99.99%),浓硝酸(AR),盐酸(AR),无水乙醇(AR);所用水为去离子水。
主要仪器和设备:AY220电子天平,DF−101S恒温加热磁力搅拌器,DHG−9023A电热恒温鼓风干燥箱,BA−4WHF微波型马沸炉,F−4500荧光分光光度计,RigakuD/max−2500VB型 X 射线衍射仪,日立H2800型透射电子显微镜透,日本分光V−570(JASCO)紫外−可见光谱仪等。
1.2 CeO2∶Eu3+纳米晶的合成
首先称取一定质量的Eu2O3溶解在适量的浓硝酸中,将多余硝酸加热挥发,容器冷却后得到固体,向其中加入少量乙醇溶解并磁力搅拌配成 100 mL 0.5 mol/L溶液备用;再准确称量1.702 g Ce(NO3)3·6H2O加入25 mL无水乙醇中,磁力搅拌10 min后得到澄清溶液,然后依次加入0.8 g PVP和4 mL 0.05 mol/L Eu(NO3)3溶液继续搅拌 1 h(Eu/Ce的摩尔比约 5∶95),再向上述溶液中逐滴加入10%NH3·H2O调节其pH值至8。持续搅拌30 min后将所得悬浮液转移到50 mL聚四氟乙烯不锈钢高压反应釜中,加乙醇至反应釜容量的80% 密封,反应物在180 ℃恒温电热烘箱中进行水热反应12 h。反应结束后,自然冷却至室温得到白色前驱体,分别用去离子水和无水乙醇洗涤3次,在80 ℃真空中干燥6 h得产品,然后分别在400、600和800 ℃煅烧上述产品4 h得各种浅黄色CeO2∶Eu3+样品。
1.3 样品的表征和测试
CeO2∶Eu3+样品采用 RigakuD/max−2500VB 型 X射线衍射仪进行物相分析,采用Cu Kα(λ=1.545Å)实施确定样品的晶型和组成;采用日立H2800透射电子显微镜(200 kV)和场发射扫描电镜(FISEM,Sirion200,FEI,GENESIS 60S,American)观测样品的晶粒尺寸和形貌并确定产物的粒径大小和分布;采用FL−4500型荧光仪分析 CeO2∶Eu3+的光致发光性能;采用 V−570紫外−可见光谱仪测试样品的紫外吸收谱。采用GX型傅里叶变换红外光谱仪测试样品的红外光谱,其工作条件:压片法,仪器分辨率为4 cm−1,检测器为MCT,检测范围为500~4 000 cm−1。
2 结果与讨论
2.1 CeO2∶Eu3+的物相结构分析
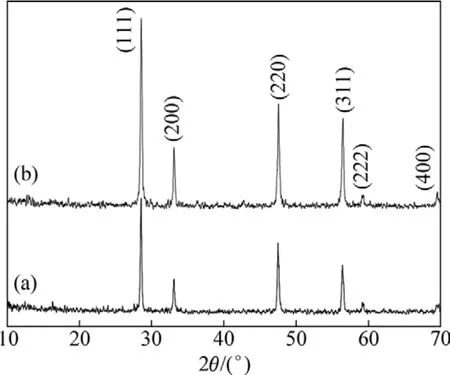
图 1 CeO2和 CeO2∶Eu的 XRD 谱Fig.1 XRD patterns of CeO2 (a)and CeO2∶Eu 3+ (b)
图1所示为以乙醇为溶剂在 180 ℃下反应 24 h所得样品的XRD谱。由图1可见,CeO2和CeO2∶Eu3+的 XRD 谱线十分相似,均在 28.5˚、33.1˚、47.5˚、56.5˚、59.2˚和69.6˚处出现了明显的6个特征峰,分别对应于CeO2晶体的(111)、(200)、(220)、(311)、(222)和(400)晶面,其它位置的峰强度均不大。所有衍射峰均与纯立方相CeO2的标准谱一致(JCPDS Card No.43−1102),因 Eu3+的掺杂量(摩尔分数)很少(≤8.0%)而无其特征衍射峰,同时谱线中没有发现其它杂质的衍射峰,说明样品的纯度较高。同时参照 XRD微结构数据,根据谢乐(Scherrer)公式 D=Kλ/(βcos θ)(其中 K 为常数,λ为X射线波长,β为半高宽,θ为衍射角)可算出CeO2和CeO2∶Eu3+样品的晶粒大小分别是80 和50 nm,这与样品的 TEM 测试结果比较吻合。由此可见,溶剂热法制备的CeO2和CeO2∶Eu3+均具有较好的结晶度。
2.2 CeO2∶Eu3+的形貌和微结构分析

图2 样品的SEM、TEM像和EDS谱Fig.2 SEM, TEM images and EDS spectrum of samples: (a) SEM image of CeO2; (b) Low magnification TEM image of CeO2∶Eu3+;(c) High magnification TEM image of CeO2∶Eu3+; (d) HRTEM image of CeO2∶Eu3+(FFT, inset); (e) EDS spectrum of CeO2∶Eu3+
用场发射扫描电镜(SEM)和透射电镜(TEM)分析样品的基本形貌和微观结构,其结果如图2所示。图2(a)所示为溶剂热法制备的CeO2纳米晶。由图2(a) 可见,CeO2纳米晶由许多立方小颗粒组成,其平均粒径约80 nm,而且产率高。图2(b)~(d)所示为CeO2∶Eu3+纳米晶的TEM和HRTEM像。由图 2(b)和(c)可见,粒子晶形比较规整,边缘较清晰,颗粒直径小于 50 nm,呈现出小多面体形状,但样品的分散性不太强, 有一定的团聚现象。图2(d)所示为单个CeO2∶Eu3+纳米晶的HRTEM像。由图2(d)可见,样品具有很整齐的晶格条纹, 对应于(111)晶面的间距为0.313 0 nm。另外,图 2(d)中的插图为样品选区的傅立叶转换图(FFT)。HRTEM和FFT图中整齐的斑点表明了样品为单晶结构。图 2(e)所示为 CeO2∶Eu3+样品的选区电子能谱(EDS)。由EDS数据可以得到产品中的元素Ce和Eu的摩尔比基本接近95∶5,这与原料加入量十分一致。而且,Ce与Eu原子半径分别为0.103和0.096 nm, 两者相差不大,溶剂热反应的条件促进了这两种离子间的同晶取代而形成完整的立方相 CeO2结构。因此,XRD谱中并没有显示出任何Eu氧化物的特征峰。这些结果说明溶剂热反应能够产生单晶结构的CeO2∶Eu3+纳米晶。
2.3 退火温度对CeO2∶Eu3+晶粒的影响
图3所示为前驱体分别在400、600和800 ℃热处理的CeO2∶Eu3+样品的XRD谱。由图3可见,所有样品的衍射峰位置没有变化,而且均对应于立方相CeO2的标准谱(JCPDS Card No.43−1102),说明热处理后 CeO2∶Eu3+的晶型没有改变。但随着温度的升高,CeO2∶Eu3+晶体的积分衍射峰强度变大,这显示出样品的结晶度得到进一步的提高。谢乐公式可以计算出样品在400、600和800 ℃热处理后的晶粒尺寸分别是43.5、78.8和 97.6 nm。
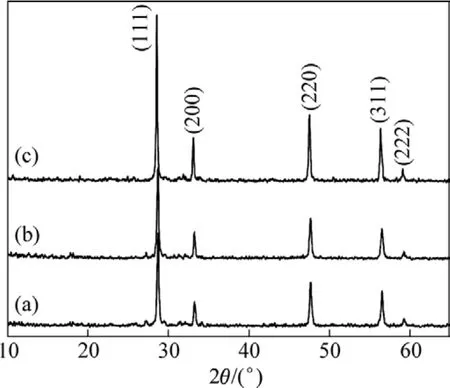
图3 不同温度退火后CeO2∶Eu3+样品的XRD谱Fig.3 XRD patterns of CeO2∶Eu3+ samples annealed at different temperatures: (a) 400 ℃; (b) 600 ℃; (c) 800 ℃

图4 不同温度退火后CeO2∶Eu3+样品的TEM像Fig.4 TEM images of CeO2∶Eu3+ samples annealed at different temperatures: (a) 400 ℃; (b) 600 ℃; (c) 800 ℃; (d) 1 000 ℃
图 4所示为不同温度退火后 CeO2∶Eu3+样品的TEM像。由图4可知,不同温度退火对样品的颗粒形貌影响不大,颗粒的形貌基本上保持多面体形状,但对颗粒的直径影响比较显著。400 ℃退火后,样品的粒径小于50 nm(见图4(a));600 ℃退火后,一些晶粒会长大,粒径达到80 nm(见图4(b));800 ℃退火,大部分颗粒的粒径超过100 nm(见图4(c));1 000 ℃退火,全部颗粒粒径不小于 100 nm,有的粒径达到 150 nm。根据经典的晶体生长和“生长基元”理论,随着退火温度的升高,平衡向较稳定的晶态相立方相(相比无定形态)移动,因此CeO2∶Eu3+样品的晶化速度增强;另外,溶剂热生成的有晶格缺陷的晶体在较高的温度退火中会进一步结晶, 因而晶体结构趋于完整。而且随着热温度升高和能量的增加,小颗粒逐渐生长成大颗粒,开始沿着一定的方向生长,形成较为均匀的多面体状的CeO2∶Eu3+纳米晶。
2.4 样品的傅里叶红外光谱和紫外光谱
图5所示为600 ℃退火后的CeO2∶Eu3+、CeO2和商业 CeO2的红外光(IR)谱。由图 5可知,所合成的CeO2纳米晶(见图 5(b))与商业 CeO2粉末(见图 5(c))的IR谱基本相同,均在1 620、1 500、1 145、999、854和661 cm−1处出现了振动峰。1 500~1 620 cm−1之间的窄峰主要来自于样品表面吸附水分子的O—H键的振动,1 145 cm−1处的宽而强的振动峰是Ce—O—Ce键的弯曲振动引起,而999、854、661 cm−1处的弱峰则来自于 Ce—O—Ce键的微弱伸缩振动。但样品CeO2∶Eu3+(见图 5(a))在 1 398、661 和 615 cm−1处出现了CeO2没有的弱峰,1 398 cm−1处宽而弱的峰是来自于样品中的Eu—O键的弯曲振动,而后两者主要是因为Eu3+进入CeO2晶格内形成的Eu—O—Ce键的伸缩振动[21]。

图5 不同样品的红外光谱Fig.5 IR spectra of different samples: (a) CeO2∶Eu; (b) CeO2;(c) Commercial CeO2
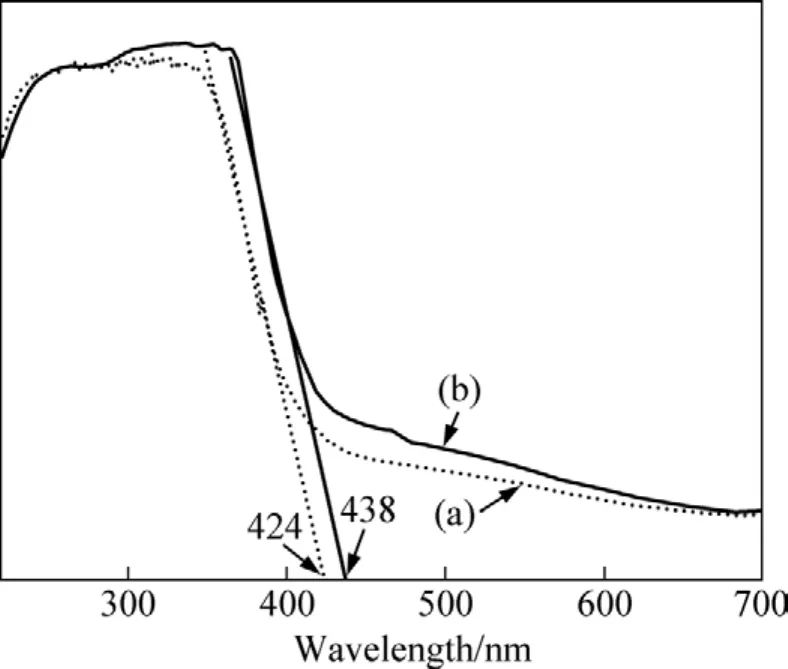
图6 样品的紫外光谱Fig.6 UV-vis spectra of different samples: (a) CeO2∶Eu3+;(b) CeO2
CeO2和 CeO2∶Eu3+样品的紫外漫反射光谱的测试结果如图6所示,图中曲线(a)和(b)分别对应于 CeO2和CeO2∶Eu3+样品。由图6可见,两者在200~380 nm范围内紫外光具有良好的吸收,呈现出一个较宽的吸收带,而对波长大于380 nm的光的吸收则较少。Eu掺杂的 CeO2紫外吸收峰的波长向长波方向发生了微量的移动,存在红移现象,说明CeO2∶Eu3+还能够吸收少量的可见光。CeO2和 CeO2∶Eu3+样品紫外线陡度切线与水平线交点的波长分别为424和438 nm。带隙能量估算公式如下:式中:λg为光谱陡度切线与水平部分的交点值,nm。CeO2和CeO2∶Eu3+样品可计算出带隙能量分别是2.925和2.831 eV,均小于块状CeO2的带隙能量(3.4 eV)[22]。而且掺杂Eu3+后的CeO2带隙宽度比纯CeO2纳米晶小了 0.113eV。这说明 CeO2∶Eu3+相比 CeO2富有更好的光吸收能力。因此,CeO2和 CeO2∶Eu3+均能作为吸收紫外线的防护材料。

2.5 样品的荧光分析
图7所示为600 ℃退火后所得CeO2和CeO2∶Eu3+样品的激发光谱(监控波长为612 nm)。由图7可见,在300~400 nm 之间存在一个宽带激发,峰值在363 nm 处。由于 CeO2是宽禁带半导体(3.4 eV), 所以在300~400 nm内出现的宽带激发峰起源于基质CeO2的吸收, 基体内电子吸收能量后发生 O2−→Ce4+的电荷迁移而产生了宽带激发峰。对于CeO2∶Eu3+而言,468 nm处出现了激发尖峰, 还出现了395 nm 的激发小尖峰,两个激发峰都属于Eu3+的4f6壳层特征激发峰。前者对应Eu3+的7F0→5D2跃迁,后者对应Eu3+的7F0→5L6跃迁。可见在 CeO2∶Eu3+样品中发生 O2−→Ce4+的电荷迁移时,已经将能量传递给Eu3+。由于掺杂Eu3+的浓度较少, 激发谱主要表现为基质的宽带吸收, 而 Eu3+的4f6壳层特征吸收较弱[23]。
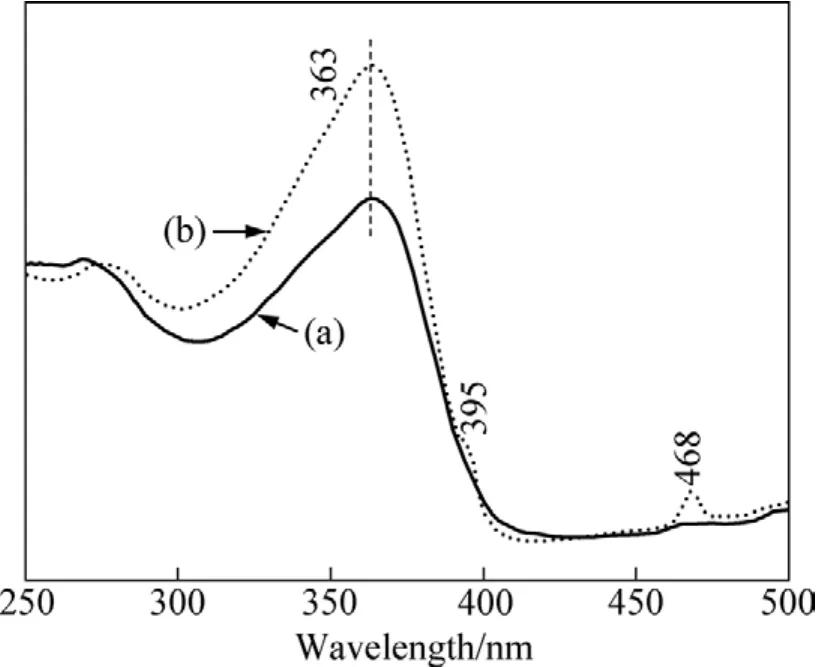
图7 CeO2和CeO2∶Eu3+纳米晶的激发光谱Fig.7 Excitation spectra of CeO2 (a) and CeO2∶Eu3+ (b)nanocrystals
图8所示为600 ℃退火后所得CeO2和CeO2∶Eu3+样品纳米晶的发射光谱(激发波长为363 nm)。由图8可以看出,CeO2基体在466 nm处是宽带峰(蓝光),当基体中掺杂少量的Eu3+后,发射谱分别在526、548、571、580、593、612、632和655 nm等出现明显的线状发射峰,它们分别对应于 Eu3+的 4f6壳层特征跃迁发射:5D1→7F1,5D1→7F2,5D0→7F0,5D0→7F1(580,593),5D0→7F2(612,632),5D0→7F3。图 8 中的插图是相关CeO2∶Eu3+在675~750 nm之间的发射谱的放大图。由插图可见,样品在682、699、713和725 nm处也出现了微弱的线状发射峰,这是5D0→7F4特征峰,而在 593,612,632 nm 处的峰强度较高,尤其是5D0→7F1(593 nm)跃迁发射的强度最大。众所周知,掺杂离子的种类、浓度、晶体的晶化程度以及晶体内部结构对发射峰的强度影响较大。在CeO2∶Eu3+晶体中的Eu3+的5D0→7F1是属于磁偶极跃迁,而5D0→7F2(612 nm)则属于电偶极跃迁。当晶格具有反演对称性时,5D0→7F1是允许跃迁,5D0→7F2是禁戒跃迁。当晶格即使稍稍偏离反演对称性时,晶体场就会出现奇次项,将相反的宇称态混合到 4f6组态,使禁戒解除,5D0→7F2变成允许跃迁或部分允许跃迁。CeO2∶Eu3+样品中的Eu含量(摩尔分数)约为4.2%,适量的Eu3+和Ce4+发生同晶取代后还没有造成晶体对称性的急剧下降,仅仅是偏离反演对称性,因此,5D0→7F1和5D0→7F2的跃迁会同时存在,但5D0→7F1跃迁的强度更强。

图8 CeO2和CeO2∶Eu3+纳米晶的发射光谱Fig.8 Emission spectra of CeO2 (a) and CeO2∶Eu3+ (b)nanocrystals
2.6 退火温度对CeO2∶Eu3+荧光强度的影响
CeO2∶Eu3+样品分别在873、1 073和1 273 K 退火后的发射光谱如图9所示,激发波长为363 nm。由图9可知,退火温度对CeO2∶Eu3+纳米晶的荧光强度有较大影响。随着退火温度从873 K升高到1 073 K,再升高至1 273 K 后,CeO2∶Eu3+晶体中5D0→7F1(593 nm)和 5D0→7F2(612,632 nm)跃迁发射的强度均依次增大。其原因是随着退火温度的升高,CeO2∶Eu3+晶体内部的缺陷减少了,内部结构的质点排列具有较高的对称性,形成结晶度好且晶粒尺寸较大的完整晶体,从而大大降低了晶体比表面积,提高了荧光强度。除此之外,图9中更有意义的现象就是:在高温处理后晶体中5D0→7F2跃迁的简并部分劈裂现象加剧,而且在1 073和1 273 K处理后,612 nm处的峰还分裂出一个小峰(607 nm),而且峰形宽化。这个现象不同于FUJIHARA等[24]和刘晓华等[23]的报道。其原因还有待进一步的探索。
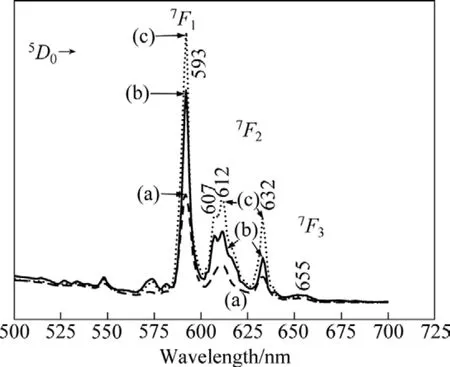
图9 不同温度退火后CeO2∶Eu3+的发射光谱Fig.9 Emission spectra of CeO2∶Eu3+ nanocrystals annealed at different temperatures: (a) 873 K; (b) 1073 K; (c) 1273 K
3 结论
1) 以乙醇为溶剂,Ce(NO3)3·6H2O、Eu(NO3)3和氨水为反应物,控制溶液pH为8并在180 ℃反应12 h后,再通过热处理成功获得晶粒粒径小于100 nm的CeO2和 CeO2∶Eu3+纳米晶。所有产品均是单相立方萤石结构的氧化铈,且均是单晶结构。
2) CeO2∶Eu3+纳米晶的IR测试说明在1 398、661和615 cm−1处出现了Eu—O键的弯曲振动和Eu—O—Ce的伸缩振动峰;同时UV-vis测试显示:该方法合成的CeO2和CeO2∶Eu3+具有良好的紫外吸收能力,而且Eu3+掺杂后CeO2紫外吸收有部分红移现象。CeO2和 CeO2∶Eu3+纳米晶的带隙能量分别约是 2.925和2.831eV,均小于块状CeO2的带隙能量(3.40 eV)。
3) CeO2和CeO2∶Eu3+纳米晶的激发谱均具有基体O2−→Ce4+的电荷迁移而产生了宽带激发峰,但后者因为掺杂Eu3+呈现出Eu3+的4f6壳层特征激发峰(395和468 nm处的激发尖峰)。CeO2只表现出基体在466 nm 处的宽带峰(蓝光),而 CeO2∶Eu3+纳米晶在 593、612和632 nm处具有较好强度的发射峰(橙红光)。升高退火温度有利于增强CeO2∶Eu3+样品的结晶度和发光强度。
[1] ZHAI Y Q, ZHANG S Y, PANG H. Preparation, characterization and photocatalytic activity of CeO2nanocrystalline using ammonium bicarbonate as precipitant[J]. Mater Lett, 2007,61(8/9): 1863−1866.
[2] KIM D H , CHA J E. A CuO-CeO2mixed-oxide catalyst for CO clean-up by selective oxidation in hydrogen-rich mixtures[J].Catalysis Letters, 2003, 86: 107−110.
[3] 朱兆武, 龙志奇, 崔大立, 张顺利, 张国成. 超细CeO2粉体的制备及其紫外线吸收性能[J]. 中国有色金属学报, 2005, 15(3):435−439.ZHU Zhao-wu, NONG Zhi-qi, CUI Da-li, ZHANG Shun-li,ZHANG Guo-cheng. Preparation of ultra-fine particle-sized CeO2 powder and its UV absorbance[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(3): 435−439.
[4] FENG X D, SAYLE D C, WANG Z L, SHARON P M,SANTORA B, SUTORIK A C, SAYLE T X T, YANG Y, DING Y, WANG X D, HER Y S. Converting ceria polyhedral nanoparticles into single-crystal nanospheres[J]. Science, 2006,312: 1504−1510.
[5] NORIYA I, WOOSUCK S, NORIMITSU M. Fast response of resistive-type oxygen gas sensors based on nano-sized ceria powder[J]. Sensors and Actuators B, 2003, 93: 449−453.
[6] ZHANG T S, MA J, CHAN S H, KILNER J A. Grain boundary conduction of Ce0.9Gd0.1O2–δceramics derived from oxalate coprecipitation: Effects of Fe loading and sintering temperature[J]. Solid State Ionics, 2005, 176: 377−384.
[7] BRETT D J, ATKINSON A, CUMMING D, ELVIA R C,ROBERT R, BRANDON N P. Methanol as a direct fuel in intermediate temperature (500~600 ℃ ) solid oxide fuel cells with copper based anodes[J]. Chemical Engineering Science,2005, 60: 5649−5662.
[8] LI Y X, CHEN W F, ZHOU X Z, GU Z J, CHEN C M.Synthesis of CeO2nanoparticles by mechanochemical processing and the inhibiting action of NaCl on particle agglomeration[J].Mater Lett, 2005, 59(1): 48−52.
[9] BUMAJDAD A, ZAKI M I, EASTOE J, PASUPLETY L.Microemulsion-based synthesis of CeO2powders with high surface area and high-temperature stabilities[J]. Langmuir, 2004,20: 11223−11233.
[10] YIN L X, WANG Y Q, PANG G S, KOLTYPIN Y,GEDANKEN A. Sonochemical synthesis of cerium oxide nanoparticals—Effect of additives and quantum size effect[J]. J Colloid Interface Sci, 2002, 246(1): 78−84.
[11] TSAI M S. Powder synthesis of nano grade cerium oxide via homogenous precipitation and its polishing performance[J].Mater Sci Eng, B, 2004, 110: 132−134.
[12] YANG H M, ZHANG K, SHI R R. Sol-gel synthesis and photocatalytic active of CeO2/TiO2nanocomposites[J]. J Am Ceram Soc, 2007, 90(5): 1370−1374.
[13] ZHU Z F, WANG B L, MA J Z. Characterization of Pr-CeO2nanocrystallites prepared by low-temperature combustion &hydrothermal synthesis[J]. Chin J Struct Chem, 2006, 25:1270−1274.
[14] FU Y P, LIN C H, HSU C S. Preparation of ultrafine CeO2powder by microwave-induced combustion and precipitation[J].J Alloys Comp, 2005, 391: 110−114.
[15] 郝仕油. 超细CeO2的微波辅助加热合成及其抛光性能[J]. 无机化学学报, 2008, 26(6): 1012−1016.
HAO Shi-You. Ultrafine CeO2: Microwave-assisted heating preparation and polishing properties[J]. Chinese Journal of Inorganic Chemistry, 2008, 26(6): 1012−1016.
[16] 宋晓岚, 何 希, 杨海平, 江 楠, 邱冠周. 沉淀法合成的纳米CeO2前驱体的热分解动力学[J]. 中南大学学报: 自然科学版, 2007, 38(3): 428−432.
SONG Xiao-lan, HE Xi, YANG Hai-ping, JIANG Nan, QIU Guan-zhou. Thermal decomposition kinetics of precursor of CeO2nanocrystalline prepared by precipitation method[J]. J Cent South Univ: Science and Technology, 2007, 38(3): 428−432.
[17] LIU Xiao-hua, CHEN Shao-jun, WANG Xiao-dong. Synthesis and photoluminescence of CeO2:Eu3+phosphor powder[J].Journal of Luminescence, 2007, 127: 650−654.
[18] LIU Guo-cong, DUAN Xue-chen, LI Hai-bin, DONG Hui,ZHUN Li-gang. Novel polyhedron-like t-LaVO4:Dy3+nanocrystals:Hydrothermal synthesis and photoluminescence properties[J].Journal of Crystal Growth, 2008, 310: 4689−4696.
[19] 刘国聪, 段学臣,李海斌,董 辉,朱立刚,梁达文. 鱼骨状LaVO4:Eu3+纳米晶的水热合成和荧光性能[J]. 中国有色金属学报, 2009, 19(1): 119−126.
LIU Guo-cong, DUAN Xue-chen, LI Hai-bin, DONG Hui, ZHU Li-gang, LIANG Da-wen. Study on hydrothermal synthesis,luminescent and magnetic properties of fishbone-like Eu3+-doped LaVO4nanocrystallite[J]. The Chinese Journal of Nonferrous Metals, 2009,19(1): 119−126.
[20] LIU Guo-cong, DUAN Xue-chen, LI Hai-bin, LIANG Da-wen.Preparation and photoluminescence properties of Eu-doped Ga2O3nanorods[J]. Materials Chemistry and Physics, 2008, 110:206−211.
[21] CHUNMAN H, JIMMY C Y, TSZYN K, ANGELO C M,SUKYIN L. Morphology-controllable synthesis of mesoporous CeO2nano- and microstructures[J]. Chem Mater, 2005, 17:4514−4522.
[22] ZHANG D S, FU H X, SHI L Y, PAN C S, LI Q, CHU Y L, YU W J.Synthesis of CeO2nanorods via ultrasonication assisted by polyethylene glycol[J]. Inorg Chem, 2007, 46: 2446−2451.
[23] 王孝东, 刘晓华, 陈绍军, 黎 明, 刘 敏. CeO2∶Eu3+粉末的溶胶-凝胶法制备及发光性能研究[J]. 光谱学与光谱分析,2007, 27(11): 2182−2185.
WANG Xiao-dong, LIU Xiao-hua, CHEN Shao-jun, LI Ming,LIU Min. Preparation of CeO2∶Eu3+powders by sol-gel method and their photoluminescence properties[J]. Spectroscopy and Spectral Analysis, 2007, 27(11): 2182−2185.
[24] SHINOBU F, MASASHI O. Structure and luminescent property of CeO2: rare earth (RE=Eu3+and Sm3+thin films[J]. J Appl Phys,2004(95): 8002−8006.

