原料预处理对柠檬膳食纤维总黄酮的影响
贺金梅
(西南大学食品科学学院,重庆 400715)
原料预处理对柠檬膳食纤维总黄酮的影响
贺金梅*
(西南大学食品科学学院,重庆 400715)
以柠檬皮渣为原料,探讨不同原料预处理方法对柠檬膳食纤维总黄酮的影响,原料进行预处理后经冷冻干燥制备膳食纤维,然后进行总黄酮含量测定。实验测得经灭酶、漂洗、不灭酶不漂洗处理后柠檬皮渣中总黄酮保存率分别为:71.72%、83.79%、92.41%,从结果可知总黄酮不稳定,而温度是影响总黄酮稳定性的重要因素。
柠檬;膳食纤维;总黄酮;脱脂;紫外分光光度计
柠檬(Citrus Limon) 为芸香科柑橘属常绿小乔木,是欧美国家主栽果树品种之一。在世界柑橘业中,柠檬占第三位,年产量约占世界柑橘总产量的9%。我国的四川、重庆、广西、云南等地也有分布,栽培品种以尤力克为主,我国柠檬产量约8万t~10万t,仅占柑橘总产量的1%左右。柠檬含有丰富的柠檬酸、VC、VB、VP、VH、VE、黄酮类、挥发油、橙皮甙、多种矿物质及微量元素等,是一种营养和药用价值都极高的水果,具有杀菌、美容、稳定情绪、提神、润喉、降低胆固醇、预防坏血病、防止肾结石和心血管动脉硬化等功效。
柠檬中的黄酮类物质含量丰富,较易分离,具有独特的芳香性和显著的药理学作用。黄酮类化合物在柠檬的果皮中含量较高,而在果汁中含量较低,仅为1%~5%(质量分数)。黄酮类化合物的生理活性主要有:抗氧化及抗自由基作用;保护心血管系统的作用;抗肿瘤、抗癌作用;保护平滑肌的作用;抗炎、抗菌、抗病毒作用;雌激素作用;保护中枢神经系统的作用;降血糖作用;镇痛止泻、防治溃疡的作用。还可作为功能食品添加剂、天然抗氧化剂使用。因此深度开发柠檬中丰富的黄酮资源,研究其生理及药理学作用,对于柠檬的深加工及其在医药、保健、食品域的应用,具有重大的经济和社会效益。本研究以柠檬皮渣为原料,探讨不同原料预处理方法对柠檬膳食纤维总黄酮的影响,以便为相关研究提供参考。
1 材料与方法
1.1 材料
新鲜柠檬,市售;芦丁,上海同田生物技术有限公司,纯度≥98 g/100 g;石油醚、无水乙醇、体积浓度95%乙醇、愈创木酚溶液、过氧化氢溶液,成都市科龙化工试剂厂,均为分析纯。
1.2 仪器
容量瓶;吸管;离心管;抽滤装置;Heto-HSC500真空冷冻干燥机;16目分样筛,浙江上虞市道墟监湖仪器筛具厂;BCD-183A冰箱,合肥荣事达电冰箱有限公司;UV-2600型紫外可见分光光度计,上海仪器有限公司;ZN-200A高速中药粉碎机,长沙市岳麓区中南制药机械厂;玻璃仪器气流烘干器,长城科工贸有限公司;SFG-02400电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;DZF-6021型真空干燥箱,上海-恒科学仪器有限公司;电子天平(TB-214),北京塞多利斯天平有限公司;HH-S数显恒温水浴锅,金坛市金城国盛实验仪器厂;SHZ-D(III) 循环水式真空泵,浙江黄岩求精真空泵厂;WTL超微台式离心机,金坛市金城国盛实验仪器厂。
1.3 实验方法
1.3.1 原料预处理及膳食纤维制取
柠檬榨汁后取皮渣,对皮渣进行三种处理:①不灭酶也不经任何处理直接破碎后再抽滤,抽滤后进行冷冻干燥;②灭酶后用流动水冷却,冷却后再进行破碎、抽滤、冷冻干燥;③用30℃温水洗2次后,再进行破碎、抽滤、冷冻干燥。然后在对三种处理原料制得的膳食纤维进行总黄酮含量测定。其原料预处理及膳食纤维制取工艺流程如下:

灭酶:要作用是破坏果胶酶,降低果胶的损失,因为果胶是可溶性膳食纤维,需要尽量保存,用愈创木酚法检测灭酶效果(恒温90℃灭酶)。其原理是:柠檬中过氧化氢酶的耐热性比果胶酶的耐热性强,所以只要检测出过氧化氢酶失活了就可以说明果胶酶也已失活了。在有过氧化氢存在时,过氧化物酶可使愈创木酚氧化成棕红色的四愈创木酚和水。过氧化物酶通常不单独对过氧化氢分解,只活化其他过氧化物,活化后去氧化多种底物,有些产物会产生有色反应。新鲜柠檬中过氧化物酶活性很强,在过氧化物酶的作用下,能促进过氧化氢放出活性很强的氧,氧化愈创木酚,从而使柠檬由无色变为红棕色。
酶活检测方法:①取上述需要灭酶的柠檬皮渣于烧杯中,再将烧杯放在恒温水浴锅内加热;②每隔1 min~2 min取烧杯中的皮渣少许进行检验;③向取出的皮渣中加入质量分数1%愈创木酚溶液,以覆盖皮渣为宜,振荡后放置3 min左右;④加入质量分数3%过氧化氢溶液1~3滴摇匀,稍等片刻,可逐渐观察到皮渣和溶液的显色情况;⑤当检测的皮渣不再变为红棕色时说明灭酶已彻底。
1.3.2 水分测定
用烘干法(失重法)测鲜柠檬和冷冻干燥后柠檬中水分含量。
1.3.3 柠檬膳食纤维中总黄酮含量测定研究
1.3.3.1 芦丁标准曲线的绘制
a) 直接法确定标准溶液的最大波长:精密称取芦丁标准品0.007 7 g,加适量体积浓度30%乙醇,待其溶解后,再以体积浓度30%乙醇定容至100 mL,摇匀备用,质量浓度为0.077mg/mL。准确量取标准品液1.2 mL,用体积浓度30%乙醇定容至10.0 mL,在200 nm~800 nm扫描,确定吸收最大波长。
b) 标准曲线绘制:准确量取质量浓度为0.077 mg/mL的芦丁标准液0mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL,用体积浓度30%乙醇分别定容至10.0 mL,在最大吸收波长处比色测定。以标准品质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.3.2 样品总黄酮含量测定
a) 样品处理:准确称取1 g~3 g经过预处理干燥后得到柠檬膳食纤维样品放入50 mL容量瓶中,样品经过脱脂未经超声处理。脱脂即用20 mL石油醚脱脂1 h进行前处理。不经超声波处理即先用20 mL体积浓度95%的乙醇浸泡3 h,分离出浸液;再用同体积浓度70%的乙醇浸泡3 h,收集浸液,混合两次所得浸液,用体积浓度30%乙醇定容至50 mL。然后取混匀样液20 mL,在3 500 r/min条件下离心10 min,然后各取2.0 mL上清液稀释定容至50 mL备用。
b)样品液吸光度测定:直接将上述稀释后定容到50 mL的溶液在最大波长下测吸光度,用体积浓度30%乙醇作空白对照。

式中:y—样液黄酮含量,mg/mL;
V1—样液体积,50 mL;
V2—样品定容体积,50 mL;
V3—量取上清液的体积,2 mL;
m—样品干基重量,mg。
(1)内部污染 内部污染具有恢复难的特点,有以下两种来源:①高温导致淬火冷却介质分子链断裂会导致内部污染,断裂下来的小分子氧化成气体逸出,断裂的较大的分子不再有冷却性能而存在于淬火液中,从而导致淬火液污染。②水的污染,应尽量用纯度高的自来水,避免Ca+等离子的混入。
d) 重复实验3次,平行测定的结果,用算术平均值表示,取3位有效数字,含量低的保留小数点后2位。
1.3.3.3 精密性、稳定性和加标回收率试验
a)精密性试验:准确吸取各处理样品液在3500 r/min条件下离心10 min的上清液2.0 mL分别用体积浓度30%乙醇稀释定容至50 mL容量瓶中,以体积浓度30%乙醇作空白对照,依次测其吸光度。
b) 芦丁稳定性试验:准确吸取标准品溶液3.0 mL同标准曲线的测定操作,在0 min、15 min、30 min、45 min、60 min、90 min、120 min 测定其吸光度。
c)样品稳定性试验:准确吸取各处理的样品液在3 500 r/min条件下离心10 min的上清液2.0 mL,用体积浓度30%乙醇稀释定容至50 mL容量瓶中,以体积浓度30%乙醇作空白对照,在0 min、15 min、30 min、45 min、60 min、90 min、120 min测其吸光度。
d)加标回收率试验:准确称取经任意预处理的样品1 g(该试验称取的是经30℃温水处理样品),样品同样经过脱脂未经超声处理后收集浸液,混合两次所得浸液,用体积浓度30%乙醇定容至50 mL。然后取混匀样液20 mL,在3 500 r/min条件下离心10 min,然后各取10 mL上清液稀释定容至50 mL备用。
准确量取上述样液1.0 mL 9份于9个容量瓶中并编号 1、2、3、4、5、6、7、8、9,然后向 9 个容量瓶依次加入质量浓度为0.077 mg/mL的芦丁标准液1.0mL、1.0mL、1.0mL、1.2mL、1.2 mL、1.2 mL、1.4 mL、1.4 mL、1.4 mL,然后用体积浓度30%乙醇补充溶液体积至10 mL,依次测其吸光度。
2 实验结果与分析
2.1 水分测定
2.1.1 鲜柠檬中水分测定
由于在计算各处理样品柠檬膳食纤维中总黄酮含量时需要统一将其含量折算为干基或湿基含量,所以需要测柠檬中水分,见表1。

表1 鲜柠檬水测定(n=3)
2.1.2 预处理冷冻干燥后柠檬膳食纤维中水分测定
柠檬皮渣经过原料预处理冷冻干燥后,皮渣中仍含有一定水分,真空冷冻干燥并不能将其中所有水分除去,因此需测出其中水分,见表2。

表2 预处理冷冻干燥后柠檬膳食纤维中水分测定(n=3)
2.2 柠檬膳食纤维中总黄酮含量测定结果
2.2.1 芦丁的标准曲线
测得最大吸收波长为326 nm。得芦丁标准曲线方程为:Y=16.926X+0.0008,R2=0.999 9;如图1所示。

图1 芦丁标准曲线
2.2.2 柠檬膳食纤维中总黄酮含量测定结果
经预处理后制得柠檬膳食纤维和鲜柠檬中总黄酮含量测定数据如表3。
2.2.3 精密性、稳定性和加标回收率试验结果
3.2.3.1 精密性试验
芦丁标准液和经各预处理制得柠檬膳食纤维、鲜柠檬总黄酮含量测定精密性见表4。结果表明,各样品吸光度的RSD在合理范围内,说明精密度良好。用此方法测定柠檬膳食纤维中总黄酮含量结果可靠。
2.2.3.2 稳定性试验
芦丁标准液和经各预处理得到柠檬膳食纤维、鲜柠檬总黄酮含量测定稳定性见表5。结果表明,标准品和经过灭酶预处理的样品在120 min内稳定,而其他3种样品在60 min内基本稳定。

表3 各预处理的柠檬膳食纤维和鲜柠檬中总黄酮含量(n=3)

表4 精密性试验(n=6)
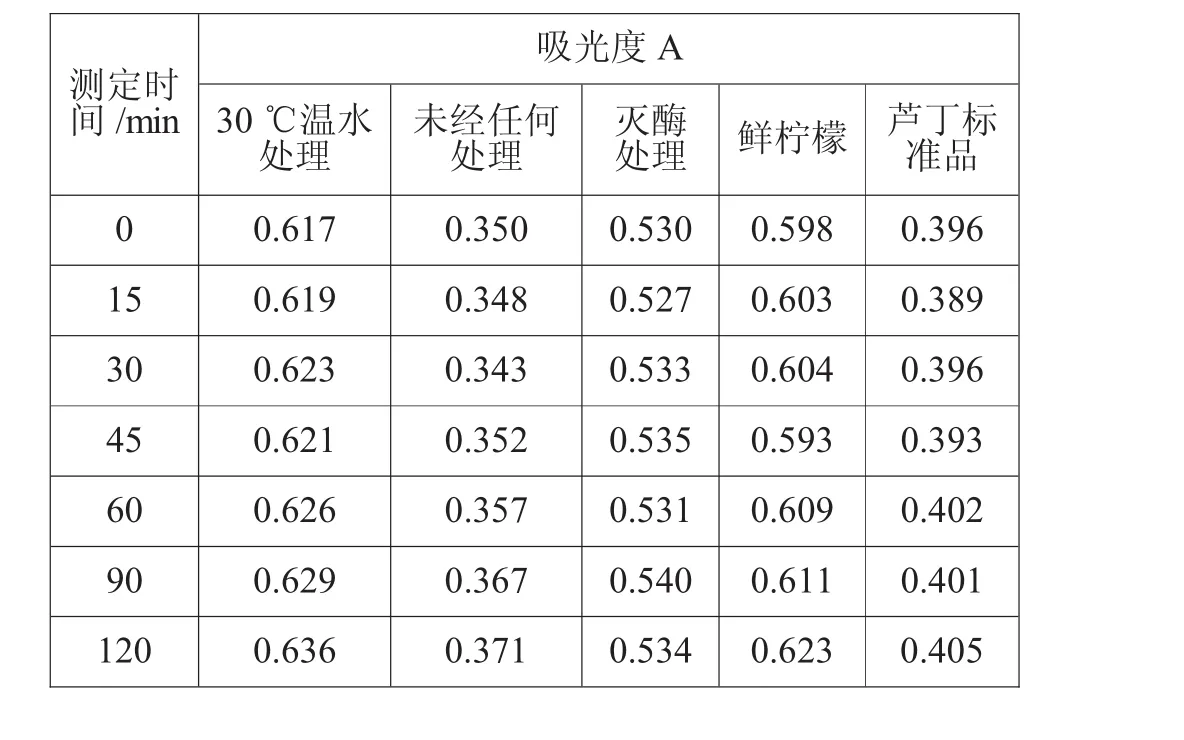
表5 稳定性试验
2.2.3.3 加标回收率试验
数据记录和结果见表6和表7。测得9次加标回收率平均值=99.33%,RSD=1.17%(n=9),说明该方法测得的结果较准确。
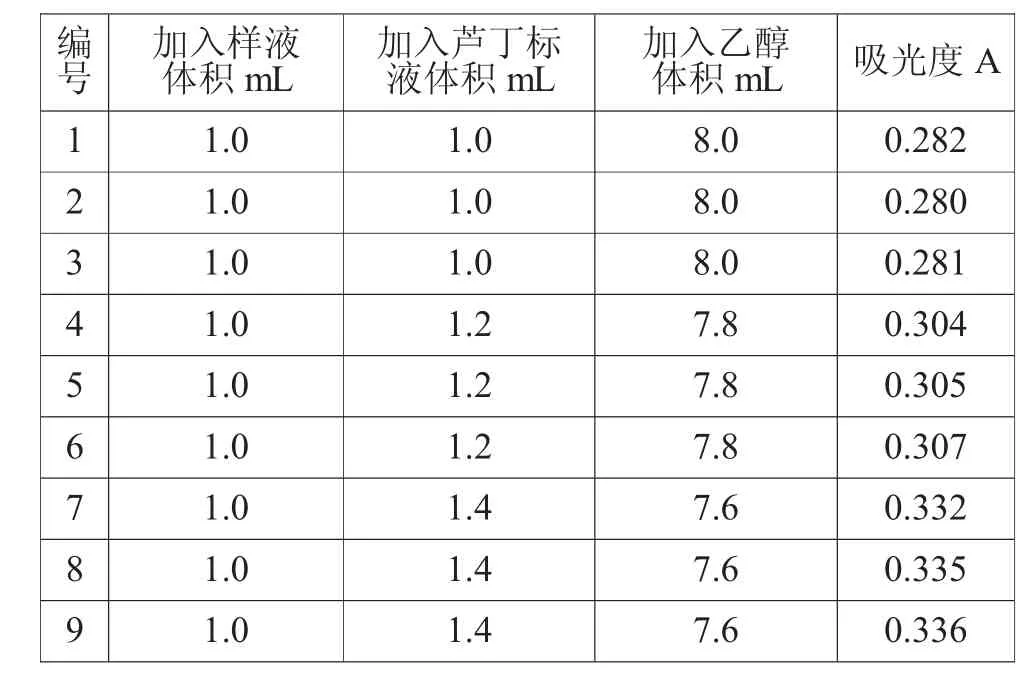
表6 加标回收率试验数据记录

表7 加标回收率试验结果(n=9)
2.2.4 结果与讨论
由于黄酮类成分均以2-苯基色原酮为母核结构,而芦丁也有此结构,因此以芦丁为对照检测柠檬膳食纤维中总黄酮的含量是科学的。黄酮类化合物含量测定方法有HPLC法、紫外分光光度法等。很多文献报道总黄酮的含量测定均以芦丁为对照品,采用NaNO2-Al(NO)3-NaOH为显色剂进行检测。但有些黄酮类物质在326 nm附近无最大吸收或吸收很弱,而有些非黄酮类物质在326 nm附近有最大吸收或有较强吸收。因此以芦丁为对照品,以NaNO2-Al(NO)3-NaOH为显色剂,于326 nm进行总黄酮含量测定的方法专属性不强,有局限性,准确性较差。
本实验采用紫外分光光度计法测定柠檬膳食纤维中总黄酮含量。从芦丁标准曲线可知,芦丁在0.01 mg/mL~0.04 mg/mL的范围内具有良好的线性关系。从试验结果可知平均回收率为99.34%,RSD为1.17%(n=9),因此以芦丁为对照品,采用紫外分光光度法测定柠檬膳食纤维中总黄酮含量,操作简便,重现性好,结果准确。
3 结论及分析
综合上述,柠檬皮渣经过漂洗、灭酶、不漂洗与不灭酶3种处理后制得的柠檬膳食纤维中总黄酮保存率分别为:83.79%、71.72%、92.41%,说明经过灭酶处理后总黄酮的损失最大,经过30℃温水处理损失次之,未经漂洗与灭酶损失的最小。
总黄酮属于多酚类物质,在各种加工处理过程中易发生酶促褐变,而温度是影响褐变重要因素,在高温灭酶期间虽然酚酶被钝化,但酶被钝化是需要一定温度的,在柠檬被加热到酚酶最高耐热温度时,由于升温加速了黄酮褐变,所以经过灭酶处理后黄酮含量最低。同时有些类黄酮以糖苷键的形式存在柠檬中,因糖苷化使类黄酮水溶性增大,经过30℃温水漂洗会损失部分黄酮,即测得黄酮含量较未经漂洗与灭酶的样品小。
[1]ZARGARI A.Medicinal plants[M].Tehran:Tehran University Press,1990:77-81.
[2]杨恩聪.“尤力克”柠檬在德宏州的表现及栽培技术[J].云南农业科技,2006(5):28-28.
[3]杨恩聪,岳建强.德宏柠檬发展概况及主要栽培技术[J].云南农业科技,2006(2):56-58.
[4]高俊燕,周东果,岳建强,等.德宏柠檬生理落花落果的变化规律研究[J].西南农业学报,2008,21(2):328-331.
[5]石健泉,曾沛繁.柠檬的经济价值及栽培管理[J].广西热带农业,2006(1):8-9.
[6]ANONN.Iranian herbal pharmacopoeia[J].MimstryofHealth Publicafion,2002(1):114-121.
[7]赵雪梅,朱大元,叶兴乾,等.柑桔属中类黄酮的研究进展[J].天然产物研究与开发,2002,14(1):89-92.
[8]张熊禄.微波法从柑桔皮中提取类黄酮[J].食品科学,2005,26(3):119-121.
[9]裴凌鹏,惠伯棣,金宗濂,等.黄酮类化合物的生理活性及其制备技术研究进展[J].食品科学,2004,25(2):203-207.
[10]阮伸.新橙皮苷结构的波谱分析[J].江苏化工,1994,22(3):36-40.
Study on the effect ofpretreatment on totalflavonoids ofdietary fiber from lemon peel
HE Jin-mei*
(College offood science,Xinan university,Chongqing 400715,China)
The studies on the effect of different pretreatments on the extraction of total flavonoids from lemon peel residue were carried out.After pretreatment of raw materials,the dietary fiber was made by freeze-drying.Then the flavonoids was determined by UV spectrophotometer.Theexperimentresultwas measured after the enzyme inactivating,rinsing,non-enzyme-inactivating and non-rinsing separately.The preservation rates of flavonoids in the lemon dietary fiber were 71.72% ,83.79% ,and 92.41%.Results suggested that flavonoids were not stable,and the temperature was an important factor influencing the stabilityofflavonoids.
lemon; dietary fiber; flavonoids; degrease;UVspectrophotometer
*贺金梅,女,1986年出生,重庆市北碚区西南大学食品学院在读研究生。
2010-10-22

