新型萘酰亚胺衍生物合成研究
吴爱斌 (长江大学化学与环境工程学院,湖北 荆州 434023)
新型萘酰亚胺衍生物合成研究
吴爱斌 (长江大学化学与环境工程学院,湖北 荆州 434023)
合成了一系列新型的萘酰亚胺-亮氨酸加合物,利用红外光谱、核磁共振氢/碳谱和高分辨质谱等对其结构进行了确认,并利用MTT法和SRB法对其抗肿瘤活性进行了研究。结果表明,该系列化合物对所测试的6种肿瘤细胞株(HeLa、A549、P388、HL-60、MCF-7、A375)表现出较好的增长抑制活性,IC50值为10-6~10-5M。
萘酰亚胺;亮氨酸;加合物;抗肿瘤
众所周知,氨基酸是细胞生长所必须的重要的起始原料,也是蛋白质合成中的重要砌块,更为重要的是,氨基酸可以促进药物在细胞中的吸收[12]。因此,促进具有生物功能的亲酯性分子透过细胞膜而发挥药效,一个可行方法就是将其与氨基酸结合[11]。亮氨酸具有柔性的异戊基碳链,该碳链与具有生物活性的N,N-二甲氨基乙基链在结构上具有很大的相似性。为此,笔者选择将萘酰亚胺与亮氨酸结合来设计新型的抗肿瘤化合物,以期获得具有不同功能的或具有改良生物活性的衍生物。
1 试验部分
1.1仪器与试剂
WRS-1A显微数字熔点仪,温度计未经校正;BS-210S万分子一电子天平(德国Sartorius公司);Perkin-Elmer 2000 FTIR红外光谱仪;Brucker AM-400核磁共振仪;HPLC-Q-Tof MS质谱仪;Leica6800荧光酶标仪;4-硝基-1,8-萘酐购于Sigma Aldrich公司,缓冲溶液为二次水配制;其他所用试剂均为国产分析纯试剂;柱色谱硅胶为青岛海洋化工厂产品(200~300目)。
1.2化合物的合成
目标化合物5a-c的合成路线如图1所示。4-硝基-1,8-萘酐(化合物1)在乙醇中与L-亮氨酸甲酯盐酸盐反应得中间体2,继而在DMF中与N,N-二甲基氨基乙二胺反应得化合物3,化合物3在碱性条件下水解得到关键中间体4,最后再与不同的芳胺发生缩合反应得到目标化合物5a-c。所合成的化合物均经过IR(红外光谱)、1H NMR(核磁共振H谱)、13C NMR(核磁共振C-13谱)和HRMS(高分辨质谱)表征,结构正确。
1.3肿瘤细胞增长抑制活性测试
离体肿瘤细胞增长抑制活性测试由国家新药筛选中心和华东理工大学药学院共同完成。采用四氮唑盐(microculture tetrozolium, MTT)还原法[13]对人宫颈癌细胞HeLa、小鼠白血病细胞P388、人白血病细胞HL-60、人乳腺癌细胞MCF-7和人恶性黑色素癌细胞A375等肿瘤细胞株进行离体细胞毒性测试,采用磺酰罗丹明B(sulforhodamine, SRB)蛋白染色法[14]对人肺癌细胞株A549进行离体细胞毒性测试,然后利用荧光酶标仪分别测定OD570值和520nm波长下测定吸光度A值,通过式(1)和式(2)分别进行计算得到被测物对癌细胞生长的抑制率。
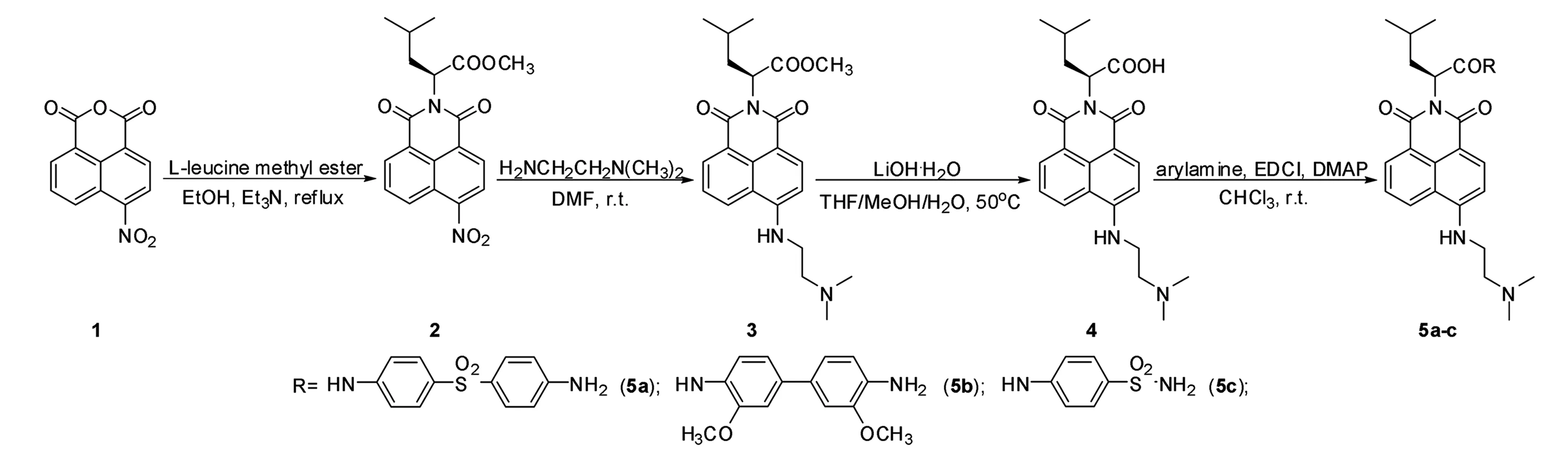
图1 目标化合物的合成路线
(1)
(2)
2 结 果
2.1化合物纯化
目标化合物通过亲核加成、取代、碱解及脱水反应4步得到,其中取代和脱水反应产率的高低对成功地得到目标化合物具有决定性影响。在合成过程中,笔者曾尝试以4-溴-1,8-萘酐为起始原料合成,但是在其芳香亲核取代脱去HBr的反应中,则需要较高的温度(约~120 ℃)[15],会造成副产物的增多而对后续的分离纯化工作产生不利影响,因此选择从4-硝基-1,8-萘酐出发,采用反应条件更温和的室温脱HNO2反应。另外,脱水反应中的溶剂必须是经过严格处理而绝对无水的,脱水效果以EDCI为最佳,采用DCC脱水则仅得到~30%左右的产率。
化合物分子具有大的平面刚性结构而有较强烈的荧光,分子间易发生聚集而呈粉末状,通过一般的重结晶方法难以提纯且存在较大的损失,因此每一步反应后均采用硅胶柱色谱分离的方法(通常为2次)而得到高纯度的化合物。
2.2化合物的结构表征
(1)4-甲基-2-(6-硝基-1,3-二氧-1-氢-苯并异喹啉-2(3-氢)-基)戊酸甲酯 (化合物2)。化合物1(300mg, 1.234mmol)、L-亮氨酸甲酯盐酸盐(269mg, 1.480mmol)和Et3N(150mg, 1.480mmol)置于25ml单口烧瓶中,加入5ml乙醇,N2保护下搅拌回流反应60min后,冷却,浓缩。所得固体经硅胶柱分离(CH2Cl2∶CH3OH, 60∶1,V/V),得411mg橙黄色固体2(90%)。熔点:105.2~107.3℃;1H NMR (400MHz, CDCl3): δ 8.863 (d,J= 8.8Hz,1H), 8.753(d,J= 7.2Hz,1H), 8.707(d,J=8.0Hz,1H), 8.420(d,J= 8.0Hz,1H),8.012 (t,J=8.0Hz,1H), 5.774 (q,J1= 4.0Hz,J2= 8.8Hz,1H), 3.732(s, 3H), 2.282~2.214(m, 1H), 2.150~2.082 (m, 1H), 1.584 (s, br, 1H), 1.014 (d,J= 6.0Hz, 3H), 0.933 (d,J= 6.0Hz, 3H);MS (EI+) calcd for C19H18N2O6[M+] 370.4, found 370.1。
(2)2-(6-(2-(二甲基氨基)乙基氨基)-1,3-二氧-1-氢-苯并异喹啉-2(3-氢)-基)-4-甲基戊酸甲酯 (化合物3)。化合物2(200mg, 0.540mmol)溶解于2ml DMF中,加入N,N-二甲氨基乙二胺(476mg, 5.400mmol),N2保护下室温搅拌反应24h后,浓缩。所得固体经硅胶柱分离(CH2Cl2∶CH3OH, 40∶1,V/V),得134mg橙色固体2(60%)。熔点:57.5~59.5℃;1H NMR (400MHz, CDCl3): δ8.576 (d,J=7.2Hz, 1H), 8.461(d,J= 8.4Hz,1H), 8.179(d,J= 8.4Hz, 1H), 7.633(t,J=8.4Hz,1H), 6.678(d,J= 8.4Hz, 1H), 6.372(s, br, 1H),5.798 (q,J1= 4.8Hz,J2= 9.2 Hz, 1H), 3.703(s, 3H), 3.396 (q,J1= 4.8Hz,J2=11.2Hz, 2H), 2.750(t,J= 6.0Hz, 2H), 2.350(s, 6H), 2.258~2.187 (m, 1H), 2.142~2.071 (m, 1H), 1.633~1.532 (m, 1H), 1.011 (d,J=6.4Hz, 3H), 0.916 (d,J= 6.8Hz, 3H); MS (EI+) calcd for C23H29N3O4[M+] 411.5, found 412.2。
(3)2-(6-(2-(二甲基氨基)乙基氨基)-1,3-二氧-1-氢-苯并异喹啉-2(3-氢)-基)-4-甲基戊酸 (化合物4)。化合物3(223mg, 0.540mmol)溶解于THF/MeOH/H2O 4∶1∶1(V/V/V),加入LiOH·H2O (45mg, 1.080mmol),升温至50℃,反应12h后浓缩至原体积的一半,加入1M HCl中和至中性,产生大量沉淀,过滤,真空干燥得206mg橙色固体5(96%)。熔点:205.5~207.5℃;1H NMR (400MHz, DMSO-d6):δ8.738 (d,J= 8.4Hz, 1H), 8.442(d,J= 7.2Hz, 1H), 8.278 (d,J= 8.4Hz, 1H), 7.861(s, br, 1H), 7.703 (t,J= 8.0Hz, 1H), 6.859(d,J= 8.8Hz, 1H), 5.547(d,J= 6.8Hz,1H), 3.623(d,J= 5.2Hz, 2H), 2.957(s, br, 2H), 2.491 (s, 6H), 2.010 (t,J=6.8Hz, 2H), 1.449~1.384 (m, 1H), 0.903 (d,J= 6.4Hz, 3H), 0.819(d,J= 6.8Hz, 3H);13C NMR (100MHz, DMSO-d6):δ172.27, 164.05, 163.17, 150.99, 135.06, 131.61, 129.95, 129.53, 125.00, 122.02, 120.70, 108.12, 104.70, 56.25, 51.41, 44.45, 38.18, 25.46, 23.53, 22.43; MS (EI+) calcd for C22H27N3O4[M+] 397.5, found 398.2。
(4)目标化合物5a-c。化合物4(50mg, 0.126mmol)溶解于2ml CHCl3中,加入各种取代的芳胺 (0.126mmol)、EDCI (48mg, 0.252mmol)、DMAP (31mg, 0.252mmol),N2保护下室温搅拌反应48h后,浓缩。所得固体经硅胶柱分离 (CH2Cl2∶CH3OH, 30∶1,V/V),得橙色至黄褐色固体5a-c (55%~65%)。
5a:N-(4-(4-氨基苯基砜基)苯基)-2-(6-(2-(二甲基氨基)乙基氨基)-1,3-二氧-1-氢-苯并异喹啉-2(3-氢)-基)-4-甲基戊酰胺。粘稠的橙色固体,产率:65%;1H NMR (400 MHz, DMSO-d6):δ 9.837 (s, 1H), 8.667 (d,J= 8.4Hz, 1H), 8.429 (d,J= 7.2Hz, 1H), 8.249(d,J= 8.8Hz, 1H), 7.942(s, 1H), 7.721~7.655 (m, 5H), 7.471 (d,J= 8.4Hz, 2H), 6.803 (d,J= 8.8Hz, 1H), 6.577(d,J= 8.8Hz, 2H), 6.093 (s, 2H), 5.595 (q,J1= 5.2Hz,J2= 8.8Hz, 1H), 3.480 (dd,J1= 6.0Hz,J2= 12Hz, 2H), 2.575 (t,J= 6.8Hz, 2H), 2.220(s, 6H), 2.185~2.151 (m, 1H), 1.887~1.817 (m, 1H), 1.465~1.398 (m, 1H), 0.914 (d,J= 6.4Hz, 3H), 0.824(d,J= 6.4Hz, 3H);13C NMR (100MHz, DMSO-d6):δ169.58, 164.48, 163.43, 153.82, 151.08, 143.37, 137.38, 134.97, 131.37, 130.27, 129.57, 128.99, 127.80, 126.54, 124.81, 122.74, 120.57, 120.45, 113.39, 108.34, 104.32, 57.36, 52.79, 45.79, 41.44, 38.02, 25.29, 23.60, 22.63; FTIR (KBr, cm-1): 3355, 2948, 2859, 1680, 1647, 1580, 1535, 1450, 1357, 1290, 1242, 1142, 1101, 830, 771, 682, 548; HRMS (ES+) calcd for C34H37N5O5SNa ([M+Na])+650.2413, found 650.2392。
5b:N-(4’-氨基-3,3’-二甲氧基双苯基-4-基)-2-(6-(2-(二甲基氨基)乙基氨基)-1,3-二氧-1-氢-苯并异喹啉-2(3-氢)-基)-4-甲基戊酰胺。粘稠的黄褐色固体,产率:55%;1H NMR (400MHz, CDCl3): δ8.547 (d,J= 7.2Hz, 1H), 8.434-8.402(m, 2H), 8.314 (s, 1H), 8.231(d,J=8.4Hz, 1H), 8.023 (s, 1H), 7.593 (t,J= 8.0Hz, 1H), 7.113 (dd,J1= 1.6Hz,J2= 8.4Hz, 1H), 6.995~6.974 (m, 3H), 6.748 (d,J= 8.4Hz, 1H), 6.624 (d,J= 8.4Hz, 1H), 6.491 (s, 1H), 5.952(dd,J1= 6.0Hz,J2= 8.8Hz, 1H), 3.911 (s, 3H), 3.791(s, 3H), 3.394 (dd,J1= 4.8 Hz,J2= 10.4Hz, 2H), 2.764 (t,J= 6.0Hz, 2H), 2.361 (s, 6H), 2.322~2.215 (m, 2H), 1.687~1.620 (m, 1H), 1.053 (d,J= 6.8Hz, 3H), 0.989 (d,J= 6.8Hz, 3H);13C NMR (100MHz, CDCl3):δ168.33, 164.72, 164.04, 149.99, 148.25, 147.48, 137.23, 135.54, 135.09, 131.79, 131.63, 130.00, 127.03, 126.33, 124.67, 122.57, 120.33, 120.06, 119.57, 119.19, 115.03, 109.49, 109.30, 108.45, 104.40, 67.96, 56.84, 55.93, 55.60, 54.06, 44.95, 40.17, 37.84, 25.79, 23.23, 22.33; FTIR (KBr, cm-1): 3355, 2955, 2859, 1680, 1647, 1576, 1535, 1509, 1450, 1357, 1238, 1112, 1031, 774; HRMS (ES+) calcd for C36H41N5O5Na ([M+Na])+646.3005, found 646.3005。
5c:2-(6-(2-(二甲基氨基)乙基氨基)-1,3-二氧-1-氢-苯基异喹啉-2(3-氢)-基)-4-甲基-N-(4-磺酰氨基苯基)戊酰胺。橙红色固体,产率:60%;熔点:136.6~138.6℃;1H NMR (400MHz, DMSO-d6):δ 9.835 (s, 1H), 8.701 (d,J= 8.4Hz, 1H), 8.468 (d,J= 7.6Hz, 1H), 8.287 (d,J=8.4Hz, 1H), 7.786 (s, br, 1H), 7.751~7.690 (m, 5H), 7.202(s, 2H), 6.879 (d,J= 8.8Hz, 1H), 5.631 (dd,J1= 4.8 Hz,J2= 9.2Hz, 1H), 3.659 (d,J= 4.8Hz,2H), 3.062(s, br, 2H), 2.596(s, br, 4H), 2.596 (s, 6H), 2.245~2.176(m, 1H), 1.940~1.871 (m, 1H), 1.488~1.404 (m, 1H), 0.926 (d,J= 6.4 Hz, 3H), 0.840(d,J= 6.4Hz, 3H);13C NMR (100MHz, DMSO-d6):δ 169.43, 164.51, 163.81, 150.69, 142.54, 138.73, 134.79, 131.44, 130.18, 129.18, 126.73, 124.98, 122.79, 120.79, 120.20, 109.07, 104.58, 52.89, 44.19, 37.45, 25.35, 23.62, 22.60; FTIR (KBr, cm-1): 3281, 3096, 2948, 2859, 1680, 1648, 1580, 1535, 1450, 1361, 1242, 1153, 830, 774; HRMS (ES+) calcd for C28H34N5O5S ([M+H])+552.2281, found 552.2244。
3 性能评价
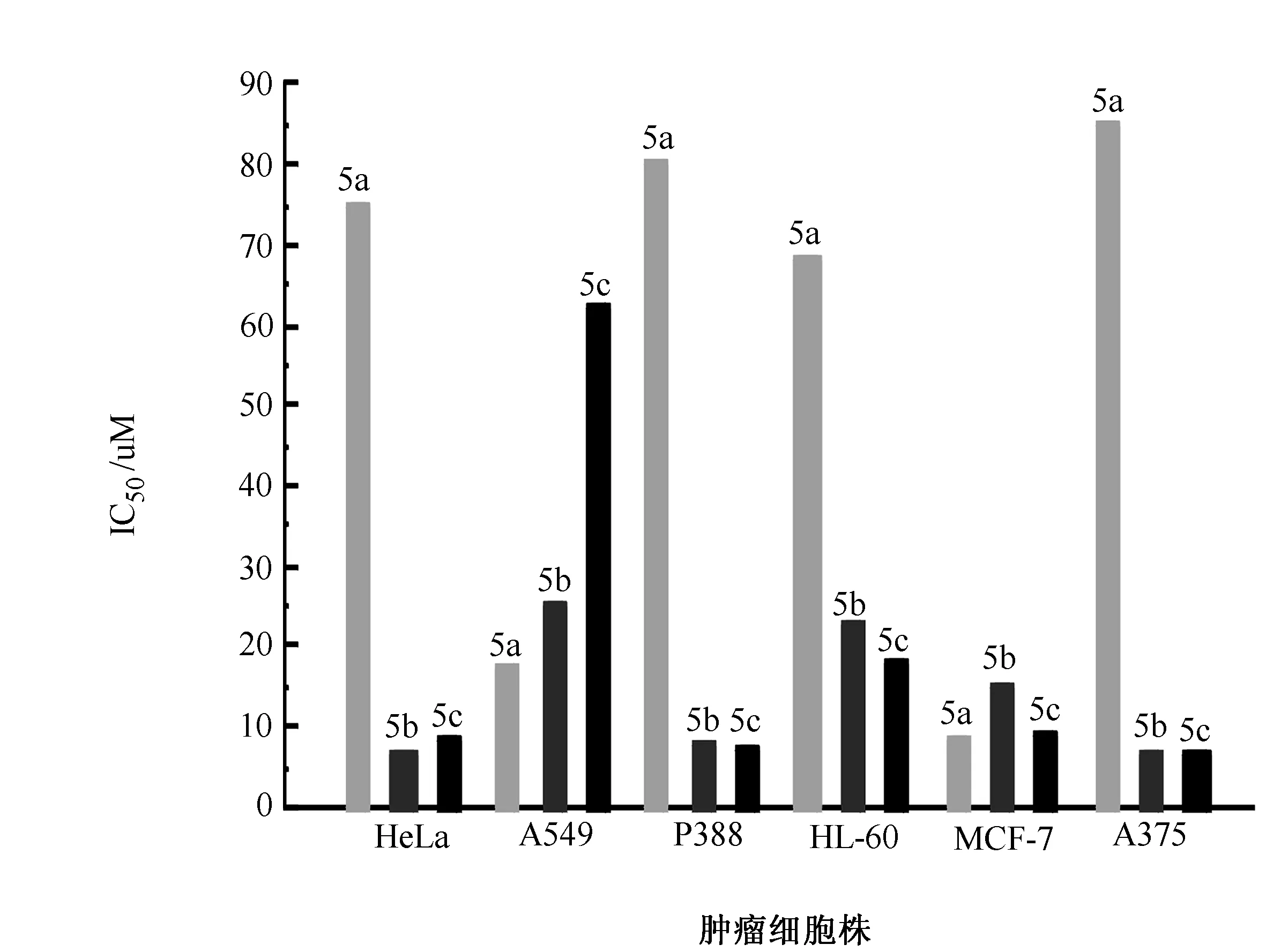
图2 目标化合物对肿瘤细胞株的增长抑制活性
目标化合物对6种不同的肿瘤细胞株(HeLa、A549、P388、HL-60、MCF-7和A375)的细胞毒性见图2。IC50值表示抑制细胞增长达50%时所需要的药物浓度。从图2中可以看出,该类化合物对所测试的肿瘤细胞株均表现出较好的增长抑制活性。化合物5a、5b和5c分别对MCF-7、A375和A375细胞株表现出最强的增长抑制活性,IC50值分别为8.6、6.5和6.6μM,而对不同的肿瘤细胞株HeLa、A549、P388、HL-60、MCF-7和A375而言,最高活性的化合物则分别为5b(HeLa)、5a(A549)、5c(P388)、5c(HL-60)、5a(MCF-7)和5b(A375)。很明显,连接在亮氨酸羧基部分的芳胺取代基,对化合物的生物活性和选择性产生明显的差异。当取代基为邻连二茴香胺和磺胺时,化合物对所测试的肿瘤细胞珠表现出较好的活性。由此可见,在萘酰亚胺的2-位是一个很关键的活性位点,合适的取代基的引入可以明显提高或改进化合物的抗肿瘤选择性[16];而且,其6-位上N,N-二甲基氨基乙二胺基的引入则可以显著提高化合物的细胞毒性,可能的解释是其侧链上的叔胺N原子在生理条件下发生一定程度的质子化,而质子化后的铵盐可以与DNA的碱基之间形成氢键,氢键的形成对于化合物细胞毒性的提高具有一定的促进作用[17,18]。
4 结 语
一个化合物的抗肿瘤活性是由多种因素共同决定的,如化合物对细胞膜的通透性、与蛋白的键合和转运能力、与DNA的结合能力以及药物代谢等因素都对其抗肿瘤活性有着重要的影响,只有当这些影响因素有效地组合平衡之后,才有可能获得高效的抗肿瘤化合物[19]。因此,对萘酰亚胺-亮氨酸加合物进行结构修饰可以获得性能优越的抗肿瘤化合物,很大程度上取决于对其侧链取代基的结构和构型的改造[16]。该系列化合物进一步的结构和性能优化正在进行中。
[3]Quaquebeke E V,Mahieu T,Dumont P,etal.2,2,2-Trichloro-N-({2-[2-(dimethylamino)ethyl]-1,3-dioxo-2,3-dihydro-1H-benzo[de]isoquinolin-5-yl}carbamoyl)acetamide (UNBS3157), a novel nonhematotoxic naphthalimide derivative with potent antitumor activity[J]. J Med Chem,2007, 50(17): 4122~4134.
[4]Zhu H, Huang M, Yang F,etal.R16, a novel amonafide analogue, induces apoptosis and G2-M arrest via poisoning topoisomerase II[J]. Mol Cancer Ther,2007, 6(2): 484~495.
[5]Hsiang Y, Jiang J, Liu L. Topoisomerase II-mediated DNA cleavage by amonafide and its structural analogs[J]. Mol Pharmacol,1989, 36: 371~376.
[6]Ratain M J, Mick R, Berezin F,etal.Phase I study of amonafide dosing based on acetylator phenotype[J]. Cancer Res,1993, 53: 2304~2308.
[7]Hsin L, Wang H, Kao P,etal.Synthesis, DNA binding, and cytotoxicity of 1,4-bis(2-amino-ethylamino)anthraquinone-amino acid conjugates[J]. Bioorg Med Chem,2008, 16:1006~1014.
[8]Paul A, Vicent M J, Duncan R. Using small-angle neutron scattering to study the solution conformation of N-(2-hydroxypropyl)methacrylamide copolymer-doxorubicin conjugates[J]. Biomacromolecules,2007, 8(5): 1573~1579.
[9]Rao K S P B, Collard M M, Dejonghe J P C,etal.Vinblastin-23-oyl amino acid derivatives: chemistry, physicochemical data, toxicity, and antitumor activities against P388 and L1210 Leukemias[J]. J Med Chem,1985, 28(8): 1079~1088.
[10]Song L, Bevins R, Anderson B D. Kinetics and mechanisms of activation of α-amino acid ester prodrugs of camptothecins[J]. J Med Chem,2006, 49(14): 4344~4355.
[11]Auclair C, Voisin E, Banoun H,etal.Potential antitumor agents: synthesis and biological properties of aliphatic amino acid 9-hydroxyellipticinium derivatives[J]. J Med Chem,1984, 27(9): 1161~1166.
[12]Margiotta N, Papadia P, Lazzaro F,etal.Platinum-based antitumor drugs containing enantiomerically pure α-trifluoromethyl alanine as ligand[J]. J Med Chem,2005, 48(24): 7821~7828.
[13]Kuroda M, Mimaki Y, Sashida Y,etal.Novel cholestane glycosides from the bulbs of ornithogalum saundersiae and their cytostatic activity on leukemia HL-60 and MOLT-4 cells[J]. Tetrahedron,1997, 53(34): 11549~11562.
[14]Skehan P, Storeng R, Scudiero D,etal.New colorimetric cytotoxicity assay for anticancer-drug screening[J]. J Natl Cancer Inst,1990, 82: 1107~1112.
[15]Yang P, Yang Q, Qian X,etal.Novel synthetic isoquinolino[5,4-ab]phenazines: inhibition toward topoisomerase I, antitumor and DNA photo-cleaving activities[J]. Bioorg Med Chem,2005, 13: 5909~5914.
[16]Wu A, Xu Y, Qian X. Novel naphthalimide-amino acid conjugates with flexible leucine moiety as side chain: design, synthesis and potential antitumor activity[J]. Bioorg Med Chem ,2009, 17: 592~599.
[17]Xiao S, Lin W, Wang C,etal.Synthesis and biological evaluation of DNA targeting flexible side-chain substituted β-carboline derivatives[J]. Bioorg Med Chem Lett,2001, 11: 437~441.
[18]Guan H, Chen H, Peng W,etal. Design of β-carboline derivatives as DNA-targeting antitumor agents[J]. Eur J Med Chem,2006, 41: 1167~1179.
[19]Li Z, Yang Q, Qian X. Novel thiazonaphthalimides as efficient antitumor and DNA photocleaving agents: effects of intercalation, side chains, and substituent groups[J]. Bioorg Med Chem,2005, 13: 4864~4870.
[编辑] 洪云飞
O622.62
A
1673-1409(2009)02-N029-05
2009-02-04
国家自然科学基金资助项目(90713026/C0508)。
吴爱斌(1973-), 男, 1995年大学毕业,讲师,博士生,现主要从事有机合成和应用化学方面的研究工作。

