月季组培最优条件的选择
邱文青 季 静 杜长城
摘要:综述了月季组织培养、快繁的研究技术及进展,并对月季组培的最优条件进行了总结。
关键词:月季;组培;快繁
中图分类号:S685.12文献标识码:A DOI编码:10.3969/j.issn.1006-6500.2009.03.009
Optimal Choice of Rose Tissue Culture
QIU Wen-qing1,JI Jing1,DU Chang-cheng2
(Agriculture and Biology Engineering College,Tianjin University,Tianjin 300072,China;2.Forestry Bureau of Tianjin,Tianjin 300061,China)
Abstract:The technology and progress on rose tissue culture and rapid propagation were reviewed in this article, and the optimal conditions of rose tissue culture were also summarized.
Key words: rose;tissue culture;rapid propagation
月季(Rosa chinensis)别名长春花、月月红、斗雪红、瘦客等,蔷薇科(Rosaceae)蔷薇属(Rosa L.)植物,是世界上著名的四大切花之一[1]。由于其特殊的情感内涵和商品价值[2],被广泛应用于园林、庭院装饰,并可制成月季盆景,作切花、花篮、花束等。此外,月季花可提取香料,根、叶、花均可入药,具有活血消肿、消炎解毒等功效。当前,月季育种是花卉育种中最活跃的领域之一。月季通常采用扦插、嫁接和压条繁殖,但是一些名贵品种扦插不易生根,主要靠芽接繁殖,而芽接速度慢,因而造成优良品种的月季苗供不应求[3]。随着生物技术的迅猛发展,植物组织培养和细胞培养等现代生物技术得到普遍重视和应用,为月季的快繁和新品种的选育提供了新的途径,在月季的改良上显示了很大的应用潜力。同时,月季组培和遗传转化系统的建立也是体细胞克隆变异育种和基因工程育种的重要前期工作[4]。笔者综述了近年来月季组培技术,并对其最优条件进行了总结。
1月季组培方法及最优条件
1.1外植体的选择、消毒及接种
外植体一般选取生长健壮的当年生枝条的饱满而未萌发的侧芽。取回枝条用自来水冲洗干净,无菌条件下用70%酒精表面消毒30~40 s,再用0.1%HgCl2溶液灭菌5~10 min,最后用无菌水冲洗3~5次。芽的快速繁殖与供试材料的基因型有关,同时还与外植体的取材部位有关,来源于枝条中部的侧芽的繁殖速率最快[5]。李青等[6]分别选取一年生枝条的冬芽和当年生枝条的腋芽作为外植体,相同条件下培养发现越冬芽的成活率较高,且从接种到萌动时间较短,生长快,在后代繁殖中植株健壮。于冰沁[7]在外植体的接种中采用了垂直接种,斜向上45°接种,水平接种和反转接种4种方式,发现垂直接种和斜向上45°接种是最佳的接种方式,腋芽再生芽数多,且生长健壮,这可能与植物的生长极性有关。
诱导培养基以MS为基本培养基,附加适量的细胞分裂素6-苄氨基嘌呤(6-BA)和生长素萘乙酸(NAA)。NAA增加至0.1 mg/L时,6-BA浓度的高与低已对增殖系数不产生明显影响[6]。最适的侧芽诱导培养基为MS+6-BA 0.5~3.0 mg/L+NAA 0.01~1.0 mg/L[6-9],且培养基中添加蔗糖有增加丛生芽数量的作用[10]。
1.2继代增殖
将诱导培养基上已经萌发的嫩芽转入附加6-BA、NAA等激素的MS培养基中,进行增殖继代。KT,IAA等激素作用效果较差,协同作用不明显[6]。低浓度的6-BA有利于不定芽的增殖,浓度过高则抑制不定芽增殖,适量NAA有利于芽和叶生长[7],但浓度过高诱导产生大量愈伤组织,不利于侧芽的直接分化和生长[8]。在 NAA 浓度相同而BA 浓度不同的培养基中,随BA 浓度的升高,芽苗的增殖系数也相应提高。在BA 浓度相同而NAA 浓度不同的培养基中,随NAA浓度升高,小芽生长速度加快,继代所需时间对增殖系数也有一定的影响[9]。此外,增殖系数还与品种有关[6]。从增殖倍数、叶片数、再生芽长势等综合因子来看 ,MS+BA 0.5~2.0 mg/L+NAA 0.01~0.05 mg/L 是最适的不定芽增殖培养基(表1)。

1.3生根培养
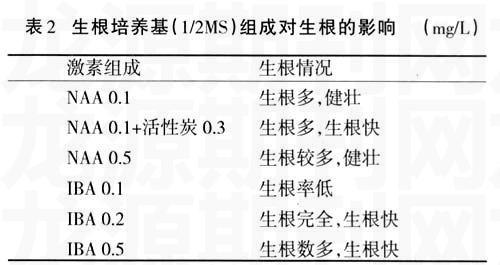
无菌芽苗在继代培养基中只诱导地上部分生长。待培养一段时间后,转入生根培养基中,诱导生根。多数试验采用的培养基为1/2 MS[6,9](大量元素减半)。Skirvin 等[13]在用“Forever yours”月季做生根试验时发现,采用1/4MS 培养基,不加生长素即可以促进生根。在无菌苗的生根诱导过程中,生长素的种类和浓度起决定性作用。李青等[6]分别使用不同浓度的NAA、IBA、IAA对藤本月季进行生根培养,发现3种生长素的生根效果不同,且浓度的影响较大。李海燕等[8]发现低浓度的生长素有利于根的形成,适当浓度的IBA、NAA对生根率有显著影响,浓度过高会抑制根的形成,NAA浓度为0.50 mg/L时效果最佳(表2)。生根阶段加入活性炭(AC)后,有助于提高生根率和生根质量[11]。李青等[6]利用1/2 MS+IBA 0.2 mg/L +活性炭诱导生根,生根率最高为90%,且随着活性炭百分比的加大,生根率逐渐下降。活性炭的加入能显著促进生根量和根的长势,但仅含活性碳的培养基只见较少发根,且根细弱,说明植物激素对于生根是必不可少的[9]。Hyndman等[12]用改良烟火月季品种进行研究发现,MS培养基中盐浓度过高,特别是氮素含量过高会导致生根不适应,所以需减少无机盐用量。
1.4移 栽
小苗接到生根培养基上后,14 d可见基部分化出根点,20 d则长出许多白根。此时组培阶段结束,进入试管苗移栽成活阶段。所有试管苗移栽前都应先将生根苗移至室温进行移栽前的锻炼。锻炼时间与移栽成活率有关,炼苗7 d以上,成活率达到95%[6]。影响移栽成活率的主要因素有3个:湿度、温度以及基质种类和带菌量[15,16]。考虑到这3个因素,移栽时应保持90%以上湿度,18~25 ℃的环境温度,基质用0.2%的高锰酸钾[14]或其他灭菌剂进行消毒灭菌[15]。而基质的选择上,以蛭石和珍珠岩的栽培效果较好。移栽成活后喷极稀的营养液,使小苗得到营养补充。10~15 d即长出新叶,且根系快速生长,可适时进行大田移栽。
2讨 论
(1)外植体应选取当年生饱满而未萌发的侧芽,来源于枝条中部的侧芽的繁殖速率最快。外植体的接种方式对再生芽生长量具有较大的影响,垂直接种,斜向上45°接种是最佳的接种方式。最适的侧芽诱导培养基为MS+6-BA 0.5~3.0 mg/L+NAA 0.01~1.0 mg/L。
(2)继代增殖中,低浓度的6-BA有利于不定芽的增殖,浓度过高则抑制不定芽增殖,又诱导大量愈伤组织。从增殖倍数、叶片数、再生芽长势等综合因子来看,MS+BA 0.5~2.0 mg/L+NAA 0.01~0.05 mg/L 是最适的不定芽增殖培养基。
(3)在无菌苗的生根诱导过程中,生长素的种类和浓度起决定性作用。培养基一般选择1/2 MS,激素浓度控制在0.1~0.5 mg/L。活性炭对生根有一定的促进作用。
(5)影响移栽成活率较大的因素有3个:湿度、温度和基质消毒灭菌。严格控制这3个条件能得到很高的成苗率。
参考文献:
[1] 郭志刚,张伟.月季[M]. 北京:中国林业出版社,2000.
[2] 余树勋.月季[M].北京:金盾出版社,1992.
[3] 林玉红.月季试管苗繁殖的研究[J].甘肃农业科技,1994 (1):36-37.
[4] 李美茹,李洪清,孙梓健,等.月季的组织培养和基因转化研究进展[J]. 广西植物,2003,23(3):243-249.
[5] Bressan P H,Kim Y J,Hyndman S E,et a1.Factors affecting in vitro propagation of rose[J].J Am Soc hort Sci,1982,107:979-990.
[6] 李青,苏雪痕,李湛东.藤本月季组织培养快繁研究[J].北京林业大学学报,1999,21(6):17-21.
[7] 于冰沁. 微型月季组织培养的研究[J]. 辽宁农业科学,2005(4):53-54.
[8] 李海燕,胡国富,胡宝忠.月季组培快繁技术的研究[J]. 东北农业大学学报,2004,35(1):84-88.
[9] 吴雪, 高成华.月季茎尖离体培养的研究[J]. 辽宁师专学报:自然科学版,2007(2):108-110.
[10] Langford P J,Wainwright H. Effect of sucrose concentration on the photosynthetic ability of rose shoots in vitro[J].Ann Bot,1987,60:633-639.
[11] 陈正华.木本植物组织培养及其应用[M]. 北京:高等教育出版社,1986:307-308.
[12] Hyndman S E, Hasegawa P M, Bressan R A. Stimulation of root initiation from cultured rose shoots through the use of ruduced concentrations of mineral salts[J]. Hort Science, 1982, 17( 1) :82-83.
[13] Skirvin R M,Chu M C. In vitro propagation of “Forever Yours” rose[J]. Hort Science, 1979,14(5):608 -610.
[14] 宫本馥,罗珍珍,唐坚志.丰花月季的组织培养和快速繁殖[J].植物生理学通讯,1992,28(2):129-134.
[15] 王惠珍.月季和玫瑰快速繁殖技术的进展[J].佛山农牧高等专科学校学报,1994(S1):59-63.
[16] 冷肖苟.月季的组织培养[J].河北林业科技,2001 (6):6-7.

