羊流产衣原体的PCR检测方法研究
张 莉 王英珍 鄢明华 李秀丽
摘要:根据羊流产衣原体16S rRNA基因保守序列,设计合成一对引物,通过优化PCR反应条件,成功地扩增出预期的523 bp片段,而沙眼衣原体、大肠杆菌、金黄色葡萄球菌及健康鸡胚的卵黄囊膜均未扩增出相应的片段。敏感性试验表明,该体系可检测到2 pg的衣原体DNA。
关键词:羊流产衣原体;PCR;检测
中图分类号:S852.67文献标识码:A文章编号:1006-6500(2009)02-0014-03
Research on the PCR Method to Detect Ovine Chlamydia abortus
ZHANG Li,WANG Ying-zhen,YAN Ming-hua,LI Xiu-li
(Tianjin Institute of Animal Husbandry and Veterinary Science,Tianjin 300112,China)
Abstract:A PCR based detection method was developed using a pair of primers designed from a conserved region of the Chlamydia abortus 16S rRNA gene.This method used all optimized PCR conditions to detect the presence of Chlamydia abortus sequence.A 523 bp fragment was amplified from infected sample,but not from Salmonella, E. coli, Staphylococcus aureus and the yolk sac membrane of health chick embryo.The sensitivity was 2 pg to detect the DNA.
Key words: Chlamydia abortus;PCR;detection
羊流产衣原体病是由流产衣原体(Chlamydia abortus)感染引起的一种以羊大量流产为特征的地方性、亚急性传染病,其症状主要表现为羊的流产和肺炎,羔羊的多发性关节炎等[1,2]。人们对衣原体的研究始于19世纪末,自1950年Stamp等首次报道羊感染流产衣原体发生流产后,相继在世界的多个国家都有了羊流产衣原体病的报道。衣原体是人兽共患病病原体,国内外许多学者都从人体分离到了动物源衣原体,人与患病动物接触可患病(呼吸感染),孕妇感染流产衣原体后发生流产[3]。因此,对衣原体的研究具有重要的公共卫生意义。
国内外学者对衣原体检测技术进行了许多探讨,例如ELISA和间接血凝试验等[4,5]。随着人们对衣原体基因组研究的深入,分子诊断技术逐渐应用于衣原体病的快速诊断,并因其高的特异性、敏感性和准确性,被研究者所认同。笔者根据羊流产衣原体16S rRNA 基因的保守序列设计并合成引物,以建立用于该病的PCR 诊断技术。
1材料和方法
1.1材 料
羊流产衣原体ZT1株由本实验室分离和保存;沙眼衣原体、大肠杆菌、金黄色葡萄球菌购自中国兽药监察所;羊鹦鹉热衣原体油乳剂灭活疫苗购自中国农科院兰州兽医研究所;布氏杆菌病活疫苗(S2株) 购自黑龙江省生物制品一厂;Taq酶、dNTP、10×PCR Buffer购自大连宝生物技术有限公司;引物由Invitrogen公司合成。
1.2方 法
1.2.1衣原体菌株的增殖将衣原体接种6日龄的SPF鸡胚卵黄囊,37 ℃温箱培养4~10 d,收获死亡鸡胚的卵黄膜冻存于-20 ℃备用[6]。
1.2.2引物根据羊流产衣原体的16S rRNA基因的保守序列设计合成一对引物。序列为:
ChU1:5' -CCCCAAGCCAGCATCTAATA3'
ChL1:5' -CCCAGGCAGTCTCGTTAGAG 3'
1.2.3DNA的提取将收获的衣原体培养物加入PBS研磨成悬液,4 000 r/min离心10 min取上清445 μL,加入12.5 μL蛋白酶K(20 mg/mL)和25 μL10%SDS,56 ℃水浴2 h,苯酚、苯酚:氯仿、氯仿分别抽提一次,吸取水相,加入2倍体积的无水乙醇后在-20 ℃沉淀1 h,10 000 r/min离心10 min,沉淀经70%乙醇洗涤,干燥后溶于20 μL TE 中,-20 ℃冻存备用。DNA浓度测定采用分光光度计法。
1.2.4PCR 扩增体系采用50 μL PCR 反应体系:20 μmol/L 引物ChU1和ChL1各1 μL,10×PCR Buffer (含500 mmol/L KCl,100 mmol/L Tris-HCl,1% TritonX-100 和15 mmol/L MgCl2 )5 μL,25 mmol/L dNTPs 4 μL,Taq DNA聚合酶0.5 μL,DNA模板2 μL,去离子水36.5 μL。
扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55~65 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳观察扩增结果。
1.2.5PCR最佳反应体系的优化除以下优化的反应条件外,均按1.2.4所述条件进行。
(1)引物浓度的选择设定20,30,40 μmol/L 3个浓度梯度,每个梯度设置3个重复。
(2)dNTPs最佳浓度的选择设定dNTP的浓度为25,50,100,150 ,200 mmol/L 5个梯度。
(3)复性温度的选择选择55,56,57,58,59,60,61 ℃的复性温度进行PCR扩增,确定最适反应温度。
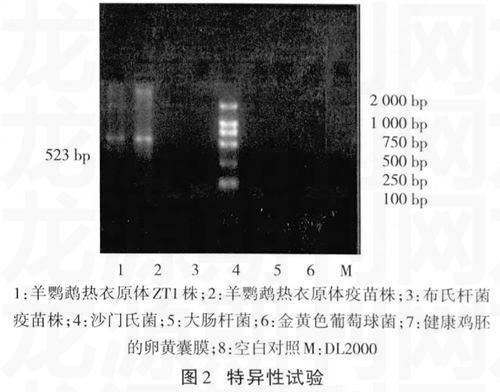
1.2.6PCR 特异性试验分别取羊鹦鹉热衣原体分离株ZT1、羊鹦鹉热衣原体疫苗株、布氏杆菌疫苗株、沙门氏菌、大肠杆菌、金黄色葡萄球菌及健康鸡胚的卵黄囊膜的DNA进行PCR扩增,并设立水对照,凝胶电泳观察结果。
1.2.7PCR 敏感性试验提取的衣原体DNA采用分光光度计法进行浓度测定,并稀释至0.1pg、1pg、10pg和100pg倍,分别取2 μL作为模板进行PCR。以出现阳性反应条带的最低DNA浓度,推算可检出的最低DNA含量。
1.2.8重复性试验取3份不同代次的衣原体样品进行重复性检测。
1.2.9PCR产物的鉴定将PCR扩增产物送大连宝生物公司测序。
2结果与分析
2.1PCR最佳反应体系的优化
2.1.1引物浓度的选择 采用20,30,40 μmol/L 3个浓度进行扩增,结果20 μmol/L和30 μmol/L虽能扩增出预期产物,但引物二聚体明显,而40 μmol/L时,扩增条带清晰,且没有引物二聚体。因此,选择40 μmol/L为最佳引物浓度。
2.1.2dNTPs最佳浓度的选择分别以25,50,100,150,200 mmol/L 5个浓度进行扩增,结果显示,100 mmol/L以上均可扩增出明显的特异性条带,基于成本的考虑,选择100 mmol/L为最佳dNTPs浓度。
2.1.3复性温度的选择选择55,56,57,58,59,60,61℃ 7个复性温度进行扩增,结果如图1,7个温度均能扩增出特异性条带,但61 ℃扩增条带最亮,且引物二聚体最不明显,为最佳复性温度。

2.2PCR 特异性试验
将提取的羊流产衣原体、沙门氏菌、大肠杆菌、金黄色葡萄球菌及健康鸡胚的卵黄囊膜的DNA进行PCR扩增,结果显示,只有羊流产衣原体菌株能够扩增出预期大小的PCR产物(图2)。经测序鉴定,扩增产物与预期产物的序列完全一致,进一步说明了PCR反应的特异性。
2.3PCR 敏感性试验
取不同稀释度的羊流产衣原体DNA 进行PCR扩增,结果显示,2 pg的DNA作为模板可以扩增出特异性条带,说明该PCR方法最低可检出2 pg的衣原体DNA(图3)。

2.4重复性试验
取3份不同代次的衣原体样品进行重复性检测,结果一致,均可扩增出特异性条带。
3讨 论
(1) PCR扩增的特异性与引物有很大关系,引物设计不合理,则会增加非特异性反应。本研究设计的引物对沙门氏菌、大肠杆菌、金黄色葡萄球菌、布氏杆菌这几种阴道分泌物中较多的细菌及健康鸡胚的卵黄囊膜的DNA进行PCR扩增,结果均为阴性,只有羊流产衣原体扩增出了特异性的条带。证明了所设计引物的可靠性和特异性。
(2) dNTPs的浓度与PCR产物量密切相关。当dNTPs浓度太高时,会抑制Taq DNA聚台酶的活性;当dNTPs浓度太低时,PCR产物量低。本研究通过设计不同的dNTPs浓度进行PCR 结果对比,认为100 mmol/L为最佳浓度。
(3)在PCR反应的温度循环参数中,复性温度对不同的PCR反应体系而言差异较大,复性温度的选择直接与引物的序列组成有关。本试验应用梯度PCR仪,设定了不同的温度,比较PCR结果,认为61 ℃为最适复性温度。
PCR具有敏感性高、特异性好和快速简便的优点,在羊流产衣原体病上的应用有待于更多学者的深入研究。
参考文献:
[1] 张莉.羊衣原体病诊断方法的研究进展[J].猪业科学,2006(增刊):25-27.
[2] 臧洪波,徐丽颖.鹦鹉热衣原体导致羊繁殖障碍疾病[J]. 黑龙江动物繁殖,2003,11(1):34-35.
[3] Pospischil A, Thoma R, Hilbe M, et al. Abortion in woman caused by caprine Chlamydophila abortus (Chlamydia psittaci serovar 1) [J]. SWISS MED WKLY, 2002, 132:64-66.
[4] 王英珍,鄢明华,李秀丽,等.河南省部分地区山羊衣原体病血清学检测[J].动物医学进展,2004,25(5):133.
[5] 姚四新,宋东亮,任晓丽,等.猪羊衣原体病的血清学调查[J].今日畜牧兽医,2007(3):56.
[6] 王英珍,张莉,李秀丽,等.羊衣原体性流产的病原分离培养与鉴定[J].中国兽医科技,2004(增刊):13-15.

