红豆杉内生菌的分离及抗植物病害活性物质的初步筛选
郑法新 程 璐 李 侠 房保海 刘 群 刘丹赤 李玉环
摘要 以云南红豆杉的根、茎、叶为材料,从中分离出内生菌163株,其中细菌91株,真菌48株,放线菌24株;以棉花枯萎、小麦赤霉、番茄叶霉等11种病原真菌作为靶标菌,研究红豆杉内生菌的抗菌活性,筛选出了有较高抗菌活性的3株内生真菌、11株内生细菌和5株内生放线菌。
关键词 红豆杉;内生菌;分离;活性物质筛选
中图分类号 S791.49 文献标识码 A 文章编号 1007-5739(2009)05-0108-02
植物内生菌(Plant endophyte)是微生物中的一个重要类群,能参与植物次级代谢产物的合成与转化或独立合成次级代谢产物,其物种丰富,数量庞大,已经成为新医(农)药活性物质的潜在资源。研究显示,目前从植物内生菌中分离出的生物活性物质,大约51%属于未报道过的新化合物[1]。因此,植物内生菌相关领域的研究工作愈来愈受到国内外同行的关注。
近年关于传统药用植物以及特殊生境中植物的内生菌研究是一个新兴的研究热点[2]。云南红豆杉(Taxus yunnane-nsis Cheng et L.K.Fu)是含有抗癌药物紫杉醇的药用植物,属红豆杉科乔木,高达 30m,胸径可达lm,产于云南西部至西北部、四川西南部、西藏东部,生于海拔2 000~3 500m高山地带,国外缅甸、锡金、不丹也有分布[3,4]。是否能从与红豆杉共生的内生菌或其代谢物中寻找其他新型防治植物病虫害药物,笔者从红豆杉中分离的细菌及真菌,以棉花枯萎、番茄叶霉等植物病害微生物为筛选模型来筛选红豆杉内生菌产生的抗病活性物质进行尝试。
1 材料与方法
1.1 材料
1.1.1 植物材料。于2008年9月选择云南省维西县塔城乡天然长成的成熟健康红豆杉植株,采集没有腐烂发霉及病斑、病虫害的健康新鲜植物组织备用。
1.1.2 病原菌。棉花枯萎病菌(Fusarium oxysporium sp.Vasinfe-ctum),西瓜枯萎病菌(Fusarium oxysporium f.niveum Snyder et He-ansen),苹果烂病菌(Valsa mali Miyabe et Yamada),玉米弯孢病菌(Curvularia lunata),苹果炭疽病菌(Glomerella cingulata),小麦纹枯病菌(Rhizoctonia cerealis),番茄早疫病菌(Alternaria so-lani),小麦赤霉病菌(Fusarium graminearum Schw),葡萄炭疽病菌(Glomerella cingulata Spauld),马铃薯干腐病菌(Pythium sola-ni),番茄叶霉病菌(Fulria fulva),以上菌株由山东出入境检验检疫局房保海工程师馈赠。
1.1.3 培养基。分离细菌所用培养基为牛肉膏蛋白胨培养基,即琼脂20g,牛肉膏3g,蛋白胨10g,NaCl 5g,水1 000mL,pH值7.0~7.2。分离真菌以及靶标菌的培养基为马铃薯葡萄糖培养基,即马铃薯200g,葡萄糖20g,琼脂20g,水1 000 mL。分离放线菌培养基为高氏Ⅰ号培养基,即可溶性淀粉20g,KNO3 1g,NaCl 0.5g,MgSO4 0.5g,FeSO4 0.01g,K2HPO4 0.5g,琼脂20g,水1 000mL,pH值7.2~7.4。培养基在高压灭菌后备用,纯化培养基与分离培养基组成成分相同。
1.2 方法
1.2.1 内生真菌的分离。先用自来水将所采集的红豆杉植物组织表面冲洗干净,晾干水分后分别切取根、茎和叶,采用下述方法进行表面消毒[5]:0.1%升汞漂洗(10~30s)→无菌水冲洗数次→75%酒精漂洗(30~60s)→无菌水冲洗数次。在无菌操作条件下取根、茎和叶,切成0.2cm×0.2cm长段(片),种植于加青霉素的PDA培养基中,在(28±1)℃条件下置于温箱静止培养3~7d。同时将上述经表面灭菌的材料不做任何处理直接种植于加青霉素的PDA培养基中,在(28±1)℃条件下置于温箱培养,检查表面消毒是否彻底。
1.2.2 内生放线菌和细菌的分离。将无菌处理的红豆杉根、茎、叶样品各3g,每样品加10mL 无菌水碾碎静置15min后,用无菌移液枪各取70μL涂在牛肉蛋白胨培养基、高氏Ⅰ号培养基平板上,28℃黑暗培养,分离细菌培养3~5d,分离放线菌培养5~8d。
1.2.3 内生菌的纯化。对内生真菌,取切口处新长出的菌丝,及时转接至新鲜PDA培养基上,对内生细菌和内生放线菌,待菌落出现后,根据菌落形态、颜色的差异以及长出时间的不同,分别挑取各平板上的菌落边缘的细胞接于新的牛肉膏蛋白胨培养基和高氏Ⅰ号培养基上进行划线分离培养。培养数日后,观察菌落的形态及其菌落边缘的整齐情况,并做相应的记录。对菌株编号后,转至新鲜箱斜面培养基上,于28℃培养箱中培养5~7d,然后放入4℃冰箱保存[6]。
1.2.4 拮抗菌活性测定。拮抗菌活性测定采用对峙培养法。在超净工作台上进行无菌操作:将直径6mm的供试病原真菌的菌块接种于PDA培养基的培养皿中央,再用直径6mm的打孔器在生长7d左右的内生真菌菌落边缘制备菌饼,并接种于PDA平板上距中心2cm处同一直线的两点上,对照不接筛选菌,28℃下培养72h,测量各筛选菌菌落边缘和病原菌菌落边缘之间的抑菌距离,选择拮抗作用明显的菌进行复筛或鉴定[7-9]。该试验重复2次,每次设3个重复。细菌和放线菌的抗病原真菌活性筛选采用混浇平板法。用PDA液体培养基28℃下振荡培养12h,发酵液10 000 rpm离心10min,取上清液,重复3次。将1.5mL滤液和15 mL PDA培养基于60℃左右混合均匀倒入培养皿,冷却凝固后,在每个培养皿中接入直径为6mm的供试病原真菌菌块,28℃下培养4d。以直接培养的病原菌作为对照[10,11],发酵液活性高的菌株将会抑制病原菌的生长。
2 结果与分析
2.1 红豆杉不同组织部位内生菌数量
对分离自红豆杉不同组织部位的内生菌数量进行分析,结果表明,红豆杉不同组织部位的内生菌种类和数量存有较大的差异,总体上来说,内生菌数量在红豆杉根中的分布最多,叶子中的内生菌数量最少;同时,无论是在根还是在茎和叶中大致的规律是内生细菌数量最多,其次是真菌,放线菌数量最少,也就是细菌、真菌和放线菌依次呈递减的趋势(见表1)。

2.2 内生真菌对病原真菌的拮抗作用
从红豆杉的各种组织中分离得到内生真菌48个菌株,通过对峙生长法,测定了内生真菌各菌株对其中11种病原真菌的皿内拮抗作用,结果表明,其中5株内生真菌对7 种病原真菌有较强的拮抗作用(见表2)。
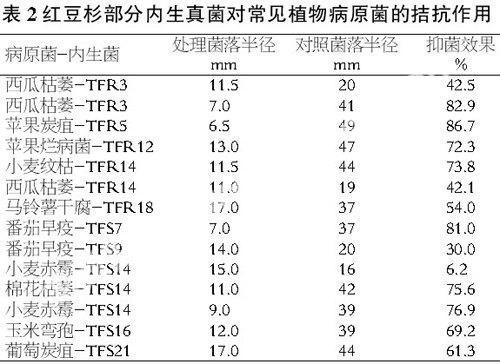
由表2可以看出,分离得到的内生真菌都有不同程度的抑菌作用,其中根和茎中分离的TFR3、TFR5、TFR14、TFS1、TFS14的抑菌作用最强,最为显著的是TFR5对苹果炭疽的拮抗作用。
2.3 内生细菌、放线菌对病原真菌的拮抗作用
经过混浇平板法培养4d,观察并记录结果,发现4株放线菌、8株细菌的发酵液都有很高的抑菌活性(见表3、表4)。
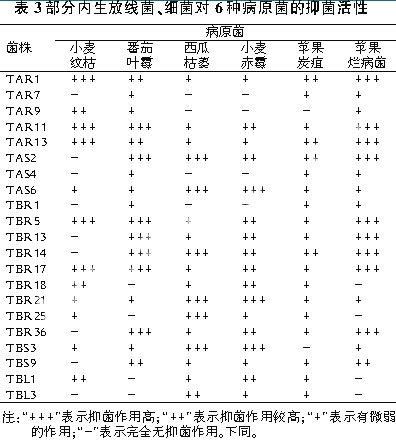
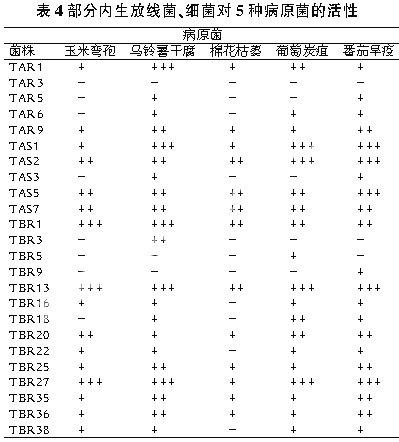
有抑菌作用的细菌占分离得到的内生细菌总数的13.75%,真菌占20.83%,放线菌占37.5%。其中TAR1对小麦纹枯病菌、苹果烂病菌、马铃薯干腐,TAR11对小麦纹枯病菌、番茄叶霉病菌、苹果烂病菌,TAR13对小麦纹枯病菌、苹果烂病菌,TAS1对马铃薯干腐、葡萄炭疽、番茄早疫,TAS2对番茄叶霉病菌、西瓜枯萎病菌、苹果烂病菌、葡萄炭疽、番茄早疫,TAS5对番茄早疫,TAS6对西瓜枯萎病菌、小麦赤霉,TBR1对玉米弯孢、马铃薯干腐,TBR5对小麦纹枯病菌、番茄叶霉病菌、苹果烂病菌,TBR13对番茄叶霉病菌、苹果烂病菌、玉米弯孢、马铃薯干腐、番茄早疫,TBR14对番茄叶霉病菌、西瓜枯萎病菌、苹果烂病菌,TBR17对小麦纹枯病菌、番茄叶霉病菌、苹果烂病菌,TBR21对西瓜枯萎病菌、小麦赤霉,TBR25对西瓜枯萎病菌,TBR27对玉米弯孢、马铃薯干腐、葡萄炭疽、番茄早疫,TBR36对番茄叶霉病菌,TBS3对西瓜枯萎病菌、小麦赤霉病菌都有很强的抑制作用,基本限制了病原体菌丝的生长与繁殖。
3 结论与讨论
试验结果表明,云南红豆杉组织内存在丰富的内生菌,不同组织内生菌的数量、种类有一定差异,在具有抑菌活性的菌物中,放线菌占的比例最高。另外,由于细菌也能产生丰富的次级代谢产物,因此可作为对多种病原菌具有抑菌活性物质筛选的资源。
目前,植物内生菌分离方法大多数采用常规表面消毒法,本试验对此方法进行了改进,先用消毒效果更好的0.1%升汞漂洗10~30s进行消毒。为确保所分离到的微生物为植物体内生菌,采用的表面消毒比一般组织培养消毒更为严格,并对所消毒材料冲洗后的第4次无菌水进行涂板培养,如在2~3d内没有菌落产生,则认为该材料消毒彻底,证明所分离到的为内生菌。但用此消毒方法也易于杀死植物体内微生物,因而所分离到的内生菌种类与数量可能比植物体内所含的要少些。
在进行内生菌分离的过程中,掌握适宜的材料消毒时间对最终分离到的内生菌的数量和种类都具有极其重要的作用。另外,所用培养基均为常规分离用的培养基,因而不能保证所有生活在红豆杉组织内的微生物能够全被分离出来,可能有的稀有微生物不能在人工培养基上生长。所选用的材料为天然生长70年左右的红豆杉树,所以不能确定生长期更长的红豆杉材料中内生菌数量和种类是否更多,产出的活性物质是否更强,这有待进一步探索和研究。试验选用的测试菌种也是从本实验室随机选取的,不能测出内生菌对所有病原菌的抑制作用,只是做了初筛,为进一步复筛奠定了基础。内生菌系统地分布于植物体根、茎、叶、花、果实和种子等器官、组织的细胞或细胞间隙。近年来,已从宿主植物的根、茎、叶及储藏器官内分离到大量内生细菌。本试验从根、茎中分离出细菌和真菌数量较多,从叶中分离出少量内生真菌,与文献报道的叶片内生真菌分布比较少的结论类似;从根中分离出较多量内生真菌的结果与文献报道的不同。
4 参考文献
[1] STROBELG A.Endophytes as sources of bioactive products[J].Microbes and Infection,2003(5):535-544.
[2] FR?魻HLICH J,HYDE KD.Palm Microfungi,Fungal Diversity Research Series:3.Fungal[M]. Hong Kong:Diversity Press,2000.
[3] WANI M C,TAYLOR H I,WALL M E,et al.Plant antitumor agents IV The isolation and structure of taxol,a novel anti-leukemic and antitumor agent from Taxus brevffolia[J]. J Am Chem Soc,1971,93(9):23-25.
[4] SCHIFF P B,FANT J,HORWITZ S B. Promotion of microtubule assembly in vitro by taxol[J].Nature,1979,277(5698):665-667.
[5] 邵士成,吴少华,陈有为,等.云南元江印楝植物内生真菌的种类组成[J].生物多样性,2008,16(1):63-67.
[6] 郭建新,孙广宇,张荣,等.银杏内生真菌抗真菌活性菌株的分离和筛选[J].西北农业学报,2005,14(40):14-17.
[7] 田小曼,吴云锋,张珏.青蒿内生菌的分离及抗病活性物质的筛选[J].西北农业学报,2008,17(4):186-190.
[8] 王美琴,陈俊美,薛丽,等.番茄内生细菌的分离及拮抗菌的筛选[J].山西农业科学,2007,35(2):55-58.
[9] 袁秀英,白红霞,白玉明,等.杨树内生真菌的分离和拮抗生防菌的筛选[J].林业科学研究,2006,19(6):713-717.
[10] 李萌,张海涛,虞星炬,等.蔬菜内生菌的分离及其生防功能初探[J].江苏农业科学,2003(5):60-65.
[11] 陈风美,孙勇,蒋继宏,等.植物内生真菌抑制细菌活性菌株的筛选[J].腐植酸,2003(6):15-18.

