实验性水上漂浮、高强度运动对大鼠HPA轴和免疫系统的影响
王 坚 赵 旦 李 洁 王国洪 胡兰萍 邵加庆 顾 萍 杜 宏 王扬天
摘要:目的:探讨大鼠经实验性水上漂浮、高强度运动后血清皮质酮(CORT)、促肾上腺皮质激素(ACTH)以及白细胞介素1β、IL-6(IL-1β、IL-6)的变化及垂体ACTH阳性表达细胞的变化。方法:将大鼠随机分为水上漂浮组(A组)、水上漂浮并高强度运动组(B组)、对照组(C组),每组12只,均为10周龄雄性大鼠。A组在人工造浪水池中接受连续180min的水上漂浮,并加以猫恐吓;B组按A组给予如前180min水上漂浮后继续给予连续奔跑120min;C组除与A组、B组同时禁食、水外不给任何应激。实验结束后测定CORT、ACTH及IL-1β、6水平及行垂体ACTH阳性表达细胞的免疫组化分析。结果:与C组相比,A组CORT水平稍增高,但差异无统计学意义(P>0.05),而B组CORT的升高具有统计学意义(P<0.01);与A组相比,B组CORT亦升高(P<0.01)。与C组相比,A组血清ACTH水平无改变(P>0.05),而B组ACTH降低,差异有统计学意义(P=0.033)。与C组相比,A组IL-6升高(P=0.023),B组IL-1β、IL-6均升高(P=0.031,0.022)。免疫组化染色示A、B组垂体ACTH表达阳性细胞数量皆减少(P皆<0.05),但A、B组间差异无统计学意义(P>0.05)。结论:急性心理应激可激活下丘脑-垂体-肾上腺轴,并导致细胞因子IL-6血浓度增加,在心理应激基础上予以单次大强度运动可进一步增加大鼠应激反应的程度,致CORT以及细胞因子IL-1β、6血浓度进一步升高,而ACTH受抑,且垂体ACTH阳性细胞也相应减少。
关键词:大鼠;水上漂浮;高强度运动;垂体肾上腺轴;白细胞介素
中图分类号:G804.7 文献标识码:A 文章编号:1004-4590(2009)02-0068-04
下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis ,HPA轴)是与应激关系最为密切的内分泌轴,无论是心理性应激还是运动应激对HPA轴都有影响,表现为促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)和皮质醇水平的改变。HPA轴的激活或抑制主要与心理性应激或运动应激的时间和强度有关。一般说来,急性应激可激活HPA轴,但慢性应激对HPA轴有抑制作用。细胞因子是一种具有调节细胞功能的高活性小分子蛋白质,能调节免疫细胞的功能,与应激的联系亦十分密切。近年来对应激的研究逐步发展,形成了以心理-神经内分泌-免疫网络为基础之跨学科概念。本文将急性心理应激、高强度运动结合起来,旨在观察急性心理应激及急性心理应激与大强度运动结合后对HPA轴和部分细胞因子的影响。
1 材料与方法
1.1 实验动物与分组
于大鼠跑台适应性训练3天,剔除无法进行跑台运动大鼠后成功筛选雄性Sprague-Dawley大鼠36只,鼠龄10周,体重180±20g(南京军区南京总医院比较医学科提供)。试验前在清洁级动物饲养中心以标准啮齿类动物维持期饲料适应性饲养1周,自由进食和饮水,室内温度为20-26°C,湿度50%-70%,自然昼夜节律光照。大鼠随机分为三组:水上漂浮组(A组)、水上漂浮并高强度运动组(B组)、对照组(C组),每组均为12只。
1.2 实验性水上漂浮、高强度运动模型的建立
实验性水上漂浮主要将大鼠置于人工造浪池中进行:采用敞开式塑料泡沫漂浮器(1×0.6×0.3m),将漂浮器置于1.8m直径的圆形造浪池中,调节造浪强度至漂浮器产生±15°的摇摆度。将实验鼠置于漂浮器中,并由间隔0.75m的土猫进行恐吓。期间主要是综合采用Adamec等提出的土猫恐吓应激模型[1]及新环境应激模型以形成急性心理应激。高强度运动模型采用大鼠跑台[2],实验前筛选大鼠的适应性训练负荷为坡度0%,速度15m/min,历时10min,共3天;实验时负荷为5%坡度,速度26.8m/min,连续奔跑120min,跑程为3216m。
1.3 实验过程
晨8时将A组与B组大鼠进行历时180min的水上漂浮,并给予土猫恐吓,之后A组大鼠结束实验而B组大鼠继续进行持续120min的跑台奔跑。按实验设计若跑台运动时大鼠提前出现力竭症状,即不能坚持负荷跑速,滞留跑道后1/3处达3次以上,则提前处死。但本实验中无提前处死大鼠。
1.4 取样和测试
实验结束,立即用水合氯醛腹腔麻醉,心脏静脉窦取血5ml,制备血清待测皮质酮(Corticosterone,CORT)、ACTH、白细胞介素1β、IL-6(Interleukin1β、6, IL-1β、IL-6)水平。测试均采用放射免疫分析法。ACTH、IL-1β、IL-6试剂盒由北京福瑞生物工程公司提供,大鼠CORT试剂盒由美国DSL公司提供。垂体ACTH阳性表达细胞免疫组化采用EnVision方法。
1.5 统计与分析
所有数值均以“均数±标准差”(mean±SD)表示, 统计分析使用SPSS11.0版软件完成,。三组间比较采用One-Way ANOVA,组间多重比较采用LSD-t检验。垂体ACTH细胞免疫组化每张切片取5个视野,以阳性细胞所占百分比行秩和检验。P<0.05为差异有统计学意义。
2 实验结果
2.1 一般情况
C组大鼠神态安静,皮毛光洁整齐,眼睛有神;A组、B组大鼠在急性心理应激阶段出现皮毛耸立,双上肢离地直立现象显著增多;B组大鼠进行高强度运动训练后表现为神态倦怠、眼神黯淡无光、呼吸深急幅度大。
2.2 血清ACTH和CORT水平
与C组相比,A组CORT水平略增高,但差异无统计学意义(P>0.05);而B组CORT的升高具有统计学意义(P<0.01);且与A组相比,B组CORT水平亦升高(P<0.01)。(图1)

与C组相比,A组血清ACTH水平无改变(P>0.05),而B组ACTH降低,差异有统计学意义(P=0.033)。(图2)
2.3 血清IL-1β、IL-6水平
与C组相比,A组IL-1β无显著改变(P>0.05),而IL-6升高,差异有统计学意义(P=0.023);B组IL-1β、IL-6均升高(P=0.031,0.022)。(图3)
2.4 垂体ACTH表达阳性细胞免疫组化
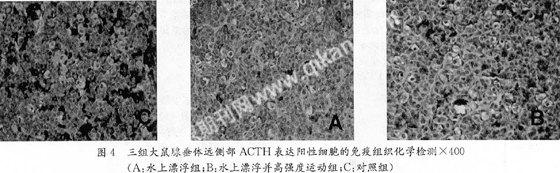
光镜下,各组大鼠垂体组织切片免疫组化染色均可见ACTH阳性细胞:多为不规则形和星形,也可为圆形,弥漫分布于腺垂体远侧部,阳性物质定位于细胞质和细胞膜,为棕褐色,高倍镜下呈颗粒状。

C组,ACTH阳性细胞染色深,为强阳性反应,数量约占总细胞数的30%~40%;A组、B组ACTH阳性细胞染色较深,数量较C组相比显示减少(P<0.05),占细胞总数的5%~20%,但A、B组间差异无统计学意义(P>0.05)。(图4)
3 讨 论
目前用以评价应激程度的指标多采用皮质酮(鼠)、皮质醇(人)、ACTH。总的来说,下丘脑的室旁核是HPA轴活动的直接控制部位[3]。在受到刺激时,室旁核的小细胞神经元分泌促肾上腺皮质激素释放激素和精氨酸加压素,经垂体门脉系统到达垂体前叶,刺激垂体分泌ACTH,随血流到达肾上腺,刺激肾上腺皮质合成和分泌糖皮质激素。
心理应激对HPA轴的影响与应激作用的时间有关。一般应激发生后5-10秒,促肾上腺皮质激素分泌,数分钟后,血浆中糖皮质激素水平开始升高,分泌高峰在应激后30分钟和1小时出现。因此,不同时程的应激引发HPA轴的变化也有所不同。胡等指出:短期、急性应激刺激可使大鼠皮质酮水平显著升高,在10分钟内增加8-10倍[4]。而Zarkovic的研究表明,长期心理应激可抑制皮质激素的释放[3]。本研究观察到急性心理应激后大鼠出现皮毛耸立、双上肢离地直立等探索性行为现象显著增多,表明大鼠处于焦虑状态[5],但CORT水平的升高及ACTH水平的下降均不显著,有观察表明血清皮质酮水平与应激强度呈显著的正相关[6],据此亦能说明本研究中的水上漂浮并猫恐吓作为急性心理应激其程度仍较轻。
运动本身作为一种躯体应激原可造成机体各种生理生化和行为的改变,有时甚至会形成各种新的应激原反作用于个体。本研究采用的跑台模型是一种经典的大鼠运动模型。根据Bedford最大摄氧量(VO2max)与运动强度的关联分析[7]以及劳动强度的划分方法:中等强度劳动为40%VO2max,重度劳动为64%VO2max,极重度劳动为70%VO2max,本研究采取的是单次大强度运动模型,最大摄氧量为74.3%±2.9%,符合本实验所需。
一般认为,运动要造成HPA轴的激活,需要达到一定的强度阈值和时间阈值[8],强度阈值激发了激素的反应速度,时间阈值则决定激素的释放总量[9]。Luger指出,当运动强度达到50%~60%VO2max强度时,即可导致强度依赖性HPA轴的激活,表现为ACTH和皮质酮的升高[10]。Wittert也认为在无氧阈以上的急性大强度运动可激活HPA轴[11]。然而,当长期剧烈运动或力竭运动时,皮质酮水平往往下降,尤其在实验动物中更为常见。对此的解释主要有两类:有学者认为力竭运动时机体糖原消耗很大,大量蛋白质分解为氨基酸进行糖异生,此时HPA轴受到抑制,肾上腺皮质激素耗竭;但更多的学者认为激烈运动中血浆CORT下降是“机体对能源致命性消耗所表现的一种防御性反应”,此时肾上腺并未衰竭,可能是通过神经调节使垂体减少了ACTH的释放,导致皮质酮分泌减少[12]。本研究中,B组皮质酮水平较A组进一步明显升高,提示单次高强度运动对心理应激大鼠可产生更大程度的应激,与尹剑春等[13]的中小负荷运动对心理应激后的大鼠皮质酮释放影响之结果截然不同。而本研究中ACTH的降低,推测可能与以下因素有关:①相比于皮质酮,ACTH对应激的反应更快速,而半衰期却较短,故其分泌峰值出现在运动后的即刻,早于皮质酮;②在HPA轴中,皮质酮的负反馈调节可使ACTH的分泌受到抑制;③可能存在其他ACTH分泌的抑制机制。
垂体免疫组化检查结果表明ACTH阳性染色在不同大鼠间有较大差异,A组、B组大鼠ACTH阳性细胞数较C组减少。Polkowska的研究提示大鼠在经历20min/h、共4h的足底电击以形成急性应激后,垂体ACTH、β-内啡肽、PRL的免疫组化染色反应显著降低;而当大鼠经历20min/h、连续9h、共3天的长时间应激后,ACTH、β-内啡肽的分泌活性增加,并表现为细胞的肥大和增生[29]。Kaur的研究也指出,大鼠在经历连续7天的高原低氧应激后,ACTH阳性细胞出现显著的增生和肥大,且ACTH分泌增加[30]。本研究属于急性应激反应,垂体的免疫组化结果与Polkowska的结果以及血液中ACTH水平下降相吻合。说明经历急性心理应激和大强度运动后,垂体ACTH分泌功能亦表现为受抑反应。
应激对免疫功能的影响可表现为影响细胞因子的级联反应。IL-1β和IL-6能启动并放大应激后的急性期反应,促进肝细胞源性急性期蛋白如C反应蛋白的合成[14]。既往的研究认为急性心理应激能引起IL-1β的升高[15],而IL-1亦能作用于HPA轴致皮质醇分泌增高[16],从而通过糖皮质激素受体及干扰NF-κB的激活来抑制细胞因子诸如IL-2、IL-4等的进一步生成而调控免疫功能[17]。Heinz的研究表明急性剧烈心理应激下过度增高的皮质醇并不会造成IL-1水平的下降[18],Reyes的研究也提示IL-6不受增高的皮质酮所抑制[19]。但IL-6对心理应激的反应是极为迅速的[20, 21],在动物试验中,足底电击、束缚应激等心理应激都能使IL-6水平升高[22, 23],在人体试验中也有类似结果[24]。Li等提出IL-6的增高可能与急性心理应激后雌二醇水平增高,从而促进外周血单核细胞IL-6的分泌有关[25]。运动对细胞因子分泌亦有影响。运动可引起细胞因子IL-1β、IL-6浓度增加[20]。其机制可能与以下因素有关:(1)运动过程中局部骨骼肌的损伤[26];(2)外周血单核细胞中各细胞亚群发生变化,分泌IL-1、IL-6的CD4+细胞比例增高[27];(3)运动过程中运动器官与内脏器官之间血液重新分配,导致肠粘膜缺血,肠腔中内毒素移入循环系统,进而触发单核巨嗜细胞合成与释放细胞因子[28]。本次研究中,急性心理应激后,IL-1仅略升高但无统计学差异,IL-6显著增高,说明IL-6对心理应激的反应更为迅速。在继续经历高强度运动后,IL-1、IL-6均显著增高,表明高强度运动可引起IL-1、IL-6的增高。由于免疫网络本身很复杂,神经—内分泌-免疫网络就更复杂,应激所引发的免疫功能改变及其与HPA轴的变化之间的关系尚需进一步研究探讨。
致谢
感谢南京军区南京总医院比较医学科提供清洁级实验大鼠,感谢江苏省体育科学研究所武露凌主任指导动物试验并提供大鼠跑台,感谢南京军区南京总医院病理科周晓军、吴波、郑晓刚主任提供实验条件并指导免疫组化检测。
参考文献:
[1] [ZK(#]Adamec R, S Walling,P Burton. Long-lasting, selective, anxiogenic effects of feline predator stress in mice. Physiol Behav, 2004, 83(3):401-410.
[2] Chen JX, X Zhao, GX Yue, et al. Influence of acute and chronic treadmill exercise on rat plasma lactate and brain NPY, L-ENK, DYN A1-13. Cell Mol Neurobiol, 2007, 27(1):1-10.
[3] Zarkovic M, E Stefanova, J Ciric, et al. Prolonged psychological stress suppresses cortisol secretion. Clin Endocrinol (Oxf), 2003, 59(6):811-816.
[4] 胡健饶,许宁一. 应激对神经内分泌系统影响的研究进展. 杭州师范学院学报(自然科学版), 2002, 1(2):65.
[5] Rybkin, II, Y Zhou, J Volaufova, et al. Effect of restraint stress on food intake and body weight is determined by time of day. Am J Physiol, 1997, 273(5 Pt 2):R1612-1622.
[6] Weinstein RS, RW Nicholas,SC Manolagas. Apoptosis of osteocytes in glucocorticoid-induced osteonecrosis of the hip. J Clin Endocrinol Metab, 2000, 85(8):2907-2912.
[7] Bedford TG, CM Tipton, NC Wilson, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol, 1979, 47(6):1278-1283.
[8] Raastad T, T Bjoro,J Hallen. Hormonal responses to high- and moderate-intensity strength exercise. Eur J Appl Physiol, 2000, 82(1-2):121-128.
[9] Viru A. Plasma hormones and physical exercise. Int J Sports Med, 1992, 13(3):201-209.
[10]A[ZK(#]Luger A, PA Deuster, SB Kyle, et al. Acute hypothalamic-pituitary-adrenal responses to the stress of treadmill exercise. Physiologic adaptations to physical training. N Engl J Med, 1987, 316(21):1309-1315.
[11]AWittert GA, JH Livesey, EA Espiner, et al. Adaptation of the hypothalamopituitary adrenal axis to chronic exercise stress in humans. Med Sci Sports Exerc, 1996, 28(8):1015-1019.
[12]A杨锡让. 实用运动生理学(修订版). 北京:北京体育大学出版社, 1998, 167-168.
[13]A尹剑春,颜军. 运动训练对心理应激大鼠神经内分泌免疫若干指标的影响. 北京体育大学学报, 2006, 29(1):70-73.
[14]ACohen MC,S Cohen. Cytokine function: a study in biologic diversity. Am J Clin Pathol, 1996, 105(5):589-598.
[15]ADobbin JP, M Harth, GA McCain, et al. Cytokine production and lymphocyte transformation during stress. Brain Behav Immun, 1991, 5(4):339-348.
[16]AMaes M, E Bosmans, HY Meltzer, et al. Interleukin-1 beta: a putative mediator of HPA axis hyperactivity in major depression? Am J Psychiatry, 1993, 150(8):1189-1193.
[17]AMoynihan JA, TA Callahan, SP Kelley, et al. Adrenal hormone modulation of type 1 and type 2 cytokine production by spleen cells: dexamethasone and dehydroepiandrosterone suppress interleukin-2, interleukin-4, and interferon-gamma production in vitro. Cell Immunol, 1998, 184(1):58-64.
[18]AHeinz A, D Hermann, MN Smolka, et al. Effects of acute psychological stress on adhesion molecules, interleukins and sex hormones: implications for coronary heart disease. Psychopharmacology (Berl), 2003, 165(2):111-117.
[19]AReyes TM,CL Coe. Resistance of central nervous system interleukin-6 to glucocorticoid inhibition in monkeys. Am J Physiol, 1998, 275(2 Pt 2):R612-618.
[20]AGoebel MU, PJ Mills, MR Irwin, et al. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways. Psychosom Med, 2000, 62(4):591-598.
[21]ABrydon L, S Edwards, V Mohamed-Ali, et al. Socioeconomic status and stress-induced increases in interleukin-6. Brain Behav Immun, 2004, 18(3):281-290.
[22]ANukina H, N Sudo, G Komaki, et al. The restraint stress-induced elevation in plasma interleukin-6 negatively regulates the plasma TNF-alpha level. Neuroimmunomodulation, 1998, 5(6):323-327.
[23]AZhou D, AW Kusnecov, MR Shurin, et al. Exposure to physical and psychological stressors elevates plasma interleukin 6: relationship to the activation of hypothalamic-pituitary-adrenal axis. Endocrinology, 1993, 133(6):2523-2530.
[24]ASteptoe A, G Willemsen, N Owen, et al. Acute mental stress elicits delayed increases in circulating inflammatory cytokine levels. Clin Sci (Lond), 2001, 101(2):185-192.
[25]ALi ZG, VA Danis,PM Brooks. Effect of gonadal steroids on the production of IL-1 and IL-6 by blood mononuclear cells in vitro. Clin Exp Rheumatol, 1993, 11(2):157-162.
[26]ABruunsgaard H, H Galbo, J Halkjaer-Kristensen, et al. Exercise-induced increase in serum interleukin-6 in humans is related to muscle damage. J Physiol, 1997, 499 ( Pt 3)(833-841.
[27]AHaahr PM, BK Pedersen, A Fomsgaard, et al. Effect of physical exercise on in vitro production of interleukin 1, interleukin 6, tumour necrosis factor-alpha, interleukin 2 and interferon-gamma. Int J Sports Med, 1991, 12(2):223-227.
[28]ABagby GJ, DE Sawaya, LD Crouch, et al. Prior exercise suppresses the plasma tumor necrosis factor response to bacterial lipopolysaccharide. J Appl Physiol, 1994, 77(3):1542-1547.
[29]APolkowska J,F Przekop. Immunocytochemical changes in hypothalamic and pituitary hormones after acute and prolonged stressful stimuli in the anestrous ewe. Acta Endocrinol (Copenh), 1988, 118(2):269-276.
[30]AKaur C, J Singh, CM Peng, et al. Upregulation of adrenocorticotrophic hormone in the corticotrophs and downregulation of surface receptors and antigens on the macrophages in the adenohypophysis following an exposure to high altitude. Neurosci Lett, 2002, 318(3):125-128.

