低氧高强度训练下大鼠骨骼肌糖酵解酶活性和HIF-1α表达的变化
汤 强 姜文凯 盛 蕾 丁宁炜 季师敏
摘要:64只经过筛选能适应高强度训练的SD雄性大鼠随机分成5组:常氧安静组(C),低氧有氧训练组(A),常氧大强度训练组(D),高住低练组(H),低住高练组(L)。A组采用在低氧环境下低强度训练, D组、H组、L组采用间歇性高强度训练。D在常氧下训练居住,H组在常氧下训练在低氧下居住,L组在低氧下训练,在常氧下居住。A、D、H、L四组动物经过2周的适应性训练和5周的正式训练。在动物最后一次训练后24小时取动物的股四头肌浅层白肌,测试肌肉CK、ALD、PK、LDH、SDH的酶活性,测试肌肉糖原含量,提取肌肉的mRNA,通过RT-PCR检测各组HIF-1αmRNA表达量。结果显示肌肉CK、ALD、LDH的活性各组间差异没有显著性(p>0.05),PK、SDH和糖原各组间差异很显著(p<0.01)。PK和糖原的变化趋势接近,C组和A组之间差异不显著且低于其他各组,H组的指标高于其他组且差异有显著性。H组的SDH显著低于A、D、L组,甚至低于C组,但与C组的差异没有显著性。A组的SDH显著高于其他各组。HIF-1α mRNA的RT-PCR测试结果与PK活性的变化趋势并不一致,L组的OID比值显著高于H组,C、A、D组则没有表达。结论:1.高强度间歇性低氧训练可以提高无氧糖酵解关键酶的活性,但对于磷酸原系统和三羧酸循环代谢酶的作用较弱。2.代谢酶的变化与不同的低氧训练方法相对应。3.糖酵解代谢酶的适应性变化受训练强度和训练环境的多重影响。4.HIF-1α的表达与缺氧刺激的程度有比较密切的关系5.高住低练的训练方法可能更适合于低氧高强度训练。
关键词: 糖酵解,间歇低氧训练,HIF-1α
中图分类号:G804.7 文献标识码:A 文章编号:1004-4590(2009)02-0062-06
1 研究背景
一直以来低氧训练(高住低练,低住高练)主要应用于提高有氧耐力,有关提高无氧耐力的基础研究和应用甚少。新的训练方法和HIF-1α(低氧诱导因子-1α)的出现为探索低氧下无氧能力训练提供了条件。本研究设计的思路是建立一个高强度间歇性低氧训练的模型,将间歇性低氧训练(高住低练,低住高练)应用到此模型,通过无氧代谢酶以及其基因的转录诱导因子HIF-1α从无氧代谢酶的角度观察这两种训练方式对无氧代谢能力的影响。本研究的目的在于探索将间歇性低氧训练应用于无氧能力训练的可能性,比较两种训练方法应用的差异,为低氧下的无氧能力训练提供理论和实验依据。
2 材料与方法
2.1 研究对象
8周龄雄性SD清洁级健康大鼠80只(172±7.8g),购自东南大学医学院动物中心。分笼饲养(室内温度20-25℃,湿度50%-60%),自由饮食。
2.2 运动模型方案
2.2.1 动物跑台适应性训练和筛选
在动物跑台上经过两周的逐级递增负荷适应训练(最高速为40m/min),在动物适应跑台后进行以动物运动能力同质化为目的的筛选。筛选的方法是从低速快速增加到40m/min开始计时,后每2min增加3 m/min至最高55 m/min,记录不能完成运动强度时(参考运动力竭的标准:动物滞留跑台后1/3达3次以上,光、电、声刺激驱赶无效[1])的运动速度和运动时间。筛选动物的标准是跑速达到52m/min以上,共有64只动物符合,其余动物淘汰。根据随机原则将筛选后的64只大鼠分为

常氧安静对照组(C),低氧有氧训练组(A),常氧大强度训练组(D),高住低练组-低氧居住常氧大强度训练(H)和低练高住组-常氧居住低氧大强度训练(L),动物分组结果见表1。
2.2.2 低氧训练方案

本训练方案分为两个阶段,第一阶段为负荷递增阶段,为期2周(第一周至第二周);第二阶段为大强度训练阶段,为期5周(第三周至第七周)。C组在常氧下安静饲养,自由饮食。A组的训练模式为低氧有氧耐力训练,D、H、L为大强度间歇训练,见表2。第一阶段的速度逐渐增加和低氧环境适应阶段,A组由30m/min×30min逐渐增加到30m/min×60min,D、H由43m/min×4min×3 bouts(间歇4min)逐渐增加到49m/min×2min×4 bouts(间歇2 min,5度上坡),L组由43m/min×4min×3 bouts(间歇4min)逐渐增加到43m/min×2min×4 bouts(间歇3 min,5度上坡)。低氧环境由1000m逐渐增加到2000m。第三周开始正式训练,A组为30m/min×60min(6d/w),D、H为45m/min×2min×4 bouts(间歇2 min,10度上坡,3d/w),L组为45m/min×2min×4 bouts(间歇2 min,5度上坡,3d/w)。第五周开始A、L组训练强度不变,D、H增加为47m/min×2min×4 bouts(间歇2 min,10度上坡,3d/w)。至第七周结束,正式训练共七周。训练各阶段的安静状态和训练后血乳酸值见表3。
2.3 样本处理
各训练组动物在最后一次训练后24小时取安静状态下的肌肉组织[2-4],安静组同时取材。动物麻醉后(10%水合氯醛,0.4ml/100g体重),安Salminen A[5]的方法分离双侧股四头肌浅层白肌,分别放置1.5ml冷冻管中,迅速投入液氮冷冻,再转移至低温冰箱(-70℃)保存待用。
2.4 测试方法
2.4.1 肌肉酶活性和糖原含量测定
称取肌肉组织0.1g,加入1ml匀浆缓冲液,用高速匀浆机在冰浴中制成10%肌肉匀浆,于4℃下3000rpm离心,吸取上清液按照试剂盒要求测试CK,ALD,PK,LDH,SDH酶活性和总蛋白。匀浆缓冲液的组成为0.17M(PH 7.4-7.6)磷酸钠缓冲液,0.05%BSA(牛血清白蛋白),5mM巯基乙醇[6]。
准确称取75mg肌肉组织,以试剂盒提供的水解液沸水中水解20min,稀释后用比色法测定糖原含量。
2.4.2 RT-PCR测定肌肉HIF-1α mRNA含量
用Tripure试剂一步法抽提总RNA,加入20μlRNase free water完全溶解RNA。用紫外分光光度计测量溶解的RNA的A260、A280,根据A260/A280的比值推测提取的总RNA纯度,要求比值大于1.6。根据A260计算RNA浓度。制作2%的琼脂糖凝胶,加入溴化乙锭,浓度调为0.5μg/ml,制成胶板,点入RAN样品,60V电压下电泳30min。电泳后的胶板放入紫外透视仪下观察,要求出现三个条带,并且28s的条带亮度要高于18s,说明抽提中没有RNA的明显降解。
根据测试的RNA浓度将所有的样品浓度用Rnase Free water调整为1μg/μl。以OligdT(18)为引物反转录(RT)合成cDNA。转录工作液分为A液和B液,A液为RNA样品 2μl,OligdT(18)(1μg/μl) 1μl, Rnase Free water 11μl:B液为RT Buffer(5×) 6μl,dNTPs(10mM) 1.25μl,M-MLV (200U/μl)0.5μl,Rnasin(40U/μl) 0.25μl,Rnase Free water 8μl。在去酶处理过的0.5ml Ep管中加入A液,70℃水浴5min,迅速置于冰上5min,同时配置B液,每管加入16μlB液,混匀后在42℃水浴中反应90min,再置70℃水浴中5min中止反应,4℃冷却后放置-20℃保存备用。反应管中的cDNA可以长期保存于-20℃冰箱中。
以β-actin为内参,引物序列:上游为5′-TCG CCC ACA CTG TGC CCA TCT ATG A-3′,下游为5′-CAT CGG AAC CGC TCA TTG CCG ATA G-3′,扩增片段长为396bp。根据参考文献[7]选择引物,并将所得的序列在GENEBANK 中进行BLAST比对,确认为大鼠HIF-1α基因序列。HIFI-1α引物上游序列为5′-AAG TCT AGG GAT GCA GCA C-3′,下游序列为5′-CAA GAT CAC CAG CAT CTA G-3′,扩增片段长为175bp。
HIFI-1α的反应体系为cDNA模板 1μl,上下游引物Primer(10pmol/μl)0.8μl,10×Tag DNA聚合酶Buffer 3μl, Mgcl2(25mM)1.8μl,dNTPs (10mM) 0.4μl,Tag DNA聚合酶(5U/μl)0.3μl,双蒸水补足至30μl。反应条件为预变性95℃ 2min,变性95℃30s ,退火53.4℃ 45s,延伸72℃45s,反应35各循环,末次延伸 72℃7min。β-actin的反应体系为cDNA模板 1μl,上下游引物Primer(10pmol/μl)0.4μl,10×Tag DNA聚合酶Buffer 3μl, Mgcl2(25mM)1.8μl,dNTPs (10mM) 0.4μl,Tag DNA聚合酶(5U/μl)0.3μl,双蒸水补足至30μl。反应条件为预变性95℃ 2min,变性95℃30s ,退火60℃45 s,延伸72℃45s,反应35各循环,末次延伸 72℃7min。cDNA样品按照上述的反应体系和反应条件在PCR仪上进行35个循环的反应,完成后样品于4℃保存。
制作2%的琼脂糖凝胶,加入溴化乙锭,浓度调为0.5μg/ml,制成胶板。将点样后在60V电压下电泳30min。电泳完成后将胶板取下置于凝胶图像分析仪上,拍照后用图像分析软件测定积分吸光度(OID)。
2.5 数据统计和处理
所有数据用SPSS统计软件处理,统计方法有t检验,方差分析,显著性标准为p<0.05。
3 研究结果
3.1 肌肉代谢酶活性和糖原含量的改变
3.1.1 肌肉酶活性的改变
测试的肌肉酶活性指标有CK(肌酸激酶),ALD(醛缩酶),PK(丙酮酸激酶),LDH(乳酸脱氢酶),SDH(琥珀酸脱氢酶)。测试数据见表4和5。
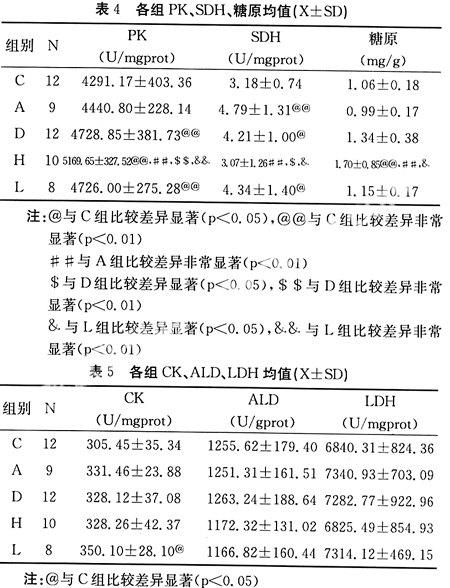
表4示H组(高住低练)的PK酶活性最高,数据显示H组显著高于其他各组(p<0.05),D(大强度训练)、H、L(低住高练)三组显著高于(p<0.05)其他C(安静)、A(有氧训练)组,D组和L组之间比较差异不显著(p>0.05,下同),C组和A组间的差异也没有显著性。
肌肉SDH酶的活性变化则与PK的变化完全不同,见表4。H组的SDH酶活性最低,甚至低于C组,但差异没有显著性,A、D、L三组显著高于H组(p<0.05)。
CK、ALD、LDH三种酶的活性各组间差异较小,方差分析没有显著性,组间两两比较唯有L组的CK显著高于C组(p<0.05),其余组间两两比较都没有显著性。
3.2 肌肉中HIF-1αmRNART-PCR结果[WTBZ]
HIF-1αmRNART-PCR的结果表明,C、A、D组基本没有HIF-1αmRNA的表达,H组和L组有表达。L组表达的强度高于H组,且两者之间有显著差异(p<0.01)。

4 分析与讨论
4.1 高强度间歇性低氧训练对肌肉代谢酶的影响
4.1.1 高强度间歇性低氧训练引起糖酵解代谢关键酶活性增高
PK是糖酵解代谢的关键酶之一,对调节糖酵解代谢速率有很重要的作用。大强度训练的三个组PK酶活性的增加表明这三个组糖酵解代谢能力的增强,也表明这一大强度训练模式的可行性。H组与D组的训练方案相同,不同的是H组受到低氧环境刺激,H组显著高于D说明了低氧刺激可以有效增加PK酶的活性。H组PK酶活性的大幅增高应该是大强度训练和低氧刺激双重作用叠加的结果。低氧环境耐力训练引起能量代谢酶改变的研究比较多,但是高强度训练引起糖酵解酶改变的研究一直较为少见。M. Vogt等人[8]设计了四个实验组,常氧高强度(Nor-High)、低氧高强度(Hyp-High)、常氧低强度(Nor-Low)、低氧低强度(Hyp-Low),结果显示高强度的两组PFK mRNA含量增高有显著性(p<0.05),低强度的两组没有显著性,而低氧高强度组的增高幅度又高于常氧高强度组。可以看出低氧刺激和高强度训练都可以诱导糖酵解酶的活性的增加,两者的叠加作用更加显著。M. Vogt的研究结果与本研究结果相吻合。
4.1.2 高强度间歇性低氧训练对糖酵解代谢非关键酶和其他系统代谢酶活性影响较小
与PK酶活性变化不同,肌肉CK、ALD、LDH酶活性方差分析没有显著性差异可以看出有氧训练和大强度训练,常氧训练和低氧训练对于CK、ALD、LDH三种酶的活性影响很小。而导致大强度训练组(D、H、L)的ALD与LDH酶活性没有变化的原因可能有1.作为糖酵解系统的代谢酶没有该系统中的关键酶变化明显2.训练的强度不够,综合负荷对肌肉的刺激强度不够。另一个值得注意的是,H组PK酶活性虽然在各组中最高,但是其SDH的活性在各组中最低,显著低于A、D、L组(p<0.05),甚至低于C组,但差异不显著,如表4所示。低氧高强度的训练对于H组糖酵解代谢酶和有氧代谢酶的作用是相反的。Howald H等[9]发现长时间的低氧刺激会引起无氧代谢酶活性上升,而有氧代谢酶下降。似乎糖酵解代谢酶和有氧代谢酶对低氧刺激存在着反向变化趋势。但是令人困惑的是L组的变化趋势与H组显著不同,L组的SDH活性显著高于H组和C组(p<0.05)如表4所示。低氧刺激方式和时间的不同是不是造成这一现象的原因还有待进一步研究证实。
4.2 两种不同的高强度间歇性低氧训练方法的差异
4.2.1 肌肉酶活性变化的差异
高住低练(Hi-Lo)和低住高练(Lo-Hi)是在模拟低氧技术出现后兴起的两种新的辅助训练方法。低住高练由Hoppeler等人[10]提出,要求在低氧环境下训练,其训练负荷明显加大,其目的在于增加训练的刺激强度。但是目前对低住高练的方法还存在争议,Levine等人[11]认为低氧下训练强度会降低,不利于运动水平的提高。
从结果来看, H组和L组的糖酵解代谢酶活性都有增加,但是H组增加的更高。在低氧高强度间歇性低氧训练模型中作用于糖酵解酶的主要有运动训练和低氧刺激两个因素。糖酵解代谢酶的变化是这两者共同作用的结果。两种因素的共同作用可能是导致H组和L组不同结果的主要原因。H组采取的是短时间常氧大强度训练加安静状态的长时间中度低氧刺激,L组采取的是短时间大强度训练复合较高强度低氧刺激,后者的刺激负荷较高而时间较短。正如Levine等人[11]认为的那样,本研究也观察到低住高练下训练的大负荷容易引起训练强度降低,而且动物的伤病淘汰率也比高住低练组要高(数据未列出)。L组动物在低氧环境作用下运动强度难以与H组维持同样水平,本模型中L组动物的运动强度要稍低于H组。可以看出,H组的高住低练模式较低住高练模式更有利于保持训练强度和低氧刺激之间的平衡。还有一点值得注意的是长期高强度低氧刺激会引起肌肉蛋白含量的降低[12],本研究也观察到训练后L组的体重要低于C组(p<0.05),而H组没有出现这种情况(数据未列出)。Miyazaki S[13]等人观察到高住低练没有引起肌肉重量的明显降低,这一点与本研究的结果一致。从这些结果来看与低住高练相比,高住低练训练更加适合于大强度训练。
4.2.2 肌肉糖原含量变化的差异
表4显示大强度训练组D、H组的糖原含量显著高于对照组(C和A组,p<0.05),而在低氧环境和大强度训练的双重作用下H组提高的幅度更高,显著高于D组(p<0.05)。这一结果提示大强度运动训练和低氧刺激都可以提高肌肉糖原的含量,且两者之间有叠加作用。已经有很多实验证明低氧刺激可以提高肌肉糖原的含量。刘晔等[14]发现,高原训练引起骨骼肌糖原增加,且与海拔高度成正比。在低氧的刺激下肌肉对葡萄糖的摄取是增加的。Chou SW[15]发现低氧训练组大鼠的肌肉糖原含量显著高于平原训练组和平原安静对照组(p<0.05),同时伴有葡萄糖转运子GLUT4的增加。Zierath J.R [16]等证实GLUT4在低氧刺激下肌肉糖原摄取的调节中起着至关重要的作用。Wagenmarkers AJ[17]认为高原缺氧训练造成骨骼肌无氧糖酵解供能比例增大,使肌糖原消耗增多,骨骼肌蛋白参与糖异生供能,肌糖原代偿性的增加。由此可见低氧刺激下肌肉对葡萄糖摄取的增加和糖原代偿性的合成与低氧诱导肌糖原增多有着密切的关系,这些结果与本研究观察到现象相符合。
比较H、L组可以发现,虽然低氧大强度间歇训练都可以诱导肌肉糖原含量的增加,但是高住低练的低氧刺激模式引起的肌肉糖原含量的增加更为显著(p<0.05)。H组与L组比较低氧刺激的时间要远远长于后者,L组的低氧刺激程度则要高于H组,由此我们推测低氧刺激的时间对肌肉糖原含量的影响要高于低氧刺激的强度。其可能的原因是,常氧大强度训练造成H组动物肌糖原的大量消耗,而长时间低氧刺激诱导的肌肉对葡萄糖摄取增加有利于肌糖原代偿性合成,这两个因素的综合作用造成了肌肉糖原含量的显著增加。虽然训练和低氧刺激造成了L组动物训练中更多肌糖原消耗,但是与H组相比其低氧刺激诱导肌肉葡萄糖摄取增加的效应不如H强,因此其肌糖原的代偿性合成量也较少。由此来看,与低住高练相比高住低练的低氧训练模式更加有利于肌肉糖原含量的增加。肌糖原是糖酵解代谢的基础能量物质,糖原含量的增加表示糖酵解代谢能力的增强,这与本研究发现的PK酶活性变化趋势一致,也印证了H组糖酵解代谢能力的增加。
4.4 低氧训练下低氧诱导因子-1α(HIF-1α)基因表达变化[WTBZ]
4.4.1 各训练组HIF-1α基因表达的差异
自1992 年Semenza GL发现HIF-1以来,在低氧训练的研究中HIF-1受到越来越多的重视。大量研究表明HIF-1在机体对低氧刺激的应激反应中其中非常重要的作用。HIF-1α是HIF-1的亚基,也是主要活性亚基和调节亚基,因此成为主要的研究对象。研究发现HIF-1α与糖酵解代谢有着密切的联系,Semenza GL等人[18]证实Hep3B细胞(合成EPO细胞)和HeLa(非合成EPO细胞)都可以被低氧(1%O2,CoCl2,去铁胺)诱导引起醛缩酶A(ALDA),磷酸果糖激酶(PFK),丙酮酸激酶(PKM)三种糖酵解代谢酶mRNA转录的增加。另外还发现PFKL, ALDA, PGKl, ENOl, LDHA五种糖酵解代谢酶基因的DNA链上有与EPO基因增强子上的HIF-1结合位点相类似的结合点。可以认为,HIF-1对低氧诱导的糖酵解代谢酶的增加起到关键的作用。因此本研究把HIF-1α作为一个重要研究内容,以通过观察上游蛋白合成诱导因子的变化来探讨间歇性低氧训练下肌肉糖酵解代谢变化的机理。
本研究HIF-1αmRNART-PCR的结果表明,常氧安静对照组(C)、低氧有氧训练组(A)和常氧大强度训练组(D)基本没有HIF-1α mRNA的表达,而低氧大强度间歇训练组(H和L组)都有表达。L组表达的强度要高于H组,且两者之间有显著差异(p<0.05),见图1。以前的研究[19,20]表明HIF-1与低氧运动诱导的糖酵解代谢酶有着密切的联系。M. Vogt等[19]证实HIF-1确定无疑的参与低氧训练引起的肌肉适应,与一系列的生理反应相关,包括肌肉毛细血管密度的增加,氧转运能力的增加,葡萄糖跨膜转运能力的增加,氧化磷酸化和糖酵解代谢的增强,热休克蛋白表达的增加。Mason SD20等用HIF-1α基因敲除小鼠(HIF-1α Knockout mice, HIF-1α KOs)证实了HIF-1调节途径在维持肌肉正常功能的代谢调节中的重要作用。Mason SD等发现与正常小鼠相比HIF-1α KOs受低氧运动诱导的糖酵解酶表达明显降低,而作为代偿线粒体代谢酶活性在HIF-1α KOs中升高。肌肉ATP没有明显的降低,但是运动中的血乳酸降低。HIF-1α KOs的训练次数与正常小鼠比较明显降低,并且重复训练造成了HIF-1α KOs肌肉的严重损伤。Mason SD等认为出现这种情况是因为缺乏糖酵解代谢供能。Pfander D等人[21]发现在缺氧环境下HIF-1α缺损的软骨细胞不能维持正常的ATP水平。
以上的这些研究说明HIF-1α在低氧训练诱导的能量代谢适应中起着至关重要的作用。本研究也同样观察到HIF-1α在高强度间歇性低氧训练(H组和L组)中诱导肌肉代谢酶适应中的重要作用。H和D组两组的训练模式不同之处就在于低氧刺激的有无,而结果表明两组间的HIF-1α基因表达的有无和糖酵解关键酶PK活性的高低与低氧刺激有密切的关系。可以推论低氧诱导的HIF-1α基因表达的差异导致了H和D组间糖酵解酶活性的差异。Huasheng Lu等发现[22],不仅HIF-1可以调节细胞糖酵解代谢酶的表达,糖酵解代谢的产物乳酸和丙酮酸也可以促进HIF-1的稳定,促进HIF-1诱导的基因的转录,这样就构成了一个正反馈循环。Huasheng Lu等人的发现说明HIF-1与糖酵解代谢酶之间的作用关系是双向的,两者的相互作用使得HIF-1对糖酵解代谢酶的调节作用更强。可以说在低氧刺激诱导的HIF-1α参与下,高强度间歇性低氧训练引起的糖酵解代谢酶的适应性改变更加明显,也说明高强度间歇性低氧训练模式对于提高无氧代谢能力在理论上和实践中都是有效的。
同样处于低氧环境下,A、H和L三组的HIF-1α基因表达情况各不相同,L组的表达最强,H组较弱,A组则没有表达。缺氧程度最高的L组表达最强,提示HIF-1α基因表达与缺氧程度关系密切。HIF-1α基因的表达受到低氧刺激诱导,一次离体低氧刺激造成的应激在复氧后很快消失[23],多次重复的低氧环境刺激可以造成在体肌肉细胞应激的积累产生适应[19]。Richardson[24]等证实训练可以使胞内氧分压降低,而低氧训练时则降的更低,这是低氧和训练的双重负荷作用的结果。L组动物肌细胞受到的低氧刺激程度要大于H组,这可能是L组的HIF-1α基因表达强于H组的原因。A组的训练模式从实质上来说也是低住高练的模式,但其训练强度要远低于L组。A和H组训练时的缺氧程度由于训练强度和训练环境的差异而无法进行比较,但是H组低氧刺激时间要远远长于A组。从A、H、L三组HIF-1α基因表达的差异可以推论HIF-1α基因表达的强弱与缺氧程度和缺氧时间都有关,而与缺氧程度的关系更为密切。这一推论是否成立还要通过进一步研究加以证实。
4.4.2 HIF-1α基因表达与肌肉代谢酶活性变化的差异
研究结果表明低氧大强度训练诱导的HIF-1α基因表达变化与PK酶活性变化趋势并不一致。H组的PK酶活性显著高于L组(p<0.05),而HIF-1α基因表达显著低于L组(p<0.01)。已经有很多研究[25~30]表明运动训练会引起肌肉代谢酶活性的改变,这是机体对运动训练的适应,本研究常氧大强度训练组(D)PK酶活性的增加也说明了这一点。而且酶活性的改变与运动训练的方式相关,不同的训练方式引起代谢酶的改变有选择性[25,27],本研究中A组和D组代谢酶活性改变的差异与此相符。
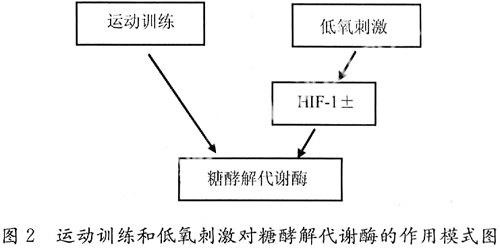
运动训练和低氧刺激对于代谢酶的活性都有影响,这两者的作用途径不同。运动训练中能量消耗增加引起肌肉细胞对能量供应的需求增加,一些能量代谢产物和代谢的中间产物(AMP、Pi)可以通过反馈刺激作用使能量代谢酶变构和活性增加,这一途径不涉及或很少涉及蛋白合成的增加[31,32]。低氧刺激诱导HIF-1α基因表达增多,并使HIF-1α稳定活化,进而促进包括糖酵解代谢酶基因在内的靶基因转录增加,这一途径需要蛋白合成的增加[33,34]。运动训练和低氧刺激的共同作用引起肌肉糖酵解代谢酶的变化,而HIF-1α基因表达直接受低氧刺激的诱导,作用模式见图2。
作用模式的不同可能是造成低氧大强度训练诱导的HIF-1α基因表达变化与PK酶活性变化趋势的不一致的原因。也就是说糖酵解代谢酶的活性不是受到某一方面因素的单独影响,而是受到低氧环境和训练模式的多因素共同影响。虽然在较强烈的低氧刺激下L组的HIF-1α基因表达最强,但是其糖酵解代谢酶的活性增加并不是最高,低氧刺激的效应与糖酵解代谢能力的变化并不一致。因此要进行有效的大强度间歇性低氧训练必须考虑到低氧环境和训练模式这两个方面的因素。
5 结论
5.1 高强度间歇性低氧训练可以提高无氧糖酵解关键酶的活性,但对于磷酸原系统和三羧酸循环代谢酶的作用较弱。
5.2 代谢效应酶的变化与不同的低氧训练方法相对应。
5.3 糖酵解代谢酶的适应性变化受训练强度和训练环境的多重影响。
5.4 HIF-1α的表达与缺氧刺激的程度有比较密切的关系
5.5 高住低练的训练方法可能较低住高练的方法更适合于无氧代谢能力训练。
参考文献:
[1] [ZK(#]辛东,李辉,李静先等. 力竭性运动时大鼠脑组织自由基产生及氧化、抗氧化能力的动态观察. 中国运动医学杂志,1999;18(4):321-3.
[2] Frandsen U, Hoffner L, Betak A.et al. Endurance training does not alter the level of neuronal nitric oxide synthase in human skeletal muscle. J Appl Physiol. 2000 Sep;89(3):1033-8.
[3] Hellsten Y, Apple FS, Sjodin B.Effect of sprint cycle training on activities of antioxidant enzymes in human skeletal muscle. J Appl Physiol. 1996 Oct; 81 (4):1484-7.
[4] Pilegaard H, Ordway GA, Saltin B. et al. Transcriptional regulation of gene expression in human skeletal muscle during recovery from exercise. Am J Physiol Endocrinol Metab. 2000 Oct;279(4):E806-14.
[5] Salminen A, Vihko V. Endurance training reduces the susceptibility of mouse skeletal muscle to lipid peroxidation in vtro. Acta Physiol Scand. 1983 ; 117(1):109-13.
[6] 李开刚,陆绍中, 冯连世等. 不同强度耐力训练后大鼠骨骼肌酶活性适应性变化的研究. 中国运动医学杂志, 2002;21(2):166-9.
[7] 倪永兵,王梦,王斌 等. 低氧诱导因子1α mRNA表达与神经细胞缺氧复氧损伤的关系[J]. 南京医科大学学报(自然科学版), 2002;22(4):271-3.
[8] M. Vogt, A. Puntschart, J. Geiser et al. Molecular adaptations in human skeletal muscle to endurance training under simulated hypoxic conditions. J Appl Physiol, 2001; 91: 173-182.
[9] Howald H, Pette D, Simoneau JA et al. Effect of chronic hypoxia on muscle enzyme activities. Int J Sports Med 1990;11:510-514.
[10]A[ZK(#]Levine BD. Intermittent hypoxic training: fact and fancy. High Alt Med Biol. 2002 ;3(2):177-93.
[11]ALevine BD, Stray-Gundersen J. The effects of altitude training are mediated primarily by acclimatization, rather than by hypoxic exercise. Adv Exp Med Biol. 2001;502:75-88.
[12]AJakobsson P, Jorfeldt L, Henriksson J. Metabolic enzyme activity in the quadriceps femoris muscle in patients with severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1995;151:374-377.
[13]AMiyazaki S, Sakai A.The effect of "living high-training low" on physical performance in ratsInt J Biometeorol. 2000 ;44(1):24-30.
[14]A刘晔,刘桂华,陈珑. 模拟海拔2000m和3000m高原训练的不同时程对大鼠骨骼肌蛋白质代谢的影响. 北京体育大学学报,2002;25(2):191-3.
[15]AChou SW, Chiu LL, Cho YM. et al. Effect of systemic hypoxia on GLUT4 protein expression in exercised rat heart. Jpn J Physiol. 2004;54(4):357-63.
[16]AZierath J.R, Tsao T.S, Stenbit A.E. et al. Restoration of Hypoxia-stimulated Glucose Uptake in GLUT4-deficient Muscles by Muscle-specific GLUT4 Transgenic Complementation. J. Bio. Chem,1998;273(33):20910-5.
[17]AWagenmarkers AJ. Aminoacid Metabolism, Musclular fatigue and muscle wasting, Int J Sports Med. 1992 ;13(Sl):S110-3
[18]ASemenza GL, Peter H. Roth, Hon-Ming Fang. Transcriptional Regulation of Genes Encoding Glycolytic Enzymes by Hypoxia-inducible Factor l. Biology Chem, 1994; 38: 23757 -23763.
[19]AM. Vogt, A. Puntschart, J. Geiser, et al. Molecular adaptations in human skeletal muscle to endurance training under simulated hypoxic conditions. J Appl Physiol, 2001;91: 173-182.
[20]AMason SD, Howlett RA, Kim MJ et al. Loss of skeletal muscle HIF-1alpha results in altered exercise endurance. PLoS Biol. 2004;2(10):e288.
[21]APfander D, Cramer T, Schipani E et al. HIF-1alpha controls extracellular matrix synthesis by epiphyseal chondrocytes. J Cell Sci 2003 May 1;116(Pt 9):1819-1826.
[22]AHuasheng Lu, Robert A. Forbes, Ajay Verma. Hypoxia-inducible Factor 1 Activation by Aerobic Glycolysis Implicates the Warburg Effect in Carcinogenesis. J. Bio. Chem, 2002;26:23111-5.
[23]ASemenza, G. L. HIF-1 and human disease : one highly involved factor. Genes Dev,2000;14:1983-1991.
[24]ARichardson RS, Wagner H, Mudaliar SRD. et al. Human VEGF gene expression in skeletal muscle: effect of acute normoxic and hypoxic exercise. Am J Physiol Heart Circ Physiol, 1999;277: H2247-H2252.
[25]AFournier M, Ricci J, Taylor AW, et al. Skeletal muscle adaptation in adolescent boys: sprint and endurance training and detraining. Med Sci Sports Exerc. 1982;14(6):453-6.
[26]ACostill DL, Daniels J, Evans W, et al. Skeletal muscle enzymes and fiber composition in male and female track athletes. J Appl Physiol. 1976 ;40(2):149-54.
[27]ARoberts AD, Billeter R, Howald H. Anaerobic muscle enzyme changes after interval training. Int J Sports Med 1982;3(1):18-21.
[28]ACadefau J, Casademont J, Grau JM. et al. Biochemical and histochemical adaptation to sprint training in young athletes. Acta Physiol Scand 1990 ;140(3):341-51.
[29]ADawson B, Fitzsimons M, Green S. et al. Changes in performance, muscle metabolites, enzymes and fibre types after short sprint training. Eur J Appl Physiol Occup Physiol 1998;78(2):163-9.
[30]ALinossier MT, Dormois D, Perier C. et al. Enzyme adaptations of human skeletal muscle during bicycle short-sprint training and detraining. Acta Physiol Scand 1997;161(4):439-45.
[31]A顾天爵等. 生物化学(第四版). 北京, 人民卫生出版社. 1999:72-82.
[32]AHowlett RA, Parolin ML, Dyck DJ et al. Regulation of skeletal muscle glycogen phosphorylase and PDH at varying exercise power outputs. Am J Physiol. 1998;275(2 Pt 2):R418-25.
[33]ASemenza GL,Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation. Mol Cell Bio, 1992;12: 5447-5454.
[34]AWang GL, Semenza GL. General involvement of Hypoxia-inducible factor 1 in transcriptional response to hypoxia. Proc.Natl.Acad.Sci.USA, 1993;90: 4304-4208.

