有关中考化学反应顺序的解析
张乐盈
在中考化学试题中,经常出现这样的试题,一种物质和某混合物中的两种或两种以上的物质都能发生化学反应,而且往往存在反应的先后顺序问题。对这类问题,不少学生都感到非常棘手,在解题时常常思路混乱、顾此失彼、得分率较低。笔者认为,其根本原因是没有正确理解化学反应顺序的本质规律。本文结合近几年中考中常见的有关化学反应顺序问题的试题,谈一谈化学反应的顺序及相关试题的解题方法。
一、金属在溶液中的置换反应
1.金属与酸溶液的置换反应
规律:把几种活泼金属同时投入到一种酸溶液中,若都能发生反应,则最活泼的金属优先与酸发生置换反应,一直到最活泼的金属反应完毕,次活泼的金属才能与酸溶液发生置换反应,依次类推。
例:将金属锌和铁同时放入一种H2SO4溶液中,可能发生的反应有( )
(1)Zn+H2SO4=ZnSO4+H2↑
(2)Fe+H2SO4=FeSO4+H2↑
(3)Zn+FeSO4=Fe+ZnSO4
(4)Fe+ZnSO4=Zn+FeSO4
A.(1)(2)(3) B.(1)(2) C.(1)(2)(3)(4) D.(1)(2)(4)
分析:金属铁和锌都能与稀H2SO4发生置换反应,分别生成FeSO4和ZnSO4,而Zn也可从FeSO4溶液中置换出Fe,因为Zn比Fe活泼。实际反应时,Zn先与H2SO4反应,直到Zn被反应完全,Fe才能与H2SO4发生反应,故不存在Zn从FeSO4溶液中置换出Fe的反应,也不可能存在Fe置换出ZnSO4中的锌的反应,因为铁比锌不活泼。所以,答案是:B。
2.金属与盐溶液的置换反应
(1)几种活泼金属与盐溶液的反应。规律:把几种活泼金属同时投入到一种不活泼金属的盐溶液中时,最活泼金属优先发生置换反应,直到此金属反应完全,次活泼的金属才开始与盐溶液反应,依次类推。
例:把金属锌粒和铁钉同时投入到一种足量的CuSO4溶液中,看到的现象是_________,有关反应式为_________。
解析:这三种金属的活泼性顺序为Zn>Fe>Cu,所以Zn能与CuSO4溶液发生反应置换出Cu;Fe也能与CuSO4溶液发生置换反应,同时生成FeSO4,而Zn又可置换出FeSO4中的Fe。实际发生反应时,Zn先与CuSO4溶液发生反应,直到Zn被完全反应,Fe才能与CuSO4溶液发生反应,故不存在Zn置换FeSO4的反应。
所以答案是:锌的表面析出亮红色的铜,然后铁钉表面再析出亮红色的铜,有关反应有:Zn+CuSO4=ZnSO4+Cu;Fe+ CuSO4=Cu+FeSO4。
(2)一种金属与几种盐溶液的反应。规律:把一种金属投入到几种盐组成的混合液中,若能发生多个反应,金属活动性最弱的金属优先从溶液中置换出来,直到置换完全,活动性稍强的金属才能开始被置换。
例:向AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,完全反应后过滤,下列情况不可能存在的是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Zn2+
B.滤纸上有Ag、Cu,滤液中有Ag+、Cu2+、Zn2+、Fe2+
C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Zn2+
D.滤纸上有Ag、Cu,滤液中有Fe2+、Zn2+
解析:四种金属的活泼性顺序为Zn>Fe>Cu>Ag,当铁投入到混合溶液中时,Zn(NO3)2不与Fe反应,所以,滤液中一定有Zn2+,而首先被Fe置换的应该是AgNO3,只有当AgNO3被置换完了,Cu(CN3)2才能被Fe置换。而题目没告诉我们哪种物质过量,很难确定滤纸上有哪些物质?滤液中有哪些物质?我们只能根据稍活泼的金属不能与比它不活泼的金属离子共存这一原则进行判断,故A、C、D中滤纸上的金属没有出现比滤液中的金属活泼的现象,所以可能存在,而B中滤纸上有金属Cu而滤液中的Ag+不可能存在。所以,正确答案是:B。
综上所述,活泼金属与酸发生置换反应时,在金属活泼性顺序表中,越靠左边的金属(越活泼的金属)越优先与酸发生置换反应,放出氢气,而H之后的金属不能与酸发生置换反应;另一方面,金属与盐溶液发生置换反应时,盐溶液中的金属在金属活泼性顺序表中越靠右,即活泼性越弱越优先发生反应,即两种金属在金属活泼性顺序表中相距越远,活泼性差距越大,越优先发生反应。
二、酸、碱、盐之间的复分解反应
1.酸与碱和盐的混合溶液反应
规律:盐溶液中有碱时,酸优先与碱发生反应,直到碱完全反应,才能与盐反应。
例:将露置在空气中已部分变质的NaOH样品,溶于水配成溶液,向其中滴加过量的稀盐酸,下列示意图能正确反映所加盐酸的质量与产生CO2的质量关系的是( )
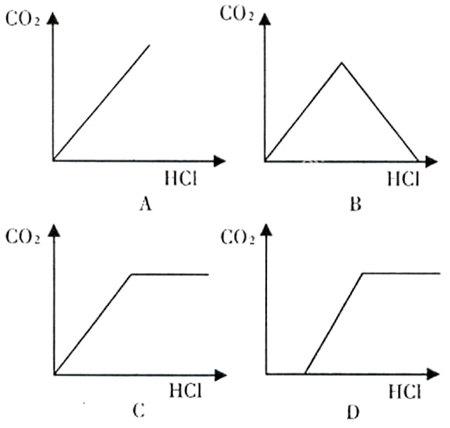
分析:稀盐酸能与Na2CO3反应生成CO2气体,也能与NaOH发生中和反应,若先与Na2CO3反应,则生成的CO2会被NaOH溶液吸收,重新生成Na2CO3。而实际反应时,稀盐酸首先与NaOH发生中和反应,直到NaOH被完全中和,稀盐酸才能与Na2CO3发生反应,发出气体。故答案是:D。
2.碱与酸和盐的混合溶液反应
规律:盐溶液中有酸时,碱优先与酸发生中和反应,直到酸完全反应,碱才能与盐反应。
例:在探究碱的性质时,小明做了将NaOH溶液逐滴滴入CuSO4溶液中的实验,细心的小明发现,并没有马上产生蓝色沉淀,而是滴了较多NaOH溶液后才开始产生大量的蓝色沉淀。对此现象,小明有以下几种猜想,你认为较合理的是( )
A.开始滴加的NaOH溶液太少,不能将CuSO4完全反应,所以见不到沉淀
B.可能开始时生成的Cu(OH)2较少,能溶于水
C.可能是CuSO4溶液中含有少量的硫酸,开始时NaOH被硫酸中和了
D.可能是CuSO4太稀了
解析:NaOH能与CuSO4溶液发生反应,不管NaOH溶液的多少,还是CuSO4溶液的浓稀,当两者相互接触时,总能生成不溶于水的Cu(OH)2沉淀,即能看到有蓝色沉淀析出;而当CuSO4溶液中混有酸(如硫酸)时,NaOH既可与H2SO4反应,也可与CuSO4反应生成Cu(OH)2沉淀,而Cu(OH)2沉淀又能被H2SO4溶解,重新生成CuSO4溶液。所以当CuSO4溶液中混有酸时,NaOH首先与酸发生中和反应,直到酸被反应完全,NaOH才能与CuSO4溶液反应。故答案是:C。
3.盐与酸和盐混合溶液的反应
规律:盐优先与改变溶液的酸碱性的物质发生反应,然后再进行其他复分解反应。
例:向盛有HCl与CaCl2的混合溶液中逐滴加入Na2CO3溶液至过量,生成沉淀物质与滴加的Na2CO3溶液的质量之间的关系如图所示,下列有关叙述中错误的是( ) 沉淀
A.M点溶液中的溶质是NaCl和CaCl2
B.N点溶液中的溶质是NaCl
C.P点溶液的pH=7
D.OM段发生反应的物质是HCl和Na2CO3
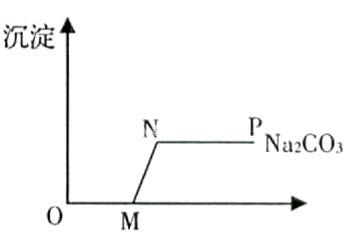
解析:Na2CO3能与HCl反应产生CO2气体,也能与CaCl2反应产生CaCO3沉淀,而生成的CaCO3沉淀又能与HCl反应,放出CO2。所以实际反应时,Na2CO3先与HCl反应,即等HCl反应完了,再与CaCl2反应生成CaCO3沉淀。M点表明Na2CO3溶液恰好与盐酸完全反应,此时,溶液中的溶质为NaCl和CaCl2。随着Na2CO3溶液的继续滴入,Na2CO3与CaCl2反应,生成Ca2CO3沉淀的质量逐渐增加,N点表明Na2CO3恰好将原溶液中的CaCl2完全反应,此时,溶液中的溶质为NaCl,NP段表明溶液中的Na2CO3过量,溶液呈碱性,所以pH>7。故答案是:C。
综上所述,溶液中酸、碱、盐之间发生复分解反应时,一般优先发生中和反应或能够改变溶液酸碱性的反应,然后再发生其他的复分解反应。

