苏云金芽孢杆菌营养期杀虫蛋白Vips研究进展
申建茹 郭 巍
摘要:苏云金芽孢杆菌Bt营养期杀虫蛋白Vips主要分为Vip1、Vip2和Vip3 3种。Vip1和Vip2构成二元毒素,对叶甲科昆虫具有特异杀虫活性。Vip3对鳞翅目昆虫具有广谱杀虫活性,该蛋白广泛存在于Bt中,与已知杀虫晶体蛋白ICPs没有序列相似性。Vip3通过诱发细胞凋亡,最终导致昆虫死亡,这与Bt δ-内毒素的作用机理完全不同,Vips的发现对于Bt的进一步开发利用具有重要意义。本文主要对营养期杀虫蛋白Vips的分布、特性、作用机制及应用等进行报道。
关键词:营养期杀虫蛋白;二元毒素;Vip3A;蛋白特性;作用机制
中图分类号:S 476.11
苏云金芽孢杆菌(Bacillus thuringiensis,Bt)在芽孢形成期产生的杀虫晶体蛋白(insecticidalcrystal proteins,ICPs)是杀虫的主要活性成分,ICPs通过作用于昆虫中肠而导致昆虫死亡[i-33。由于ICPs对鳞翅目(Lepidoptera)、鞘翅目(Coleopter-a)、双翅目(Diptera)等多种重要的农林业害虫均具毒杀作用,Bt已成为目前研究最深入、应用最广的杀虫微生物。但是,在实际应用中仍有许多重要农作物害虫对ICPs低敏感或不敏感,并且由于大规模和连续使用Bt,一些种群对Bt制剂产生了不同程度的抗性。因此,寻找具有与ICPs不同杀虫作用方式的蛋白以延缓抗性产生具有深远的意义。
Estrueh和Warren等人于1996年和1998年分别从B。thuringiensis菌株AB88和蜡状芽孢杆菌(B.cereus)菌株AB78上清液中发现了新型分泌杀虫蛋白,即营养期杀虫蛋白(vegetative insecti-cidal proteins,Vips),该类蛋白从对数生长中期开始分泌,直到稳定前期达到最高峰,具有热不稳定性,95℃处理20 min便失活;一般不形成伴孢晶体且与已知的ICPs没有序列相似性,最重要的是其杀虫作用机理与ICPs不同。该蛋白的发现使Bt在杀虫活性、杀虫范围方面得到很大突破,在一定程度上克服了多种害虫对ICPs低敏感或不敏感的弊端。可见,Vips是一个极为丰富而且具有巨大潜力的资源,该领域已成为Bt研究的热点。
Vips主要分为Vipl、Vip2和Vip3 3种。最近,Bt蛋白命名委员会提出按照Bt Cry毒蛋白的分类命名方法,将所有的Vip蛋白和类Vip毒素蛋白分为3个种、8个亚种以及更下一级的分类。
1Vip1/Vip2
对于vip1A/vip2A的研究较少,目前GenBank已收录的全长vip1A/vip2A基因主要有4种。
1.1vip1A/2A基因的分布及Vip1A/Vip2A的杀虫活性
Warren等人认为vip1A/vip2A基因在芽孢杆菌中分布较广,约为11.9%。作者对本实验室分离并保存的171株野生型Bt菌株进行PCR检测,得到20株含有vip1A/vip2A基因的菌株,检出率为11.69%(申建茹,郭巍,待发表),与Warren等人的研究结果一致,而师永霞等人得出的检出率仅为2%。
vip2A基因正位于vip1A基因的上游,两基因的ORF(open reading frame)之间仅相差4个碱基。对viplA(a)/vip2A(a)基因的亚克隆和移码突变分析表明,两者的表达产物构成二元毒素,对玉米幼芽根叶甲等叶甲科昆虫具有特异性,但对鳞翅目昆虫无效。
1.2Vip1A/Vip2A蛋白的特性及其作用机理
Blast结果表明,ViplA蛋白N-端氨基酸序列相似性明显高于C-端,Vip2A蛋白的C-端氨基酸序列相似性明显高于N-端。而且Vip2A蛋白的保守性较高。
Vip1A(a)分子量为100 ku,分泌到胞外时,N-端1~33位氨基酸信号肽被切除,加工成约为80 ku的蛋白质。ViplA(a)与炭疽杆菌(Bacillus anthra-cis)的主要毒素成分即保护性抗原(protective antigen,PA)具有氨基酸序列相似性,PA可以将有活性的酶分子转位到宿主细胞中。Vip2A(a)的信号肽位于其N-端1~49位氨基酸,其N-端还存在LKID-KVEDF(53~66),因此在成熟蛋白质中信号肽已被切除。Vip2A(a)蛋白与一些具有ADP核糖转移酶活性的二元毒素的酶活成分具有序列相似性,因此Vip2蛋白也代表了一种肌动蛋白-ADP核糖基化毒素的家族。Vip2蛋白的酶结构区域是一种混合的a/β蛋白,分为两个domain,即N-domain(60~265氨基酸)和C-domain(266~461氨基酸),C-domain能够与NAD结合,突出的N-domain与Vip1蛋白相互作用。
对于典型的A-B型二元毒素,两个功能不同的亚基或结构域必须组装成复合物才能发挥活性。但Vip1和Vip2的作用方式不同,二元毒素的两种多肽并不结合,而是独立行使功能。100 ku的Vip1多聚体具有膜结合能力,为Vip2进入靶标昆虫细胞质提供途径;含有NAD结合位点的Vip2具有ADP-核糖基转移酶活性,可能在Arg177处阻止肌动蛋白的多聚化,引起肌动蛋白无法构成细胞骨架,由于肌动蛋白微丝亚基的快速交接从而导致昆虫最后死亡。
2Vip3
2.1Vip3A的杀虫活性
Vip3A对草地贪夜蛾(Spodoptera frugiper-da)、甜菜夜蛾(S.exigua)、烟芽夜蛾(Heliothisvirescens)等对ICPs不敏感或低敏感的昆虫具有广泛的杀虫活性,且毒效都在纳克(ng)水平上,对小地老虎(Agrotis ipsilon)的毒性比Cry1Ac高260倍,但对鞘翅目昆虫无效。Vip3A类蛋白间的序列相似性在98.6%~100%之间,已有文献报道该类蛋白仅第206、284、291、406、464、742位氨基酸的变动频率偏高,随着研究的深入,目前已经鉴定的Vip3A蛋白共28个,通过氨基酸序列比对,发现Vip3A蛋白在第284、358、406、536、633、755、761、776位氨基酸的变动频率均较高。但仅几个氨基酸的差异,蛋白间的杀虫谱和毒性却差异很大。Vip83蛋白N端比Vip-C9蛋白多两个氨基酸,对小菜蛾表现高活性,而Vip-C9对小菜蛾的活性很低。
2.2vip3A基因的分布和保守性分析
vip3A基因广泛存在于Bt菌株中,分布率为15%~63%。刘金环等从606株Bt菌株中鉴定出382株含有vip3A基因,分布率高达63%,其中315株含有与mip3Aal相同的基因带型。
作者从本实验室分离并保存的171株野生型Bt菌株中筛选出63株含vip3A基因的菌株,vip3A分布率为36.84%,63株均含有与vip3Aal相同的基因带型(申建茹、郭巍,待发表),这与前人的研究结果一致,充分说明该类基因在遗传上比较保守,可能是Bt菌株某种结构或功能所必需的关键基因。
2.3vip3A基因的鉴定及其定位研究
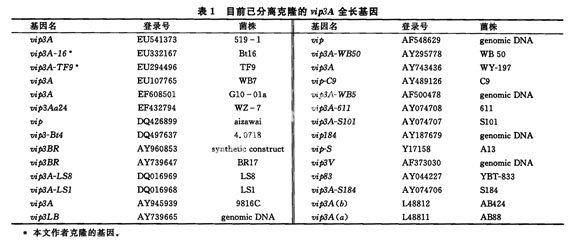
GenBank收录的vip基因大多属于vip3A型基因。截至2008年4月9日,GenBank已收录的vip3A全长基因共有28个,具体见表1。1996年Estruch等研究发现,vip3A(a)基因位于染色体DNA上,但是此后定位研究表明vip3A基因是定位于质粒上,因此该类基因的定位是因菌株而异还是全部定位于某特定质粒上,仍有待研究。
2.4Vip3A(a)蛋白的结构与功能
Vip3A(a)的分子量为88 ku,N-端含有带正电荷氨基酸(Asn2~Lys7)及其相连的疏水核心功能区(Leu8~Met34),这与其他芽孢杆菌的信号肽序列类似。但是Vip3A(a)蛋白N-端缺少信号肽酶作用位点,因此,易位时不进行N-端加工,这种情况在G+细菌中较少见。功能结构域分析表明,其N-端存在一个引导序列,不被切除却起着分泌到细胞外的作用,C-端存在纤维素结合结构域(CBD)相似肽。初步说明了Vip3A是一种与信息传递相关的蛋白,在分泌到细胞外后可能要发挥某种功能,而C-端结合结构域则可能正是发挥蛋白功能的区域。
Estruch等研究表明,C-端150个氨基酸区域决定Vip3A(a)杀虫谱,Selvapandiyan等证明缺失C-端220个氨基酸的Vip3A-S对斑禾草螟和斜纹夜蛾都失去了杀虫活性,证明Vip3A蛋白C-端含有稳定功能区,对于维持Vip3活性至关重要,缺失或增加几个氨基酸都会使它的活性完全丧失,因此不同Vip3蛋白C-端的变异可能是对不同生物活性的选择。陈建武等构建缺失N-端27个氨基酸的Vip-S184缺失体失去了对甜菜夜蛾和斜纹夜蛾幼虫的杀虫活性,揭示了Vip3A信号肽序列对该类基因的杀虫活性是十分重要的,而且在大肠杆菌中对于蛋白可溶性、包涵体形成位置和杀虫活性等是必需的,在Bt中影响蛋白的表达时相、分泌性和杀虫活性。刘荣梅等通过构建缺失蛋白Vip-C9-N,也表明N-端信号肽序列(39个氨基酸)对甜菜夜蛾的活性是必需的。
2.5Vip3A的作用机理
Vip3A(a)与敏感昆虫的中肠液进行混合处理后,可形成4条主要蛋白带:22 ku、33 ku、45 ku和66 ku。非敏感昆虫的中肠液也可以将Vip3A蛋白水解成上述4种蛋白带,但是并不会导致明显的病理变化。Vip3A蛋白仅结合在敏感昆虫的中肠细胞上,因而Vip3A(a)的杀虫作用谱和其与中肠上皮细胞结合与否直接相关。
细胞病理学试验表明:饲喂小地老虎和草地贪夜蛾等敏感昆虫Vip3A(a)蛋白72 h后,中肠上皮杯状细胞和柱状细胞与基膜完全脱落,昆虫死亡。Vip3A引起的症状与ICPs的相似,但是时间上推迟了。Vip3A蛋白只要在pH低于7.5时即可溶解,其C-端也不被切除,与敏感昆虫上皮结合,诱发昆虫细胞凋亡(PCD),细胞核溶解,最终昆虫死亡。Lee等根据烟草天蛾BBMV的配体印迹发现,Vip3A与CrylAb毒蛋白在烟草天蛾中肠上的受体明显不同,为一类80 ku或100 ku左右的蛋白,而激活的CrylAb毒蛋白的受体是120 ku的氨肽酶(APN)类似物和250 ku的钙黏蛋白(cadherin)类似物。蛋白杂交试验证明,Vip3A并不是结合到已知的Cry1Ac的受体上,并且Vip3A与Cry1Ac和Cry2Ab2之间存在着对BBMV的非竞争性结合。
3Vips的应用前景
苏云金芽孢杆菌在对数生长期表达分泌的蛋白质对于杀虫活性来说是一个极丰富的资源,表现出较为广阔的应用前景。
3.1构建工程菌
通过Vips之间、Vips和ICPs之间以及Vips和其他与杀虫有关的蛋白之间融合构建嵌合蛋白,将为有效地构建特异高毒力工程菌提供新的途径。将Vip1和Vip2的受体结合功能区或易位功能区与其他杀虫蛋白融合,可以增大融合蛋白的杀虫范围或增强其杀虫活性。Vip3A和ICPs之间可能存在着协同增效作用;将不同生物活性的vip基因通过基因序列交换或者改造,可以获得杀虫谱更广、活性更高的融合基因;将vips基因单独在高毒力Bt菌株中进行表达或将该基因与ICPs基因进行共表达,构建的工程菌株对于扩大杀虫谱、提高杀虫活性和延缓抗性等方面均具有重要意义。
3.2构建转基因植物
对vip3基因的研究利用也可以作为转基因植物抗性管理策略之一。Vip3新菌株、新杀虫特性、新杀虫蛋白及其编码基因的发现和报道层出不穷,为构建转基因植物提供了新的杀虫基因资源,vip3A(a)基因可以全序列或以毒性片断导入植物。现在Vips已经成功地应用于转基因杀虫植物的构建,先正达公司已成功地将Vip3A导入不同作物,得到高效抗虫多价转基因玉米、棉花,延缓了抗性发展。2004年,先正达公司将转包括该基因的多价转基因棉花在美国进行田间释放试验,大大提高了植物的抗虫性,降低了防治费用,减少了环境污染,降低了损失,显示了很好的应用前景。
3.3杀虫活性物质的筛选
Vip1、Vip2、Vip3 3种杀虫蛋白具有特殊的杀虫作用机理,可以为筛选新的杀虫活性物质提供新的思路,可用于筛选诱发细胞凋亡或者是跨膜前后产生活性的化学配体,包括生物小分子、多肽或蛋白质。
3.4其他方面
可以将vip基因导入其他芽孢杆菌或酵母、其他杀虫微生物或者根际微生物,有利于原有性状的改良。此外,对VIPs的研究对于研制广谱杀虫剂具有重要的意义,也具有潜在的应用价值。

