甘肃省玉米大斑病菌交配型组成及遗传多样性分析
高建昊 戴子淙 张小杰 周天旺 王春明 洪流 郭成

摘 要 为明确甘肃省玉米大斑病菌交配型组成及遗传结构,利用交配型鉴定特异引物对采自该省不同地区的玉米大斑病菌进行交配型测定,并采用简单序列重复区间扩增多态性(ISSR)分子标记技术对供试菌株进行遗传多样性分析。结果表明:甘肃省玉米大斑病菌主要包括3种交配型,即A交配型、a交配型和Aa交配型,其比例约为8∶8∶1。24条ISSR引物共扩增出136条条带,平均每个引物扩增出5.67条,其中多态性条带134条,多态性条带比例为98.53%。利用PopGen 32软件分析发现甘肃3个地区玉米大斑病菌间的亲缘关系更近,遗传距离均小于0.08;陇南地区与陕西省的菌株有更高的遗传相似度,为0.933 8;用NTSYS-pc软件对陇东地区的菌株聚类分析,发现ISSR类群的划分与菌株交配型间并没有直接关系。说明玉米大斑病菌遗传类群和交配型之间无明显相关性,但与菌株地理来源有一定的相关性。
关键词 玉米大斑病菌;交配型;ISSR;遗传多样性
玉米大斑病是世界玉米产区普遍发生的一种叶部病害,在玉米整个生育期均可发病,影响玉米的生产,一般年份发病可造成20%左右的产量损失,严重时可达到50%以上[1]。近年来,随着感病品种‘先玉335及其近缘种的广泛种植,加之气候及耕作制度的变化,导致玉米大斑病在不同地区和不同年份频频发生与流行,现已成为危害甘肃东南部玉米生产的主要叶部病害之一[2]。
大斑凸脐蠕孢菌Exserohilum turcicum (Pass.) Leonard & Suggs[有性态为大斑刚毛座腔菌Setosphaeria turcia (Luttr.) Leonard & Suggs]是引起玉米大斑病的病原菌[2]。该病菌为异宗配合真菌,其有性生殖受MAT基因控制,包括仅含 StMAT1-1基因的A交配型、仅含 StMAT1-2基因的a交配型和同时包含两种基因的Aa交配型[3]。在自然条件下不断地进行有性生殖,病原菌基因有性重组,使得病菌变异频率频繁,生理小种也随之不停变化,对病害的防治与抗病品种造成严重威胁[4]。
分子标记能够在DNA水平上反应病原菌个体及种群间的差异[5-6],目前已有多种分子标记技术被广泛应用。ISSR具有可获信息量高,可重复性强,检测多态性高且操作简单等优点[2] 。谷守芹等[7]利用ISSR分子标记技术分析了玉米大斑病菌的遗传多样性;郭丽媛[2]在谷守芹等[7]的基础上优化了ISSR-PCR分析的最佳反应体系和反应程序,并讨论了玉米大斑病菌的遗传多样性与菌株地理来源和交配型间的关系;代玉立等[4]利用ISSR法研究了福建省玉米大斑病菌的遗传多样性。目前尚未见到对甘肃省玉米大斑病菌遗传多样性研究的报道。
根据郭成等[8]的调查,玉米大斑病在甘肃省陇东地区发病严重,部分地块病情级别高达7~9级,平均病株率为87.9%,严重危害了当地玉米安全生产。本研究对甘肃省玉米大斑病菌的交配型和遗传多样性进行研究,以期为进一步深入研究甘肃省玉米大斑病的流行规律及综合防控技术提供理论依据。
1 材料与方法
1.1 供试材料
供试病样:2021-2022年采集甘肃省及陕西省具有典型玉米大斑病症状的病叶标样,风干后带回实验室进行病原菌分离。
供试培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL。
试剂及仪器:2×Power Taq PCR Master Mix、DL1000 DNA Marker和DL2000 DNA Marker均购自近岸蛋白质科技有限公司;TBE购自北京索莱宝科技有限公司;B518229-0100真菌基因组DNA快速抽提试剂盒购自上海生工生物工程股份有限公司;PCR引物均由上海生工生物工程股份有限公司合成。
1.2 试验方法
1.2.1 病原菌的分离培养 采用组织分离法,剪取病健交界处的组织块(4 mm×6 mm),于75%的酒精中消毒40 s,然后用无菌水清洗3次,置于PDA平板中。室温培养3~4 d后转至PDA上纯化2~3次,保存菌株。经分离培养后共获得60株供试菌株,其中50株甘肃菌株进行交配型鉴定和遗传多样性分析,10株陕西菌株仅作为地理种群的对照进行遗传多样性分析(表1)。[FL)]
1.2.2 DNA提取 刮取纯化的病菌菌丝装入灭过菌的1.5 mL离心管中,干燥后加入小钢珠,于液氮中冷却,用组织研磨机将菌丝研磨成粉末,利用B518229-0100真菌基因组DNA快速抽提试剂盒提取各菌株DNA,测定OD260/OD280,确定其浓度与纯度,-20 ℃保存,备用。
1.2.3 病原菌鉴定 将纯化后的单菌落接种在PDA平板上,室温培养7 d,观察菌落特征,并于普通光学显微镜下观察孢子形态。同时,以提取的DNA为模板,利用引物ITS1(5′- TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[6,9]对ITS区序列进行扩增。采用25 μL 的PCR反应体系,即 12.5 μL 2×Power Taq PCR Master Mix,1 μL上游引物,1 μL下游引物,2 μL DNA模板,ddH2O补足至25 μL。PCR反应程序参考马周杰等[6]病原菌鉴定的PCR反应程序。PCR扩增产物经1.0%琼脂糖凝胶电泳检測拍照后,交于上海生工生物工程股份有限公司测序。将测序结果在GenBank中进行比对,下载相似性大于99%的序列,以芸薹链格孢(Alternaria brassicae)、细极链格孢(Alternaria tenuissima)、茄链格孢(Alternaria solani)、菜豆壳球孢(Macrophomina phaseolina)等为外类群,以大斑刚毛座腔菌(Setosphearia turcica)和凸脐蠕孢菌(Exserohilum turcicum)为内类群,基于ITS序列构建系统发育树。
1.2.4 交配型分子鉴定
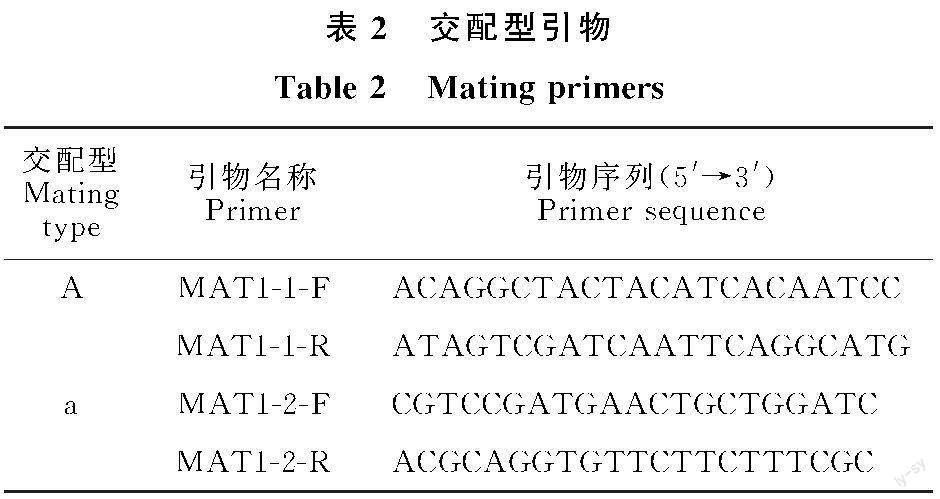
以提取的50株甘肃省玉米大斑病菌株DNA为模板,参照张泗举[3]提出的玉米大斑病菌交配型测定引物(表2)进行PCR鉴定。反应体系同“1.2.3”节。参照张泗举[3]设定PCR反应程序,PCR扩增产物经1.2%琼脂糖凝胶电泳检测,根据扩增条带有无及大小确定交配型。只扩增出800 bp左右目的条带的菌株为A交配型菌株,只扩增出250 bp左右目的条带的菌株为a交配型菌株,同时可扩增出2个目的条带的菌株为Aa交配型菌株,无目的条带扩增结果的菌株为中性菌株。
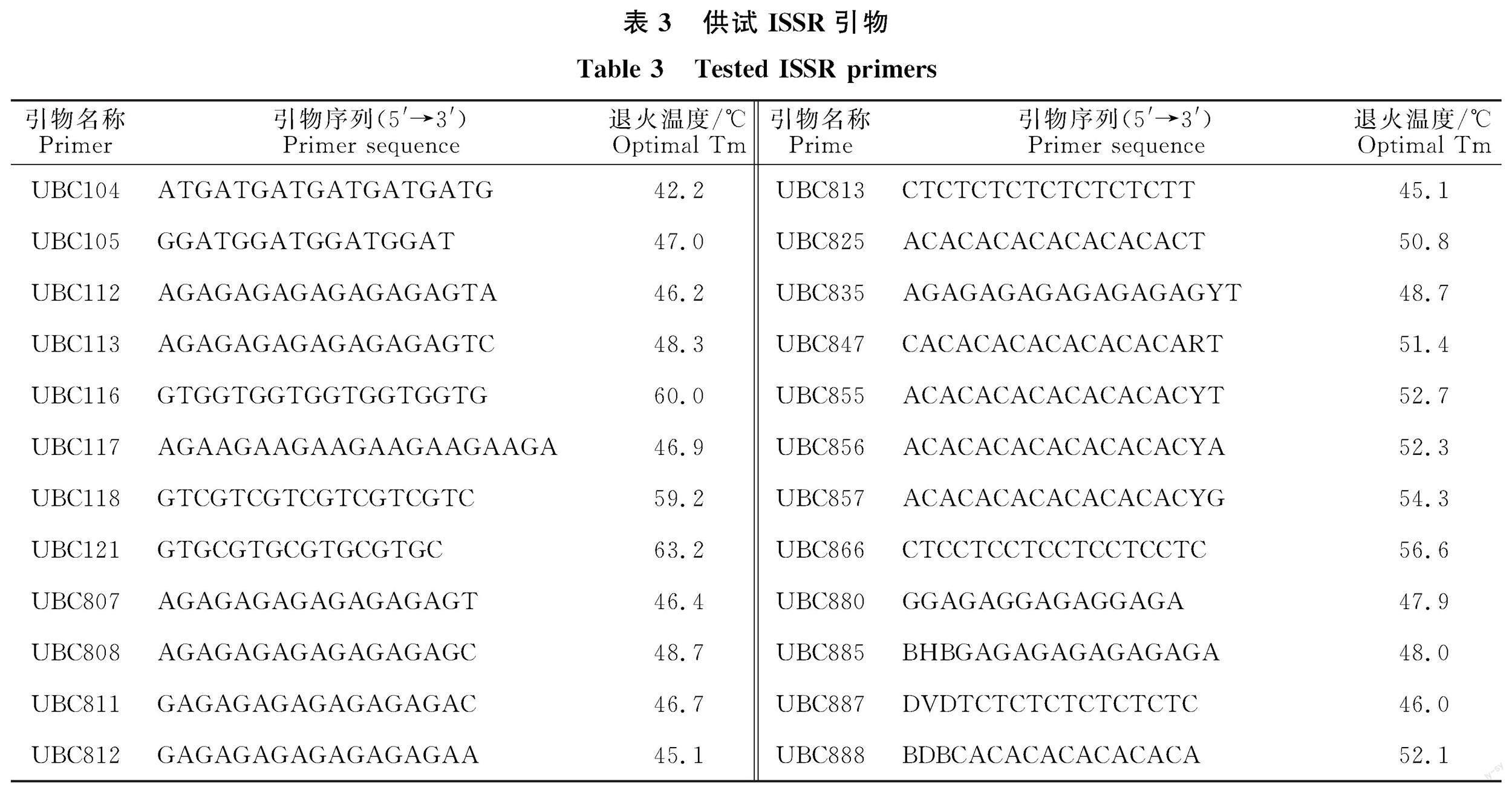
1.2.5 ISSR-PCR扩增 参考谷守芹等[7]、郭丽媛[2]和代玉立等[4]优化的ISSR-PCR反应体系和筛选的引物,对所有供试的60株大斑病菌株进行ISSR扩增,引物由上海生工生物工程股份有限公司合成(表3)。反应体系同“1.2.3”节。PCR反应程序参考郭丽媛[2]ISSR-PCR扩增所用程序(退火温度见表3)。取6 μL扩增产物用的1.5%琼脂糖凝胶在220 V恒定电压下电泳约20 min,用凝胶成像系统检测并拍照。
1.2.6 数据分析 统计电泳条带,在迁移率相同的位置,有条带的记为1,无条带的记为0,将数据结果录入Excel表中构建原始数据矩阵。利用PopGen 32计算遗传距离、遗传相似度、Neis基因多样性指数和Shannon信息指数等遗传变异参数,并利用UPGMA构建基于Neis遗传距离的聚类图谱。
2 结果与分析
2.1 病原菌鉴定
所有供试菌株的菌落背面为榄绿色或黑褐色;在光学显微镜下观察(图1),菌丝为灰黑色,分生孢子梗呈直立状或弯曲状,单生或簇生,棕褐色,顶端为浅棕色,有2~6 个横隔膜,分生孢子为黄褐色,呈长梭形或纺锤形,中下部较宽,有明显的脐点,具2~8个横隔膜,大小为(36.56~ 59.14) μm×(8.19~14.51) μm。
所有供试菌株均用ITS1/ITS4引物扩增出约600 bp的条带,PCR扩增产物序列结果与GenBank中的玉米大斑病菌的无性态大斑凸脐蠕孢菌(Exserohilum turcicum) 菌株序列(NCBI accession NO. MG727619.1)和有性态大斑刚毛座腔菌(Setosphearia turcica)菌株序列(NCBI accession No. KJ922728.1)进行比对,同源性均达99%以上。利用软件MEGA 11.0构建系统发育树(图2),所有供试菌株均能与E. turcicum和S. turcica聚为一支。因此,所有分离株均被鉴定为大斑刚毛座腔菌(S. turcica)。
2.2 交配型组成分析
利用鉴定交配型的2对特异性引物对甘肃省的50株供试菌株DNA进行PCR扩增,在供试的50株甘肃菌株中,A交配型(仅包含 StMAT1-1)共有24株,占菌株总数的48%,a交配型(仅包含 StMAT1-2)共有23株,占菌株总数的46%,Aa交配型的(同时包含 StMAT1-1和 StMAT1-2)共有3株,占菌株总数的6%,未检测到中性菌株。从甘肃不同地区交配型的分布情况来看,28株来自陇南地区的供试菌株中有17株为A交配型,10株为a交配型,1株为Aa交配型,A交配型和a交配型的比例接近2∶1;15株来自陇东地区的供试菌株中有4株为A交配型,9株为a交配型,2株为Aa交配型,A交配型和a交配型的比例接近1∶2;7株陇中地区的菌株中有3株为A交配型,4株为a交配型, A交配型和a交配型的比例接近1∶1。这表明陇南地区玉米大斑病菌的优势交配型为A交配型,陇东地区玉米大斑病菌的优势交配型为a交配型,陇中地区玉米大斑病菌A交配型和a交配型同为优势交配型。
2.3 ISSR-PCR扩增
对供试的60株玉米大斑病菌进行ISSR-PCR扩增,扩增条带的大小为100~5 000 bp,24条ISSR引物共扩增出136条条带,平均每条引物扩增出5.67条条带,其中多态性的条带数为134条,多态性条带比例为98.53%,表明玉米大斑病菌群体存在丰富的遗传多样性。将统计的电泳谱带建立0、1矩阵,利用POPGEN软件分析,结果显示(表4),Neis基因多样性指数和Shannon信息指数均以陇南地区为最高,分别为 0.394 7和0.565 5 ,表明该地区菌株的基因丰富度最高;陕西省次之,分别为0.373 8和0.544 9;而陇东地区分别为0.371 4和0.538 0;陇中地区的则分别为0.329 5和0.474 3,说明玉米大斑病菌基因多样性与地理区域有较大的相关性。甘肃省3个地区的Shannon信息指数均在0.47以上,Neis基因多样性指数均在0.32以上,表明甘肃省玉米大斑病菌的遗传多样性十分丰富。如表4所示,甘肃省3个地区中有效等位基因数、Neis基因多样性指数、Shannon信息指数、多态性位点数和多态位点百分率均以陇南地区最高,表明陇南地区菌株遗传多样性最丰富。
如表5所示,陇南地区与陇东地区的遗传距离最小,为0.036 4;遗传相似度最高,为0.964 3。相比陇东地区和陕西省,陇中地区与陇南地区的遗传距离更小,为0.043 9;遗传相似度更高,为 0.957 1。甘肃3个地区中,隴南地区与陕西地区的遗传距离最小,为0.068 4;遗传相似度最高,为0.933 8 。对popgen聚类图谱分析发现(图3),在距离2.85处甘肃省3个地区和陕西省可聚为2个类群,分别是甘肃类群和陕西类群;在距离 1.82处甘肃类群又聚为2个亚类群,其中陇东地区和陇南地区聚为一支,陇中地区聚为一支。以上结果表明,甘肃各地区玉米大斑病菌的亲缘关系更近,陇南、陇中、陇东3个地区相比,陇南地区与陕西地区的菌株遗传相似度更高。说明玉米大斑病菌的遗传亲缘关系与地理来源有相关性。
在用NTSYS-pc软件对陇东地区的菌株进行聚类分析时发现,不同交配型的菌株可以聚类在同一类群中,说明菌株的交配型与遗传分化之间并没有明显的相关性。
3 讨论与结论
在甘肃,玉米大斑病主要危害陇东和陇南地区的玉米生产,是不可忽视的重要病害。中国玉米大斑病菌存在不同的交配类型(A交配型、a交配型和Aa交配型),且可以进行有性生殖,这增加了玉米大斑病菌遗传变异的几率。异宗配合真菌的有性生殖受交配基因MAT的控制,交配类型A和a分别由 StMAT1-1和 StMAT1-2基因编码[10]。在本研究中,检测出甘肃省玉米大斑病菌存在A、a和Aa 3种交配类型,其中A交配型和a交配型比例接近1∶1,与Bunkoed等[11]报道泰国玉米大斑病菌A交配型与a交配型比例接近1∶1的研究结果比较一致;但与孙淑琴等[12]的中国玉米大斑病菌中Aa交配型的两性菌株数量最大,王利智等[13]的云南省玉米大斑病菌A交配型比例明显大于a交配型,以及郭丽媛[2]的中国北方玉米产区玉米大斑病菌a交配型比例远大于A交配型之结果有差异。以上研究结果表明,不同地区存在不同的优势交配型,且交配型分布比例也存在差异,有些地区交配型组成较为简单,有些地区交配型组成较为复杂,而不同的交配型有性杂交可能是生理小种趋于复杂的原因之一[12]。因此,监测不同地区玉米大斑病菌的交配型分布及比例,对大斑病菌遗传分化与病害流行的预测具有重要意义。此外,Nelson[14]发现玉米大斑病菌还存在双性菌株和中性菌株,认为玉米大斑病菌的交配类型不是简单的双极性,但本研究并未发现中性菌株,今后还需扩大样本容量。
根据郭成等[8]的调查,近年来玉米大斑病在甘肃省发病日益严重,除气候适宜等原因外,可能还与病原菌丰富的遗传多样性有关。因此,本研究以大斑病发病最严重的陇东地区为中心,采集了陇东地区、陇中地区、陇南地区及临近甘肃省的陕西省部分地区的大斑病样用于试验。本研究对供试的60株玉米大斑病菌进行聚类分析,发现甘肃各地区菌株间的亲缘关系更近,其中陇东地区与陇南地区的菌株有更高的遗传相似度;陇中地区与陇东地区的遗传相似度及陇中地区与陇南地区的遗传相似度均高于陇中地区与陕西省的遗传相似度,表明玉米大斑病菌的变异与地域之间有一定的关系,地域间的距离越近,菌株间的亲缘关系越近。这与Ferguson等[15]、 Borchardt等[16]和郭丽媛[2]研究所得玉米大斑病菌的遗传变异与地域间有一定的关系的结论一致。但与谷守芹等[7]、张明会等[17]、王利智等[13]和马周杰等[6]分析认为玉米大斑病菌类群划分与菌株地理来源间的相关性并不显著的结果不一致。以上结果表明,不同地区的病原菌受气候、生态环境、人工作业、推广品种的抗病基因组成等诸多因素影响,其地理来源对遗传变异的影响表现出差异。本研究的结果表明,在甘肃省内,病原菌的地理来源是影响遗传多样性的一个重要因素。同时在本研究中,不同的交配型可以划分在同一类群中,说明玉米大斑病菌的ISSR多态性与交配型之间的相关性不显著。这与郭丽媛[2]交配型与菌株遗传分化的关系不明显的结果一致;但与谷守芹等[7]和马周杰等[6]研究发现玉米大斑病菌菌株遗传类群和交配型在分子水平上存在一定关系的结果不一致。这可能与各地菌株遗传背景或海拔、气候等环境因素的差异有关。因河西走廊干旱少雨,大斑病零星發生,甘肃中部干旱,大部分地区大斑病发生偏轻,故所有供试菌株中,主要缺乏甘肃中部地区的菌株,今后还需增大样本容量,同时进行生理小种的鉴定,进一步确定玉米大斑病菌遗传多样性与地域、交配型和生理小种之间的关系以及同一地区的菌株变异趋势,以期对大斑病的综合防控起到支撑作用。
参考文献 Reference:
[1] 左建英,李育才.山西省玉米大斑病的发生特点和综合防治技术[J].内蒙古农业科技,2011(3):123,128.
ZUO J Y,LI Y C.Occurrence characteristics and integrated control techniques of Exserohilum turcicum in Shanxi province[J]. Journal of Northern Agriculture,2011(3):123,128.
[2] 郭丽媛.中国北方玉米产区玉米大斑病菌生理小种监测及遗传多样性分析[D].河北保定:河北农业大学,2013.
GUO L Y.Physiological races monitoring and genetic diversity of Setosphaeria turcica in maize production areas of Northern China[D].Baoding Hebei:Hebei Agricultural University,2013.
[3] 张泗举.玉米大斑病菌交配型基因片段的克隆与分析[D].河北保定:河北农业大学,2008.
ZHANG S J.Cloning and analysis of mating type gene fragments in Setosphaeria turcica[D].Baoding Hebei:Hebei Agricultural University,2008.
[4] 代玉立,甘 林,阮宏椿,等.福建省玉米大斑病菌ISSR-PCR反应体系的优化和引物的筛选[J].福建农业学报,2019,34(7):810-817.
DAI Y L,GAN L,RUAN H CH,et al.ISSR-PCR optimization and primer selection for analyzing Exserohilum turcicum isolates collected in Fujian[J].Fujian Journal of Agricultural Sciences, 2019,34(7):810-817.
[5] 周艳春.无芒雀麦种质资源遗传多样性分析及其核心种质的构建[D].长春:东北师范大学,2020.
ZHOU Y CH.Genetic diversity analysis and construction of core germplasm in Bromus inermis Leyss[D].Changchun:Northeast Normal University,2020.
[6] 马周杰,何世道,庞欣宇,等.东北地区玉米大斑病菌交配型组成及遗传多样性分析[J].沈阳农业大学学报,2021, 52(4):402-408.
MA ZH J,HE SH D,PANG X Y,et al.Analysis of mating type composition and genetic diversity of Setosphaeria turcica in Northeast China[J].Journal of Shenyang Agricultural University, 2021,52(4):402-408.
[7] 谷守芹,范永山,李 坡,等.玉米大斑病ISSR反应体系的优化和遗传多样性分析[J].植物保护学报,2008,35(5):427-432.
GU SH Q,FAN Y SH,LI P,et al.Optimization of ISSR reaction genetic diversity analysis of Exserohilum turcicum[J].Journal of Plant Protection,2008,35(5):427-432.
[8] 郭 成,徐生军,金社林.2015年甘肃玉米病虫害发生情况调查报告[J].甘肃农业科技,2016(4):1-3.
GUO CH,XU SH J,JIN SH L.Investigation report on the occurrence of corn diseases and pests in Gansu in 2015[J].Gansu Agricultural Science and Technology, 2016(4):1-3.
[9] 唐 琳.凸脐蠕孢菌玉米、高粱专化型的致病分子差异研究[D].沈阳:沈阳农业大学,2015.
TANG L.The pathogenic molecular differences of Setosphearia turcica f.sp.zeae and Setosphearia turcica f.sp.sorghi[D].Shenyang:Shenyang Agricultural University,2015.
[10]ARIE T,CHRISTIANSEN S K,YODER O C,et al.Efficient cloning of ascomycete mating type genes by PCR amplification of the conserved MAT HMG box[J].Fungal Genetics and Biology,1997,21(1):118-130.
[11] BUNKOED W,KASAM S,CHAIJUCKAM P,et al.Sexual reproduction of Setosphaeria turcica in natural corn fields in Thailand[J].Agriculture and Natural Resources, 2014,48(2):175-182.
[12] 孙淑琴,温雷蕾,董金皋.玉米大斑病菌的生理小种及交配型测定[J].玉米科学,2005,13(4):112-113,123.
SUN SH Q,WEN L L,DONG J G.Identifiction of physiological races and mating type of Exserohilum turcicum[J].Journal of Maize Sciences,2005,13(4):112-113,123.
[13] 王利智,吳景芝,康志钰,等.云南省玉米大斑病菌的RAPD分析[J].云南大学学报(自然科学版),2011, 33(2):244-248.
WANG L ZH,WU J ZH,KANG ZH Y,et al.Phylogenetic analysis on Exserohilum turcicum isolates from Yunnan province by RAPD[J]. Journal of Yunnan University(Natural Sciences Edition),2011,33(2):244-248.
[14] NELSON R R.A major gene locus for compatibility inTrichometasphaeria turcica[J].Phytopathology,1959, 49(3):159-160.
[15] FERGUSON L M,CARSON M L.Spatial diversity of Setosphaeria turcica sampled from the eastern United States[J].Phytopathology, 2004,94(8):892-900.
[16] BORCHARDT D S,WELZ H G,GEIGER H H.Molecular marker analysis of European Setosphaeria turcica populations[J].European Journal of Plant Pathology, 1998,104(6):611-617.
[17] 張明会,徐秀德,姜 钰,等.玉米大斑病菌种群遗传多样性研究[J].玉米科学,2009,17(1):143-146.
ZHANG M H,XU X D,JIANG Y,et al.Genetic diversity of Exserohilum turcicum on maize[J].Journal of Maize Sciences,2009,17(1):143-146.
Analysis of Mating Type Composition and Genetic Diversity of Northern Maize Leaf Blight in Gansu
Abstract To clarify the current situation of mating type composition and genetic structure of Exserohilum turcicum in Gansu province,the specific primers were used to identify the mating type of Exserohilum turcicum collected from different regions of Gansu province,and the tested strains were analyzed for genetic diversity using simple sequence repeat interval amplified polymorphism (ISSR) molecular marker technology. The results showed that there were three mating types of the pathogen in Gansu province,namely “A” mating type (only containing StMAT1-1 gene) ,“a” mating type (only containing StMAT1-2 gene) and “Aa” mating type (containing both StMAT1-1 and StMAT1-2 genes),its ratio was about 8∶8∶1. A total of 136 bands were amplified from 24 ISSR primers,with an average of 5.67 bands amplified per primer,including 134 polymorphic bands and a 98.53% proportion of polymorphic bands. PopGen32 software was used to analyze the genetic relationship among the three areas in Gansu,and the genetic distance was less than 0.08; the strains from Longnan had a higher genetic similarity (0.933 8) with those from Shaanxi; NTSYS-pc software was used to cluster the strains in Longdong area,and it was found that there was no direct relationship between ISSR classification and strain mating type. The results indicated that there was no significant correlation between the genetic group and mating type of the pathogen,while there was a certain correlation with the geographical origin of the strain.
Key words Maize leaf spot pathogen; Mating types; ISSR; Genetic diversity

