紫苏磷脂酸磷酸水解酶基因( PfPAH1)的鉴定及功能分析
董书言 邢志 尹苗 王尧 周雅莉 黄旭升 王超 王计平 李润植

摘 要 本文基于紫苏基因组数据筛选获得两条 PfPAH1基因序列,分别命名为 PfPAH1-1和 PfPAH1-2。应用生物信息学工具分析PfPAH1s蛋白理化性质、功能结构域及系统进化。定量PCR(qRT-PCR)检测 PfPAH1s在紫苏根、茎、叶、花及不同发育时期种子的表达谱。进一步克隆到高表达的 PfPAH1-1基因的编码序列并进行烟草瞬时转化以鉴定其功能。结果表明, PfPAH1-1和 PfPAH1-2基因的开放阅读框(ORF)长度均为2 715 bp,编码904个氨基酸残基,含有Lipin_N 、Lipin_mid 和属于HAD_like超家族的LNS2 三个保守结构域。系统进化分析显示紫苏PfPAH1-1蛋白与唇形科植物一串红的SsPAH1亲缘关系最近,其次是葡萄和芥菜。PfPAH1-2蛋白则与唇形科的芝麻SiPAH1亲缘关系最近,其次为油橄榄,紫苏和芝麻均为油料作物,推测PfPAH1-2和SiPAH1可能具有相似功能。qRT-PCR分析表明 PfPAH1-1和 PfPAH1-2基因均在开花后40 d种子中表达量最高,预示着其可能参与油脂合成积累。烟草瞬时转化揭示过表达 PfPAH1-1基因烟草叶片总脂肪酸及中性脂含量均高于野生型烟草,然而磷脂含量降低。
关键词 紫苏;磷脂酸磷酸水解酶;基因克隆;表达特性;烟草瞬时表达
紫苏(Perilla frutescens (L.) Britt.)属唇形科紫苏属1 a生草本植物,是一种传统的药食同源植物,在亚洲东部国家,特别是中国、韩国和日本广泛种植[1]。 紫苏种子出油率高达46%~58%,不饱和脂肪酸含量丰富(>种子中总含油量的90%),特别是α-亚麻酸含量(约60.7%)远高于大豆(5%~13%)、油菜(1%~8%)、玉米 (0.5%~2%)、向日葵 (0.5%~2.0%)等油料作物[2]。极低的ω-6/ω-3 FAs(linoleic acid/alpha-linolenic acid)比率(0.2∶1)使紫苏油成为人类饮食中植物油的理想来源。此外,紫苏油还可用于制作干燥油漆、清漆、油墨等[3]。因此,紫苏作为一种多用途经济作物,在制药、食品及工业等方面具有潜在的应用前景。
植物细胞中,甘油脂合成具有两条完全独立的途径,即真核途径和原核途径[4]。磷脂酸(PA,phosphatidic acid)是所有甘油酯从头合成的共同前体物[5]。PA由甘油-3-磷酸(glycerol-3- phosphate,G3P)途径合成,在磷脂酸磷酸水解酶(PAP/PAH,phosphatidic acid phosphatase/phosphatidic acid hydrolase)作用下生成二酰甘油(DAG,diacylglycerol)进而合成三酰甘油(TAG,triacylglycerol)[6-7],或由胞苷二磷酸-二脂酰甘油合酶(CDS,cytidinedi phosphate-diacylglycerol synthase)催化形成胞苷二磷酸-二脂酰甘油(CDP-DAG,cytidinediphosphatediacylglycerol),進一步合成磷脂酰肌醇 (PI,phosphatidylinositol)、磷脂酰甘油(PG,phosphatidylglycerol)和磷脂酰丝氨酸(PS,phosphatidylserine)[4]。此外,PA经 PAP/PAH催化合成的DAG可经核苷酸途径形成磷脂酰胆碱(PC,phosphatidylcholine)及磷脂酰乙醇胺(PE,phosphatidylethanolamine),也可通过连续催化反应合成半乳糖脂及硫代异鼠李糖甘油二酯(SQDG,sulfoquinovosyldiacylglycerol)[5]。因此,细胞中的PA及DAG含量的变化能够影响细胞膜脂质的合成代谢,同时DAG也是连接油脂和膜脂的关键节点,可以直接调节细胞内油脂、膜脂的 平衡。
植物中含有多种磷脂酸水解酶异构体,这些酶的代谢功能一直是脂质代谢研究的焦点[7]。PAP作为调控生物体内PA和DAG含量的关键酶,根据其催化特性分为PAP1/PAH和PAP2/LPP,其中PAP1包括酵母Pah1p、植物PAH1、PAH2和动物的Lipin 1~3。Reitman[8]研究表明Lipin 1过表达会导致小鼠体内TAG含量升高,体质量增加;Han等[9]指出酵母PAH1与甘油酯合成有关,其 pah1Δ突变体中PA含量高于野生型植株,DAG和TAG含量较野生型减少;Mietkiewska等[10]将拟南芥PAH和油菜PAH在酵母 pah1Δ突变体中表达能够在突变体酵母中重新合成TAG;Wang等[11]研究发现拟南芥 Δ pah1 pah2双突变体中PA、PC、PE、PI等磷脂含量较野生型显著升高,双半乳糖二脂酰甘油(DGDG)及糖脂单半乳糖二脂酰甘油(MGDG)低于野生型。目前,PAH在酵母中已被纯化[12],动物Lipin也得到较为广泛的研究[5],而有关植物PAH的研究报道相对较少。
本研究基于从紫苏基因组数据库中鉴定获得 PfPAH1-1和 PfPAH1-2基因序列,分析其基本理化性质、结构特点及系统发育关系等,通过实时荧光定量PCR研究 PfPAH1-1和 PfPAH1-2基因在紫苏不同组织中的表达特异性;对表达量较高的 PfPAH1-1基因进行分子克隆,获得完整编码的CDS序列,并通过侵染野生烟草(Nicotiana tobaccum,Sumsun NN(SNN))叶片,瞬时表达目的基因,研究过表达 PfPAH1-1基因的烟草脂质组成变化,为深入探讨紫苏 PfPAH1-1基因在脂质代谢中的生物学功能提供理论依据。
1 材料与方法
1.1 试验材料
紫苏及烟草种子由山西农业大学分子农业与生物能源研究所保存。于2020年5月将紫苏种植于山西农业大学试验基地,在适宜时期取其根、茎、叶、花及开花后不同发育时期(开花后10 d、20 d、30 d、40 d)的种子,置于-80 ℃冰箱保存备用。烟草置于恒温光照培养箱中培养(温度25 ℃,光照时间16 h,光照度15 000 lx)。
1.2紫苏 PfPAH1基因筛选及鉴定
以拟南芥AtPAH1(NP_001118604.1)蛋白序列为检索序列,利用BioEdit软件在紫苏基因组及转录组数据库中进行BLAST同源比对,通过ORF(https://www.ncbi.nlm.nih.gov/orffinder/)及CDD功能结构域(Conserved Domains Datebase,http://ncbi.nlm.nih.gov/Structure/cdd/Wrpsb.cgi)分析比对,筛选获得紫苏PAH1基因序列。
1.3 PfPAH1基因生物信息学分析
通过GSDS(Gene Structure Display Server,http://gsds.gao-lab.org/index.php)在线软件分析紫苏 PfPAH1基因外显子、内含子分布情况;利用在线ExPasy网站中的ProtParam工具(http://web.expasy.org/protgaram)分析 PfPAH1基因编码蛋白的理化性质;使用在线软件TMHMM Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)、Signal 4.1(www.cbs.dtu.dk/services/Signal P-4.1/)和PSORTⅡ(https://psort.hgc.jp/form2.html)对紫苏PfPAH1蛋白的跨膜区域、信号肽切割位点及亚细胞定位进行预测;依据SOPMA(http://npsa- pr abi. ibcp.fr/cgi-bin/nspa_automat.pl?page=npsa_sopma.html)分析PfPAH1蛋白的二级结构;通过在线软件SWISS-MODEL(http://swissmodel.expasy.org/interactive)对PfPAH1蛋白的三级结构进行预测分析与同源建模;用Jalview软件将紫苏 PfPAH1氨基酸序列与其他物种进行多序列比对;运用MEGA 7.0软件,采用邻接法(neighbor-joining,即N-J法)构建紫苏PfPAH1蛋白与其他物种PAH1蛋白的系统发育树。
1.4 PfPAH1基因的表达特性分析
采用EASYspin植物RNA快速提取试剂盒(RN09,北京艾德莱生物科技有限公司)提取紫苏根、茎、叶、花及花后不同发育时期种子的RNA,并用核酸浓度仪和琼脂糖凝胶电泳检测RNA的浓度和质量;用StarScript Ⅱ cDNA 第一鏈合成试剂盒(A222-10,北京康润诚业生物科技有限公司)进行反转录合成cDNA,置于-20 ℃冰箱保存备用。
利用Primer 5.0设计qRT-PCR特异性引物 PfPAH1-qPCR-F/R(表1)。实时荧光定量PCR以 18S rRNA作为内参基因,使用TaKaRa公司的TB Green○R Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒,通过CFX 96TM Optics Module实时荧光定量PCR仪(BIO-RAD)检测 PfPAH1基因在紫苏不同组织器官中的表达模式。反应体系为10 μL,包含TB Green Premix Ex TaqTM Ⅱ 5 μL,上下游引物各0.4 μL,cDNA 0.8 μL;反应程序为95 ℃预变性10 min;95 ℃变性5 s,57 ℃退火34 s,共40个循环,反应结束后升温至95 ℃进行溶解曲线分析。每个样品重复3次。
1.5 PfPAH1-1基因的克隆
以筛选比对出的 PfPAH1-1基因CDS序列为模板,设计PCR扩增引物 PfPAH1-1-ORF-F/R(表1)。参考TOYOBO公司的KOD-Plus-Neo说明书,使用KOD酶(KOD DNA polymerase)进行PCR扩增。反应体系为50 μL:模板cDNA 2 μL,上下游引物各1.5 μL,10×Pfu Buffer 5 μL,dNTP(2 mmol/L)5 μL,MgSO4(25 mmol/L)2 μL,KOD- Plus-Neo 1 μL,dd H2O 32 μL。反应条件为:94 ℃预变性2 min;94 ℃变性15 s,50 ℃退火30 s,68 ℃延伸2 min 30 s,循环35次;68 ℃终延伸10 min。反应结束后通过琼脂糖凝胶电泳检测扩增产物,将检测正确的产物纯化回收并连接到pMD18-T载体上,转化大肠杆菌DH5α感受态。挑取单克隆进行PCR鉴定筛选阳性克隆,送至北京擎科生物技术有限公司测序。
1.6 植物表达载体构建及烟草瞬时转化
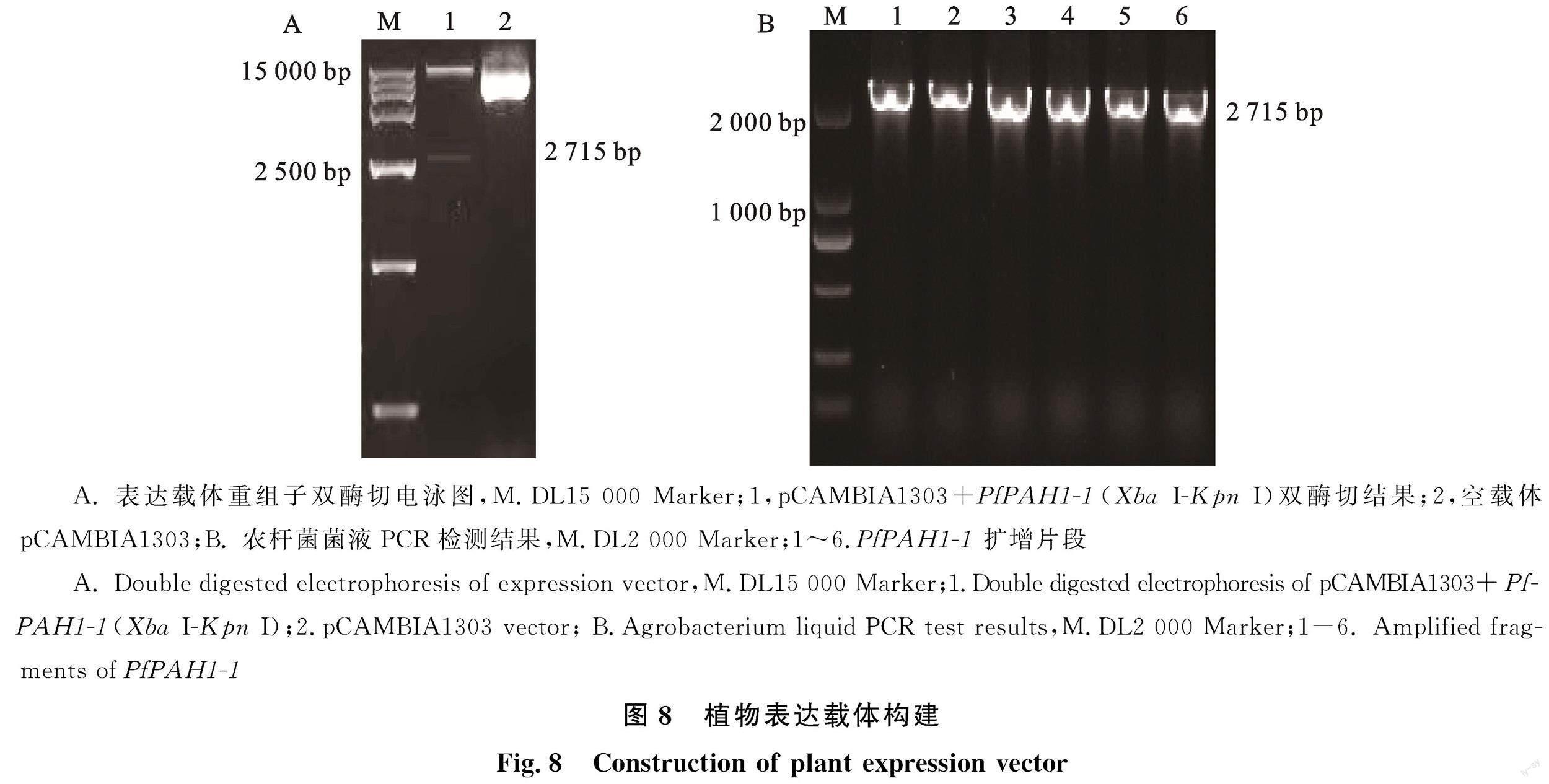
设计带有XbaⅠ和KpnⅠ酶切位点的引物 PfPAH1-1-1303-F和 PfPAH1-1-1303-R(表1),扩增 PfPAH1-1基因目的片段,同时对pCAMBIA1303载体(图1-A)进行双酶切。采用Vazyme公司的ClonExpress○R Ultra One Step Cloning Kit克隆得到过表达重组质粒pCAMBIA1303+ PfPAH1-1,将重组质粒转化到农杆菌中,侵染烟草叶片(图1-B),于2 d后取部分样品提取RNA进行RT-PCR检测,验证目的基因是否成功转入,5 d后取剩余样品真空冷冻干燥备用。
1.7 总脂肪酸含量测定及脂质组成分析
总脂提取:称取50 mg样品粉末置于50 mL离心管中,加入4 mL甲醇∶氯仿(V∶V,2∶1)混合液,37 ℃抽提4 h,4 000 r/min离心10 min后吸取上清液,并向剩余样品沉淀中继续加入甲醇∶氯仿(V∶V,2∶1)混合液3.5 mL,提取 2 h,4 000 r/min离心10 min收集上清,再次加入7.5 mL甲醇∶氯仿(V∶V,2∶1)混合液抽提 12 h,4 000 r/min离心10 min;合并3次所得上清液于干净的50 mL离心管,加入1%NaCl溶液和氯仿溶液,使得最终氯仿∶甲醇∶水(V∶V∶V)为 2∶2∶1.8,充分混匀,离心吸取下层有机相至已称量的玻璃管中。经氮吹仪吹干后称量管质量,每个样品3次重复。
总脂肪酸含量=(提取后管质量-提取前管质量)/样品质量。
脂質分级:以一定体积的氯仿∶甲醇 (V∶V=1∶1)溶解上述已称量的总脂,利用Cleanert Silica固相萃取小柱(Agela/博纳艾杰尔科技有限公司,天津)进行脂质分级。先用1 mL氯仿活化硅胶柱,上样。用10 mL氯仿洗脱得到中性脂,再用10 mL丙酮洗脱得到糖脂,最后用10 mL甲醇洗脱得到磷脂,收集每一组分于已称量的玻璃管中,氮吹仪吹干至恒量,计算不同脂类组分含量。
2 结果与分析
2.1 紫苏 PfPAH1基因的鉴定与结构分析
以拟南芥AtPAH1蛋白序列为检索序列,在紫苏基因组及转录组数据库中进行BLAST比对,通过ORF及CDD数据库进一步分析,筛选获得2个紫苏 PfPAH1基因序列,分别命名为 PfPAH1-1和 PfPAH1-2。蛋白质功能结构域预测表明,PfPAH1-1和PfPAH1-2均含有3个保守结构域,分别为Lipin_N结构域、Lipin_mid结构域和属于HAD_like(haloacid dehalogenase-like)超家族的LNS2结构域(图2-A);基因结构分析显示(图2-B), PfPAH1-1基因含有8个内含子和9个外显子, PfPAH1-2基因含有9个内含子和10个外显子,与拟南芥和芝麻PAH1基因的内含子、外显子分布相似。
2.2 紫苏 PfPAH1基因编码蛋白的序列特征
通过ProtParam软件预测分析(表2)表明:紫苏 PfPAH1-1和 PfPAH1-2基因编码氨基酸数为904,编码蛋白的分子式分别为C4 375H6 819N1 191O1 419S32,分子质量分别为 10.08 ku和9.98 ku,理论等电点pI 分别为4.73和4.96,二者亲疏水性系数均小于0,预测其为亲水性水性蛋白质。
采用TMHMM Server v2.0、Signal 4.1软件对紫苏PfPAH1蛋白的跨膜区域及信号肽切割位点进行预测,结果表明(图3)紫苏PfPAH1蛋白无跨膜区域,且无信号肽存在,推测其为非分泌性蛋白。运用SOPMA软件对PfPAH1蛋白进行二级结构预测,结果显示:紫苏PfPAH1-1和PfPAH1-2蛋白的二级结构主要由4种元件组成,PfPAH1-1包含无规则卷曲56.08%,α-螺旋23.01%,直链延伸16.37%,β-转角4.54%;PfPAH1-2包含无规则卷曲56.75%,α-螺旋 22.9%,直链延伸15.93%,β-转角4.42%,推测无规则卷曲和α-螺旋为PfPAH1蛋白的主要结构元件。
通过SWISS-MODEL数据库采用同源建模的方法预测紫苏PfPAH1蛋白三级结构,如图4所示,选择6tzy.2[13]蛋白作为模板蛋白进行同源建模,结果显示:PfPAH1-1、PfPAH1-2蛋白与模板蛋白6tzy.2的序列覆盖度分别为36.75%和35.05%,保守序列范围分别为589~876 aa和578~878 aa。PfPAH1蛋白与模板蛋白均由一条多肽链(nuclear elongation and deformation protein:A)构成,模板蛋白含有2个CA配体,而PfPAH1-1和PfPAH1-2蛋白仅含有1个CA 配体。
2.3 PAH1蛋白氨基酸多序列比对及系统进化分析
通过Jalview对紫苏、拟南芥(Arabidopsis thaliana)、芝麻(Sesamum indicum)、油橄榄 (Olea europaea)、一串红(Salvia splendens)的PAH1蛋白氨基酸序列进行比对(图5-A)。分析可知,紫苏PfPAH1蛋白存在已公布植物PAH1蛋白序列中的DXDX(T/V) 催化模体 [14],该序列在这些物种中高度保守,由此推断DXDX(T/V)结构域在PAH1蛋白中发挥重要功能。利用MEGA 7.0软件对紫苏PfPAH1蛋白和拟南芥、芝麻、烟草(Nicotiana tomentosiformis)和油橄榄等植物的PAH1 蛋白构建进化树,结果如图5-B所示,紫苏PfPAH1-1 蛋白与一串红聚为一支,同属唇形科植物,与葡萄、芥菜等其他物种关系较远,其进化基本符合植物进化分类,PfPAH1-2蛋白与芝麻SiPAH1亲缘关系最近,其次为油橄榄,与山嵛菜属、辣椒等亲缘关系较远,推测紫苏 PfPAH1-2基因的功能可能与芝麻SiPAH1基因相似。
2.4 PfPAH1基因在紫苏不同组织中的表达 特性
由图6可知, PfPAH1-1基因在紫苏根、茎、叶、花及种子中均有表达,根中表达量显著高于其他组织;该基因表达量在不同发育时期种子中存在显著差异,随着种子的成熟呈现先降低后升高的趋势,开花后20 d种子中的表达量最低,40 d表达量达到最高,是开花后20 d表达量的3.2倍; PfPAH1-2基因在紫苏根、茎、叶、花及开花后10 d的种子中几乎不表达,且随着种子的成熟表达量逐渐增加,但与 PfPAH1-1基因相比表达均较低。王计平等[15]研究表明,紫苏种子脂肪酸积累在开花后40 d达到高峰,据此推测 PfPAH1-1基因高表达可能与紫苏种子脂质合成代谢过程相关。
2.5 PfPAH1-1基因的克隆
以紫苏各组织cDNA 混样为模板,根据表达量高的 PfPAH1-1基因全长ORF序列设计克隆引物(表1),使用KOD高保真酶进行PCR 扩增,将得到的目的片段经纯化、回收后连接到pMD18-T载体上,得到重组质粒pMD18-T+PfPAH1-1,将重组质粒转入大肠杆菌DH5α感受态。挑取单克隆进行PCR扩增,琼脂糖凝胶电泳检测在2 000 bp以上得到1条特异性条带,经测序分析该序列与转录组数据结果一致,未发生突变,表明成功分离得到 PfPAH1-1基因(图7)。
2.6 植物表达载体的构建及农杆菌转化
利用XbaⅠ和KpnI对重组质粒pCAMBIA1303+ PfPAH1-1进行双酶切,以空载作为对照。双酶切后得到的目的基因条带,长度大小为2 715 bp,与 PfPAH1-1序列长度大小一致,结果表明,植物表达载体pCAMBIA1303+ PfPAH1-1構建成功(图8-A)。菌液PCR检测转化农杆菌GV3101,在2 715 bp处有目的条带(图8-B),表明目的基因 PfPAH1-1成功转入农杆菌中。
2.7 瞬时表达烟草叶片脂质含量分析
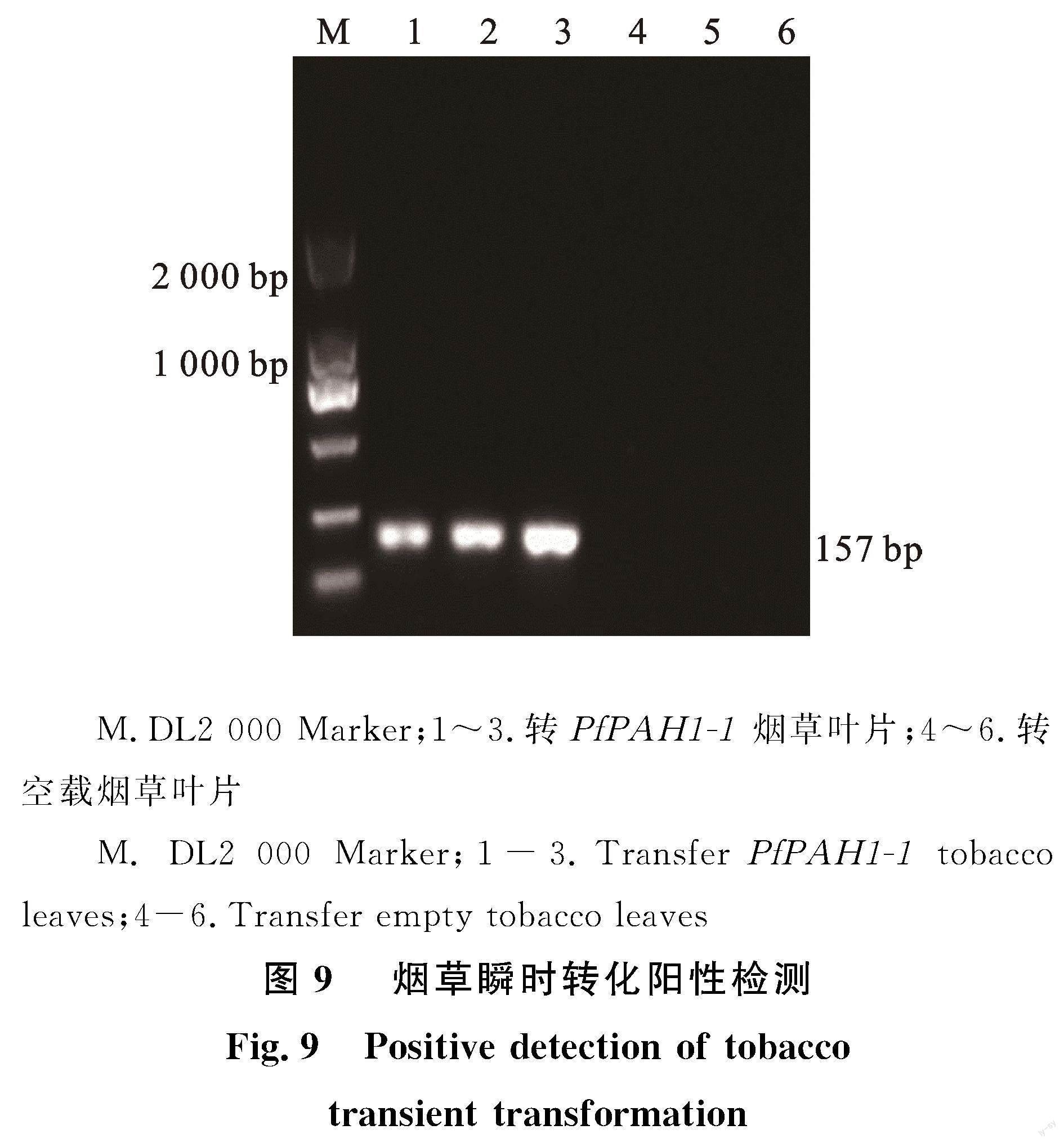
农杆菌瞬时侵染2 d后,取烟草叶片提取总RNA,通过qRT-PCR检测 PfPAH1-1基因是否有效表达,结果表明(图9),瞬时转化后的烟草叶片中目的基因
PfPAH1-1正常转录形成 mRNA。
取瞬时侵染5 d后的烟草叶片分析紫苏 PfPAH1-1基因瞬时表达对烟草叶片各脂质含量的影响。结果如图10所示,野生烟草(WT)叶片中总脂肪酸占叶片干质量的15.29%,转 pCAMBIA1303空载(EV)的烟草叶片中总脂肪酸占叶片干质量(DW)的15.30%,而转 PfPAH1-1基因烟草叶片中总脂肪酸的含量为17.35%(占叶片干质量),总脂肪酸含量显著上升。分析其脂质组成发现, PfPAH1-1基因瞬时表达烟草叶片中糖脂含量没有明显变化,约占叶片干质量的 3.55%~3.56%,磷脂含量较WT下降0.3%(占叶片干质量),而中性脂含量提高1.86%(占叶片干质量)。
3 讨 论
紫苏作为一种多用途经济作物,因其含有丰富的营养物质及种子含油量和不饱和脂肪酸含量较高,越来越引起国内外学者的广泛关注,是目前深海鱼油的良好替代产品。三酰甘油(TAG)是油料作物种子油脂的主要贮存形式,PAH是TAG合成途径中的关键酶,其介导反应的底物PA是脂核苷酸CDP-DAG合成的直接前体,产物DAG是TAG合成的直接前体,这些脂质中间体的代谢失调是导致脂质性疾病产生的根本[16-17]。有研究表明,PAH 活性依赖于卤代酸脱卤酶样结构域(HAD_like)的DXDX(T/V)催化模体[9,17-18]。酿酒酵母PAH1 DXDX(T/V) 催化模体上的天冬氨酸D398和D400两个位点同时突变时,其活性将降低99.9%以上[9]。本研究在紫苏中鉴定获得两个编码904个氨基酸残基的 PfPAH1-1和 PfPAH1-2基因,均包含HAD_like 结构域,同时具有PAH 特有的活性位点DXDX(T/V),且序列(DVDGT)与拟南芥、芝麻等已公布的植物相同,表明PfPAH1-1和PfPAH1-2能够催化其蛋白质功能。序列特征分析表明紫苏PfPAH1蛋白无转运肽或跨膜区域,与Eastmond等[14]和Santos-Rosa等[19]研究结果 一致。
Zimmermann等[20]分析拟南芥PAH1(At3G09560)基因表达谱显示, 该基因在拟南芥各组织器官和不同发育阶段种子中均有表达,并在成熟期的种子中表达量达到最高;Eastmond等[14]对拟南芥 [QX(Y15]PAH1的qRT-PCR 分析表明,该基因在幼苗、叶、根、茎、花中都有表达,在不同发育时期种子中的表达呈先降后升的趋势,且在成熟种子中的表达量显著高于其他组织;Nakamura等[21]研究结果表明PAH基因在拟南芥不同发育时期的花中均有表达。本试验分析了紫苏 PfPAH1基因的时空表达模式,表明 PfPAH1-1在紫苏各组织中均有表达,随着种子的成熟, PfPAH1-1表达量先下降后升高,在种子发育前期(开花后20 d)表达量最低,随后逐渐升高,成熟种子中(开花后40 d)表达量显著高于其他时期; PfPAH1-2基因在紫苏不同组织中表达量均较低。推测在紫苏脂质合成代谢调控过程中 PfPAH1-1起主导作用,且在发育中期(开花后 20 d、30 d)种子中可能更多参与以PA为底物合成PI及PG的反应,而后在TAG及磷脂合成过程中同时发挥作用[4]。
PAH将PA转化为DAG以提供磷脂和TAG生物合成的底物,是甘油酯组装的重要步骤[22]。在酿酒酵母的研究中, pah1Δ突变体中磷脂生物合成相关基因(INO1、INO2、OPI)表达上调,磷脂水平增加,但DAG、TAG水平明显下降,相反,PAH1的过表达会导致磷脂生物合成基因表达被抑制,磷脂生物合成受到损害,但可有效加强酿酒酵母细胞内的油脂合成[9,19,23-24];在植物中,拟南芥Δpah1 pah2双突变体中含有的磷脂是野生型的2倍,编码磷脂合成的几种关键酶基因均被上调,且总脂肪酸含量降低15%[14,25]。为进一步分析紫苏 PfPAH1-1基因的功能,本研究通过农杆菌侵染法将目的基因在烟草叶片中瞬时表达,测定瞬时表达后烟草叶片中各脂质组分的含量,结果表明,转 PfPAH1-1基因烟草叶片中的总脂肪酸含量显著升高,其脂质组成也有所变化,其中中性脂水平提高,磷脂含量降低,而糖脂含量基本不变。由此推测,紫苏 PfPAH1-1基因瞬时表达有效加强了TAG合成途径中磷脂PA向DAG的转变,中性脂水平升高;而该基因过表达可消耗磷脂合成底物PA,使得磷脂合成过程受阻,降低磷脂含量,结合前人研究结果,这一现象也可能与磷脂合成酶基因表达降低有关。在植物的长期进化过程中,改变膜脂组分是植物适应逆境胁迫的重要途径[26]。其中,甘油酯是膜脂质的主要成分,膜甘油脂由附着在sn-1和sn-2位置的两种疏水性脂肪酸及甘油主链sn-3位置上的磷(磷脂)或糖(糖脂)分子组成[27]。 PfPAH1-1基因在烟草叶片的瞬时表达可引起烟草叶片中膜脂组分的变化,因此推测其在响应植物逆境胁迫中可能具有一定调控作用。
4 结 论
以拟南芥AtPAH1蛋白序列为参考序列,鉴定得到2个紫苏 PfPAH1基因,分别命名为 PfPAH1-1和 PfPAH1-2,对其序列特征和表达特性进行分析。通过RT-PCR技术成功获得组织中高表达紫苏 PfPAH1-1基因的cDNA克隆,并初步探讨了该基因在烟草中异源表达对烟草脂质组成的影响,为深入研究 PfPAH1-1基因在植物油脂合成积累中的分子机制奠定理论基础,同时为通过基因工程手段改变紫苏及其他油料作物的脂质组分提供有益基因元件。
参考文献 Reference:
[1] HOU T,NETALA VR,ZHANG H,et al.Perilla frutescens:A rich source of pharmacological active compounds[J].Molecules,2022 ,27(11):3578.
[2] LIAO B N,HAO Y J,LU J X,et al.Transcriptomic analysis of Perilla frutescens seed to insight into the biosynthesis and metabolic of unsaturated fatty acids[J].BMC Genomics,2018,19(1):213.
[3] PARK H,SA K J,HYUN D Y,et al.Identifying SSR markers related to seed fatty acid content in Perilla crop (Perilla frutescens L.)[J].Plants-Basel,2021 ,10(7):1404.doi:10.3390/plants10071404.
[4] PRANNESHRAJ V,SANGHA M K,DJALOVIC I,et al.Lipidomics-Assisted GWAS (lGWAS) approach for improving high-temperature stress tolerance of crops[J].International Journal of Molecular Sciences,2022,23(16):9389.
[5] 李一路,張晴晴,胡卫芹,等.磷脂酸磷酸酶在脂质代谢和信号转导中的作用及其调控[J].植物生理学报,2017,53(6):897-904.
LI Y L,ZHANG Q Q,HU W Q,et al.Roles and regulation of phosphatidic acid phosphatase in lipid metabolism and signaling[J].Plant Physiology Journal,2017,53(6):897-904.
[6] COOK R,LUPETTE J,BENNING C.The role of chloroplast membrane lipid metabolism in plant environmental responses[J].Cells,2021,10(3):706.
[7] BATES,PHILIP D.Understanding the control of acyl flux through the lipid metabolic network of plant oil biosynthesis[J].Biochim Biophys Acta,2016:1214-1225.
[8] REITMAN M L.The fat and thin of lipin[J].Cell Metabolism,2005,1(1):5-6.
[9] HAN G S,SINIOSSOGLOU S,CARMAN G M.The cellular functions of the yeast lipin homolog Pah1p are dependent on its phosphatidate phosphatase activity[J].Journal of Biological Chemistry,2007,282(51):26-35.
[10] MIETKIEWSKA E,SILOTO R M,DEWALD J,et al.Lipins from plants are phosphatidate phosphatases that restore lipid synthesis in a [QX(Y15]pah1Δ mutant strain of Saccharomyces cerevisiae[J].The FEBS Journal,2011, 278(5):764-775.
[11] WANG L,KAZACHKOV M,SHEN W,et al.Deciphering the roles of Arabidopsis LPCAT and PAH in phosphatidylcholine homeostasis and pathway coordination for chloroplast lipid synthesis[J].Plant Journal,2015, 80(6): 65-76.
[12] 柏 杨,章文华.二酰甘油从头合成途径的关键酶及其功能[J].植物生理学报,2018,54(12):1763-1773.
BAI Y,ZHANG W H.Key enzymes for de novo synthesis of diacylglycerol in plant cells[J].Plant Physiology Journal,2018,54 (12):1763-1773.
[13] KWIATEK J M,HAN G S,CARMAN G M.Phosphatidate-mediated regulation of lipid synthesis at the nuclear/endoplasmic reticulum membrane[J].Biochimicaet Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids,2020,1865(1):158434.
[14] EASTMOND P J,QUETTIER A L,KROON J T M,et al.Phosphatidic acid phosphohydrolase 1 and 2 regulate phospholipid synthesis at the endoplasmic reticulum in Arabidopsis[J].The Plant Cell,2010,22(12):4216.
[15] 王計平,张玲慧,赵 静,等.紫苏种子脂肪酸代谢及关键酶基因调控油脂合成规律的研究[J].中国粮油学报,2016,31(3):91-95.
WANG J P,ZHANG L H,ZHAO J,et al.Regulation of controlling oil synthesis by fatty acid metabolism of Perilla seed and key enzyme gene[J].Journal of the Chinese Cereals and Oils Association,2016,31(3):91-95.
[16] DEY P,HAN G S,CARMAN G M.A review of phosphatidate phosphatase assays-science direct[J].Journal of Lipid Research,2020,61(12):1556-1564.
[17] KHAYYO V I,HOFFMANN R M,WANG H,et al.Crystal structure of a lipin/Pah phosphatidic acid phosphatase[J].Nature Communications,2020,11(1):1309.
[18] PETERFY M,PHAN J,XU P,et al.Lipodystrophy in the fld mouse results from mutation of a new gene encoding a nuclear protein,lipin[J].Nature Genetics,2001,27(1):121-124.
[19] SANTOS-ROSA H,LEUNG J,GRIMSEY N,et al.The yeast lipin Smp2 couples phospholipid biosynthesis to nuclear membrane growth[J].The Embo Journal,2005, 24(11):31-41.
[20] ZIMMERMANN P,HIRSCH-HOFFMANN M,HENNIG L,et al.Arabidopsis microarray database and analysis toolbox[J].Plant Physiology,2004,136(1):21-32.
[21] NAKAMURA Y,TEO N Z W,SHUI G H,et al.Transcriptomic and lipidomic profiles of glycerolipids during Arabidopsis flower development[J].The New Phytologist,2014,203(1):10-22.
[22] CARMAN G M,HENRY S A.Phosphatidic acid plays a central role in the transcriptional regulation of glycerophospholipid synthesis in Saccharomyces cerevisiae[J].The Journal of Biological Chemistry,2007,282(52):37293-37297.
[23] HAN G S,WU W I,CARMAN G M.The Saccharomyces cerevisiae lipin homolog is a Mg2+-dependent phosphatidate phosphatase enzyme[J].The Journal of Biological Chemistry,2006,281(14):9210-9218.
[24] 张昕昱,周海龙,李丽丽,等.磷脂酸磷酸酶在酿酒酵母中的过表达及表型分析[J].大连工业大学学报,2020, 39(2):5.
ZHANG X Y,ZHOU H L,LI L L,et al.Expression of phosphatidate phosphatase in Saccharomyces cerevisiae strain and the phenotype analysis[J].Joural of Dalian Polytechnic University,2020,39(2):5.
[25] CRADDOCK C P,ADAMS N,BRYANT F M,et al.Phosphatidic acid phosphohydrolase regulates phosphatidylcholine biosynthesis in Arabidopsis by phosphatidic acid-mediated activation of CTP:phosphocholine cytidylyltransferase activity[J].Plant Cell,2015,27(4):1251-1264.
[26] 齊凌云.叶片膜脂组成变化与耐低氮胁迫的关系[D].陕西杨凌:西北农林科技大学,2017.
QI L Y.The relationship between the leaf lipid composition changes and nitrogen-deficiency tolerance[D].Yangling Shannxi:Northwest A&F University,2017.
[27] YU L,ZHOU C,FAN J,et al.Mechanisms and functions of membrane lipid remodeling in plants[J].The Plant Journal,2021,107(1):37-53.
Identification and Functional Analysis of Phosphatidic Acid
Phosphohydrolase Gene ( PfPAH1) from Perilla frutescens
Abstract This enzymatic process plays an important role in plant lipid metabolism. In this study,two PfPAH1 genes ( PfPAH1-1 and PfPAH1-2) were retrieved from the perilla genome database.Bioinformatics tools were used to analyze the physicochemical properties,functional domains and phylogenetic tree of PfPAH1 proteins. Quantative PCR (qRT-PCR) was employed to examine the expression profiles of the PfPAH1 genes in perilla roots,stems,leaves,flowers and seeds at different development stages. The coding sequence of the highly-expressed PfPAH1-1 gene was cloned and and further used for transient transformation in tobacco to characterize PfPAH1-1 function. The results showed that the open reading frame (ORF) of PfPAH1-1 and PfPAH1-2 gene sequences were 2 715 bp in length,encoding 904 amino acid residues. The PfPAH1 protein contained three conservative domains( Lipin_N,Lipin_mid and LNS2) the typical characteristics of the HAD_like superfamily. Phylogenetic tree analysis indicated that PfPAH1-1 protein exhibited the closest genetic relationship with SsPAH1 from Salvia splendens of Labiatae,followed by PAH1s from Vitis vinifera and Capsella rubella,Similarly,PfPAH1-2 protein demonstrated the closest genetic relationship with SiPAH1 from Sesamum indicum of Labiatae,followed by PAH1s from Olea europaea and Capsicum annuum. This suggested that PfPAH1-2 and SiPAH1 genes,which have similar functions,are present in oil crops from the same family. qRT-PCR analysis indicated that the highest expression levels of PfPAH1-1 and PfPAH1-2 genes were detected in the developing seeds at 40 days after flowering,suggesting their crucial role in lipid biosynthesis. The evaluation of transiently transformed tobacco plants showed higher contents of total fatty acids and neutral lipids in the PfPAH1-1 transgenic leaves compared to wild tobacco leaves,while the content of phospholipids was lower in the transgenics.
Key words Perilla frutescens; Phosphatidic acid phosphohydrolase (PAH1); Gene cloning; Expression characteristics; Transient expression

