RBP47C调控苜蓿生长的分子机理研究






摘要:为阐明RBP47C调控苜蓿(Medicago sativa L.)生长的分子机理,本研究通过检测分析不同光照时间或不同温度下其mRNA相对表达量,观察RBP47C沉默苜蓿植株与对照植株的表型变化,高通量测序分析RBP47C沉默植株与对照植株顶芽转录组,筛选二者显著差异基因,对苜蓿顶芽采用RIP-seq筛选RBP47C可能结合基因,最后通过比对获得二者共有的基因。结果表明:RBP47C表达受光照时间负调控、受温度正调控;RBP47C沉默植株在春季生长加快,在夏季生长受到抑制;RBP47C沉默植株总干重增加、叶茎比降低;获得RBP47C沉默植株与对照植株顶芽中显著差异基因2629个,得到66个RBP47C结合的可能基因,二者共有基因20个。结论:RBP47C表达同时受光照时间和温度的调控,且在秋季主要受光照时间负调控;RBP47C沉默植株在适宜条件下加速生长,提高了产量,但其抗逆性变弱、叶茎比降低;得到RBP47C很可能结合的15个基因,RBP47C通过调节这些基因参与的代谢途径调控苜蓿的生长和抗逆性。
关键词:RBP47C;苜蓿;基因表达调控;生长;抗逆性
中图分类号:S541" " " " 文献标识码:A" " " " 文章编号:1007-0435(2025)02-0401-09
Molecular Mechanism of RBP47C Regulating Alfalfa Growth
DU Hong-qi1, YAN Xiang-zhou1, FENG Chang-song1*, HAN Kang-kang2, LYU Xian-zhao2,
LOU Zhi-guo1, LIU Lei1, LIANG Zhi-yan1
(1.Institute of Animal Husbandry, Henan Academy of Agricultural Sciences, Zhengzhou, Henan Province 450002, China;2.Henan Huahuaniu Industrial Group Co., Ltd., Zhengzhou, Henan Province 450002, China)
Abstract:In order to clarify the molecular mechanism of RBP47C regulating of alfalfa (Medicago sativa L.) growth, this study analyzed the relative mRNA expression of RBP47C-silenced plants under different day lengths or different temperatures, observed the phenotype changes of RBP47C-silenced" plants, the transcriptome of RBP47C-silenced plants and control plants was analyzed by high-throughput sequencing to screen their significant difference genes, RBP47C protein binding genes were screened by RIP- seq. The results indicate that the expression of RBP47C gene was negatively regulated by light time and positively regulated by temperature. The growth of RBP47C-silenced alfalfa plants were accelerated in spring and inhibited in summer; The dry weight of RBP47C-silenced alfalfa plants increased and the ratio of leaf to stem decreased. A total of 2629 genes with significant difference between the apical buds of RBP47C-silenced alfalfa plants and wild plants were obtained, and 66 possible RBP47C protein-binding genes were obtained by RIPseq. There are 20 common differential genes between the both. The conlusion is that the expression of RBP47C gene is regulated by light time and temperature, and is mainly negatively regulated by light time in autumn. We got 15 genes that are probably RBP47C protein binding genes, and RBP47C protein regulates growth and stress resistance of alfalfa by regulating the metabolic pathways involved in these genes. The growth of RBP47C-silenced alfalfa plants was accelerated and the yield was increased under suitable conditions, but their stress resistance was weaker, the ratio of leaf to stem was decreased and the quality was slightly poorer.
Key words:RBP47C;Alfalfa;Regulation of gene expression;Growth;Stress resistance
RNA结合蛋白(RNA binding protein,RBP)与具有顺式调节功能的RNA的非翻译区相互作用,形成控制RNA命运的动态核糖核蛋白复合物,调控RNA的合成、编辑、加工(包括旋盖、剪接和聚腺苷水解)、转运和定位、储存、翻译、周转以及细胞质中的整体RNA代谢[1-2]。有研究表明:紫花苜蓿MsRBP可能在紫花苜蓿逆境胁迫调控中发挥重要作用[3]。多聚腺苷酸结合蛋白(Polyadenylate-binding proteins,PABs)是高度保守RBP,它们特异性的结合mRNA 3′端聚腺嘌呤尾巴,参与基因翻译的起始、多聚腺苷酸(poly A)缩短[4],参与决定细胞核中mRNA 3′端poly(A)的长度[5-6]。RBP47(Polyadenylate-binding protein 47)属于核蛋白中的PABs 家族蛋白,在不同的器官中是组成性表达,含有三个RNA结合结构域(RNA binding dormain,RBD)型RNA结合结构域和富含谷氨酰胺的N-末端,RBP47的两个RBD型RNA结合结构域对于RBP47与RNA的相互作用是必需的,它们与poly(A)+RNA有关[7-8],RBP47C属于RBP47家族蛋白。PABs可影响植物的表型和环境抗性,过表达PABs的植物具有强的环境抗性和高的种子生产力[9-10],RBP47C 在秋眠苜蓿顶芽中特异高表达,RBP47C 高表达促进了苜蓿(Medicago sativa L.)的秋眠,RBP47C 低表达加快了苜蓿的生长[11],但它的作用机理还不清楚。
本研究拟通过检测分析不同日照长度或不同温度下RBP47C mRNA相对表达量,观察RBP47C沉默植株与对照植株的表型变化,应用转录组测序和RIP-seq筛选RBP47C结合基因来研究它在苜蓿生长和抗逆性中的作用机理,也为苜蓿分子育种提供功能基因和理论基础。
1 材料与方法
1.1 不同苜蓿品种在不同光照时间、不同温度下RBP47C mRNA相对表达量的分析
‘Maverick’(秋眠级为1级)和 ‘CUF101’(秋眠级为9级)是紫花苜蓿秋眠性的标准品种,由北京林业大学卢欣石教授惠赠。‘Maverick’和 ‘CUF101’各自均设三组,每组各三株植株,在温度为24℃、光照强度为3000 Lux,但光照时间分别为8 h,12 h和16 h的条件下培养;两品种苜蓿另设三组,每组各三株植株,在光照强度为3000 Lux、光照时间为16 h的条件下培养,但温度分别为16℃,24℃和32℃。每个处理均是刈割后开始处理,处理14 d后取各自的叶片并储存于-80℃冰箱待用。根据RBP47C和GAPDH内参基因序列,应用Primer5.0软件设计它们的引物(RBP47C-S为CACAACATTACGCGCCGCCTC,RBP47C-A为TCCATAACCCTCTGAAATACC;GAPDH-S为TGGGA-AGCACATTACAGCAG,GAPDH-A为CATCAGCATTGACACCAACC),提取样品总RNA并调至同一浓度,按照反转录试剂盒操作步骤对其反转录,采用荧光定量和2-ΔΔCt公式检测计算各样品中RBP47C mRNA相对表达量,用平均值±标准差表示,并应用SPSS软件One-way ANOVA,LSD方法分析不同处理间的差异显著性。
1.2 ‘伏纳尔’与RBP47C沉默伏纳尔顶芽的转录组分析
RBP47C沉默‘伏纳尔’植株[10]与对照‘伏纳尔’植株返青后生长45天分别采取5株苜蓿顶芽,放于液氮中,取出后储存于-80℃冰箱待用。提取总RNA,建立测序文库,应用Illumina Hiseq™对所取顶芽样品进行转录组测序分析。应用FastQC,Trimmomatic软件对原始数据质量评估、质量剪切得到相对准确的有效数据。使用HISAT2软件比对样本有效数据到紫花苜蓿参考基因组(https://figshare.com/articles/genome_fasta_sequence_and_annotation_files/12327602)上,统计Mapping信息。采用RSeQC,Qualimap,DESeq2软件对比对结果分别进行冗余序列分析、插入片段分布和均一性分布检查、基因组结构、基因表达差异分布等分析和可视化,以q Valuelt;0.05且差异倍数|FoldChange|gt;2作为标准选取差异基因。
1.3 测量田间RBP47C沉默‘伏纳尔’和‘伏纳尔’苜蓿植株株高、茎重和叶重
在2020年春季4月22日和夏季5月20日,‘伏纳尔’与RBP47C沉默‘伏纳尔’苜蓿植株[10]初花期时随机选取15株,应用钢尺测每株高、中、低枝条高度取平均值作为该苜蓿株高。刈割后将茎叶分离后收集,晾晒,烘干,使用电子秤对每株茎和叶分别称重,获得茎和叶重量,将每株茎重和叶重相加得到每株干重,将每株叶重与茎重相比得到每株的叶茎比,应用SPSS19.0(IBM Corp., USA)软件采用One-way ANOVA和LSD方法分析‘伏纳尔’与RBP47C沉默‘伏纳尔’苜蓿植株株高、两茬干重总和和平均叶茎比的差异显著性,并应用GraphPad prism 5 (GraphPad Software,Inc.,USA)软件对各数据制作柱状图。
1.4 RNA 免疫共沉淀-测序(RNA Immunoprecipi-tation Sequence, RIP-seq)和序列数据分析
1.4.1 RIP文库制备及测序 在2020年秋季10月12日上午10时左右取秋眠型苜蓿‘Maverick’顶芽并液氮冻存,委托SeqHealth(武汉,中国)对该顶芽进行RIP试验。通过组织裂解器研磨冻干的苜蓿顶芽,研磨后的粉末用细胞裂解缓冲液处理,10%裂解样品保存命名为“input”,80%的与 anti-RBP47C antibody(Abmart公司定制)进行免疫沉淀反应,命名为“IP”,10%与兔IgG (Cell Signaling Technology)作为阴性对照孵育,命名为“IgG”。使用TRIzol试剂(Invitrogen, Invitrogen, cat)提取input和IP的RNA。采用kc - digitalTM stranded mRNA library Prep Kit for Illumina®构建富集200~500 bps RNA测序文库,并进行定量最终在DNBSEQ-T7sequencer (MGI technology Co.,Ltd.)上测序。
1.4.2 RIP-Seq分析 使用Trimmomatic(0.36版本)对原始测序数据进行过滤得到clean reads,根据unique multiple index(UMI)序列对clean reads进行聚类和多次序列比对得到一个一致序列,使用STAR软件(版本2.5.3a)使用默认参数将所得到的一致序列与紫花苜蓿参考基因组(https://figshare.com/articles/genome_fasta_sequence_and_annotation_ files/12327602)进行比对。使用RSeQC(Version 2.6)、exomePeak(Version 3.8)、bedtools(Version 2.25.0)软件分别对序列进行分布分析、峰值调用和注释,使用deepTools(version2.4.1)进行峰分布分析,采用fisher检验,用python脚本对差异结合峰进行鉴定,利用Homer(Version 4.10)识别峰区富集的序列基序,以logFCgt;1且P lt;0.05作为标准选取差异基因,在差异基因中选取3′poly A端含有大于等于连续5个A的基因作为RBP47C结合的候选基因,并采用KOBAS软件(Version 2.1.1)做GO分析和KEGG富集分析。同时,用候选RBP47C结合的基因注释号在转录组选出的差异基因中查找得到二者共有的基因。
2 结果与分析
2.1 不同光照时间或不同温度下苜蓿顶芽中RBP47C mRNA相对表达量
两品种苜蓿受光周期和温度的调控规律一致;随着光照时间延长,苜蓿顶芽中RBP47C mRNA的含量逐渐减少;随着温度的升高,苜蓿顶芽中RBP47C mRNA的含量呈增加趋势(图1)。
2.2 田间RBP47C沉默‘伏纳尔’和‘伏纳尔’苜蓿植株的株高、干重与叶茎比
2.2.1 春夏季‘伏纳尔’与RBP47C沉默‘伏纳尔’苜蓿植株株高 在春季RBP47C沉默‘伏纳尔’苜蓿植株的株高极显著高于对照‘伏纳尔’的株高(Plt;0.01)(图2),但是在夏季RBP47C沉默‘伏纳尔’苜蓿植株的株高显著低于对照‘伏纳尔’的株高(Plt;0.05)(图2)。
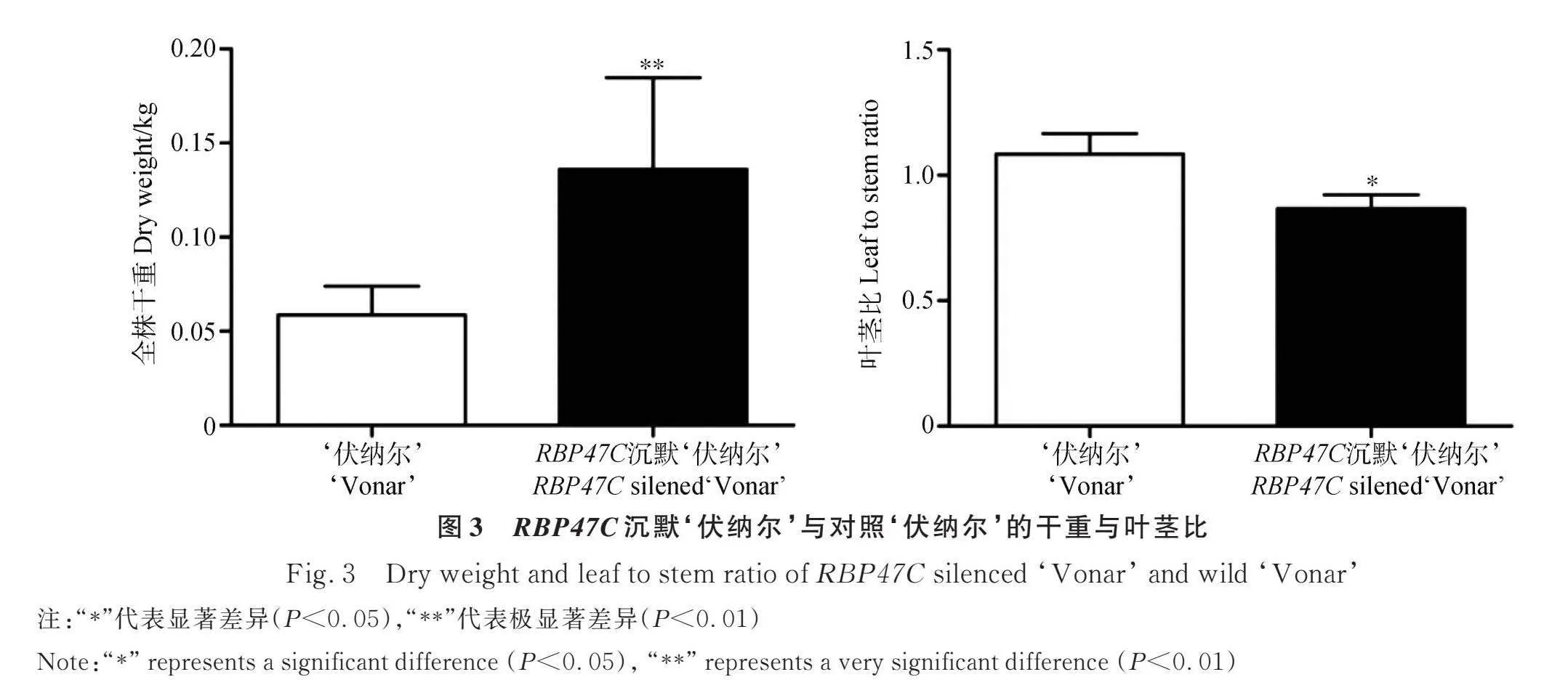
2.2.2 ‘伏纳尔’与RBP47C沉默‘伏纳尔’苜蓿植株干重与叶茎比 RBP47C沉默‘伏纳尔’苜蓿植株的干重极显著高于对照‘伏纳尔’的干重(Plt;0.01)(图3),但是RBP47C沉默‘伏纳尔’苜蓿植株的叶茎比显著低于‘伏纳尔’的叶茎比(Plt;0.05)(图3)。
2.3 RBP47C沉默植株与对照植株转录组测序分析结果
通过转录组测序和生物信息学分析,本研究共获得q Valuelt;0.05且差异倍数|FoldChange|gt;2显著差异基因2629个,1727个下调基因,902个上调基因,差异基因显著富集的GO条目158个,差异基因显著富集的KO条目44个,上调的28个、下调的16个,差异基因显著富集的KOG 6个。
2.4 RIP-seq分析结果
RIP-seq分析筛选出实验组和对照组之间显著差异的基因66个(表1),通过KEGG通路富集分析发现这些基因主要富集在烟酸代谢(VB3代谢)、氨基酸合成、氨基酸代谢、脂肪酸代谢、生物素代谢、核糖体合成、RNA转运和降解、mRNA监视通路、色氨酸代谢、激素信号转导、丁酸甲酯新陈代谢、乙醛酸盐和二羧酸盐代谢、丙酮酸代谢,胰高血糖素信号通路,糖酵解/糖异生等途径(表1)。
与转录组联合分析显示,二者共有的差异基因共20个,主要富集在磷酸化传感器激酶活性、水解酶活性、转运体活性、烟碱-核苷酸二磷酸化酶(羧化)活性、烟碱-磷酸核糖基转移酶活性、草酸-辅酶A连接酶活性、α- l -阿拉伯糖核苷酶活性、ATP结合、RNA- DNA杂交核糖核酸酶活性、核酸结合、核糖体大亚基结合、RNA结合等分子功能。这些基因位于外质体、叶绿体间质、胞浆连丝、膜的组成部分以及线粒体中。它们参与草酸分解代谢过程、对细胞分裂素的反应、种皮发育、对真菌的防御反应、对镉离子的反应、种子萌发的正调控、mRNA加工、l-阿拉伯糖代谢过程、核糖体从细胞核输出大亚基、烟酸核苷酸回收以及NAD生物合成过程等生物过程。其中有5个共有基因参与PPAR信号通路、烟酸和烟酰胺代谢、乙醛酸和二羧酸代谢、植物激素信号转导、真核生物核糖体生物发生,RNA转运等代谢途径(表1)。
3 讨论
3.1 RBP47C 基因表达的调控
由于RBP47C表达受光照时间和温度调控规律相反,且RBP47C表达受光照时间负调控、温度正调控(图1),因此,在秋季光照时间缩短会增加RBP47C表达、温度降低会减少其表达。而事实是从春季到秋季,‘Maverick’苜蓿顶芽RBP47C mRNA在秋季显著特异高表达[11],因此推测在秋季,秋眠性苜蓿顶芽中RBP47C表达主要受光照时间调控,说明不同季节不同秋眠型苜蓿RBP47C表达的主要调控因子不同。
3.2 RBP47C蛋白参与调节苜蓿的生长和抗性
PABs可影响植物的表型和环境抗性,过表达PABs的植物具有较强抗逆性[9-10]。本研究的结果表明,在春季RBP47C沉默苜蓿植株的株高极显著高于对照,而在炎热、病虫害高发的夏季,RBP47C沉默植株生长受到抑制(图2),说明在适宜的环境条件下RBP47C沉默植株生长速度快,在不利的环境下RBP47C沉默植株的抗逆性差,不利于苜蓿的生长,而且RBP47C沉默植株总体上的干重增加,但其叶茎比低于对照植株(图3),因此,RBP47C沉默后有益于提高苜蓿产量,但同时其质量有所下降。Li等研究表明酵母Pab1p在烟草中过表达可显著抑制植株的生长[10],RBP47C过表达可抑制苜蓿植株的生长[11]。这些结果说明PABs在影响植物生长方面有一定的共性。
3.3 RBP47C蛋白结合的基因
虽然RIP得到的66个基因都有可能是RBP47C结合的基因,但是与“沉默植株与对照植株显著差异基因”共有的20个基因更可能是RBP47C真正结合的基因。由于RBP结合基因的另一个重要的作用是保护结合的基因,因此,在20个共有基因中沉默RBP47C植株相对表达量相对于对照植株低的15个基因才最可能是RBP47C真正结合的基因。
通过本研究GO,KEGG分析结果和Uniprot数据库中该15个基因的功能注释以及查阅文献得到:烟酸磷酸核糖转移酶2(MS.gene047612)是烟酸和烟酰胺代谢(ko00760)途径的关键酶,该酶的增加有利于NAD+的产生,促进三羧酸循环和呼吸作用;草酸-辅酶A连接酶(MS.gene60078)参与乙醛酸盐和二羧酸盐代谢(ko00630)途径,最终合成甲酸盐。研究表明,甲酸盐保护光合机制免受光抑制,从而减少光抑制条件下对光系统的氧化损伤[12],对水稻植株生长有促进作用[13];细胞分裂素受体组氨酸激酶(MS.gene66267)具有磷酸接力传感器激酶活性,参与植物激素信号转导途径(ko04075),在众多参加细胞分裂素信号传导的转录因子中起主要作用。比如在介导的细胞分裂素信号传导是SSPP诱导延缓叶片衰老所必需的[14];羧酸酯酶1(MS.gene20413)在植物激素活性调控中发挥重要作用,使植物能够应对外界环境变化。它参与病原菌侵染后的过敏反应,直接水解植物病原菌细胞壁中的酯类物质抑制病原菌的生长发育,并在合成和水解抗病信号分子的过程中起到重要作用[15]。无义介导的mRNA衰变蛋白(MS.gene21925)参与核糖体生物合成(ko03008)和 RNA转运(ko03013),作为真核细胞中重要RNA监控机制,识别并降解开放阅读框中含有提前终止密码子的mRNA,以避免因截短的蛋白产物积累对细胞造成毒害,还调控正常生理基因的表达[16];解毒蛋白35(MS.gene006248)参与类黄酮代谢的多种药及毒素外排转运体,也是正常生殖发育所必需的,影响植物的类黄酮水平、根系生长、种子发育和萌发以及花粉发育和释放的改变[17],与对照型相比,增强生长和提早开花[18]。从所举蛋白的功能上看,它们都具有促进苜蓿生长发育的功能,然而从转录组结果看它们在沉默植株中的mRNA相对含量较对照植株显著减少,而沉默后的植株生长加快,因此推测这些基因在蛋白水平上含量增加了。这两个结果看似是矛盾的,但前人研究已经证明,PABs扮演着一个双面“间谍”的角色。一方面,它在物理上保护转录本的3′端免受非特异性的降解[19];另一方面,它又是poly(A)尾巴脱腺苷所必需的[20],由于Poly A尾巴及其相关蛋白(比如PABs)在胞质中介导mRNA降解的同时保护细胞核中的mRNA不受酶的破坏。因此,沉默RBP47C后,RBP47C mRNA和蛋白含量下降导致在细胞核中的RBP47C 结合的基因mRNA没有了RBP47C的保护而被降解,最终导致这些基因总mRNA 减少,然而在细胞质中的mRNA由于减少或没有RBP47C介导导致其降解缓慢或不被降解,最终导致其蛋白含量增加,最终促进沉默植株的生长。
4 结论
RBP47C受光照时间负调控,受温度正调控,在秋季主要受光照时间的调控。本研究得到RBP47C很可能的15个结合基因,并通过调节这些基因参与的代谢途径调控了苜蓿的生长和抗逆性。RBP47C沉默苜蓿植株在适宜条件下生长加速,产量提高,但其抗逆性变弱和叶茎比降低。
初步推测RBP47C调控苜蓿生长的分子机理:自然环境(光照时间、温度)的变化调控RBP47C表达,RBP47C通过调节其结合基因(烟酸磷酸核糖转移酶2、草酸-辅酶A连接酶、细胞分裂素受体组氨酸激酶、羧酸酯酶1、RNA识别基序、无义介导的mRNA衰变蛋白、解毒蛋白35、α-阿拉伯糖醛酸苷酶、多泛素11亚型X1等)mRNA在细胞核中的降解和细胞质核糖体中的翻译,从而影响它们参与的代谢途径合成的代谢产物含量来调控苜蓿的生长和抗逆性。
参考文献
[1] GLISOVIC T,BACHORIK J L,YONG J,et al. RNA-binding proteins and post-transcriptional gene regulation[J]. FEBS Letters,2008,582(14):1977-1986
[2] MARONDEDZE C. The increasing diversity and complexity of the RNA-binding protein repertoire in plants[J]. Proceedings Biological Sciences,2020,287(1935):20201397
[3] 王慧敏,龙瑞才,沈益新,等. 紫花苜蓿MsRBP基因的克隆、分析及烟草的遗传转化[J]. 草地学报,2013,21(2):379-387
[4] SACHS A B,DAVIS R W. The poly(A) binding protein is required for poly(A) shortening and 60S ribosomal subunit-dependent translation initiation[J]. Cell,1989,58(5):857-867
[5] AMRANI N,MINET M,LE GOUAR M,et al. Yeast Pab1 interacts with Rna15 and participates in the control of the poly(A) tail length in vitro [J]. Molecular and Cellular Biology,1997,17(7):3694-3701
[6] MINVIELLE-SEBASTIA L,BEYER K,KRECIC A M,et al. Control of cleavage site selection during mRNA 3′ end formation by a yeast hnRNP[J]. The EMBO Journal,1998,17(24):7454-7468
[7] LORKOVIĆ Z J,WIECZOREK KIRK D A,KLAHRE U,et al. RBP45 and RBP47, two oligouridylate-specific hnRNP-like proteins interacting with poly(A)+ RNA in nuclei of plant cells [J]. RNA,2000,6(11):1610-1624
[8] LAMBERMON M H,SIMPSON G G,WIECZOREK KIRK D A,et al. UBP1, a novel hnRNP-like protein that functions at multiple steps of higher plant nuclear pre-mRNA maturation [J]. EMBO Journal,2000,19(7):1638-1649
[9] IMAI R,KIM M H,NAGIRA Y,et al. Environmental stress-resistant plant with high seed productivity and method for producing the same: US20150211016[P]. 2015-07-30
[10] LI Q,VON LANKEN C,YANG J,et al. The yeast polyadenylate-binding protein (PAB1) gene acts as a disease lesion mimic gene when expressed in plants[J]. Plant Molecular Biology,2000,42(2):335-344
[11] 杜红旗,娄治国,邹靖,等. 不同秋眠型苜蓿顶芽中特异表达蛋白筛选及其功能鉴定[J]. 草地学报,2022,30(1):55-61
[12] SHIRAISHI T,FUKUSAKI E I,MIYAKE C,et al. Formate protects photosynthetic machinery from photoinhibition[J]. Journal of Bioscience and Bioengineering,2000,89(6):564-568
[13] FUKUZAKI E,SHIRAISHI T,KAJIYAMA S I,et al. Effect of C1 compounds on the plant metabolism:Growth stimulation by formate in rice plant[J]. Proceedings of the Phytochemical Society Symposium,1998:29-30
[14] UEGUCHI C,KOIZUMI H,SUZUKI T,et al. Novel family of sensor histidine kinase genes in Arabidopsis thaliana[J]. Plant amp; Cell Physiology,2001,42(2):231-235
[15] 刘建光,赵贵元,赵俊丽,等. 植物羧酸酯酶的结构、表达调控及生物功能研究进展[J]. 作物杂志,2018(3):32-36
[16] 贾晓波,胡剑. 无义介导的mRNA降解[J]. 中国生物化学与分子生物学报,2012,28(2):115-120
[17] THOMPSON E P,WILKINS C,DEMIDCHIK V,et al. An Arabidopsis flavonoid transporter is required for anther dehiscence and pollen development[J]. Journal of Experimental Botany,2010,61(2):439-451
[18] THOMPSON E P,DAVIES J M,GLOVER B J. Identifying the transporters of different flavonoids in plants[J]. Plant Signaling amp; Behavior,2010,5(7):860-863
[19] FORD L P,BAGGA P S,WILUSZ J. The poly (A) tail inhibits the assembly of a 3'-to-5'exonuclease in an in vitro RNA stability system[J]. Molecular and Cellular Biology,1997,17(1):398-406
[20] CAPONIGRO G,PARKER R. Multiple functions for the poly (A)-binding protein in mRNA decapping and deadenylation in yeast[J]. Genes amp; Development,1995,9(19):2421-2432
(责任编辑" 闵芝智)

