基于16S rRNA测序和网络药理学方法探讨参附注射液治疗心力衰竭的作用机制
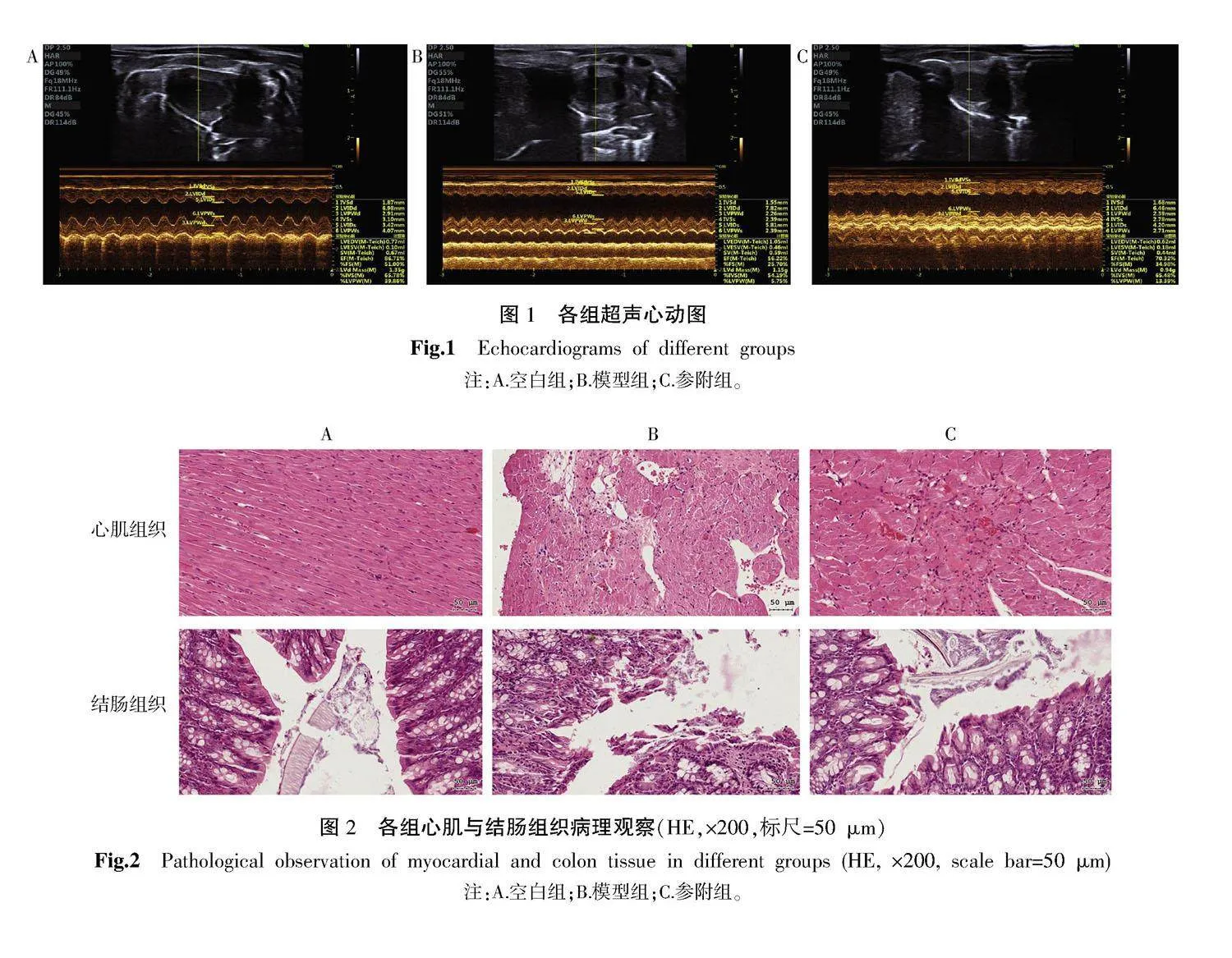




〔摘要〕 目的 探讨参附注射液治疗心力衰竭(以下简称“心衰”)的作用机制。方法 30只雄性SD大鼠随机分为空白组(n=7)和造模组(n=23)。造模组大鼠采用异丙肾上腺素皮下注射法(5 mg·kg-1·d-1,连续1周)制备心衰大鼠模型,空白组大鼠经皮下注射等量生理盐水。造模完成后,将成模大鼠随机分为模型组(n=8)和参附组(n=8)。参附组大鼠腹腔注射参附注射液(6 mL·kg-1·d-1,连续1周),空白组和模型组大鼠腹腔注射等量生理盐水。药物干预结束后,于麻醉状态下行心脏超声心动图检测;经腹主动脉取血,收集血液样本检测炎症指标;于结肠段收集粪便样本和结肠组织进行16S rRNA测序和HE染色;摘取大鼠心脏行HE染色。运用网络药理学方法,筛选参附注射液活性成分、靶点及心衰和差异菌群相关靶点,并对相同靶点进行GO功能和KEGG通路富集分析。结果 与空白组比较,模型组大鼠射血分数(EF)、缩短分数(FS)下降(Plt;0.001),N末端B型利钠肽原(NT-proBNP)升高(Plt;0.001),脂多糖(LPS)、白细胞介素(IL)-6、IL-1β升高(Plt;0.001)。与模型组比较,参附组大鼠EF、FS升高(Plt;0.001),NT-proBNP下降(Plt;0.001),LPS、IL-6、IL-1β下降(Plt;0.01,Plt;0.001)。参附组与空白组的肠道菌群相似度高于模型组与空白组。群落组成和线性判别分析效应量(LEfSe)结果表明,与空白组比较,模型组大鼠多级物种丰度发生改变,上述改变在参附组中呈现回调趋势。网络药理学结果发现,“参附注射液-肠道菌群-心衰”的共同靶点为IL-10、IL-1β、IL-6、肿瘤坏死因子,并且GO功能、KEGG富集分析结果也与炎症反应密切相关。结论 参附注射液可能通过调节肠道菌群,抑制机体炎症反应,进而改善心功能。
〔关键词〕 参附注射液;心力衰竭;16S rRNA;肠道菌群;网络药理学;异丙肾上腺素
〔中图分类号〕R285.5"""""""" 〔文献标志码〕A""""""""" 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.02.007
〔收稿日期〕2024-07-31
〔基金项目〕国家自然科学基金项目(82274412,82305092);湖南省自然科学基金项目(2023JJ30453);湖南省青年科技创新人才项目(2024RC3199);湖南省中医药科研项目(B2023045)。
〔通信作者〕*胡志希,男,博士,二级教授,博士研究生导师,E-mail:003405@hnucm.edu.cn;李" 琳,女,博士,副教授,E-mail:471920830@qq.com。
Mechanism of action of Shenfu Injection in treating heart failure based on 16S rRNA sequencing and network pharmacology approaches
ZHAO Zhenyu1, LI Lin2*, HU Zhixi2*
1. Hunan Provincial Key Laboratory of Chinese Medicine Diagnostics, Hunan University of Chinese Medicine,
Changsha, Hunan 410208, China; 2. Institute of Chinese Medicne Diagnosis, Hunan University of Chinese
Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the mechanism of action of Shenfu Injection in treating heart failure (HF). Methods Thirty male SD rats were randomly divided into blank group (n=7) and modeling group (n=23). Rats in the modeling group were administered subcutaneous injections of isoproterenol (5 mg·kg-1·d-1 for one week) to induce HF, while rats in the blank group received an equal volume of normal saline subcutaneously. After model induction, successfully modeled rats were randomly divided into model group (n=8) and" Shenfu group (n=8). Rats in the Shenfu group were treated with Shenfu Injection (6 mL·kg-1·d-1 for one week) via intraperitoneal injection, while rats in the normal and model groups received intraperitoneal injections of an equal volume of normal saline. After drug intervention, echocardiography was performed under anesthesia, blood samples were collected from the abdominal aorta for the detection of inflammatory markers, fecal samples and colon tissues were collected for 16S rRNA sequencing and HE staining, and rats' hearts were excised for HE staining. Network pharmacology methods were used to screen the active components and targets of Shenfu Injection, as well as targets related to HF and differential microbiota, followed by GO function and KEGG pathway enrichment analysis for common targets. Results Compared with the blank group, the rats in the model group showed decreased ejection fraction (EF) and fractional shortening (FS) (Plt;0.001), and increased N-terminal pro-B-type natriuretic peptide (NT-proBNP) (Plt;0.001), lipopolysaccharide (LPS), interleukin-6 (IL-6), and interleukin-1β (IL-1β) levels (Plt;0.001). Compared with the model group, rats in the Shenfu group exhibited increased EF and FS (Plt;0.001) and decreased NT-proBNP (Plt;0.001), LPS, IL-6, and IL-1β levels (Plt;0.01, Plt;0.001). The intestinal microbiota composition in the Shenfu group was more similar to that of the normal group than to the model group. Community composition and linear discriminant analysis effect size (LEfSe) results indicated that compared with the blank group, the model group rats had altered multi-level species abundance, and these changes showed a trend of recovery in the Shenfu group. Network pharmacology results revealed that the common targets of \"Shenfu Injection-intestinal microbiota-HF\" were interleukin-10 (IL-10), IL-1β, IL-6, and tumor necrosis factor, and the GO function and KEGG enrichment analyses results were also closely related to the inflammatory response. Conclusion Shenfu Injection may improve cardiac function by regulating the intestinal microbiota and inhibiting the body's inflammatory response.
〔Keywords〕 Shenfu Injection; heart failure; 16S rRNA; intestinal microbiota; network pharmacology; isoprenaline
本文引用: 赵震宇, 李" 琳, 胡志希. 基于16S rRNA测序和网络药理学方法探讨参附注射液治疗心力衰竭的作用机制[J]. 湖南中医药大学学报, 2025, 45(2): 239-249.
心力衰竭(以下简称“心衰”)是由心脏结构或功能异常引起的,以肺循环和(或)体循环淤血为主的一组临床综合征[1]。在过去的半个世纪里,心血管疾病的预防、诊断和治疗取得了重大进展,发达国家心血管疾病死亡率显著降低,但心衰除外[2]。包括利尿剂、β受体拮抗剂、肾素-血管紧张素-醛固酮系统抑制剂等在内的许多药物被广泛用于心衰的临床治疗。然而,目前的治疗方法主要针对一小部分假定的病理生理途径。心衰总体预后不佳,是患者住院和死亡的最常见原因之一[3-4]。中医药因其毒副作用小且作用靶点、途径广泛的特点日益受到重视。许多中药注射制剂被广泛应用于心血管疾病的治疗[5],其中参附注射液有明确治疗心衰的效果[6]。杨柳等[7]研究发现,参附注射液能通过减轻Toll样受体信号通路介导的炎症反应和心肌纤维化,对心衰大鼠心肌起到保护作用。课题组前期实验研究结果证实[8],参附注射液可通过降低血管加压素及其2型受体的表达,改善心衰大鼠水钠潴留现象。人体各处生活着数万亿微生物群,其在肠道中的密度最高,称为肠道菌群[9]。肠道菌群是一个复杂的共生微生物系统,定植着约100万亿微生物,包括细菌、真菌、古菌、病毒等,其中细菌占99%以上,在人类健康和疾病中发挥着重要作用,如调节自身代谢与免疫功能、排出体内毒素、提供营养等[9-10]。肠道菌群失调在心衰的发展过程中扮演着重要角色,调节肠道菌群可能是治疗心衰的一个新的靶点[11]。ZHAO等[12]研究证实,四逆汤可通过改善心衰大鼠肠道黏膜屏障功能和菌群结构,降低致病菌丰度,增加产短链脂肪酸(short chain fatty acids, SCFAs)细菌的丰度,从而改善心功能。GAO等[13]研究发现,芪参颗粒可显著增加心衰大鼠肠道菌群中拟杆菌门的丰度,并增加SCFAs的产生,同时降低血清脂多糖(lipopolysaccharide, LPS)水平,改善肠道结构,恢复肠道屏障功能,提高心功能。故本文运用16S rRNA高通量测序联合网络药理学研究参附注射液治疗心衰的潜在机制。
1 材料与方法
1.1" 动物
30只雄性SD大鼠[动物合格证号:4307272111
01030871,动物生产许可证号:SCXK(湘)2019-0004],体质量(220±10) g,购自湖南斯莱克景达实验动物有限公司。本实验过程符合相关伦理要求,已通过湖南中医药大学动物实验伦理委员会审核(审批号:LLBH-202105180001)。实验前,所有大鼠于湖南中医药大学SPF级实验动物中心饲养,温度20~23 ℃,湿度55%~67%,12 h周期性明暗交替,适应性喂养7 d。
1.2" 药物
参附注射液(华润三九雅安药业有限公司,批号:201106AK05,国药准字:Z51020664,规格:10 mL/支);盐酸异丙肾上腺素(美国MedChemExpress公司,批号:HY-B0468/CS-2582,规格:5 g);乌拉坦[阿拉丁试剂(上海)有限公司,批号:U299635-100,规格:500 g]。
1.3" 主要试剂与仪器
DNA抽提试剂盒(美国Omega Bio-Tek公司,批号:M9636-02);琼脂糖(美国Thermo Scientific公司,批号:75510019);高保真DNA聚合酶(中国TransGen公司,批号:AS221-02);AxyPrep DNA凝胶回收试剂盒(中国逾华公司,批号:C01-10000);建库试剂盒(美国Bioo Scientific公司,批号:NOVA-5144);测序试剂盒(美国Illumina公司,批号:MS-102-3003)。
电泳仪(中国北京六一仪器厂,型号:DYY-6C);机械破碎研磨仪(美国MP公司,型号:FastPrep-24 5G);测序仪(美国Illumina公司,型号:Illumina Miseq);粉碎研磨仪(中国上海万柏生物科技有限公司,型号:TL-48R);便携式小动物超声仪(北京益仁恒业科技有限公司,型号:6 LAB);-80 ℃低温冰箱(美国Thermo公司,型号:TDE30086FV-ULTS)。
1.4" 动物分组与造模
采用Excel表格的Random函数随机生成7个数字,对应7只空白组大鼠,空白组大鼠皮下注射等量生理盐水。其余23只大鼠皮下注射异丙肾上腺素5 mg·kg-1·d-1(给药浓度2.5 mL·kg-1),连续1周,制备心肌缺血诱导的心衰大鼠模型[14]。适应性喂养2周后,经眼眶取血检测N末端B型利钠肽原(N-terminal pro-brain natriuretic peptide, NT-proBNP)及超声心动图。与空白组大鼠比较,射血分数(ejection fraction, EF)降低20%以上,判定为造模成功[15]。本研究成功构建16只模型大鼠(成模率69.57%)。
1.5" 给药和取材
16只大鼠按照Excel表格的Random函数随机分为模型组和参附组。参附组大鼠腹腔注射参附注射液(6 mL·kg-1·d-1),模型组大鼠腹腔注射生理盐水(6 mL·kg-1·d-1),连续1周。所有大鼠实验期间常规饲养。末次给药后禁食24 h,于乌拉坦麻醉下行超声心动图检测。随后经腹主动脉取血,静置30 min,于4 ℃、3 000 r·min-1离心15 min(离心半径10 cm),收集上层血清冻存于-80 ℃冰箱中。在4%多聚甲醛溶液中保存取出的完整心脏。切除大鼠结肠段,按照SHAO等[16]的方法收集粪便,液氮速冻后保存于-80 ℃冰箱中。将结肠段用生理盐水冲洗后保存于4%多聚甲醛溶液中。
1.6" 检测指标及方法
1.6.1" 超声心动图检测" 利用大鼠超声检测系统,在大鼠探头上均匀涂抹耦合剂,通过二维超声的引导,使用M型超声线阵探头对大鼠左心室长轴进行切面观察,并运用8点法对EF和缩短分数(fractional shortening, FS)进行测算,评价心脏功能。
1.6.2" HE染色" 对固定后的心肌与结肠组织进行清洗以去除多余的固定剂,并脱水处理。组织经过透明化处理,浸入石蜡中,制成石蜡包埋块。使用切片机将石蜡包埋块切成薄片,贴附在载玻片上。对载玻片上的组织进行去蜡和水分恢复。使用苏木精染液对细胞核进行染色,使用伊红染液对细胞质进行染色。染色完成后,对组织进行脱水、透明化处理,并使用封片剂封固,在显微镜下进行观察。
1.6.3" 血清ELISA检测" 严格按照ELISA试剂盒说明书步骤检测各组大鼠血清NT-proBNP、LPS、白细胞介素(interleukin, IL)-6、IL-1β水平。
1.6.4" 肠道菌群的DNA抽提和测序" 根据FastDNA[R][○] Spin Kit for Soil说明书对大鼠粪便进行微生物群落总DNA抽提与检测。使用338F_806R引物对16S rRNA基因V3~V4可变区进行PCR扩增[17]。根据中国上海美吉生物医药科技有限公司的标准协议,将纯化的扩增子汇集在等摩尔浓度中,在Illumina MiSeq PE300平台上进行配对末端测序。使用fastp 0.20.0(https://github.com/OpenGene/fastp)软件对原始测序序列进行质控,使用FLASH 1.2.7(http://www.cbcb.umd.edu/software/flash)软件进行拼接[17]。
1.7" 网络药理学分析
1.7.1" 中药活性成分、靶点及心衰靶点、肠道菌群靶点的获取" 通过BATMAN-TCM数据库(http://bionet.ncpsb.org.cn/batman-tcm/)筛选参附注射液所含中药红参、附子的活性成分和靶点,标准设置为Scoregt;20,Plt;0.05,并通过UniProt数据库标准化靶点名称,去除重复靶点后得到中药靶点;以“Heart Failure”为关键词检索OMIM数据库(https://www.omim.org/)、GeneCards数据库(http://www.genecards.org)、NCBI数据库(https://www.ncbi.nlm.nih.gov/nuccore)和DisGeNet数据库(https://www.disgenet.org/),GeneCards筛选标准为Relevance scoregt;20,合并后去重,得到心衰靶点;通过gutMGene数据库(http://bio-computing.hrbmu.edu.cn/gutmgene/#/Home)检索模型组与参附组间显著差异细菌所调控的基因,得到菌群作用靶点。
1.7.2" “中药-肠道菌群-心衰”共同靶点的可视化分析" 将中药、肠道菌群和心衰靶点通过PERL 5.38.0软件进行筛选,并利用Venny平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html)进行可视化分析。
1.7.3" 核心有效成分和靶点的筛选" 将获得的共同靶点导入STRING在线数据库(https://stringdb.org/),选择物种“Homo sapiens”,设置置信度≥0.4。
1.7.4" GO功能富集分析和KEGG通路富集分析" 运用Bioconductor数据库及R 4.2.2(64 bit)软件对潜在靶点进行GO功能和KEGG富集分析。
1.8" 统计学分析
使用SPSS 22.0软件分析数据,计量资料均以“x±s”表示,多组比较采用单因素方差分析。两组比较若数据服从正态分布,采用参数t检验;若数据不服从正态分布,采用非参数t检验。以Plt;0.05表示差异具有统计学意义。
2 结果
2.1" 各组心功能指标比较
与空白组比较,模型组EF、FS显著降低(Plt;0.001),NT-proBNP含量显著升高(Plt;0.001)。与模型组比较,参附组EF、FS显著升高(Plt;0.001),NT-proBNP含量显著降低(Plt;0.001)。详见表1、图1。
2.2" 各组心肌与结肠组织形态学观察
空白组大鼠心肌组织结构完整,形态正常,未见炎性细胞浸润、水肿、坏死等病理性改变;模型组大鼠心肌组织可见明显炎性细胞浸润,成纤维细胞增多,部分心肌纤维溶解;参附组大鼠心肌组织炎性细胞减少,可见纤维化现象,未见心肌纤维溶解。空白组大鼠结肠组织绒毛上皮连续、光滑、无脱落,未见充血和炎性细胞;模型组大鼠结肠组织可见绒毛上皮脱落坏死,炎性细胞浸润;参附组大鼠结肠组织绒毛上皮连续但欠光滑,炎性细胞减少。详见图2。
2.3" 各组炎症因子含量比较
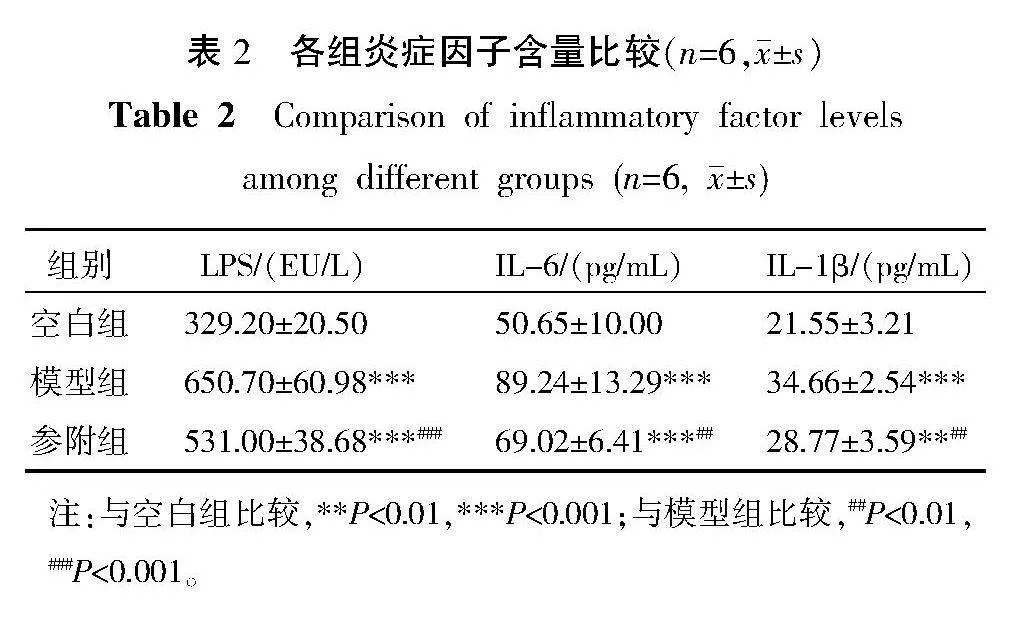
与空白组比较,模型组LPS、IL-6、IL-1β含量显著升高(Plt;0.001)。与模型组比较,参附组LPS、IL-6、IL-1β含量显著降低(Plt;0.01,Plt;0.001)。详见表2。
2.4" 各组肠道菌群比较
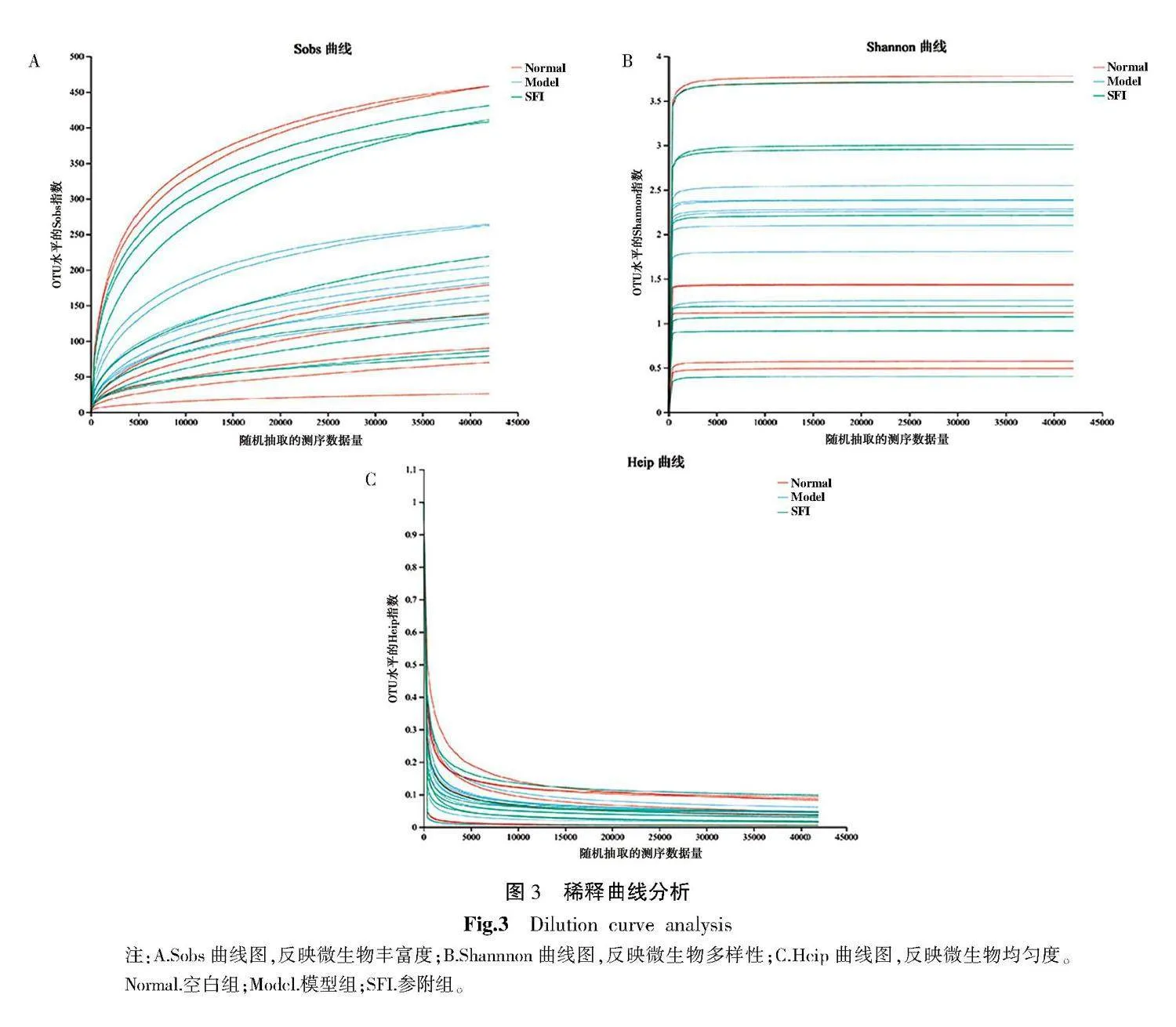
2.4.1" 稀释曲线分析" 如图3所示,各组曲线趋于平缓,测序数据达到饱和,所获数据能够较全面地反映大鼠肠道菌群信息,可用于后续分析。
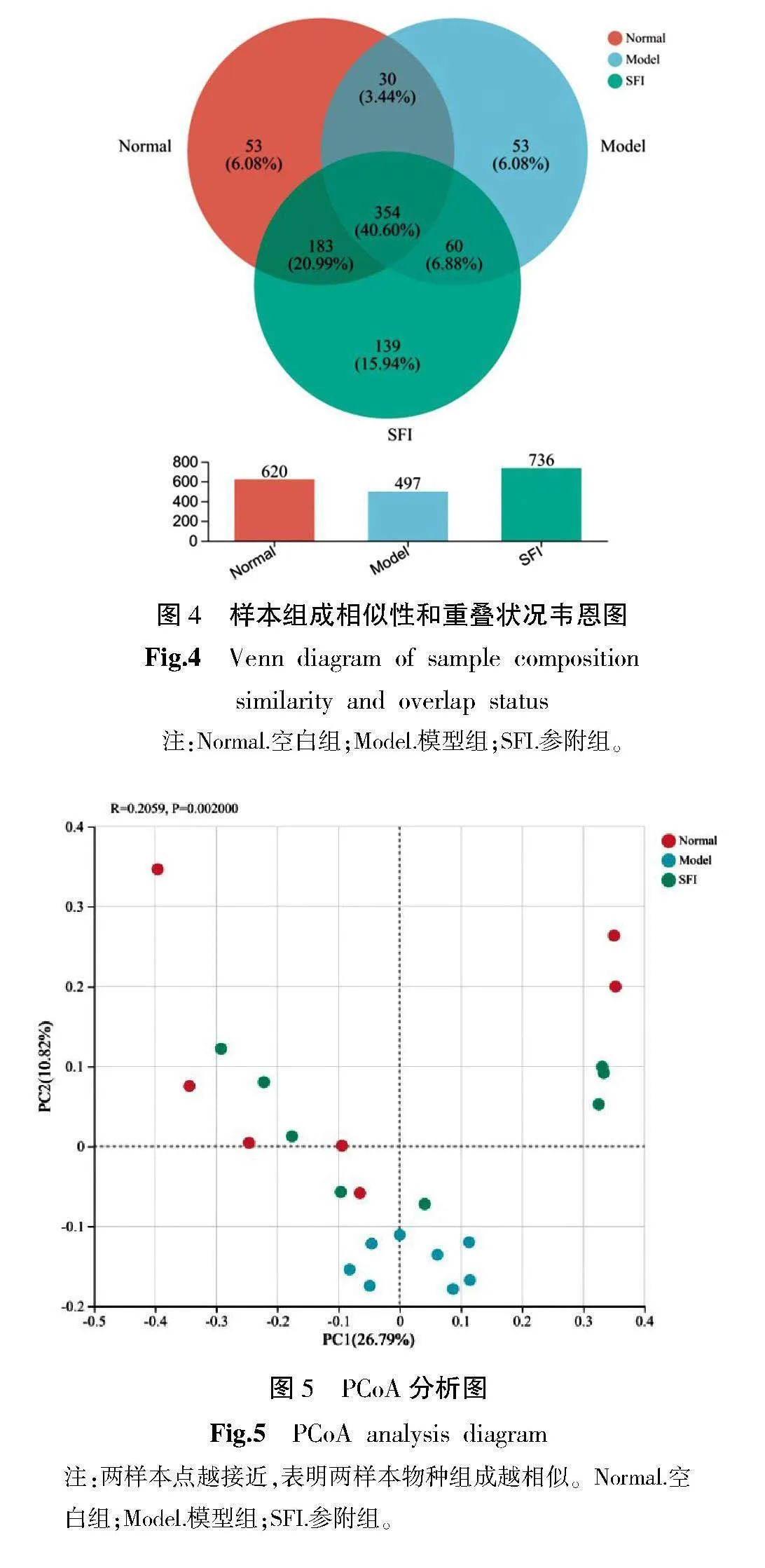
2.4.2" 韦恩图分析" 所有序列依据97%相似度水平划分为872个操作分类单元(operational taxonomic unit, OTU),绘制可直观表现3组样本物种组成相似性和重叠状况的韦恩图(图4)。统计并分析空白组、模型组、参附组样本中共有和特有的OTU数量。空白组、模型组、参附组的OTU分别为620、497、736个。3组共有OTU为354个(40.60%),其中空白组、模型组、参附组特有的OTU分别为53个(6.08%)、53个(6.08%)、139个(15.94%)。空白组和模型组共有的OTU为384个(44.04%),空白组和参附组共有的OTU为537个(61.59%),模型组和参附组共有的OTU为414个(47.48%)。空白组与参附组的共有菌占比高于模型组与参附组的共有菌占比,空白组大鼠与参附组大鼠的菌群结构更加相近。
2.4.3" PCoA分析(principal co-ordinates analysis, PCoA)" PC1的代表性为26.79%,PC2的贡献度是10.82%。基于未加权的Unifrac距离算法的PCoA分析(图5)表明,空白组、模型组、参附组的肠道细菌存在明显的组间差异,空白组样本同参附组样本的组间距离较空白组样本同模型组样本的组间距离缩短。
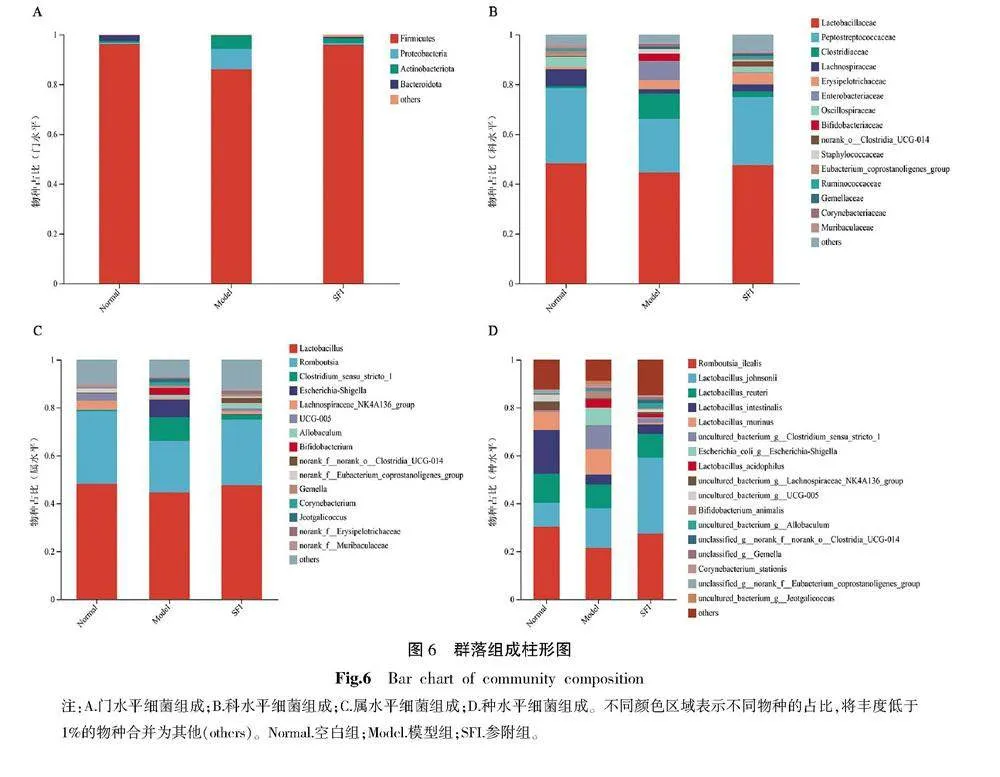
2.4.4" 群落组成分析" (1)门水平物种组成情况:" 如图6A所示,结果表明空白组、模型组、参附组在门水平的最优细菌相同,为厚壁菌门(Firmicutes);其余优势细菌门依次为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)。相较于空白组,模型组的厚壁菌门相对丰度由96.30%降低至86.03%,拟杆菌门相对丰度由2.15%降低至0.08%;变形菌门相对丰度由0.28%升高至8.27%,放线菌门相对丰度由0.99%升高至5.23%。相较于模型组,参附组的厚壁菌门相对丰度由86.03%升高至95.91%,拟杆菌门相对丰度由0.08%升高至0.62%;变形菌门相对丰度由8.27%降低至0.64%,放线菌门相对丰度由5.23%降低至1.92%。
(2)科水平物种组成情况:如图6B所示,空白组的优势细菌科及其相对丰度依次为乳酸杆菌科(Lactobacillaceae)48.22%、消化链球菌科(Peptostreptococcaceae)30.28%、毛螺旋菌科(Lachnospiraceae)6.86%、颤螺旋菌科(Oscillospiraceae)3.99%等。模型组的优势细菌及其相对丰度依次为乳酸杆菌科44.61%、消化链球菌科21.47%、梭菌科(Clostridiaceae)10.28%、肠杆菌科(Enterobacteriaceae)7.40%等。参附组的优势细菌科及其相对丰度依次为乳酸杆菌科47.65%、消化链球菌科27.39%、丹毒丝菌科(Erysip⁃elotrichaceae)4.56%、毛螺旋菌科2.90%等。
(3)属水平物种组成情况:如图6C所示,相对丰度前8的细菌属依次为乳酸杆菌属(Lactobacillus)、罗姆布茨菌属(Romboutsia)、Clostridium_sensu_stricto_1、埃希-志贺菌属(Escherichia-Shig⁃ella)、毛螺旋菌科NK4A136组(Lachnospiraceae_NK4A136_
group)、UCG-005、异杆菌属(Allobaculum)、双歧杆菌属(Bifidobacterium)。相较于空白组,模型组的乳酸杆菌属相对丰度由48.22%降低至44.61%,罗姆布茨菌属相对丰度由30.28%降低至21.47%,毛螺旋菌科NK4A136组相对丰度由3.58%降低至0.62%,UCG-005相对丰度由2.93%降低至0.01%;Clostridium_sensu_stricto_1相对丰度由0.58%升高至9.94%,埃希-志贺菌属相对丰度由0.10%升高至7.40%,异杆菌属相对丰度由0.12%升高至1.35%,双歧杆菌属相对丰度由0.01%升高至2.82%。相较于模型组,参附组的乳酸杆菌属相对丰度由44.61%升高至47.65%,罗姆布茨菌属相对丰度由21.47%升高至27.39%,毛螺旋菌科NK4A136组相对丰度由0.62%升高至1.13%,UCG-005相对丰度由0.01%升高至1.17%,异杆菌属相对丰度由1.35%升高至2.33%;Clostridium_sensu_stricto_1相对丰度由9.94%降低至1.97%,埃希-志贺菌属相对丰度由7.40%降低至0.34%,双歧杆菌属相对丰度由2.82%降低至0.34%。
(4)种水平物种组成情况:如图6D所示,空白组的优势细菌种及其相对丰度分别为Romboutsia_ilealis 30.28%、Lactobacillus_intestinalis 18.37%、Lactobacillus_reuteri 12.13%、Lactobacillus_johnsonii 9.87%等。模型组的优势细菌种及其相对丰度分别为Romboutsia_ilealis 21.47%、Lactobacillus_johnsonii 16.59%、Lactobacillus_murinus 10.59%等。参附组的优势细菌种及其相对丰度分别为Lactobacillus_johnsonii 31.76%、Romboutsia_ilealis 27.39%、Lactobacillus_reuteri 9.94%等。
2.4.5" 多级物种差异判别分析" 如图7所示,多级物种差异判别分析法通过检测显著丰度差异特征,找到丰度有显著性差异的细菌,采用线性判别分析来估算每个物种丰度对差异效果影响的大小。相较于空白组,模型组厚壁菌门等细菌丰度显著降低,梭菌目(Clostridiales)、梭菌科、变形菌门、肠杆菌目(Enterobacterales)、放线菌门等细菌丰度显著升高。与模型组比较,参附组s_Lactobacillus_murinus、梭菌目、梭菌科、放线菌门等细菌丰度显著下降,拟杆菌科(Bac⁃teroidaceae)、拟杆菌属(Bacteroides)等细菌丰度显著升高。
2.5" 网络药理学结果
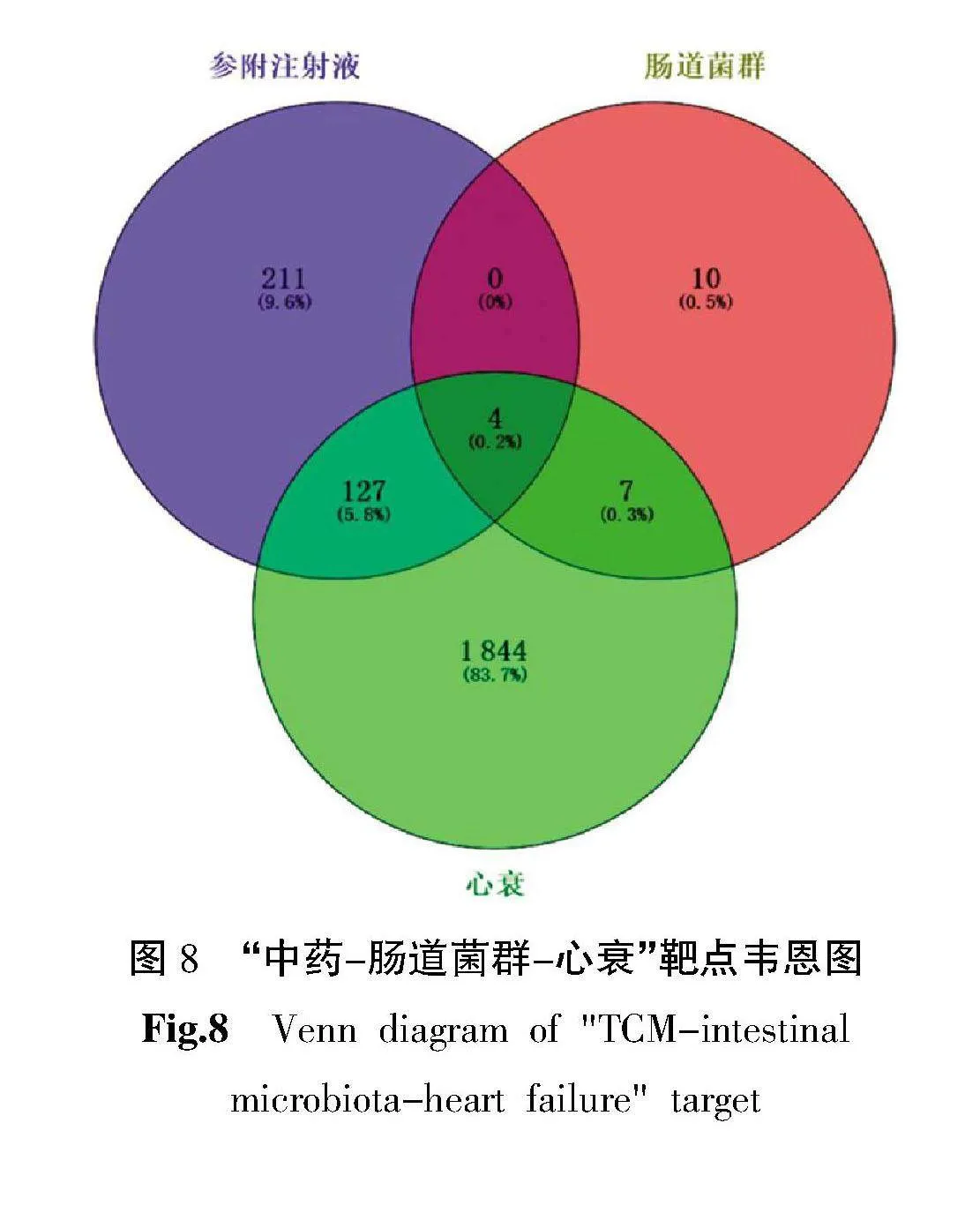
2.5.1" 靶点预测" 从BATMAN-TCM数据库得到附子有效成分46个、红参有效成分9个,共获得55个有效成分;得到附子靶点258种、红参靶点99种,删除重复靶点,最终得到342个中药靶点。分别从GeneCards数据库、DisGeNET数据库、NCBI数据库、OMIM数据库得到1 108、223、748、473个心衰靶点,删除重复靶点,最终得到1 982个心衰靶点。从gutMGene数据库得到21个肠道菌群靶点。利用韦恩图对“中药-肠道菌群-心衰”靶点进行可视化分析,共有4个相同靶点。详见图8。
2.5.2" 核心有效成分及靶点的筛选" 按照Degree值筛选核心有效成分,核心有效成分为:间氨基苯酚、邻氨基苯酚、对氨基苯酚、棍掌碱和榄香烯。按照Degree值筛选核心靶点,核心靶点为:IL-10、IL-1β、IL-6和肿瘤坏死因子(tumor necrosis factor, TNF)。详见图9。
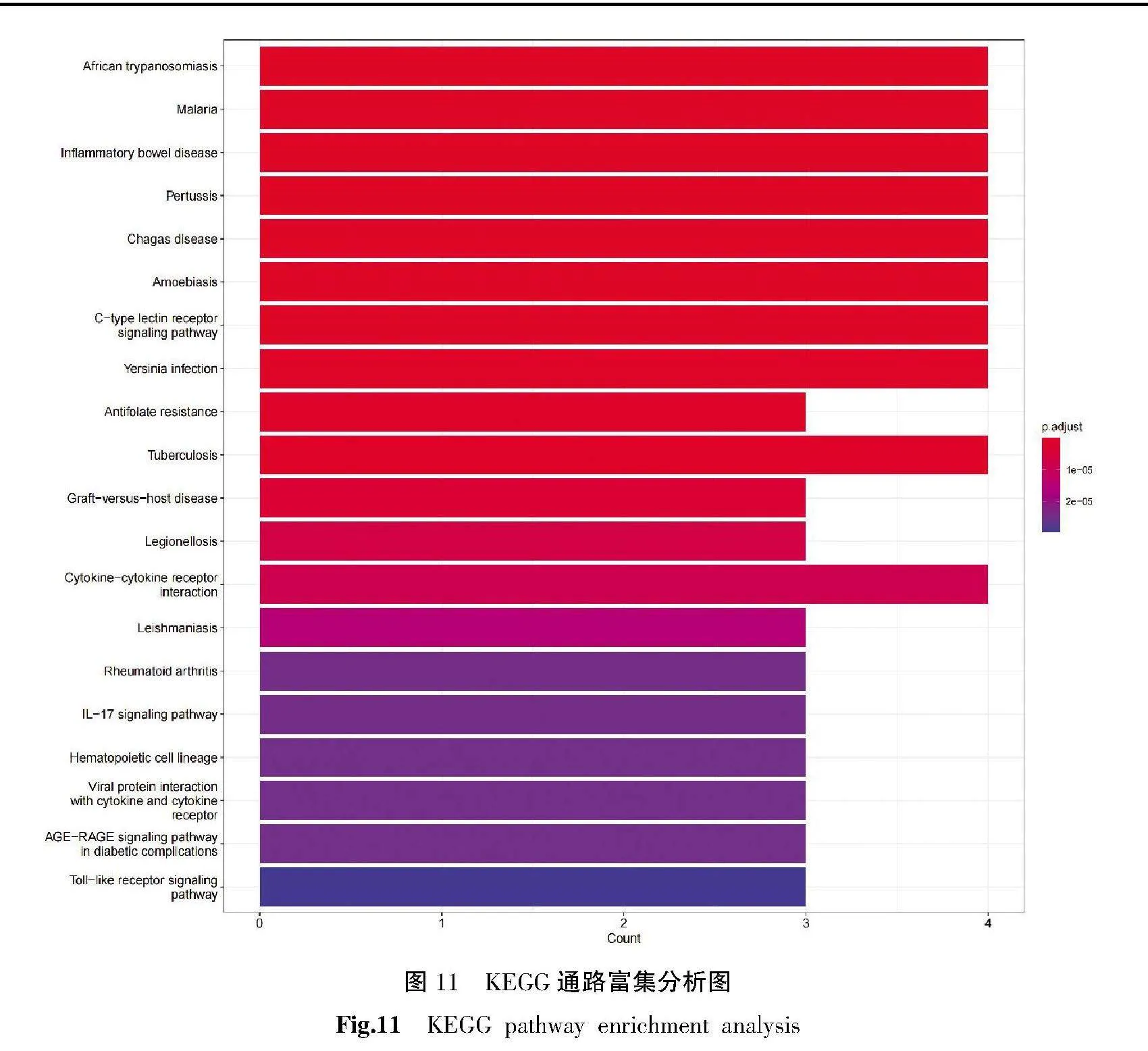
2.5.3" GO功能和KEGG通路富集分析" GO富集分析结果显示,生物过程(biological process, BP)条目1 089条,主要与趋化因子产生的调节、趋化因子的生产等相关;细胞组分(cellular component, CC)条目1条,与吞噬杯相关;分子功能(molecular function, MF)条目0条,详见图10。KEGG富集到63条通路,主要与炎症性肠病等疾病通路相关,详见图11。
3 讨论
目前,许多研究证实肠道菌群及其代谢产物与心衰具有相关性,即“心力衰竭的肠道假说”[18]。心衰通过影响机体的血流动力学,引发肠黏膜的缺血-再灌注损伤,导致其防御功能减弱,有利于肠道菌群及其内毒素向肠外转移,从而促进炎性因子的释放,引起系统炎症损伤,加重心衰程度[19-20]。可见,心衰的发展与肠道菌群的改变相互影响,调节肠道菌群结构,改善肠道微环境,或可成为治疗心衰的新途径。
动物实验结果中,韦恩图和PCoA分析结果均表明,空白组肠道菌群结构与参附组相近,与模型组存在差异,提示心衰发展过程中存在菌群失调现象,参附注射液对菌群结构的恢复有一定作用。
菌群组成分析结果表明,与空白组比较,模型组大鼠变形菌门数量显著增加,成为模型组第二丰富的细菌门,和SUN等[21]的发现类似。变形菌门被认为是肠道菌群失衡的标志[22],该菌门的所有成员都是革兰氏阴性菌,其外膜主要由LPS构成,LPS入血后可激活NF-κB信号通路,促进TNF-α、IL-6、IL-1β的表达,加重系统炎症反应,对心衰的发展产生负面影响[23-24]。治疗后大鼠肠道内变形菌门丰度降低,推测参附注射液可能通过改善肠道菌群结构,减轻炎症反应,发挥治疗心衰的作用。SCFAs是肠道微生物最丰富的代谢产物之一,主要包括乙酸、丙酸、丁酸等,能够参与心衰相关的免疫代谢[25]。乙酸可通过上调TRIM40的表达,抑制TNF-α、IL-6等炎性因子的释放,减轻炎症反应[26];丙酸可通过FFAR2依赖的方式增强Treg功能,使结肠促炎因子水平降低,改善肠道微环境[27];丁酸作为SCFAs的一种,可以激活活化蛋白1信号通路,抑制IL-6、IL-1β等促炎因子的释放,并通过抑制NF-κB等信号通路,调控免疫反应,改善机体炎症状态[28]。毛螺旋菌科和瘤胃菌科(Ruminococcaceae)是丁酸盐产生菌[29];拟杆菌属和阿克曼菌属(Akkermansia)丰度与丁酸盐、丙酸盐水平呈正相关[30];鼠杆菌科(Muribaculaceae)可通过降解特定类型的多糖产生乙酸、丙酸等,其丰度是肠道SCFAs含量的重要预测指标[31]。本研究结果表明,与空白组大鼠比较,模型组毛螺旋菌科、瘤胃菌科、拟杆菌属、阿克曼菌属、鼠杆菌科相对丰度降低,参附注射液治疗后上述细菌丰度增加,其中拟杆菌属丰度与模型组比较有显著差异,提示参附注射液治疗心衰的机制可能与促进肠道内产SCFAs细菌增殖,进而抑制机体炎症反应有关。
网络药理学分析发现,“参附注射液-肠道菌群-心衰”共有4个炎症相关靶点,分别是IL-10、IL-1β、IL-6和TNF。GO功能富集分析显示,参附注射液通过肠道菌群治疗心衰主要与趋化因子的产生等炎症反应途径相关。KEGG分析主要富集在与免疫调节相关的通路。结合血液炎症指标LPS、IL-6、IL-1β的改变,推测参附注射液对心衰伴发菌群失调大鼠的治疗与调节免疫炎症反应密切相关。
本实验通过16S rRNA测序联合网络药理学方法初步开展了基于心衰状态下的“肠-心”对话研究,发现参附注射液治疗心衰的潜在靶点、作用通路,及其与肠道菌群的内在联系。这一发现不仅可以提高研究人员对参附注射液治疗心衰机制的认识,而且揭示了调节肠道菌群可能成为治疗心衰的一种新策略。但由于本实验未进行菌群移植以验证其抗炎效果的直接作用,参附注射液能否通过调节肠道菌群,抑制机体炎症反应,进而改善心功能,尚需深入探究。
参考文献
[1] 徐" 芬, 周" 洲. 《心力衰竭通用定义和分类》将开启心力衰竭诊疗的标准化进程[J]. 协和医学杂志, 2021, 12(5): 621-623.
[2] LIANG B, ZHAO Y X, ZHANG X X, et al. Reappraisal on pharmacological and mechanical treatments of heart failure[J]. Cardiovascular Diabetology, 2020, 19(1): 55.
[3] SEVERINO P, MAESTRINI V, MARIANI M V, et al. Structural and myocardial dysfunction in heart failure beyond ejection fraction[J]. Heart Failure Reviews, 2020, 25(1): 9-17.
[4] JIA Q J, LI H, ZHOU H, et al. Role and effective therapeutic target of gut microbiota in heart failure[J]. Cardiovascular Therapeutics, 2019, 2019: 5164298.
[5] 王" 淳, 刘丽梅, 宋志前, 等. 心血管疾病常用中药注射液及相关中药有效组分研究概况[J]. 中草药, 2015, 46(15): 2315-2328.
[6] 侯雅竹, 毛静远, 王贤良, 等. 参附注射液治疗心力衰竭的系统评价[J]. 中国循证医学杂志, 2011, 11(3): 292-299.
[7] 杨" 柳, 叶" 东, 胡" 耀, 等. 参附注射液基于TLRs信号通路对慢性心力衰竭大鼠模型保护作用的机制研究[J]. 中国中医药现代远程教育, 2023, 21(13): 134-137.
[8] 梁" 昊, 黄建华, 简维雄, 等. 参附注射液通过血管加压素逃避改善心衰大鼠水钠代谢[J]. 中药药理与临床, 2020, 36(6): 57-62.
[9] ZOU Y F, SONG X J, LIU N, et al. Intestinal flora: A poten⁃tial new regulator of cardiovascular disease[J]. Aging and Disease, 2022, 13(3): 753-772.
[10] WEN Y N, SUN Z F, XIE S Y, et al. Intestinal flora derived metabolites affect the occurrence and development of cardiovascular disease[J]. Journal of Multidisciplinary Healthcare, 2022, 15: 2591-2603.
[11] CHEN X, LI H Y, HU X M, et al. Current understanding of gut microbiota alterations and related therapeutic intervention strategies in heart failure[J]. Chinese Medical Journal, 2019, 132(15): 1843-1855.
[12] ZHAO Z Y, LIU J H, HU Y Z, et al. Bacterial diversity in the intestinal mucosa of heart failure rats treated with Sini Decoction[J]. BMC Complementary Medicine and Therapies, 2022, 22(1): 93.
[13] GAO K, YU X, LI F H, et al. Qishen granules regulate intestinal microecology to improve cardiac function in rats with heart failure[J]. Frontiers in Microbiology, 2023, 14: 1202768.
[14] 黄淑敏, 廖晓倩, 范星宇, 等. 基于“以方测证”理论探讨异丙肾上腺素诱导慢性心力衰竭大鼠模型的制备及中医证型[J]. 湖南中医药大学学报, 2023, 43(3): 368-375.
[15] 孔文文, 张" 昕. 内质网应激和蛋白质羰基化在心力衰竭恶病质中的作用[J]. 安徽医科大学学报, 2021, 56(2): 244-248.
[16] SHAO H Q, ZHANG C Y, XIAO N Q, et al. Gut microbiota characteristics in mice with antibiotic-associated diarrhea[J]. BMC Microbiology, 2020, 20(1): 313.
[17] 赵震宇, 胡炎芝, 董振华, 等. 参附注射液对阿霉素诱导的心力衰竭大鼠肠道细菌多样性的影响[J]. 中成药, 2022, 44(7): 2334-2340.
[18] LI L, ZHONG S J, CHENG B, et al. Cross-talk between gut microbiota and the heart: A new target for the herbal medicine treatment of heart failure?[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020: 9097821.
[19] 武文娟, 吴纪珍, 黄改荣, 等. 老年肠道菌群失调与特发性肺纤维化患者心力衰竭的相关性研究[J]. 中华老年心脑血管病杂志, 2022, 24(1): 14-16.
[20] 李国敬, 刘玲梅. 肠道菌群改变与心力衰竭关系的研究进展[J]. 内科, 2021, 16(5): 643-645.
[21] SUN W J, DU D B, FU T Z, et al. Alterations of the gut microbiota in patients with severe chronic heart failure[J]. Frontiers in Microbiology, 2022, 12: 813289.
[22] SHIN N R, WHON T W, BAE J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503.
[23] VIOLI F, CASTELLANI V, MENICHELLI D, et al. Gut barrier dysfunction and endotoxemia in heart failure: A dangerous connubium?[J]. American Heart Journal, 2023, 264: 40-48.
[24] 孙悦龙, 张梦洁, 豆佳红, 等. 基于网络药理学及分子对接技术研究黄芪调控仔猪肠道菌群失调性腹泻的作用[J]. 中国畜牧兽医, 2022, 49(8): 3200-3211.
[25] ZHAO P, ZHAO S H, TIAN J W, et al. Significance of gut microbiota and short-chain fatty acids in heart failure[J]. Nutrients, 2022, 14(18): 3758.
[26] YANG H G, MENG L, AI D B, et al. Acetic acid alleviates the inflammatory response and liver injury in septic mice by increasing the expression of TRIM40[J]. Experimental and Therapeutic Medicine, 2019, 17(4): 2789-2798.
[27] SMITH P M, HOWITT M R, PANIKOV N, et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis[J]. Science, 2013, 341(6145): 569-573.
[28] 张锦涛, 伊" 曼, 李志嘉, 等. 丁酸盐在炎症反应中作用机制的研究进展[J]. 免疫学杂志, 2015, 31(12): 1101-1104.
[29] AHMAD A F, DWIVEDI G, O'GARA F, et al. The gut microbiome and cardiovascular disease: Current knowledge and clinical potential[J]. American Journal of Physiology Heart and Circulatory Physiology, 2019, 317(5): H923-H938.
[30] WANG Z J, LIU J, LI F, et al. Mechanisms of qingyi decoction in severe acute pancreatitis-associated acute lung injury via gut microbiota: Targeting the short-chain fatty acids-mediated AMPK/NF-κB/NLRP3 pathway[J]. Microbiology Spectrum, 2023, 11(4): e0366422.
[31] SUN Z Q, YU Z, WANG B. Perilla frutescens leaf alters the rumen microbial community of lactating dairy cows[J]. Microorganisms, 2019, 7(11): 562.
(本文编辑" 周" 旦)

