菌群移植对神经认知恢复延迟小鼠炎症反应以及菌群和代谢产物的研究
【摘 要】目的:探讨粪便菌群移植(fecal microbiota transplantation,FMT)对神经认知恢复延迟(delayed neurocognitive recovery,dNCR)小鼠认知能力、肠道菌群及代谢物和炎症反应的影响,为dNCR患者提供一种有效治疗方式。方法:将小鼠随机分为对照组、模型组和菌群移植组3组。采用胫骨中段骨折的方式建立dNCR模型,收集健康小鼠粪便进行FMT。采用Morris水迷宫实验和旷场实验检测行为学能力,Elisa法检测海马和血清中白细胞介素(interleukin,IL)-6、IL-1β和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的含量,Western blot法检测结肠组织紧密连接蛋白-1(zonula occludens protein 1,ZO-1)及海马神经元特异性烯醇化酶(neuron-specific enolase,NSE)和中枢神经特异性蛋白β(S100 Calcium-binding protein,S-100β)的蛋白含量。透射电镜下观察海马区神经细胞超微结构。采用16s rRNA基因测序以及液相色谱-质谱联用技术来检测肠道菌群及代谢物的变化。结果:旷场实验和水迷宫实验结果显示模型组认知功能受损而菌群移植后改善了认知损害。模型组血清以及海马中IL-6、IL-1β和TNF-α高于其他2组。模型组结肠组织中ZO-1蛋白含量低于其他2组(P=0.000),而NSE及S-100β高于对照组和菌群移植组(P=0.000)。透射电镜结果显示模型组海马组织结构破坏,而菌群移植后改善了这些变化。3组之间的Chao 1指数和Shannon指数相似。基于bray_curtis的PCoA发现模型组与对照组、菌群移植组明显分离。模型组和菌群移植组的优势菌以拟杆菌门、厚壁菌门为主,模型组中厚壁菌、脱硫弧菌和变形杆菌高于另两组,而拟杆菌降低。代谢分析中PLS-DA分析显示3组明显分离。热图显示出模型组与对照组、菌群移植的明显差别,与对照组和菌群移植组相比,模型组中色氨酸、5-羟色胺、吲哚等代谢物含量减少,而溶血磷脂酰胆碱增加。结论:肠道菌群及代谢产物的失调以及炎性反应可能是dNCR发生发展的重要机制,而FMT可能通过这机制能够改善麻醉/手术后小鼠的认知功能。
【关键词】16s rRNA;神经认知恢复延迟;粪便微生物群移植;胃肠道微生物组;肠道代谢产物;炎症反应
【中图分类号】R619【文献标志码】A【收稿日期】2024-05-13
基金项目:国家自然科学基金资助项目(编号:8226150830);甘肃省科技计划资助项目(编号:20YF3FA020);兰州市科技计划资助项目(编号:2022-3-31)。
Effects of fecal microbiota transplantation on inflammatory responses,microbiota composition,and metabolites in mice with delayed neurocognitive recovery
Tang Lu1,Zhang Binsen1,Zhang Xiaojia1,Song Wenjing2,Du Zhongying1,Wang Chunai3
(1. The First Clinical Medical College,Gansu University of Chinese Medicine;2. The Fifth Clinical Medical College of Chongqing Medical University;3. Anesthesiology and Pain Medicine Center,Gansu Provincial Hospital of Traditional Chinese Medicine)
【Abstract】Objective:To investigate the effects of fecal microbiota transplantation(FMT) on the cognitive ability,microbiota composi‐tion,metabolites,and inflammatory response of mice with delayed neurocognitive recovery(dNCR),and to provide insights into the de‐velopment of effective treatments for dNCR patients. Methods:Mice were randomly divided into the control group,model group,and FMT group. The dNCR model was established by middle tibial frac‐ture,and fecal samples were collected from healthy mice for FMT. Cognitive ability was assessed using the Morris water maze test(MWMT) and open field test(OFT). IL-6,IL-1β and TNF-α levels in the hippocampus and serum were measured using ELISA. Co‐lonic Z0-1 and hippocampal NSE and S-100β protein expression was measured by Western blot. The microbiota composition and changes in metabolites were examined using 16s rRNA sequencing and LC-MS,respectively. Results:OFT and MWMT showed that model mice had cognitive impairment,which was attenuated in FMT mice. Serum and hippocampal levels of IL-6,IL-β and TNF-αwere higher in the model group than in the other two groups. In addition,the model group had significantly lower colonic ZO-1 protein expression(P=0.000) but significantly higher hippocampal NSE and S-100β protein expression than the other two groups(P=0.000). The Chao1 index and Shannon index were similar among the three groups. Principle coordinates analysis using Bray-Curtis dissimilar‐ity revealed that the microbiota composition of model group was markedly distinct from those of the control and FMT groups. Bacte‐roidetes and Firmicutes were the predominant phyla in the model and FMT groups. The model group also had higher abundance of Fir‐micutes,Desulfobacterota,and Proteobacteria and lower abundance of Bacteroides than the control group and FMT group. Partial leastsquares discriminant analysis demonstrated that the model group had a distinct metabolite composition than the other two groups,char‐acterized by decreased tryptophan,5-hydroxytryptophan,and indole,as well as increased lysophosphatidylcholine. Conclusion:Dys‐regulated microbiota and metabolites as well as inflammatory responses may be the key mechanisms driving dNCR development and progression. FMT can act on these pathways to improve the cognitive function of anesthetized or operated mice.
【Key words】16s rRNA;delayed neurocognitive recovery;fecal microbiota transplantation;gut microbiota;gut metabolites;inflamma‐tory response
神经认知恢复延迟(delayed neurocognitive re‐covery,dNCR)是一种在术后30 d内出现的任何形式的认知功能障碍,是一种术后常见的并发症。dNCR的发生不仅严重影响了患者的生活质量,也给社会带来了沉重的负担,因此加快对dNCR的预防和治疗尤为重要。目前,针对dNCR的治疗大多以预防为主,而肠脑轴概念的提出可能为dNCR的治疗带来新的可能性。作为大脑和肠道的交流通道,可以通过肠道菌群及其代谢产物影响大脑的结构和功能,从而改善认知功能[1]。
粪便菌群移植(fecal microbiota transplantation,FMT)是将健康供体体内的菌群移植到患者体内从而恢复患者正常功能的方式。有研究表明dNCR与正常小鼠肠道菌群之间存在的巨大差异[2]。在帕金森小鼠中移植健康小鼠菌群粪便后观察到帕金森小鼠的行为认知功能得到恢复[3]。虽然目前FMT对dNCR的作用仍然不清楚,但是理论分析认为菌群粪便移植也可以改善dNCR患者的认知功能。由此本研究有理由推测菌群移植不失为1个治疗dNCR的有效方式。
炎症反应也是dNCR发生发展的一个重要病理过程。麻醉/手术引起dNCR机制可能与外周促炎信号通过血脑屏障从而激活胶质细胞,从而加重神经损伤和死亡有关。然而对FMT是否可以改善神经炎症反应从而减轻dNCR的研究鲜有报道。因此,本研究通过制备dNCR小鼠模型,观察小鼠经过FMT后,对术后学习记忆能力、炎性因子以及肠道菌群和其代谢产物的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 研究从2022年10月到2023年6月,选择8周龄的雄性C57BL/6J小鼠40只,体质量为23~25 g。小鼠由斯贝福(北京)生物技术有限公司提供[许可证号:SCXK(京)2019-0010]。将它们饲养在(24±2)℃,40%~70%湿度,12 h光/暗循环的环境下,同时允许自由获取食物和水。实验开始前小鼠在该环境适应7 d。实验中所有操作均得到甘肃中医药大学伦理委员会批准(审批编号:2023-512)。
1.1.2 主要实验仪器 髓内钉(锘海生物科学仪器上海有限公司),医用缝合针(杭州华威医疗用品有限公司),灌胃针(上海玉研科学仪器有限公司),Morris水迷宫系统(成都泰盟科技有限公司),离心机(德国Eppendorf公司),酶标仪(美国Molecular公司),摇床(美国SCILOGEX公司),转印槽(美国Bio-Rad公司),novaseq 6000测序仪(美国illumine公司),质谱仪(美国Thermo Fisher公司),透射电子显微镜(美国FEI公司)。
1.1.3 主要试剂 七氟烷(上海恒瑞医药有限公司),大鼠肿瘤坏死因子-α(tumor necrosis factor,TNF-α),白细胞介素(interleukin,IL)-6和IL-1β ELISA试剂盒(上海酶联生物科技有限公司),BCA蛋白定量试剂盒(苏州新赛美生物科技有限公司),紧密连接蛋白-1(zonula occludens protein 1,ZO-1)(美国protientech公司),海马神经元特异性烯醇化酶(neuron-specific aldehyde Reductase ,NSE)(美国 Immunoway公司),S-100β(美国 Immunoway公司),GAPDH抗体(美国Affinity公司),粪便基因组DNA提取试剂盒(北京天根生化科技有限公司),NEBNext? Ultra? II FS DNA PCR-free文库制备试剂盒(美国 New England Biolab公司),电镜固定液(江苏酶免实业有限公司)、812包埋剂(美国 SPI公司)。
1.2 实验方法
1.2.1 实验分组 小鼠在经过了7 d环境适应后,通过计算机随机将40只小鼠分为3组:对照组(n=10),模型组(n= 15)和菌群移植组(n=15)。考虑到在造模后和灌胃过程中小鼠死亡的可能性,因此将模型组和菌群移植组的小鼠数量定为15只。
1.2.2 dNCR模型建立及各组的处理 dNCR模型组和菌群移植组:依据之前的描述[4],使用胫骨骨折的方式建立模型。3%七氟烷诱导麻醉小鼠,然后在2%七氟烷维持下进行手术,全程氧气供应,浓度为100%。在麻醉过程中注意小鼠的呼吸频率和肌张力。待小鼠安静不动,呼吸变慢皮肤夹捏反应消失后[5],将右侧胫骨剃光并使用碘伏消毒。在膝关节下方切开皮肤,显露胫骨,将髓内固定针从胫骨转轴处钻孔植入,胫骨中端骨折。在清创后,用0.25%布比卡因浸润切口,逐层缝合切口,无菌敷料覆盖。整个手术时间持续30 min左右。术后局部涂敷复方利多卡因乳膏,每日2次,直到伤口愈合。待小鼠完全清醒后放回笼子,允许自由进食。对照组:仅置于有100%氧气的装置中30 min。实验过程中因造模和灌胃过程中死亡10只,共纳入的小鼠30只,最终3组的数量分别是9、10、11只。
1.2.3 粪便菌群移植 收集健康小鼠的新鲜粪便,以1粒粪便/2 mL的标准加入PBS液。待浸泡15 min后,以1 000 r/min、4 ℃离心5 min。取上清液与甘油混合后在-80 ℃冰箱储存。然后通过灌胃法将供体粪便悬液移植给菌群移植组,每只小鼠每次200 U悬浮液,每周2次,持续2周。另外,在FMT前通过Morris水迷宫试验。当结果表明建模成功后的小鼠才会进行FMT。对照组和模型组使用同等量0.9%生理盐水进行2周灌胃。2周后检测海马和血清炎症因子IL-6、IL-1β和TNF-α的表达,同时检测认知功能以及小鼠体内肠道菌群及代谢产物。
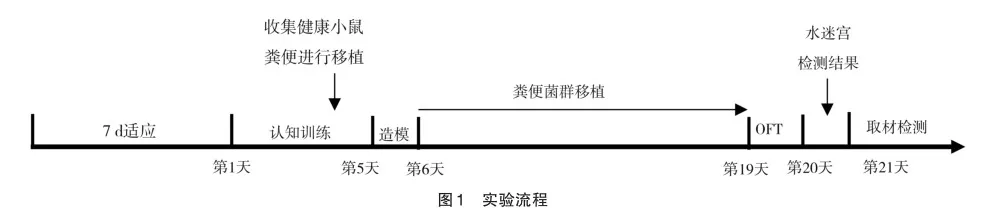
1.2.4 行为学测试
1.2.4.1 旷场实验 如图1所示,小鼠在2周菌群移植结束后进行旷场实验(open field test,OFT),小鼠放在40 cm×40 cm×40 cm 的正方体区域内自由移动5 min,使用摄像机记录小鼠运动的总距离、中央区域停留时间及百分比、中央区域及百分比。测试时实验人员离开旷场箱周围以避免干扰老鼠。每次测试结束后,都用75%的乙醇擦拭装置,以避免嗅觉线索。
1.2.4.2 Morris水迷宫试验 Morris水迷宫试验来测试和评价记忆和学习能力。试验在1个直径120 cm,高50 cm白色塑料制成的大型圆形池内进行。池中充满水,深度为25 cm,池内水温为(24.0±1.0) ℃。水中加入二氧化钛粉,使水成为乳白色变得不透明。水面分成4个象限,然后将直径为10 cm的圆形平台浸没在第四象限中央水面以下约0.5~ 1.0 cm处。小鼠首先于造模前进行5 d的行为训练,将小鼠头朝池壁放入水中,如果小鼠在60 s内找到平台,让小鼠在平台上停留10 s;如果小鼠60 s内找不到平台,则由实验者将其引导登上平台并停留10 s,潜伏期记录为60 s。每天固定时间训练4次(即将小鼠从4个不同象限放入水中),用系统纪录逃避潜伏期。菌群移植后进行定位航行试验,方法如上。定位航行结束后,撤掉平台进行空间探索试验。记录在60 s内的游泳路径,记录游泳总距离、穿越平台的次数、在目标象限停留的时间。
1.2.5 粪便菌群分析 行为学试验结束后2 h内,收集新鲜粪便样本,并在液氮中快速冷冻,然后放在-80 ℃冰箱中。通过细菌16s rRNA基因测序来测量肠道菌群的变化。基因组DNA提取采用CTAB方法。使用细菌16 S rRNA基因(V4区)特异性引物扩增基因组DNA,引物为:515F(5’-GTGCCA GCMGCCGCGGTAA-3’)和806R(5’-GG ACTACHVGGGTWT CTAAT-3’)。在98 ℃下进行1 min的第1次变性,然后在98 ℃(10 s)、50 ℃ (30 s)和72 ℃(30 s) 下进行30次循环,最后在72 ℃下保持5 min。使用NovaSeq 6000进行PE 250上机测序。将序列以97%的一致性聚类到相同的操作分类单位中。使用QIIME工具进行α和β多样性分析。通过Chao 1、观测运算分类单元和Shannon指数分析α多样性,同时进行β多样性分析。
1.2.6 代谢物分析 将小鼠处死后,采用心尖取血方式采血,离心后收集上层血清。使用80%甲醇水溶液从样本中提取代谢物,涡旋震荡,冰浴静置5 min,15 000 r/min和4 ℃下离心20 min。加水稀释至甲醇含量为53%后,将提取的混合物以15 000 r/min、4 ℃离心20 min,并使用液相色谱-质谱联用仪分析上清液以鉴定代谢物。数据处理是基于 Linux操作系统(CentOS版本6.6)以及R、Python软件进行。在进行质控后,使用数据处理软件metaX对代谢物进行偏最小二乘法判别分析(Partial least squares Discriminant Analysis,PLS-DA)。
1.2.7 免疫印迹法检测 使用免疫印迹法检测海马组织中的NSE、S-100β以及结肠组织ZO-1的蛋白表达。取海马组织和结肠组织裂解匀浆,在4 ℃下3 000 r/min离心20 min,取上清液。使用含有蛋白酶和磷酸酶抑制剂的混合物以及苯甲基磺酰氟和放射免疫沉淀法缓冲液从检测样品中提取蛋白质。根据所测的目的蛋白分子量配置凝胶,待电泳结束使用PVDF膜进行转膜。取出PVDF膜,使用5%的脱脂牛奶封闭1 h,加入稀释过的单克隆兔抗NSE(稀释浓度为1∶2 000)、S-100β(稀释浓度为1∶1 000)和ZO-1(稀释浓度为1∶3 000),在4 ℃孵育过夜,并使用GAPDH(稀释浓度为1∶5 000)进行对照。过夜后,室温摇床下用Tris盐缓冲液洗涤4次,每次8 min,加入二抗(稀释比例是1∶5 000),摇床上孵育1.5 h,同样方法洗涤4次。配置ECL发光液并机器曝光成像。Image J分析软件计算蛋白含量。
1.2.8 酶联免疫吸附实验分析 按照免疫印迹法方法取上清液。根据制造商的说明,用相应的酶联免疫吸附实验试剂盒测定海马中IL-6、IL-1β和TNF-α浓度。使用酶标仪以450 nm波长测量各孔吸光度,测定在加终止液后15 min内进行。根据标准曲线计算海马和血清样品中 IL-6、IL-1β和TNF-α浓度。
1.2.9 透射电镜 通过透射电镜观察海马区的超细结构。取海马组织并将切成<1 mm3的方块,在2.5%戊二醛固定2~ 4 h。经过脱水、渗透、包埋、固化后,将样本切片60~80 nm的超薄切片。2%醋酸铀-枸橼酸铅双染色后在电镜下观察。
1.3 统计学方法
采用Graphpad Prism 9软件进行统计分析。ShapiroWilk法用来检测数据是否符合正态分布(P>0.05)。对于非正态分布或方差不齐的数据采用非参数检验,以四分位数Md(P25,P75)表示。计量资料符合正态分布以均数±标准差(x±s)表示。除术前认知功能行为训练采用分析采用双因素方差分析外,其他检测数据均采用单因素方差分析。事后检验采用Bonferroni进行多重比较。检验水准α=0.05。
2 结 果
2.1 小鼠行为学检测结果

2.1.2 水迷宫检测结果 为了确认dNCR模型是否成功建立以及研究菌群移植是否能改善麻醉/手术引起的认知功能改变,本研究使用Morris水迷宫进行评估,具体见表2。3 组的游泳总距离无差异(F=0.290,P=0.750),表明排除了菌群移植后运动能力的影响。3 组小鼠的逃避潜伏期(F=9.850,P=0.002)、穿越平台的次数(F=30.620,P<0.001)以及在目标象限的停留时间(F=10.800,P=0.001)的差异有统计学意义。其中,在定位航行中,与对照组相比,模型组小鼠显示出更长的潜伏期,菌群移植后与模型组相比潜伏期缩短。而在空间探索中,与对照组相比,模型组的穿越平台次数和在目标象限的时间均减少,而菌群移植后可以改善这种变化。以上结果表明FMT治疗后改善了由麻醉/手术损害的认知功能。
2.1.3 旷场实验结果 菌群移植治疗对dNCR小鼠的焦虑影响由OFT进行评估。3组的运动总距离差异无统计学意义(F=2.090,P=0.144),而3组的中央区域停留时间(H= 10.380,P=0.006)、中央区域停留时间比例(H=10.380,P= 0.006)、中央区域路程(H=11.040,P=0.004)和中央区域路程比例(H=13.020,P=0.002)均有显著差异。其中,在模型组中这些指标显著下降(P<0.05 vs.对照组),而在菌群移植组显著增加(P<0.05 vs.模型组)。见表3。
2.2 小鼠菌群移植炎症反应情况
为了研究FMT对于炎症反应的影响,于是测定了小鼠海马以及血清中IL-1β、IL-6以及TNF-α水平。如表4所示,3 组小鼠IL-1β(F=21.340,P=0.000)、IL-6(F=18.570,P= 0.001)、TNF-α(F=22.200,P=0.000)含量差异均有统计学意义。同样的,如表5所示,在海马中与在血清中结果类似。模型组的IL-1β、IL-6、TNF-α高于对照组,菌群移植组与模型组相比炎性因子水平均降低,对照组和菌群移植组之间无差异。结果表明肠道菌群可能参与外周以及神经炎性反应。
2.3 小鼠菌群移植肠道和脑损伤情况
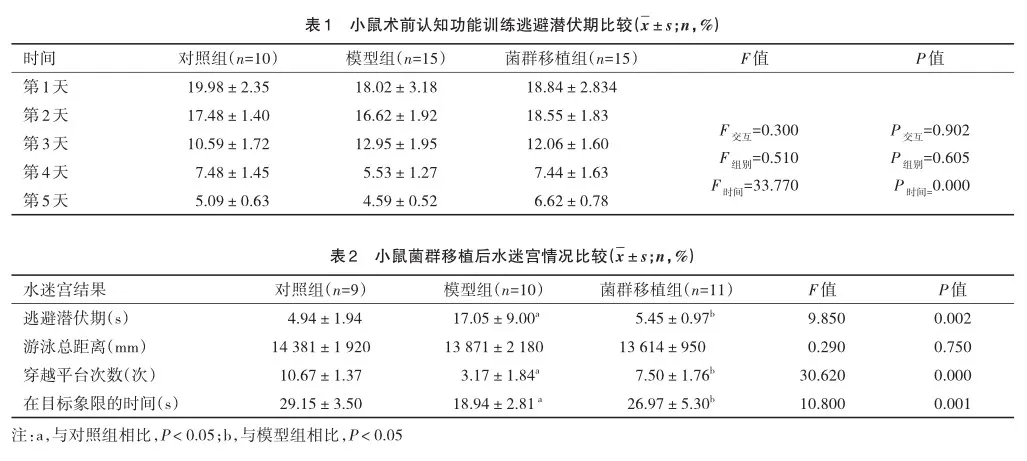
ZO-1作为肠黏膜屏障的重要组成部分[6],可以反映肠道的损伤情况。因此取小鼠结肠组织测量ZO-1的相对表达。由图2A可以观察到,3组小鼠的ZO-1的相对表达差异有统计学意义(F=105.900,P=0.000)。在这之中,模型组与对照组相比ZO-1的表达量下降,菌群移植后ZO-1表达明显上调。
为了探讨FMT后,健康的供体的菌群是否参与改善脑损伤,于是测量了海马中NSE、S-100β蛋白的表达,见图 2A。3组间NSE(F=90.550,P=0.000)、S-100β(F=107.800,P= 0.000)蛋白表达有显著差异。在麻醉/手术后,与对照组相比2种蛋白相对含量有增加,菌群移植后出现下降。如图2B所示,在海马组织的电镜结果中对照组细胞核形态规则,表面光滑,而模型组可见细胞核形态不规则,表面凹凸不平,基质电子密度降低呈空泡化,而菌群移植后得到改善。
2.4 小鼠肠道菌群结果
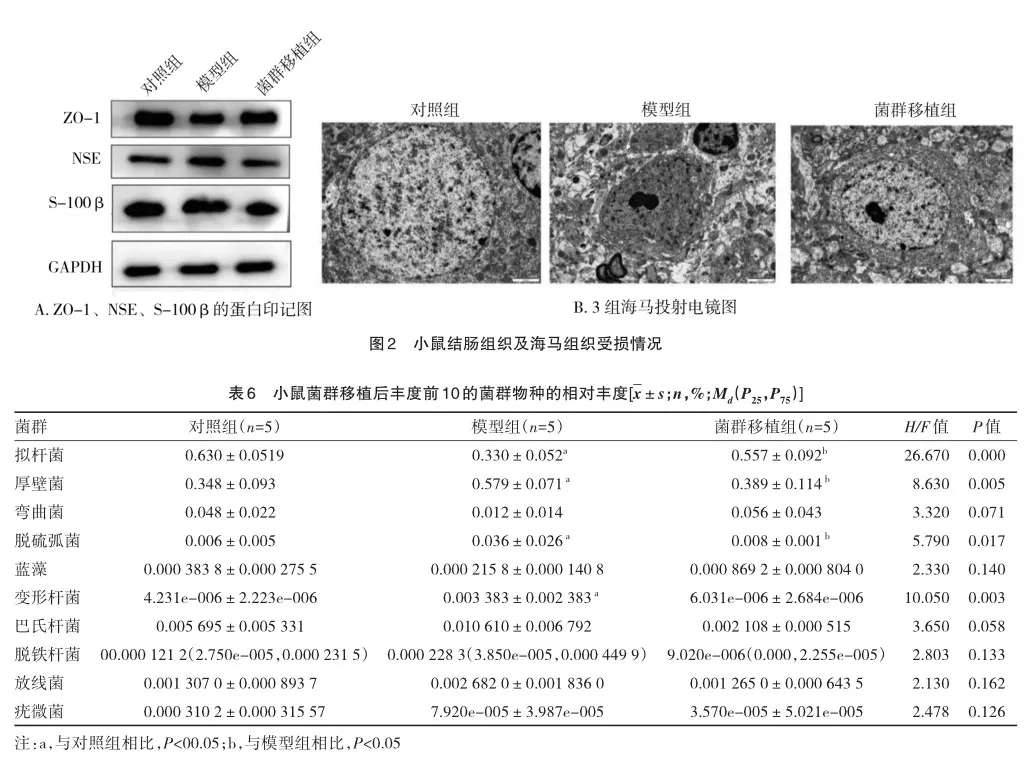
在确认了菌群移植会改善炎性反应以及脑损伤后,为了进一步确认这种变化是否通过肠道菌群发生变化的,对样本的粪便进行了16S rRNA测序分析。α多样性用来评价群落内菌群的多样性。3组之间的Chao 1指数和shannon指数相似,表明三者之间的群落内微生物物种多样性差异不显著,(图3A、3B)。β多样性主要用来评价群落和群落间的菌群多样性[7]。通过基于bray_curtis的PCoA发现模型组与对照组明显分离,而对照组与菌群移植组之间的更为接近(图3C),表明对照组与菌群移植组之间的菌群构成比的相似性。
在门水平上,如表6所示,展示了每个组丰度前10的菌群物种相对丰度。3组的拟杆菌(F=26.670,P=0.000)、厚壁菌(F=8.630,P=0.005)、脱硫弧菌(F=5.790,P=0.017)和变形杆菌(F=10.050,P=0.003)的差异有统计学意义。其中,相比于对照组,拟杆菌的相对丰度下降,而厚壁菌、脱硫杆菌和变形杆菌相对丰度增加。在经历菌群移植后,观察到小鼠粪便中的这些细菌朝着对照组方向变化。这个结果不仅表明了FMT的成功,而且说明这些细菌很可能是参与认知变化的关键菌群。

2.5 小鼠代谢组学结果
为了进一步探索这种行为学的变化是否由某些菌群的代谢物引起,所以基于LC-MS技术进行非靶向代谢组学分析。
热图显示了3组10种差异代谢物的全局特征,通过这个图可以看到模型组与对照组代谢物有明显差异,而菌群移植组与对照组代谢物含量类似,具体见图3D。在这之中,与对照组,模型组中色氨酸、5-羟色胺、吲哚等代谢物含量减少,而LPC有增加。FMT后,这些代谢物向着相反的方向变化。此外,图3E的PLS-DA分析显示无论是对照组还是菌群移植组,与模型组组都出现了分离,而对照组和菌群移植组接近。这与热图结果是一致的。结果表明,FMT认知功能的变化可能是通过这些代谢物发生改变的。
3 讨 论
dNCR患者主要表现为认知、注意力、记忆力、定向力以及执行力的下降,严重情况时会持续数月、数年甚至更长时间[8]。因此找到dNCR的有效治疗方式显得十分重要。菌群移植是一种潜在的治疗方式,但是目前还未有FMT治疗dNCR的相关研究。本研究发现dNCR小鼠在粪便的菌群移植后,肠道内某些微生物及代谢产物得到恢复,并减轻神经炎症,从而改善了小鼠的认知功能。
作为肠道微生物和大脑交流的通道,肠脑轴可以通过肠道菌群本身或者是其代谢物影响认知功能[9]。在麻醉/手术后,观察到小鼠的肠道微生物组成与对照组的差异巨大,而FMT后肠道菌群向着健康方向恢复。其次,在门水平上,可以观察到拟杆菌是小鼠肠道菌群中的主要组成,而在麻醉/手术后,dNCR小鼠具有更高丰度的厚壁菌和脱硫杆菌,更低丰度的拟杆菌和变形杆菌。在经过菌群移植后会改善这些变化。有相关研究表明,拟杆菌丰度的下降与认知障碍相关[10]。作为在健康肠腔内丰富存在的细菌,其导致认知的下降可能与拟杆菌死亡导致血浆中脂多糖增加从而引起神经炎症反应有关[11]。此外,在帕金森疾病的小鼠研究中发现变形杆菌丰度的显著增加[12]。变形杆菌与认知功能障碍呈正相关,机制可能与拟杆菌类似,通过脂多糖激活TLR 4/NF-kB介导神经炎症[13]。因此,可以提出假设拟杆菌、变形杆菌等可能是dNCR的标志菌群,而菌群移植后可以通过检测这些标志菌群的变化来观察治疗方式的有效性。
肠道微生物的某些代谢物可以通过循环系统影响认知功能。色氨酸在肠道微生物的作用下可以生成5-羟色胺、吲哚化合物和犬尿氨酸等代谢物。而色氨酸及其代谢物可能通过肠脑轴参与dNCR的发生过程[14]。肠道中的色氨酸95%可转换成犬尿氨酸,犬尿氨酸与认知功能障碍的改善呈正相关,它可以通过激活N-甲基-D-天冬氨酸受体和谷氨酰胺神经传递来调节神经可塑性[15-16]。另一种代谢物是5-羟色胺,作为中枢神经发育的关键调节剂,它可能通过防止线粒体和突触损伤来调节认知功能[17-18]。此外,5-羟色胺经过转化后还可以产生褪黑素。虽然在本实验中发现差异性物质溶血磷脂酰胆碱(lysphosphatidylcholine,LC),但是目前的研究对于LC在认知功能的影响结果并不一致,这也成为本团队今后重点关注的研究方向。
在麻醉/手术后,可以诱导海马中小胶质细胞激活,从而对神经炎症起促进作用。有研究认为外周炎症的变化可能影响中枢神经系统,从而影响神经炎症[19]。在本研究中海马和血清中都观察到了麻醉/手术组中IL-1β、IL-6、TNF-α炎性因子的升高,因此正是印证这个假说。ZO-1蛋白参与了黏膜屏障完整性,在本研究中观察到菌群移植后对麻醉/手术引起的肠道炎性黏膜恢复有重要作用。S-100β在神经胶质细胞中分布,可以敏感的提示胶质细胞的炎症反应,而NSE可以作为神经损伤的标志物,当脑损伤时血脑屏障通透性增加[20]。而海马区的透射电镜可以进一步证实菌群移植还减轻了脑损伤,改善了认知功能。
本实验研究存在一定问题需要进行后续研究。首先本实验虽然发现了代谢产物LC,但是还不能确定其对认知的影响。其次,进一步的研究需要确定肠道菌群和代谢产物之间的关系。最后实验对象为成年的小鼠,因此研究结果在老年中是否有其他的变化,这也需要进一步研究。
综上所述,肠道菌群及代谢产物的失调以及炎性反应可能是dNCR发生发展的重要机制,而FMT可能通过这个机制能够改善麻醉/手术后小鼠的认知功能。本研究为dNCR的治疗提供了一个新的思路,但是仍需要进一步的验证。
参考文献
[1] Jiang XL,Gu XY,Zhou XX,et al. Intestinal dysbacteriosis medi‐ates the reference memory deficit induced by anaesthesia/surgery in aged mice[J]. Brain Behav Immun,2019,80:605-615.
[2] Lian XR,Zhu QM,Sun L,et al. Effect of anesthesia/surgery on gut microbiota and fecal metabolites and their relationship with cognitive dysfunction[J]. Front Syst Neurosci,2021,15:655695.
[3] Jang JH,Yeom MJ,Ahn S,et al. Acupuncture inhibits neuroinflam‐mation and gut microbial dysbiosis in a mouse model of Parkinson’s dis‐ease[J]. Brain Behav Immun,2020,89:641-655.
[4] Zhan GF,Hua DY,Huang NN,et al. Anesthesia and surgery in‐duce cognitive dysfunction in elderly male mice:the role of gut micro‐biota[J]. Aging,2019,11(6):1778-1790.
[5] 王 辉,曹永孝,聂会勇,等. 选择性神经损伤模型所致神经病理性疼痛对小鼠肠道菌群多样性的影响[J]. 西安交通大学学报(医学版),2023,44(4):549-556. Wang H,Cao YX,Nie HY,et al. Effects of neuropathic pain induced by selective nerve injury model on intestinal microflora diversity in mice[J]. J Xi’an Jiaotong Univ Med Sci,2023,44(4):549-556.
[6] Zhao L,Luo L,Jia WK,et al. Serum diamine oxidase as a hemor‐rhagic shock biomarker in a rabbit model[J]. PLoS One,2014,9(8):e102285.
[7] Thackray VG. Sex,microbes,and polycystic ovary syndrome[J]. Trends Endocrinol Metab,2019,30(1):54-65.
[8] Wang CM,Chen WC,Zhang Y,et al. Update on the mechanism and treatment of sevoflurane-induced postoperative cognitive dysfunc‐tion[J]. Front Aging Neurosci,2021,13:702231.
[9] Camara-Lemarroy CR,Metz L,Meddings JB,et al. The intestinal barrier in multiple sclerosis:implications for pathophysiology and thera‐peutics[J]. Brain,2018,141(7):1900-1916.
[10] He C,Huang ZS,Yu CC,et al. Preventive electroacupuncture ameliorates D-galactose-induced Alzheimer’s disease-like inflamma‐ tion and memory deficits,probably via modulating the microbiota-gutbrain axis[J]. Iran J Basic Med Sci,2021,24(3):341-348.
[11] Wang S,Huang XF,Zhang P,et al. Chronic Rhein treatment im‐proves recognition memory in high-fat diet-induced obese male mice[J]. J Nutr Biochem,2016,36:42-50.
[12] Gorecki AM,Preskey L,Bakeberg MC,et al. Altered gut microbi‐ome in Parkinson’s disease and the influence of lipopolysaccharide in a human α-synuclein over-expressing mouse model[J]. Front Neurosci,2019,13:839.
[13] Sampson TR,Debelius JW,Thron T,et al. Gut microbiota regu‐late motor deficits and neuroinflammation in a model of Parkinson’s dis‐ease[J]. Cell,2016,167(6):1469-1480.
[14] Bosi A,Banfi D,Bistoletti M,et al. Tryptophan metabolites along the microbiota-gut-brain axis:an interKingdom communication system influencing the gut in health and disease[J]. Int J Tryptophan Res,2020,13:1178646920928984.
[15] Heilman PL,Wang EW,Lewis MM,et al. Tryptophan metabolites are associated with symptoms and nigral pathology in Parkinson’s dis‐ease[J]. Mov Disord,2020,35(11):2028-2037.
[16] Schwarcz R,Stone TW. The kynurenine pathway and the brain:challenges,controversies and promises[J]. Neuropharmacology,2017,112(Pt B):237-247.
[17] Israelyan N,Margolis KG. Reprint of:Serotonin as a link between the gut-brain-microbiome axis in autism spectrum disorders[J]. Pharma‐col Res,2019,140:115-120.
[18] Chen R,Davis LK,Guter S,et al. Leveraging blood serotonin as an endophenotype to identify de novo and rare variants involved in au‐tism[J]. Mol Autism,2017,8:14.
[19] 秦晓宇,张斌森,张笑佳,等. 电针对术后认知功能障碍模型大鼠炎症反应和铁死亡影响的研究[J]. 中国全科医学,2024,27(6):723-732.
Qin XY,Zhang BS,Zhang XJ,et al. Effect of electroacupuncture on in‐flammation response and ferroptosis in rats modeling postoperative cog‐nitive dysfunction[J]. Chin Gen Pract,2024,27(6):723-732.
[20] Isgrò MA,Bottoni P,Scatena R. Neuron-specific enolase as a bio‐marker:biochemical and clinical aspects[J]. Adv Exp Med Biol,2015,867:125-143.
(责任编辑:李青颖)
本文引用格式:
唐 璐,张斌森,张笑佳,等. 菌群移植对神经认知恢复延迟小鼠炎症反应以及菌群和代谢产物的研究[J]. 重庆医科大学学报,2025,50(1):44-51.

