黄芪种子小蜂气味结合蛋白基因的鉴定及表达分析


摘要
气味结合蛋白(odorant-binding proteins, OBPs)在黄芪种子小蜂 Bruchophagus huonchili Liao et Fan 识别并为害中药材黄芪种子的过程中发挥着重要作用。为探明黄芪种子小蜂的嗅觉识别机理, 本研究建立了黄芪种子小蜂成虫触角转录组数据库, 挖掘和鉴定嗅觉识别相关的气味结合蛋白基因。采用Illumina HiSeq平台对黄芪种子小蜂成虫触角转录组进行分析, 在COG、GO、KEGG、KOG、Pfam、Swissprot、TrEMBL、eggNOG、Nr等公共数据库进行基因功能注释, 根据注释信息筛选黄芪种子小蜂OBP基因;利用DNAMAN和MEGA 11.0软件分析OBP基因结构特点及进化关系;通过RT-qPCR技术检测黄芪种子小蜂雌、雄成虫触角中OBP基因的表达量及被不同挥发物诱导后的表达量。结果显示, 从黄芪种子小蜂成虫触角转录组中共获得98 655条unigenes, 其中54 670条unigenes 在公共数据库被注释到, 从注释结果中筛选到25个BhuoOBPs, 序列比对结果显示, 除BhuoOBP14、BhuoOBP19外, 其余 23个BhuoOBPs均包含6个保守的半胱氨酸残基, 属于classic OBPs。系统进化树分析表明, 大部分BhuoOBPs与丽蝇蛹集金小蜂Nasonia vitripennis、白蛾周氏啮小蜂Chouioia cunea、丽蚜小蜂Encarsia formosa、松毛虫赤眼蜂Trichogramma dendrolimi等小蜂总科昆虫的OBPs氨基酸序列聚到一起, 表明它们之间亲缘关系较近。RT-qPCR结果显示, 在10 μg/μL的引诱剂罗勒烯诱导下, 雌虫触角中BhuoOBP18和雄虫触角中BhuoOBP21表达上调最显著, 分别为对照的147.4 倍和615.6倍;在100 μg/μL的驱避剂4-萜烯醇诱导下, 雌虫触角中BhuoOBP22和雄虫触角中BhuoOBP10上调最显著, 分别为对照的742.4倍和1 684.4倍。本研究建立了黄芪种子小蜂成虫触角转录组数据库, 鉴定并分析了BhuoOBPs 基因在不同挥发物诱导下触角中的表达量, 为进一步研究黄芪种子小蜂嗅觉识别机制提供了理论基础。
关键词
黄芪种子小蜂;" 转录组测序;" 气味结合蛋白;" 触角;" RT-qPCR
中图分类号:
S 433
文献标识码:" A
DOI:" 10.16688/j.zwbh.2024049
收稿日期:" 20240125""" 修订日期:" 20240218
基金项目:
财政部和农业农村部:国家现代农业产业技术体系建设专项(CARS-21)
致" 谢:" 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
* 通信作者
E-mail:
zxh6288@126.com
#
为并列第一作者
Identification and expression analysis of odorant-binding protein gene in adult Bruchophagus huonchili (Hymenoptera: Eurytomidae)
KANG Jie1," XUE Zhaozhuo1," SHI Wenli1," ZHENG Haixia1," NIU Yanbing2," ZHANG Xianhong1*
(1. College of Plant Protection, Shanxi Agricultural University, Taigu" 030801, China; 2. College of Life
Sciences, Shanxi Agricultural University, Taigu" 030801, China)
Abstract
Odorant-binding proteins (OBPs) play a crucial role in the recognition and infestation of Bruchophagus huonchili Liao et Fan to Astragalus membranaceus. To investigate the olfactory recognition mechanism, an adult antennal transcriptome database of B.huonchili was established, and OBP genes were mined and identified. Transcriptome analysis was performed using the Illumina HiSeq platform, and gene annotations were performed across multiple public databases, including COG, GO, KEGG, KOG, Pfam, Swissprot, TrEMBL, eggNOG, and Nr. OBP gene structural characteristics and evolutionary relationships were analyzed using DNAMAN and MEGA 11.0 software, while RT-qPCR was used to assess the expression of OBP genes in the antennae of female and male adult wasps and its response to different volatile inductions. A total of 98 655 unigenes were obtained from the transcriptome, with 54 670 unigenes annotated in the public databases. Among the 25 identified BhuoOBPs, all except BhuoOBP14 and BhuoOBP19 contained six conserved cysteine residues, belong to classic OBPs. Phylogenetic analysis indicated that most BhuoOBPs clustered with OBPs from other Chalcidoidea insects, such as Nasonia vitripennis, Chouioia cunea, Encarsia formosa, and Trichogramma dendrolimi, indicating that they are closely related to each other. RT-qPCR results showed significant upregulation of BhuoOBP18 in female and BhuoOBP21 in male antennae by 147.4-fold and 615.6-fold, respectively, under 10 μg/μL ocimene induction. Under 100 μg/μL terpinen-4-ol induction, BhuoOBP22 in female and BhuoOBP10 in male antennae were most significantly up-regulated, reaching 742.4-fold and 1 684.4-fold, respectively. This study provides a theoretical basis for further exploration of the olfactory recognition mechanism in B.huonchili.
Key words
Bruchophagus huonchili;" transcriptome sequencing;" odorant-binding protein;" antenna;" RT-qPCR
黄芪种子小蜂 Bruchophagus huonchili Liao et Fan属膜翅目 Hymenoptera 广肩蜂科 Eurytomidae 种子广肩小蜂属 Bruchophagus,是为害中药材黄芪种子的单食性害虫[1],广泛分布于我国北方黄芪各产区[2]。当黄芪种子处于鼓粒期时,雌成虫将卵产于豆荚内的种皮下,幼虫在种子内孵化后开始蛀食为害并化蛹[34]。近年来,随着中药材黄芪产业在山西等省的种植区快速发展,黄芪种子小蜂的发生与为害呈现日趋严重的态势。调查表明,包括黄芪种子小蜂在内的黄芪籽蜂对黄芪的
一般为
害率为30%~50%,严重时可高达60%以上,对中药材黄芪种子的产量和品质构成了严重的威胁,并对黄芪产业的可持续发展造成了一定的影响[5]。
嗅觉在昆虫与外界信息交流中发挥重要作用,是昆虫寄主选择、寻找配偶、躲避不利环境等行为活动的基础[69]。昆虫对气味分子的识别过程包括:亲脂性气味分子通过触角表面感受器上的微孔进入淋巴液,与其中的气味结合蛋白(odorant binding protein, OBP)特异性结合形成OBP-气味分子复合物,
复合物被运送至嗅觉神经元膜上的
气味受体(odorant receptor, OR)并使之激活,化学信号被转化为电信号,形成神经冲动,从而指导昆虫作出相应的嗅觉反应[1012]。其中,OBPs特异性识别化学物质的过程被认为是气味分子影响昆虫行为活动的第一步,更是决定昆虫能否对气味分子作出响应的关键蛋白[1314]。根据保守半胱氨酸(Cys)残基的数量,OBP可以分为至少5种类型:典型的OBPs(classic OBPs, C1-Xn-C2-X3-C3-Xn-C4-Xn-C5-X8-C6)、minus-C OBPs (C1-Xn-X3-C3-Xn-C4-Xn-X8-C6)、plus-C OBPs (C1-Xn-C2-X3-C3-Xn-C4-Xn-C4a-X9-C5-X8-C6-P-Xn-C6a-Xn)、二聚体OBPs(dimer OBPs,有2个保守的6个Cys位点)、非典型OBPs (atypical OBPs,具有9~10个Cys和较长的C-末端)[15]。
近年来,有关昆虫OBP的分子特性、结构和功能及对植物挥发物的识别机理的研究不断深入[1617]。He等[18]在丽蚜小蜂 Encarsia formosa 转录组数据库中鉴定出39个OBP基因并构建了组织表达谱, 为进一步研究丽蚜小蜂EforOBPs 的功能以及EforOBPs与寄主的相互作用提供了分子基础;Zhang等[19]通过分析淡足侧沟茧蜂 Microplitis pallidipes OBP基因的组织表达谱, 发现MpOBP2和MpPBP主要在雌成虫触角中表达, 推测这2个基因可能是识别寄主挥发物的关键基因;而MpOBP3、MpOBP8和MpOBP10主要在雄成虫触角中表达, 可能是检测性信息素的关键基因, 这些发现为OBP在寄生蜂甚至其他昆虫中的功能提供了重要的研究基础。与其他昆虫相比, 黄芪种子小蜂的寄主植物单一, 除黄芪外并未发现其他寄主, 且1头幼虫仅危害1粒种子, 前期研究发现1粒种子被2头幼虫同时寄生的概率仅为1/4 000(未发表)。黄芪种子小蜂成虫是如何精准定位到黄芪豆荚进行产卵, 其嗅觉识别机制如何目前还未见报道。为此, 本研究构建了黄芪种子小蜂成虫触角转录组数据库, 从中筛选鉴定出OBP基因进行生物信息学分析, 并通过实时荧光定量PCR分析BhuoOBPs在不同植物挥发物诱导前后的表达量, 旨在为黄芪种子小蜂专一识别寄主植物的嗅觉机理奠定基础。
1" 材料与方法
1.1" 供试材料
2022年6月下旬-7月上旬, 于山西省介休市绵山镇兴地村黄芪田(111.95°E, 36.88°N)采集处于鼓粒期的黄芪豆荚, 带回实验室置于温度(30±2)℃、光照周期L∥D=14 h∥10 h、相对湿度(55±5)%的人工气候箱中。待被害豆荚内的成虫羽化后, 选择触角完整、活跃的1~2日龄成虫进行转录组测序和OBP基因的表达分析。
1.2" 方法
1.2.1" 总RNA的提取与质量检测
分别挑选羽化1~2 d活跃的黄芪种子小蜂雌、雄成虫各30头,收集触角,
使用微量总RNA提取试剂盒(简石生物)提取触角总RNA, 3次生物学重复。
1%琼脂糖凝胶电泳检测是否存在RNA降解和DNA污染;利用超微分光光度计和荧光分光光度计分别检测RNA的纯度、浓度,
选取OD260/OD280在1.8~2.2之间的RNA样品备用。
1.2.2" cDNA 文库构建与测序
取1 μg检测合格的RNA样品, 使用NEBNext UltraTM RNA Library Prep Kit构建cDNA文库。具体方法: 首先用带有Oligo(dT)的磁珠富集mRNA, 在Buffer中将mRNA随机打成短片段, 以短片段mRNA为模板、使用随机寡核苷酸引物在M-MuLV逆转录酶体系中合成 cDNA 第一链。之后加入dNTPs、RNaseH、缓冲液与 DNA polymeraseⅠ合成 cDNA第二链。纯化双链 cDNA并进行黏性末端修复, 在cDNA的3′末端加上碱基A并连接测序接头。再用AMPureXP系统 (Beckman Coulter, Beverly, USA)筛选250~300 bp的cDNA, 采用Phusion高保真DNA聚合酶、通用PCR引物和Index (X)引物进行扩增。最后用AMPure XP系统对PCR产物进行纯化, 并运用Agilent 2100 Bioanalyzer (安捷伦科技, 美国)系统对其进行质量评估。基于边合成边测序(sequencing by synthesis, SBS)技术, 在 Illumina Hiseq 2000高通量测序平台对cDNA文库进行测序。cDNA文库构建及测序由北京百迈客生物科技有限公司完成。
1.2.3" 触角转录组测序数据组装与分析
首先对原始测序数据(raw data)进行过滤,去掉reads中的测序接头和引物序列, 将不确定碱基比率超过10%的reads和低质量的reads过滤出去, 得到高质量的测序数据(clean data)。然后计算clean data的 Q30、Q20和GC含量以及重复序列水平。采用Trinity系统对clean reads进行拼接, 从而获得高质量的unigenes。使用 BLAST软件, 将黄芪种子小蜂成虫触角的unigenes序列与 COG、GO、KEGG、KOG、Pfam、Swissprot、TrEMBL、eggNOG、Nr数据库进行比对, 应用KOBAS 2.0软件对获得的unigenes进行KEGG富集和注释。使用HMMER软件预测unigenes的氨基酸序列, 然后与Pfam数据库进行比对,获得unigenes的注释信息。
1.2.4" 黄芪种子小蜂触角OBP的鉴定及生物信息学分析
将上述测序完成的黄芪种子小蜂触角转录组信息, 结合从NCBI Identical Protein Groups数据库中下载的其他昆虫OBP序列进行本地BLAST比对,根据模式特征来判断所得序列是否为OBP基因, 最后通过BLASTx和BLASTn软件进行人工检验。对鉴定到的OBP基因进行开放阅读框预测(http:∥www. ncbi. nlm. nih. gov/gorf/gorf.html), 并将核苷酸序列翻译为蛋白序列;利用在线网站ExPASy(https:∥web.expasy.org/protparam/)预测蛋白的理化性质;运用SignalP4.1Server (http:∥www.cbs.dtu.dk/services/SignalP-4.1/)在线工具对信号肽进行预测。用 DNAMAN 6.0软件进行氨基酸序列比对[20];应用MEGA 11.0软件的邻接法(1 000次重复)构建黄芪种子小蜂与其他膜翅目昆虫OBP氨基酸序列的系统发育进化树[2122]。
1.2.5" 黄芪种子小蜂OBP基因在触角中的表达分析
取质量合格的总RNA 1 μg, 采用HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)合成cDNA,具体操作步骤参照试剂盒说明书。雌、雄各3个生物学重复, 每个生物学重复包含30头成虫的触角。利用Primer Premier 5.0软件设计黄芪种子小蜂25个OBP基因的qPCR引物, 以β-actin为内参基因(表1)。RT-qPCR在安捷伦Mx3000P实时荧光定量PCR 仪上进行, 反应体系(20 μL): 2×ChamQ Universal SYBR qPCR Master Mix 10 μL, 上、下游引物各0.4 μL, cDNA 模板0.8 μL, ddH2O补足至20 μL。qPCR反应程序: 95℃ 30 s;95℃ 10 s, 60℃ 30 s, 40个循环;95℃ 15 s, 60℃ 60 s, 95℃ 15 s。
1.2.6" 黄芪种子小蜂成虫触角OBP基因被不同挥发物刺激后表达量分析
使用实验室前期筛选出的具有引诱效果的10 μg/μL罗勒烯(上海麦克林生化科技有限公司)和具有驱避效果的100 μg/μL 4-萜烯醇(上海阿拉丁生化科技股份有限公司), 分别刺激黄芪种子小蜂成虫20 min后取样, 以石蜡油[生工生物工程(上海)股份有限公司]做对照。雌、雄各3个生物学重复, 每个生物学重复包含30头成虫的触角。具体步骤参见 1.2.5。
1.2.7" 数据分析
采用2-ΔΔCT法分析基因表达量数据, 用 SPSS 25.0 软件进行单因素方差分析, 用 GraphPad Prism 9.5.1 软件绘图。
2" 结果与分析
2.1" 黄芪种子小蜂成虫触角转录组序列组装与分析
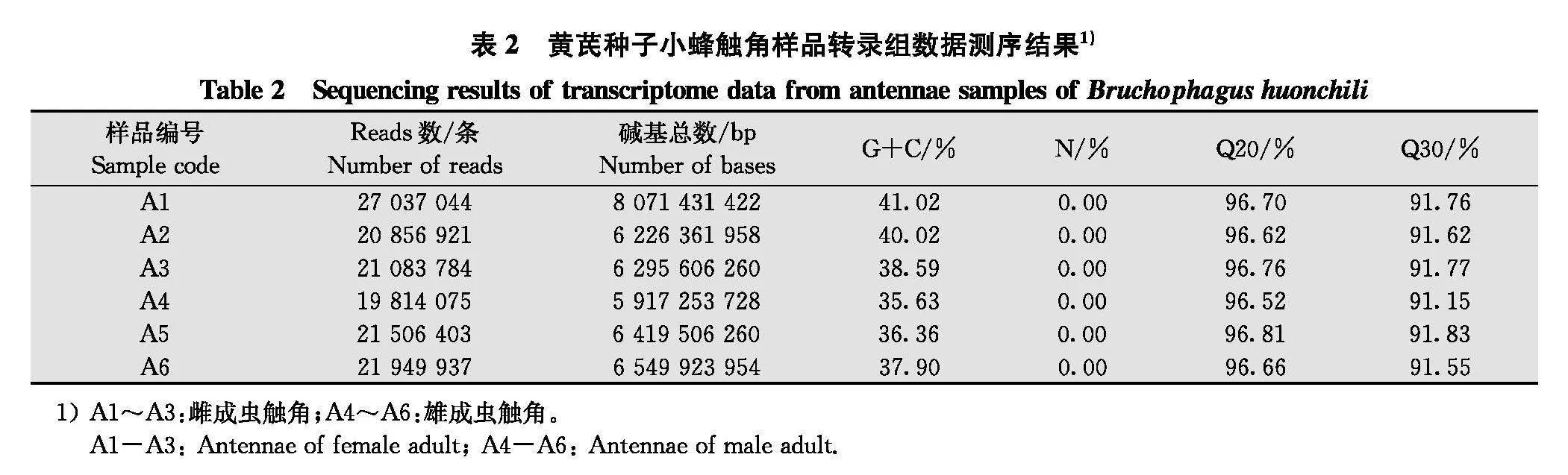
黄芪种子小蜂成虫触角的转录组测序结果如表2所示。6个样品筛选后总碱基数基本在5~9 Gb之间, GC含量分别为41.02%、40.02%、38.59%、35.63%、36.36%、37.90%, N碱基均为0.00, Q20均大于96%, Q30均大于91%。表明本次测序数据质量好,置信度高, 可用于后续数据分析。clean reads在Trinity软件上进行拼接组装, 共得到转录本(transcript) 167 209条, 平均长度为1 447 bp, N50长度值为3 200;unigenes 98 655条, 平均长度为775 bp, N50长度值为1 493。说明样品的组装完整性良好, 可用于后续分析。
2.2" 黄芪种子小蜂成虫触角转录组基因功能注释
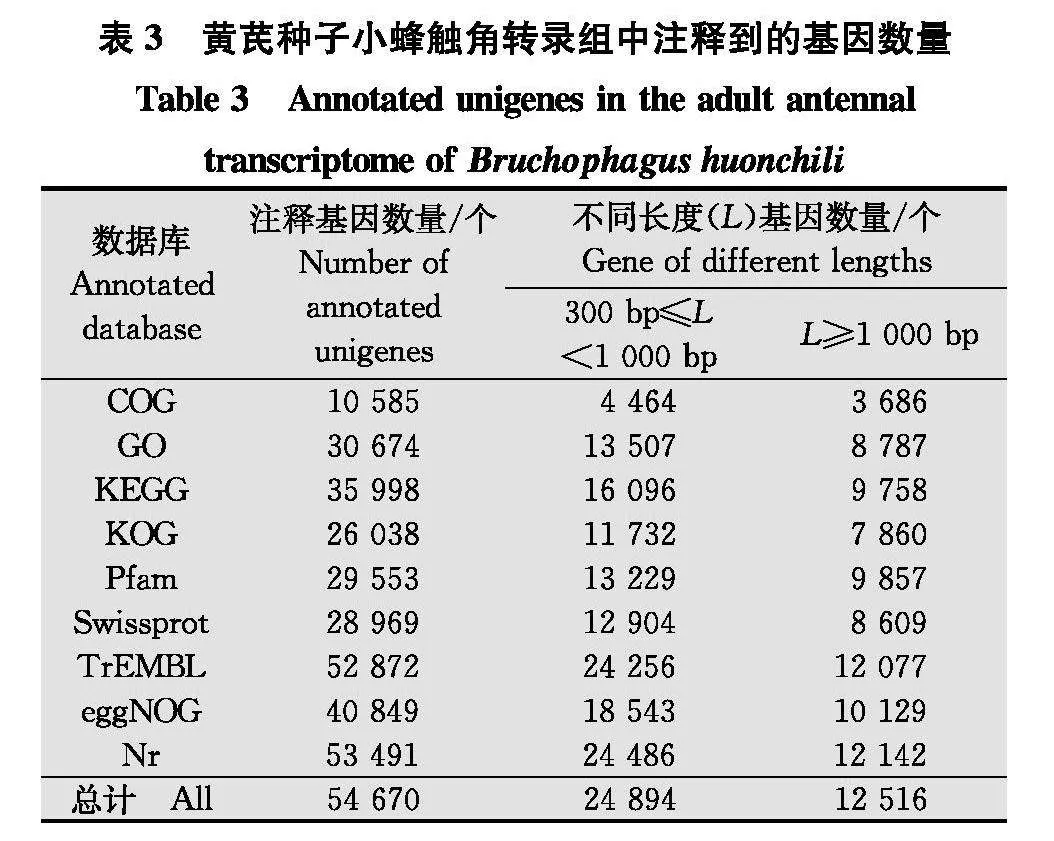
黄芪种子小蜂成虫触角unigenes序列通过 BLAST 软件(E≤10-5)与各大数据库进行比对,在Nr、TrEMBL、COG、GO、KEGG、KOG、Pfam、Swissprot 和 eggNOG 数据库中分别注释到53 491、52 872、10 585、30 674、35 998、26 038、29 553、28 969和40 849条unigenes(表3)。
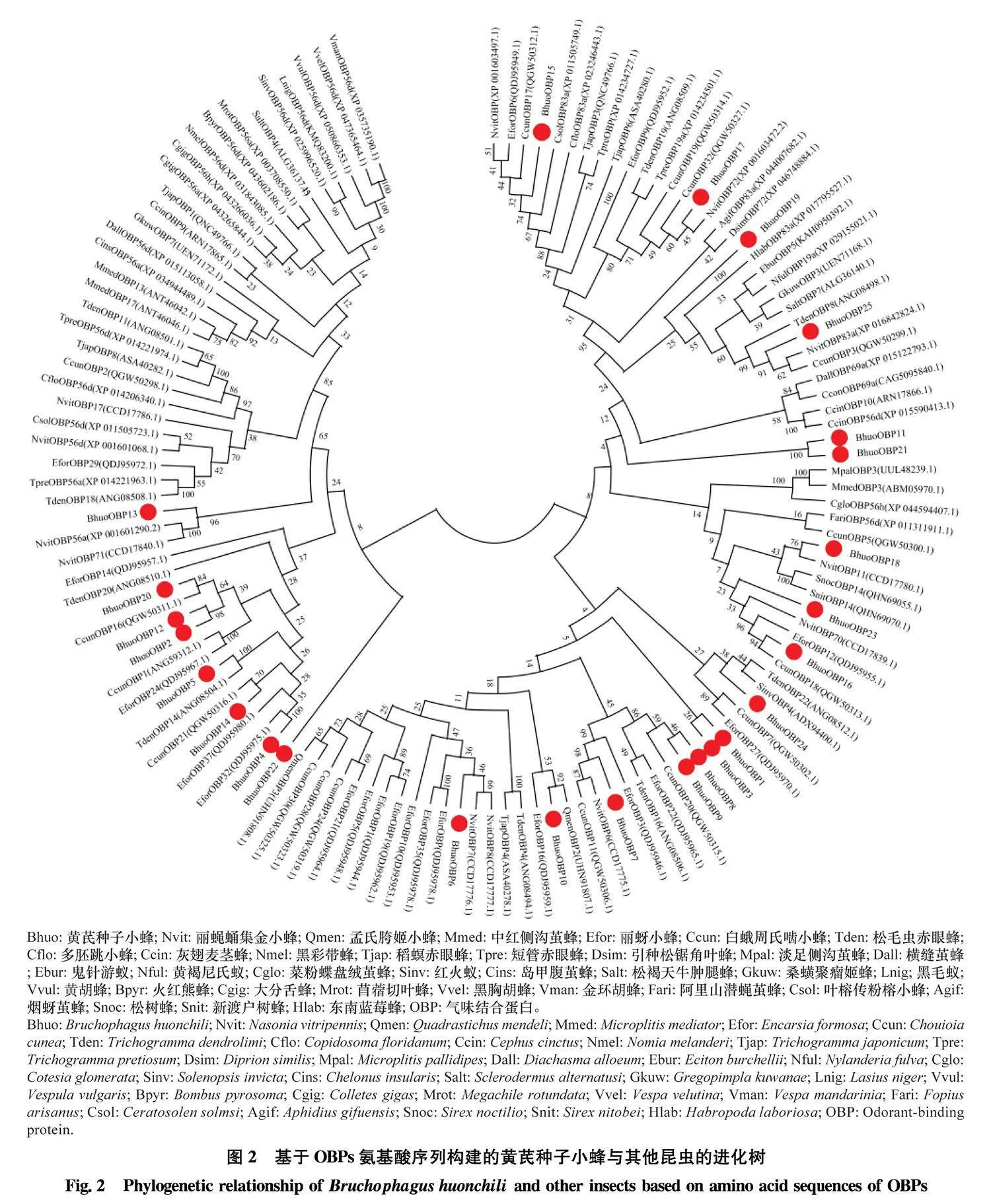
2.3" 黄芪种子小蜂触角 OBP 的鉴定及系统进化分析
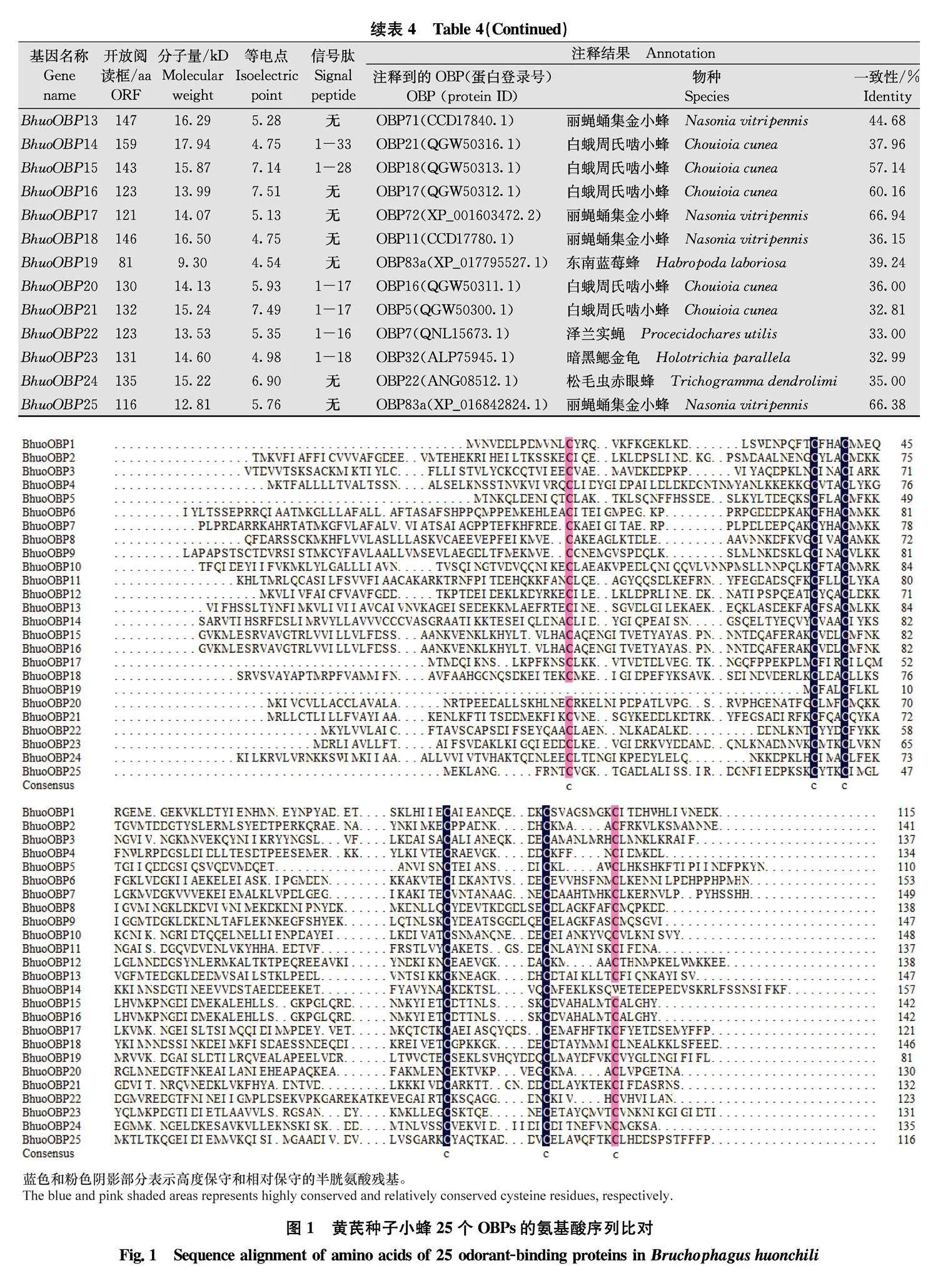
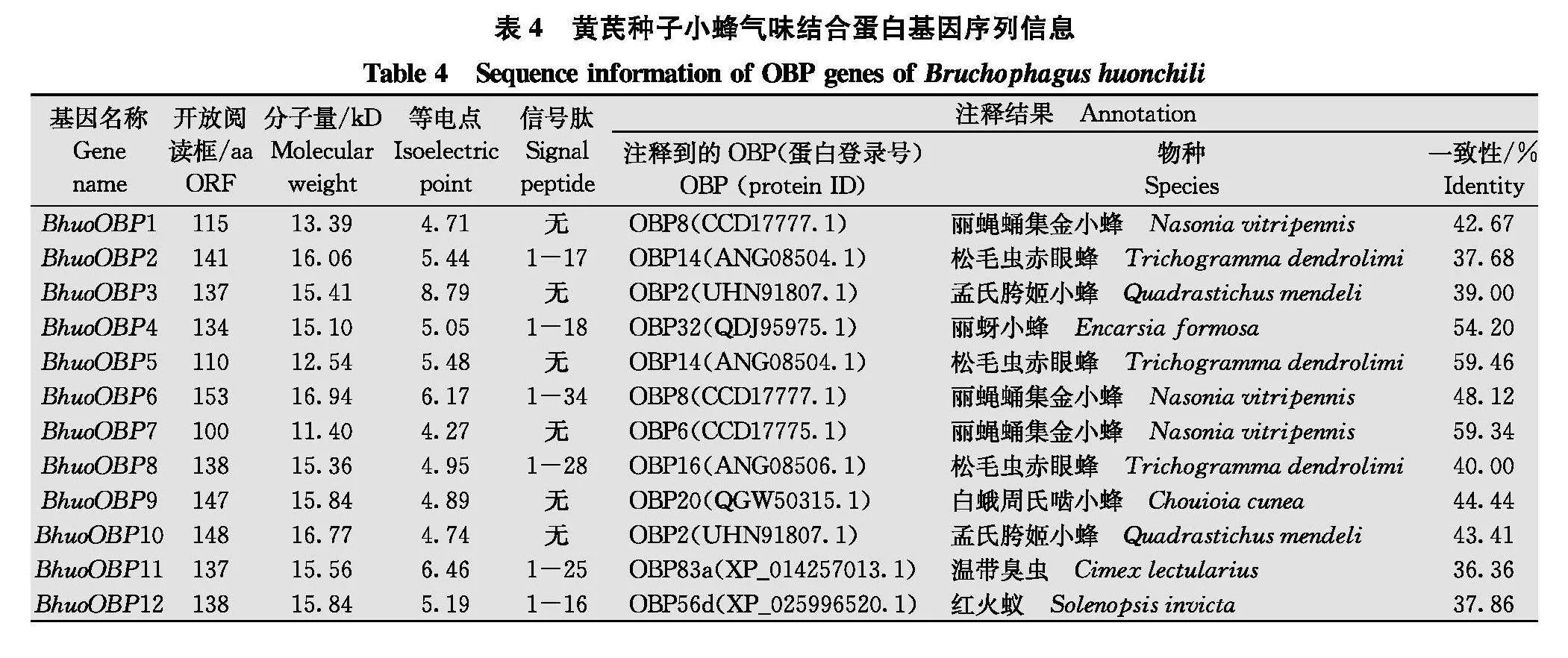
黄芪种子小蜂触角中共鉴定得到25个OBP, 依次命名为BhuoOBP1~BhuoOBP25, 开放阅读框编码的氨基酸长度均介于81~159 aa之间, 12 个 BhuoOBPs具有信号肽(表4)。通过氨基酸序列比对, 除BhuoOBP14缺少第6个半胱氨酸位点、BhuoOBP19 缺少第1个半胱氨酸位点外, 其余BhuoOBPs均含有6个保守的半胱氨酸位点, 符合classic OBPs的结构特征(图1)。将鉴定到的25个OBP与NCBI其他膜翅目昆虫OBP的氨基酸序列进行系统发育分析, 结果显示, 所有序列聚为两大分支, 其中BhuoOBP1和BhuoOBP3, BhuoOBP2 和 BhuoOBP12, BhuoOBP8和BhuoOBP9、BhuoOBP11 和BhuoOBP21亲缘关系最近。大部分OBP都与小蜂总科的OBP聚类到一起, 其中BhuoOBP6、BhuoOBP13、BhuoOBP17和BhuoOBP18与丽蝇蛹集金小蜂Nasonia vitripennis的OBP聚类到一起;BhuoOBP9、BhuoOBP14、BhuoOBP16和BhuoOBP20与白蛾周氏啮小蜂Chouioia cunea的OBP聚类到一起;BhuoOBP4与丽蚜小蜂Encarsia formosa的OBP聚类到一起;BhuoOBP5和BhuoOBP24与松毛虫赤眼蜂Trichogramma dendrolimi的OBP聚类到一起;BhuoOBP10与孟氏胯姬小蜂Quadrastichus mendeli的OBP聚类到一起;BhuoOBP7、 BhuoOBP25分别与丽蝇蛹集金小蜂和白蛾周氏啮小蜂的OBP聚为一小支(图2)。
2.4" 黄芪种子小蜂OBP基因在触角中的表达分析
BhuoOBPs 在黄芪种子小蜂触角中的表达情况如图3所示, 共鉴定到 25 个OBP基因, 其中 BhuoOBP1、BhuoOBP5、BhuoOBP7、BhuoOBP10、BhuoOBP13、BhuoOBP16、BhuoOBP18、BhuoOBP19、BhuoOBP24和BhuoOBP25在雄虫触角的表达量高于雌虫触角,而BhuoOBP8和BhuoOBP21在雄虫触角中的表达量比雌虫触角低。
2.5" 不同植物挥发物诱导后BhuoOBPs在触角中的表达分析
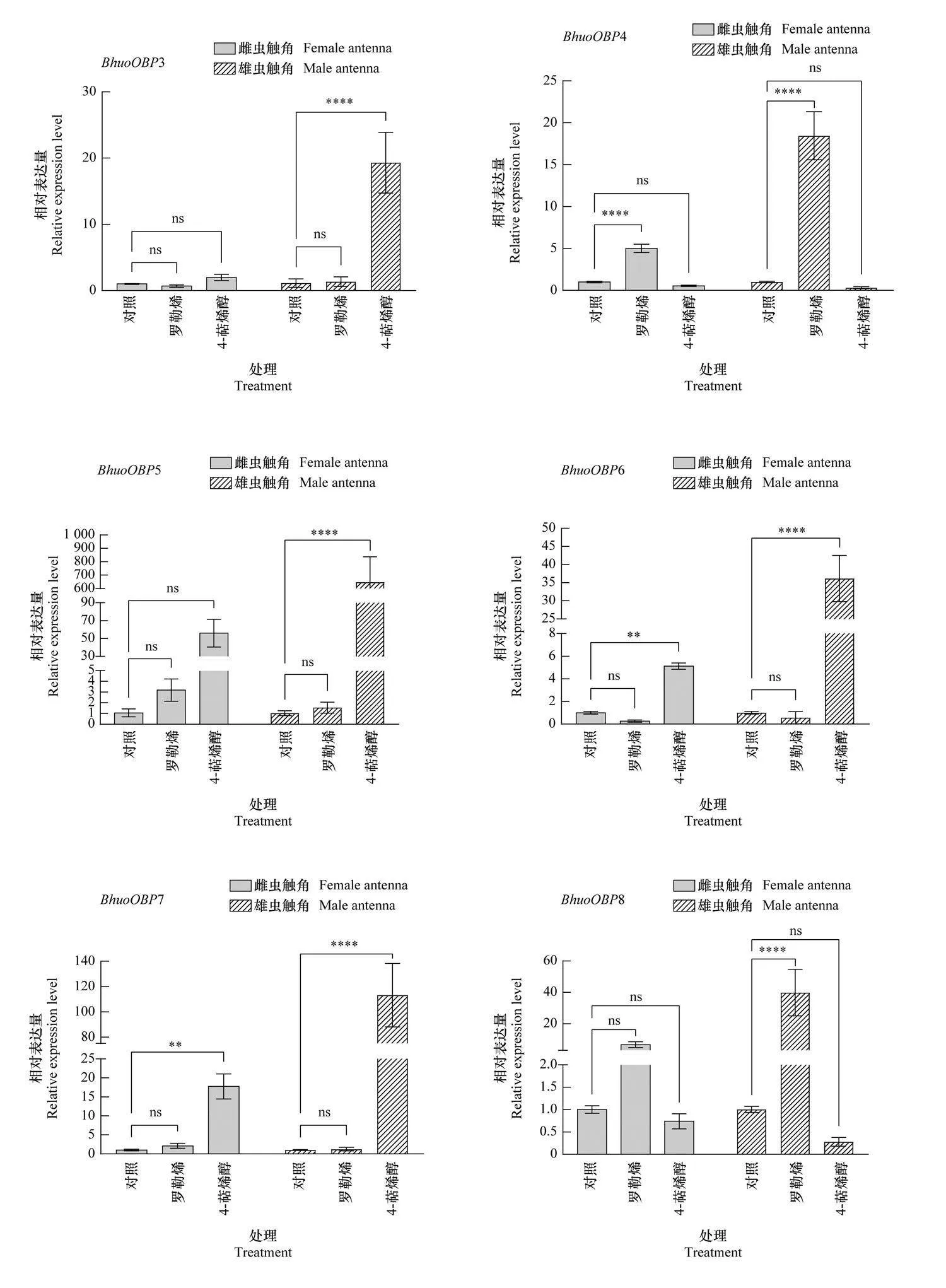
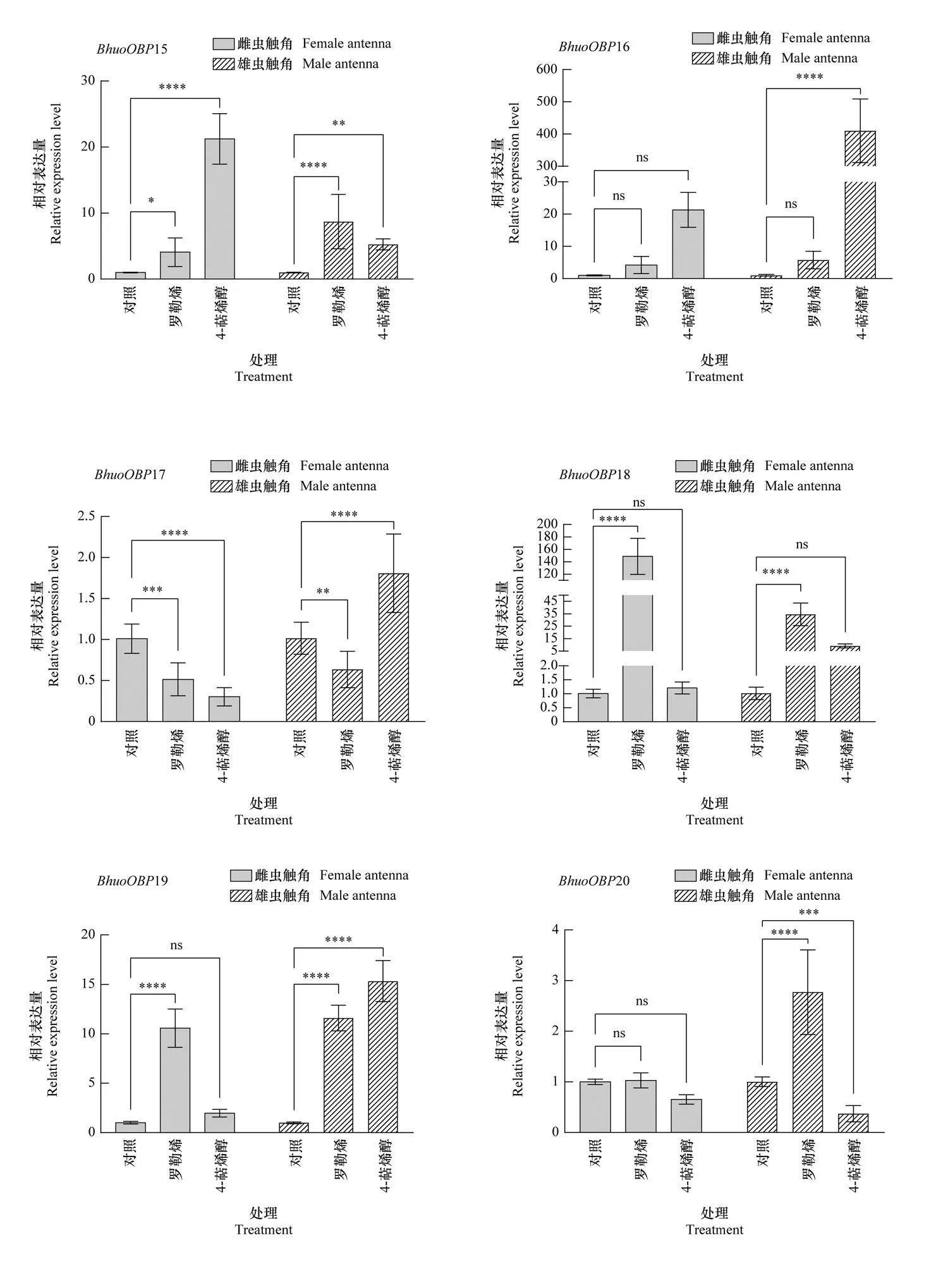
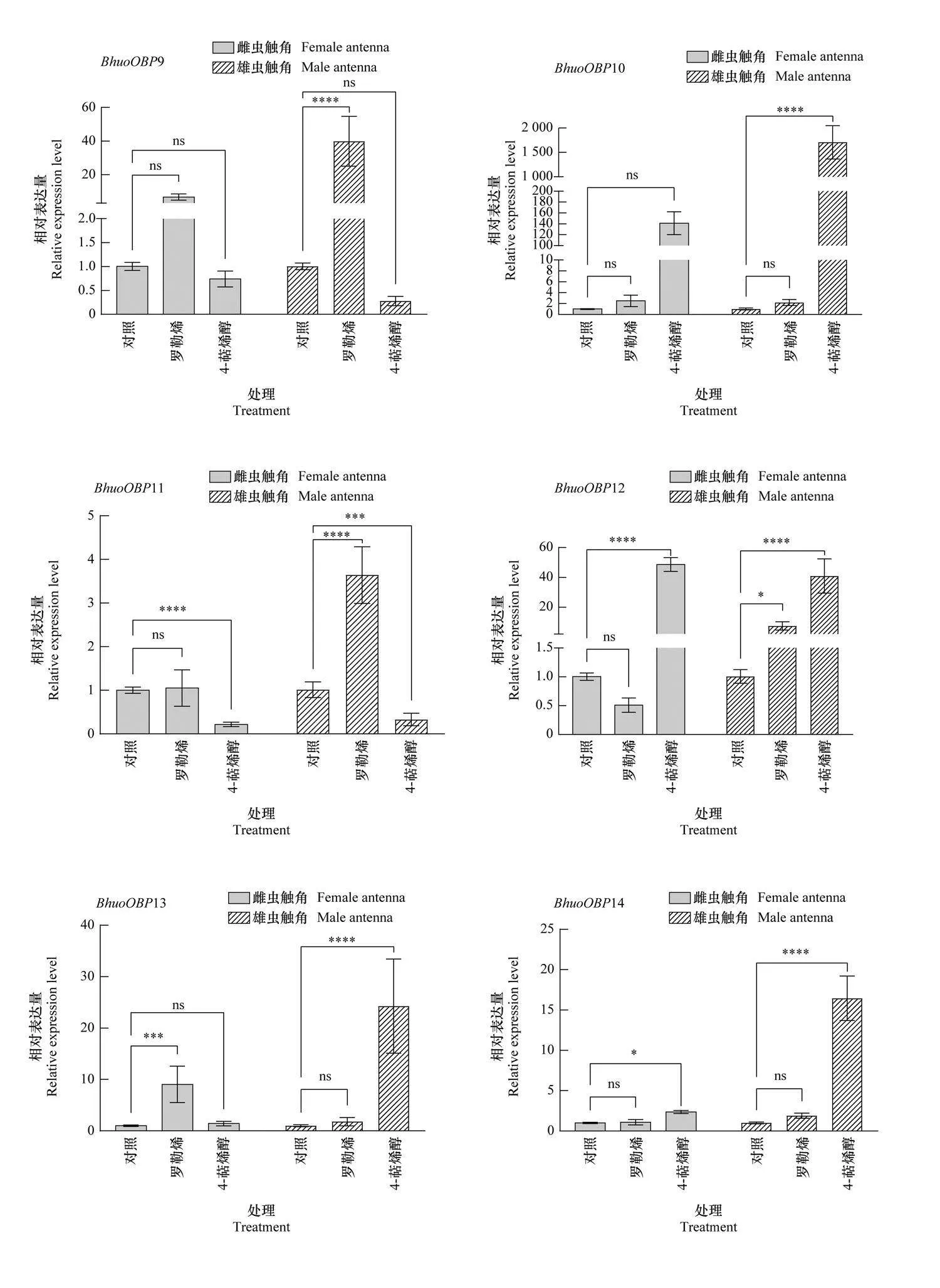
不同挥发物诱导后, 黄芪种子小蜂触角中OBP基因的表达如图4所示。引诱物10 μg/μL 罗勒烯的诱导下, 雌虫触角中有7个BhuoOBPs的相对表达量显著上调, 其中BhuoOBP18的上调倍数最大, 为对照的147.4倍(Plt;0.000 1), 其他上调倍数均较小, 雄虫触角中14个 BhuoOBPs的相对表达量显著上调, 其中BhuoOBP21的上调倍数最大, 为对照的615.6倍(Plt;0.000 1);驱避物100 μg/μL 4-萜烯醇的诱导下, 雌虫触角中9个BhuoOBPs的表达量显著上调, 其中BhuoOBP22的表达量上调最显著, 为对照的742.4倍(Plt;0.000 1), 雄虫触角中18个BhuoOBPs的表达量显著上调, 其中BhuoOBP10上调倍数最大, 为对照的1 684.4倍, 其他依次为BhuoOBP22上调838.9倍、BhuoOBP5上调633.7倍、BhuoOBP25上调409.3倍、BhuoOBP16上调400.9倍、BhuoOBP9上调153.9倍、BhuoOBP7上调112.2倍, 其他上调倍数均较低。
3" 结论与讨论
本研究运用生物信息学方法从黄芪种子小蜂触角转录组数据库中鉴定出25个OBP基因, 与大多数膜翅目昆虫的OBP数量相当。例如, 白蛾周氏啮小蜂Chouioia cunea触角中鉴定到25个OBP基因[23], 短翅蚜小蜂Aphelinus asychis触角中鉴定到27个OBP基因[24], 中红侧沟茧蜂Microplitis mediator中鉴定到20个OBP基因[25], 短管赤眼蜂Trichogramma pretiosum中鉴定到22个OBP基因[26], 丽蚜小蜂Encarsia formosa触角中鉴定到39个OBP基因[18], 前裂长管茧蜂Diachasmimorpha longicaudata中鉴定到43个OBP基因[27]。在膜翅目昆虫中只有少数种类的OBP数量超过50个, 如在丽蝇蛹集金小蜂Nasonia vitripennis中鉴定到90个OBP基因[28]。这种数量上的差异可能是因为复杂的外界环境变化或基因功能的多样性造成的, 或是因为OBP基因不仅存在于触角中, 也存在于其他组织器官[29]。
本研究鉴定到的25个BhuoOBPs中23个含有6个保守的半胱氨酸(Cys)位点, 属于classic OBP家族, 这些保守的Cys残基可以形成6个a-螺旋结构域来限定疏水结合腔结构, 且保守Cys之间形成交联的二硫键可以稳固OBPs的三维结构并形成气味结合袋, 从而确保蛋白与外界气味分子的特异性结合[12,3031]。
基于OBPs氨基酸序列构建的系统进化树表明, 多数BhuoOBPs集中分布在两大支上, 说明黄芪种子小蜂BhuoOBPs在种内分化较小, 且大部分BhuoOBPs都与小蜂总科的丽蝇蛹集金小蜂、白蛾周氏啮小蜂、丽蚜小蜂、松毛虫赤眼蜂聚类到一起, 表明它们的进化程度相近, 可能具有相似的生理功能。
表达谱分析是研究基因功能的基础手段[32]。本研究采用实时荧光定量PCR 技术对 BhuoOBPs 在黄芪种子小蜂雌、雄成虫触角中的表达情况进行分析, 发现不同基因的相对表达量差异很大, 高表达的 BhuoOBPs 可能在识别寄主的过程中发挥着重要作用,且这些基因也存在性别偏向性表达的现象, 这可能是由于雌、雄黄芪种子小蜂成虫在整个种群生活中的分工不同, 使得不同性别在特定时期承担的角色不同, 也可能是由于这些基因除嗅觉功能外, 还能调节昆虫生长发育、免疫作用等[15]。陈聪[33]研究发现,香樟Cinnamomum camphora的挥发物活性组分樟脑(D(+)-camphor)可诱导香樟齿喙象Pagiophloeus tsushimanus雌、雄成虫的PtsuOBP7、PtsuOBP16、PtsuOBP24、PtsuOBP33与PtsuOBP39等5个基因的表达量上调, 推测这几个OBP是结合转运气味分子的关键OBP。张小凤[34]用4种寄主植物处理橘小实蝇 Bactrocera dorsalis, 均出现部分OBP基因显著上调表达的情况, 其中BdorOBP1和BdorOBP5在橘小实蝇雌虫头部显著表达, 推测这2个OBP在橘小实蝇雌虫选择产卵寄主的过程中发挥了重要作用。而本研究发现, 在具有引诱效果的寄主植物挥发物罗勒烯的诱导下, 黄芪种子小蜂雌虫触角中BhuoOBP18和雄虫触角中BhuoOBP21的表达量显著上调, 这2个OBP可能是黄芪种子小蜂识别寄主挥发物过程中的重要OBP。而在驱避物4-萜烯醇的诱导下, 雌虫触角中BhuoOBP22和雄虫触角中BhuoOBP10的表达量上调最显著。不同挥发物刺激后雌、雄虫OBP基因表达有所差异, 这可能与黄芪种子小蜂雌、雄成虫触角感器数量、种类有关。
被挥发物诱导后上调表达的BhuoOBPs可能在与寄主植物互作或者识别具有驱避效果的组分的过程中发挥重要作用。因此, 后期可以对这些基因进行克隆, 并运用荧光竞争结合、RNA干扰等试验对BhuoOBPs进行功能验证。本研究为进一步研究黄芪种子小蜂寄主定位、交配和产卵等重要生命活动的嗅觉分子机制奠定理论基础, 并为今后开展绿色防治工作提供了理论依据。
参考文献
[1]" 樊瑛, 杨春清, 吕秀茂. 黄芪籽蜂的研究[C]∥中国昆虫学会. 走向21世纪的中国昆虫学—中国昆虫学会2000年学术年会论文集. 北京: 中国科学技术出版社, 2000: 5.
[2]" 董田. 黄芪籽蜂植物源引诱剂配方筛选及有关感器的扫描电镜观察[D]. 太谷: 山西农业大学, 2022.
[3]" 董田, 康婕, 张昕, 等. 三种黄芪籽蜂雌成虫触角和产卵器感器的超微形态[J]. 应用昆虫学报, 2021, 58(6): 14331442.
[4]" ZHANG Chaoran, BAI Penghua, KANG Jie, et al. Deciphering the chemical fingerprint of Astragalus membranaceus: Volatile components attractive to Bruchophagus huonchili wasps [J/OL]. Insects, 2023, 14(10): 809. DOI:10.3390/insects14100809.
[5]" 师文丽, 康婕, 郝佳伟, 等. 山西省黄芪籽蜂的危害及田间发生规律[J]. 山西农业科学, 2024, 52(3): 123128.
[6]" WANG Shanning, PENG Yong, LU Ziyun, et al. Identification and expression analysis of putative chemosensory receptor genes in Microplitis mediator by antennal transcriptome screening [J]. International Journal of Biological Sciences, 2015, 11(7): 737751.
[7]" 郑海霞, 张耀文, 张仙红, 等.绿豆象触角转录组及嗅觉相关基因的分析[J]. 昆虫学报, 2018, 61(2): 168177.
[8]" 白鹏华, 王冰, 张仙红, 等. 昆虫气味受体的研究方法与进展[J]. 昆虫学报, 2022, 65(3): 364385.
[9]" 范广文, 桑育黎, 石磊, 等. 鞘翅目昆虫气味结合蛋白研究进展[J]. 天津农业科学, 2023, 29(5): 5160.
[10]HALLEM E A, DAHANUKAR A, CARLSON J R. Insect odor and taste receptors [J]. Annual Review of Entomology, 2006, 51: 113135.
[11]胡军, 付丽, 张彬, 等. 莲草直胸跳甲气味结合蛋白鉴定及其在触角中的表达分析[J]. 植物保护学报, 2019, 46(4): 849859.
[12]林亚平, 侯有明. 寄生蜂基于嗅觉信号识别的宿主定位及其机制的研究进展[J]. 昆虫学报, 2023, 66(4): 591608.
[13]吉帅帅, 庄翔麟, 刘乃勇. 灭字脊虎天牛触角转录组中气味结合蛋白基因的鉴定及表达谱分析[J]. 四川农业大学学报, 2018, 36(2): 193202.
[14]李凯旋, 李艳艳, 王树娟, 等. 桃小食心虫成虫期高表达气味结合蛋白基因的克隆与表达谱分析[J]. 昆虫学报, 2022, 65(11): 14261436.
[15]刘靖涛. 桃蚜嗅觉相关基因鉴定及功能分析[D]. 沈阳: 沈阳农业大学, 2022.
[16]吴帆, 张莉, 邱一蕾, 等. 昆虫嗅觉结合蛋白研究进展[J]. 昆虫学报, 2021, 64(4): 523535.
[17]胡佳萌, 徐丹萍, 卓志航, 等. 云斑天牛成虫触角转录组及嗅觉相关基因分析[J]. 应用昆虫学报, 2019, 56(5): 10371047.
[18]HE Yanyan, WANG Ke, ZENG Yang, et al. Analysis of the antennal transcriptome and odorant-binding protein expression profiles of the parasitoid wasp Encarsia formosa [J]. Genomics, 2020, 112(3): 22912301.
[19]ZHANG Hao, WANG Jinyan, WAN Nianfeng, et al. Identification and expression profile of odorant-binding proteins in the parasitic wasp Microplitis pallidipes using PacBio long-read sequencing [J/OL]. Parasite, 2022, 29: 53. DOI: 10.1051/parasite/2022053.
[20]宋月芹, 董钧锋, 陈庆霄, 等. 点蜂缘蝽触角转录组及化学感受相关基因的分析[J]. 昆虫学报, 2017, 60(10): 11201128.
[21]TAMURA K, STECHER G, KUMAR S. MEGA11: Molecular evolutionary genetics analysis version 11 [J]. Molecular Biology and Evolution, 2021, 38(7): 30223027.
[22]姚玮宸, 徐继伟, 徐鹿, 等. 梨木虱化学感受蛋白CchiCSP8与梨树挥发物的结合特性分析[J]. 昆虫学报, 2022, 65(7): 818830.
[23]ZHAO Yanni, WANG Fengzhu, ZHANG Xinyue, et al. Transcriptome and expression patterns of chemosensory genes in antennae of the parasitoid wasp Chouioia cunea [J/OL]. PLoS ONE, 2016, 11(2): e0148159. DOI: 10.1371/journal.pone.0148159.
[24]李真祥. 气味结合蛋白在短翅蚜小蜂嗅觉识别中的功能研究[D]. 泰安: 山东农业大学, 2023.
[25]PENG Yong, WANG Shanning, LI Keming, et al. Identification of odorant binding proteins and chemosensory proteins in Microplitis mediator as well as functional characterization of chemosensory protein 3 [J/OL]. PLoS ONE, 2017, 12(7): e0180775. DOI: 10.1371/journal.pone.0180775.
[26]AL-JALELY B H, XU Wei. Olfactory sensilla and olfactory genes in the parasitoid wasp Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae) [J/OL]. Insects, 2021, 12(11): 998. DOI: 10.3390/insects12110998.
[27]TANG Liangde, LIU Jimin, LIU Lihui, et al. De novo transcriptome identifies olfactory genes in Diachasmimorpha longicaudata (Ashmead) [J/OL]. Genes, 2020, 11(2): 144. DOI: 10.3390/genes11020144.
[28]VIEIRA F G, FORT S, HE Xiaoli, et al. Unique features of odorant-binding proteins of the parasitoid wasp Nasonia vitripennis revealed by genome annotation and comparative analyses [J/OL]. PLoS ONE, 2012, 7(8): e43034. DOI: 10.1371/journal.pone.0043034.
[29]王宏民, 张静, 张冲, 等. 绿豆象气味结合蛋白基因的克隆及表达分析[J]. 昆虫学报, 2021, 64(8): 920928.
[30]BRITO N F, MOREIRA M F, MELO A C A. A look inside odorant-binding proteins in insect chemoreception [J]. Journal of Insect Physiology, 2016, 95: 5165.
[31]刘盼静, 魏洪义, 郭坤, 等. 绿芫菁成虫触角中气味结合蛋白和化学感受蛋白基因的鉴定和表达分析[J]. 昆虫学报, 2022, 65(8): 927936.
[32]韩世鹏, 梁超, 李新兵, 等. 异色瓢虫气味结合蛋白基因HaxyOBP1和HaxyOBP6的克隆及表达谱分析[J]. 昆虫学报, 2019, 62(3): 284293.
[33]陈聪. 香樟齿喙象信息化学物质的活性组分鉴定及其关键气味结合蛋白的功能分析[D]. 南京: 南京林业大学, 2022.
[34]张小凤. 橘小实蝇气味结合蛋白在雌虫产卵寄主选择中的作用研究及其基因鉴定[D]. 武汉: 华中农业大学, 2014.
(责任编辑:杨明丽)

