机器人辅助手术治疗子宫内膜癌中国专家共识(2025年版):附手术视频
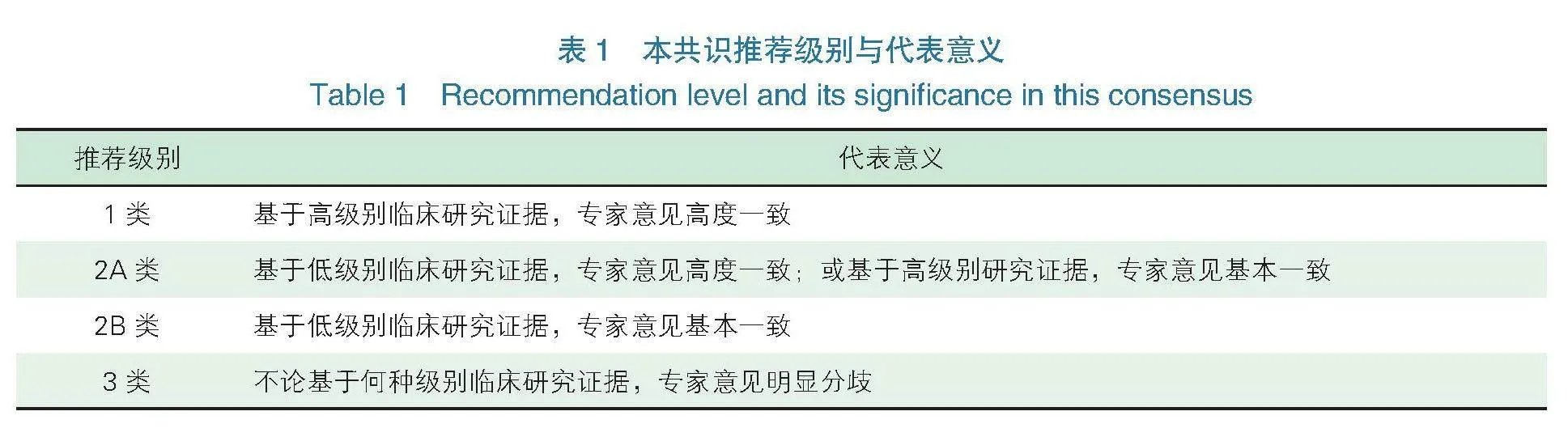

摘要 早期子宫内膜癌微创手术治疗已得到广泛认可,其基本术式为筋膜外全子宫切除术+双侧附件切除术±盆腔和腹主动脉旁淋巴结切除术或前哨淋巴结活检术。机器人手术系统克服了传统腹腔镜技术的操作瓶颈,使更多高龄、大子宫、合并肥胖及严重粘连的患者获得微创治疗的机会,治疗结局无异于传统腹腔镜技术,这使得机器人辅助手术应用于早期子宫内膜癌治疗具有较明显的优势。
关键词 子宫内膜癌;机器人辅助手术;手术治疗;专家共识
中图分类号 R608 R711 文献标识码 A 文章编号 2096-7721(2025)01-0175-12
Chinese expert consensus on robot-assisted surgery for endometrial cancer (2025): with surgical video
Gynecologic Oncology Group of Minimally Invasive and Noninvasive Medicine Committee of CMDA, Obstetrics and Gynecology Branch of Guangxi Medical Association
Abstract Minimally invasive surgery has been widely used in the treatment of early endometrial cancer recognized. The basic surgical approach for early endometrial cancer is extrafascial total hysterectomy + bilateral adnexectomy and pelvic and /or abdominal aortic lymph node resection or sentinel lymph node biopsy. By breaking some technical limitations of conventional laparoscopic surgery, robotic surgical system enables more patients with advanced age, large uterus, combined obesity and severe adhesions to obtain minimally invasive treatment, and similar outcomes can be achieved, which makes advantages of robot-assisted surgery in the treatment of early-stage endometrial cancer more obvious.
Key words Endometrial Cancer; Robot-assisted Surgery; Surgical Treatment; Expert Consensus
2024年调查数据显示,子宫内膜癌位居女性常见恶性肿瘤第4位,在世界范围内其发病率和死亡率逐年增长,为女性中死亡率增长最快的恶性肿瘤[1],且在过去40年里,子宫内膜癌是唯一生存率下降的癌症[2]。通过分析1990—2019年中国子宫内膜癌疾病负担的变化趋势,预测2030年我国子宫内膜癌标化发病率将从6.90/10万升至11.72/10万,标化死亡率将出现小幅增长,人口老龄化会加重治疗负担,死亡率也随着年龄的增加逐渐上升[3]。可见子宫内膜癌在我国造成的疾病负担在短期内将持续增加,应引起重视。子宫内膜癌患者多发生在绝经后,仅25%发生在绝经前[4]。与白人女性相比,亚洲女性罹患子宫内膜癌更早(65.1岁Vs
58.4岁)[5],中国子宫内膜癌发病率在55~59岁达到峰值[3]。50%左右的子宫内膜癌与肥胖有
关[6],代谢综合征使其发病率增加约2倍[7]。高龄、肥胖作为子宫内膜癌的独立危险因素,也将带来更大的手术难度和围手术期风险。
近70%子宫内膜癌处于疾病早期,以手术治疗为主。与开腹手术(Laparotomy,LT)相比,微创手术(Minimally Invasive Surgery,MIS)已被证实住院时间更短,术后感染、血栓等并发症发生率更低,且肿瘤结局相似。自机器人手术系统于2005年被批准用于妇科手术以来,机器人辅助腹腔镜手术(Robotic-assisted Laparoscopic Surgery,RALS)在子宫内膜癌中的应用得到了迅速发展。2023年的一项Meta分析比较了RALS、传统腹腔镜手术(Traditional Laparoscopic Surgery,TLS)、LT治疗子宫内膜癌的肿瘤结局,研究显示RALS的肿瘤结局与TLS相当,优于LT,认为RALS治疗子宫内膜癌是安全的[8]。目前,国内外正在积极开发机器人手术系统应用于妇科疾病治疗,因此,我们应更加重视机器人辅助手术的规范性。近年来,子宫内膜癌的诊治理念、模式出现了新的变化,对于一些热点问题仍存在学术争议。中国医师协会微无创医学专业委员会妇科肿瘤学组和广西医学会妇产科学分会组织国内机器人辅助手术及妇科肿瘤领域的有关专家,参考最新文献、开展专题讨论后,在《机器人手术治疗子宫内膜癌的中国专家共识(2021年版)》[9]的基础上,对相应内容进行更新以制定本共识,并形成参考意见,旨在将机器人辅助腹腔镜技术规范化应用于子宫内膜癌的手术治疗。本共识并非唯一的实践指南,不排除其他共识、意见与建议的合理性。推荐级别及其代表意义见表1。
1 RALS治疗子宫内膜癌的适应证与禁忌证
1.1适应证 病灶局限于子宫者,即Ⅰ~Ⅱ期的早期患者。子宫内膜癌的分子特征对于手术指征及范围的指导作用逐渐被重视。术前分子分型检测对保留生育功能的判断意义日渐显现。当分子分型为MMR缺陷型(dMMR)和p53突变型(p53 abn)时,患者对孕激素治疗低反应,缓解后复发率高,特别是p53 abn型发生早期远处转移概率增高,应与患者沟通保留生育的风险并告知手术治疗的获益。而非特异性分子改变型(NSMP)子宫内膜癌患者最有可能成为孕激素治疗的受益者。《早期子宫内膜癌保留生育功能治疗专家共识(2022年版)》已将符合NSMP型纳入保留生育的必要条件[4]。但有研究提出,NSMP型具有异质性,当合并L1细胞黏附分子(L1CAM)高表达时与子宫内膜癌远处复发和疾病特异性生存期(Disease Specific Survival,DSS)缩短有显著相关性[10]。另外,我国学者从TCGA数据库中纳入了473例子宫内膜癌患者,研究了分子特征对于不同手术入路(开腹Vs微创)治疗子宫内膜癌的预后,指出POLE突变型(POLE mut)、dMMR型患者推荐行MIS,而从肿瘤结局考虑,p53 abn型患者更建议行LT[11]。可见,术前明确分子特征对选择药物或手术治疗、开腹或微创治疗有一定指导作用,仍需高级别循证医学证据支持其作用和价值。实际工作中多在术后进行分子特征分析,应重视术前分子分型的应用。
1.2禁忌证 ①Ⅲ~Ⅳ期的晚期患者;②Ⅱ期,伴主骶韧带受累或宫颈病灶最大径线gt;2 cm,评估后认为不适合腹腔镜手术者;③合并严重的心、肝、肺、肾功能异常和(或)其他严重内外科合并症,不能耐受手术、人工气腹及陡峭头低臀高体位者;④子宫体积gt;妊娠3个月,或因阴道狭窄等原因不能经阴道完整取出子宫者。
RALS对于处理肥胖、高龄、严重粘连、大子宫的患者具有优势,可以克服TLS的操作瓶颈,使原本可能只有开腹才能完成的手术,获得了微创治疗机会。高龄和肥胖均增加了手术风险和围手术期并发症风险,对于行肾静脉水平腹主动脉旁淋巴结切除术的肥胖患者而言,特别是合并严重粘连时,TLS更具有挑战性。我国一项研究发现,当BMI≥28 kg/m2或年龄≥53岁
时,RALS的手术时间和术中出血量并不劣于对照组(BMIlt;28 kg/m2或年龄lt;53岁)[12]。国外研究纳入了BMI更高的患者,比较了Ⅲ度
(40 kg/m2≤BMI≤49 kg/m2)和Ⅳ度(BMI≥
50 kg/m2)肥胖子宫内膜癌患者接受RALS后的并发症发生率、再入院率以及复发率,认为RALS安全可行[13]。一项Meta分析纳入了7629例
老年子宫内膜癌患者,根据年龄阶段(gt;65岁、gt;70岁、gt;75岁)分为不同亚组,研究发现与LT相比,RALS可以显著降低手术总并发症和围手术期并发症,缩短住院时间,且随着患者年龄增加总体并发症风险的降低幅度更大[14]。对于肥胖、高龄、多种合并症的早期子宫内膜癌患者,LT风险更大,TLS技术上更具有挑战性,而RALS则具有一定优势[15]。当子宫大小接近妊娠3个月时,RALS行全子宫切除术较TLS更有优势,机器人手术系统的内窥镜可灵活旋转和调节远近,能够帮助术者逾越视野盲区,且机械关节更大角度的腕关节功能有助于保障手术的安全性[16]。但术前仍应首先评估将子宫从阴道完整取出的可能性。
推荐意见:RALS适用于Ⅰ~Ⅱ期子宫内膜癌患者。Ⅲ~Ⅳ期,以及Ⅱ期伴主骶韧带受累或宫颈病灶最大径线gt;2 cm,合并严重内外科疾病,子宫体积gt;妊娠3个月或因阴道狭窄等原因不能经阴道完整取出子宫者,均为RALS应用于子宫内膜癌治疗的禁忌。(推荐等级:2A类)
2 RALS治疗子宫内膜癌的术前评估
2.1病史询问及体格检查 患者病史采集内容如下:①一般情况,应注意年龄;②月经史,应注意有无初潮早、绝经延迟、异常子宫出血;③婚育史,应注意有无不孕病史及治疗情况;④合并症,如肥胖、糖尿病、多囊卵巢综合征、高血压、高脂血症、心脑血管疾病、血栓性疾病等,及治疗情况;⑤雌激素暴露情况,应注意有无分泌雌激素的卵巢肿瘤、乳腺癌病史以及他莫昔芬治疗等;⑥家族史,应注意有无肿瘤史、Lynch综合征、Cowden综合征等。
常规体格检查应测量患者身高、体重,并计算BMI值,行全身浅表淋巴结检查;妇科检查时应注意评估子宫大小及活动度、阴道及骨盆有无狭窄和畸形,尤其对绝经后妇女需评估经阴道完整取出子宫可能性。
2.2辅助检查 患者行三大常规、肝肾功能、血糖、凝血功能、D2聚体、输血前感染检查、血型、心电图、阴道分泌物常规、宫颈防癌筛查等检查。目前子宫内膜癌无特异性的肿瘤标志物,血清糖类抗原125(Carbohydrate Antigen 125,CA125)有一定辅助作用。妇科超声检查最常用,经阴道彩色超声检查准确性更高。增强MRI或增强CT可评估肿瘤累及范围及淋巴结转移情况,子宫及附件首选增强MRI。胸部影像学检查首选胸部CT平扫。全身PET-CT适用于可疑远处转移的患者。建议患者行肿瘤基因和遗传性癌症风险评估,可考虑行胚系基因和(或)多基因组检测[17]。60岁以上的患者建议完善肺功能、心脏彩超、下肢血管超声等检查。有特殊疾病史者应追加对应实验室检查,如合并糖尿者检测糖化血红蛋白;高血压者必要时行类固醇激素的实验室检查;心脏病者完善心肌损伤标志物、心肌酶、脑利钠肽等,必要时行24 h动态心电图、24 h动态血压检查和冠脉造影检查;老年及易栓症者检测抗凝血酶、蛋白C、蛋白S;心率异常者检查甲状腺功能等[18]。
2.3明确病理类型 术前应明确子宫内膜癌的组织病理学类型,多通过分段诊刮或宫腔镜下子宫内膜定位活检获得。采用第5版WHO女性生殖器官肿瘤分类进行病理学分级。全面分期手术前组织形态学存在可重复性差的缺点,建议2名
以上病理医师核实,必要时商请专家会诊或免疫组化进一步明确,尤其是高级别病变或伴有混合型组织学类型者。病理学诊断包括组织病理学特征(病理类型、肿瘤分级),免疫组织化学染色包括雌激素受体(ER)、孕激素受体(PR)、p53、PTEN、PAX2、MLH1、PMS2、MSH2及MSH6[19]。
2.4分子分型 2013年癌症基因组图谱(The Cancer Genome Atlas,TCGA)研究网络发布了子宫内膜癌分子分型,在不依赖肿瘤形态学特征的前提下,通过分子特征进行分类,提升了子宫内膜癌诊断的准确性和可重复性,可更精准预测子宫内膜癌患者的预后并指导术后辅助治疗[20]。推荐对所有确诊的子宫内膜癌患者进行林奇综合征筛查[21]。2023年国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)公布了新的子宫内膜癌分期系统,全面整合了分子分型。但《2024 NCCN子宫肿瘤临床实践指南(第1版)》仍采用第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)
分期和2009年FIGO分期,具体治疗推荐仍按FIGO 2009分期标准执行。目前为止,尚未形成按照分子分型进行风险分层的统一意见,且多数在术后完成,术前分子分型如何指导手术策略尚缺乏高级别证据支持。虽然价格昂贵、等待时间长等客观因素限制了术前分子分型的临床应用,但临床医生应重视其应用价值。
2.5评估宫颈是否受累 可通过分段诊刮初步评估宫颈是否受累,但准确性偏低,多数情况下很难通过分段诊刮判断宫颈间质是否受累。宫腔镜检查或影像学检查,如增强MRI,能够提供比较准确的宫颈受累情况。如确需宫腔镜辅助诊断,注意调低膨宫压力,减少癌细胞脱落播散概率。有数据显示膨宫液沿输卵管进入盆腔,会增加腹水细胞学阳性率的风险,但对患者预后无影响。应完善TCT、HPV检查,尤其对于肿瘤位于子宫下段或宫颈受累者,评估有无宫颈原发疾病。
2.6评估有无子宫肌层、附件受累及淋巴结转移情况 影像学检查是初步评估的重要手段。妇科超声检查初步了解子宫体大小、宫腔有无占位性病变、子宫内膜厚度、肌层浸润情况、附件有无占位性病变等,经阴道超声检查准确性更高。盆腹腔增强MRI或增强CT可用于评估肿瘤累及范围、盆腹腔淋巴结有无转移及其他器官累及情况。增强MRI对评估子宫肌层浸润深度和范围、子宫颈间质受累情况具有较高的特异性,增强CT评估淋巴结转移更有优势。
2.7血栓风险评估 早期有效的风险评估是降低围
手术期静脉血栓栓塞(Venous Thromboembolism,VTE)发生率、改善患者预后的关键。建议患者入院后24 h内进行血栓风险评估。常采用Caprini评分进行评估,0~1分为低危,2分为中危,3~4分为高危,≥5分为极高危[22]。
2.8营养状态评估 常采用营养风险筛查(Nutrition
Risk Screening,NRS)2002量表进行评估[23],适用于成年住院患者,根据疾病评分、营养状况受损评分、年龄评分计算营养风险总评分。总分≥3分时表明患者存在营养不良风险,应在术前给予针对性干预,改善营养状态[18]。
2.9其他 对于高龄、肥胖、存在多种合并症、营养不良风险的特殊人群,必要时应先完善多学科会诊。对既往有手术史的患者术前应进行粘连风险评估[24],参考欧洲防粘连妇科专家组(Anti-adhesions in Gynaecology Expert Panel,ANGEL)粘连风险评分体系[25],对患者进行心理评估和支持。
推荐意见:术前明确患者子宫内膜癌的组织病理学类型,通过超声或增强MRI/CT可了解病灶大小、子宫肌层浸润深度、子宫颈、淋巴结以及其他器官是否受累,有条件者应行术前分子分型检测。(推荐等级:2A类)
3 RALS治疗子宫内膜癌的术前准备
3.1进入手术室前
3.1.1患者及家属签署知情同意书 告知患者及家属手术方式、手术路径、手术团队的机器人辅助手术经验以及疾病的替代治疗手段,并取得明确同意。在术前告知举宫器的使用及对应的术中无瘤原则实施方案。充分沟通和告知腹腔镜辅助手术特有的风险,如气腹对肿瘤扩散的影响、穿刺孔肿瘤转移等。对于特殊病理类型、具有高危因素的子内膜癌患者,应告知MIS的争议及预后情况。麻醉评估后签署麻醉同意书。
3.1.2其他准备 包括肠道、阴道、局部皮肤准备。进行贫血管理,预防和控制生殖道和(或)手术部位感染,检测并控制血糖、血压,预防血栓发生等。拟行加速康复路径的患者应按照加速康复外科程序进行饮食准备。具体实施细节可参考《妇科手术术前评估与准备的中国专家共识(2022年版)》[18]。
3.2进入手术室后
3.2.1麻醉 进入手术间后首先进行三方手术安全核查,建立静脉通道,进行气管插管全身麻醉。
3.2.2体位摆放 取膀胱截石位,大腿屈曲分开外展,小腿腘窝置于截石位支架上,臀部移出手术床缘外8~10 cm。一般设定气腹压力上限13 kPa,
建立人工气腹后取头低脚高Trendelenburg体位。因机器人辅助手术中不能再调整手术床倾斜角度,可以直接选择30°倾斜,以便使肠管、大网膜等器官因重力滑向上腹部,暴露术野,同时局部调高头颈部倾斜角度。常规在患者双肩部放置肩托,背部使用海绵防滑垫,以防止患者因体位而下滑。采用截石位时,注意保护患者腘窝,防止过度外展的体位,并预防腓总神经损伤。同时应尽可能穿下肢弹力袜以预防血栓形成。
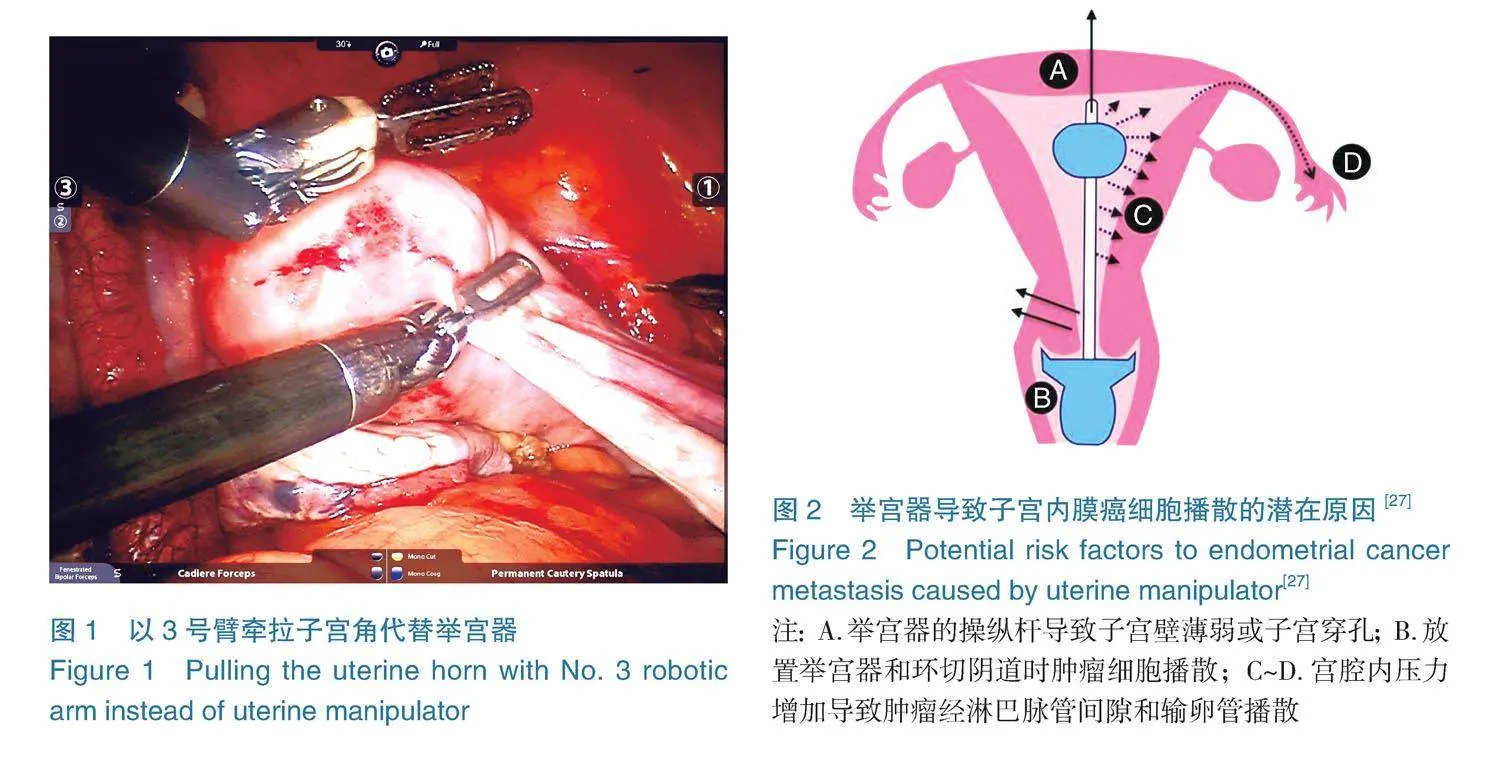
3.2.3放置举宫器 考虑到手术无瘤原则,举宫器使用需采取审慎态度,尤其当术前确定有宫颈受累或为高危型子宫内膜癌时,不建议使用举宫器。机器人手术系统的第3号机械臂(以下称3号臂)为免举宫操作创造了条件,使用
3号臂牵拉子宫角,固定和调整子宫位置,是替代举宫器是一种可行的方式(如图1),也可采用缝合牵拉子宫代替举宫器等方法。
目前对于子宫内膜癌全面分期手术是否使用举宫器仍存在争议。2021年一项Meta分析结果显示,TLS中使用举宫器不会增加子宫内膜癌患者腹水细胞学阳性率、术后复发率,但与LT相比,使用举宫器的TLS增加了腹水细胞学阳性率[26]。Padilla-Iserte回顾性研究了举宫器对Ⅰ~Ⅱ期内膜癌微创治疗的肿瘤结局,与未使用举宫器相比,使用举宫器与更短的无疾病生存期(HR=1.74,95%CI:0.57~0.97,P=0.027)、更高的死亡率(HR=1.74,95%CI:1.07~2.83,P=0.026)有关,但两组患者复发率差异无统计学意义[27]。也有研究未观察到举宫器对无进展生存期和总生存期的影响[28]。近期一项研究发现,球囊型举宫器和非球囊型举宫器都增加了淋巴脉管间隙浸润(Lymphovascular Space Invasion,LVSI)阳性率,推测与更差的肿瘤结局有关[29],但是Scutiero G等人的研究未发现TLS中使用举宫器对LVSI阳性率有显著影
响[26]。一项前瞻性队列研究探讨了使用举宫器对子宫内膜癌手术中子宫穿孔的影响,结果显示举宫器类型和手术入路(TLS或RALS)对子宫穿孔无显著影响,但子宫穿孔可增加LVSI阳性率,并有22%的患者改变了术后辅助治疗策略[30]。举宫器与肿瘤细胞播散的潜在原因如图2。
3.2.4置入Trocar 建立人工气腹后,按照术前设计的布局置入Trocar。基本原则是各手术机械臂之间应有足够的间距,一般不小于8 cm。机械臂Trocar位置应根据患者体型、子宫大小、宫底位置,术前影像学显示的腹主动脉、下腔静脉和髂血管走行,助手站位以及计划进行的术式等具体情况进行布局(如图3)。不使用
3号臂时,2号臂Trocar可以平脐。如需切除大网膜或计划切除大网膜者,镜头孔及操作孔需相应抬高,以适应在横结肠下缘切除大网膜的手术操作需求,建议将镜头孔位于剑突下,对于某些机器人辅助手术,可以在术中根据手术切除的位置来调整内窥镜位置。床旁助手的Trocar位置应在两个机械臂连线的外侧,避免术中受到机械臂干扰,建议助手使用加长器械以便在体外狭小的空间中完成良好配合。
3.2.5机器人床旁系统与Trocar连接 将机器人床旁系统推近手术床并与各Trocar相连接。注意各机械臂之间留有适当的空间,避免相互碰撞、干扰。
3.2.6置入内窥镜和操作器械 一般选用30°内窥镜,根据术者习惯和对器械的熟悉程度,选用单极电铲、单极电钩、单极电剪、超声刀、双极电凝、持针器等进行手术的电凝切割和缝合。若采用3号臂,则连接无损伤抓钳,进行术中协助。
3.2.7其他操作 床旁助手可通过助手孔使用无损伤抓钳、吸引器协助暴露,或根据术者指令更换手术器械等。
推荐意见:当患者术前确定有宫颈受累或为高危型子宫内膜癌时,不建议使用举宫器。可使用机器人3号臂牵拉和调整子宫位置替代举宫器。穿刺孔位置应根据患者体型、子宫大小、宫底位置,术前影像学显示的腹主动脉、下腔静脉和髂血管走行,助手站位以及计划进行的术式等具体情况进行布局。(推荐等级:2A类)
4 手术步骤
4.1手术方式 手术方式为筋膜外全子宫切除术+双附件切除术±盆腔和腹主动脉旁淋巴结切除术,可选择前哨淋巴结活检术替代淋巴结系统切除术。对年龄lt;45岁的低级别子宫内膜样癌、子宫肌层浸润lt;1/2、术前检查和术中评估无卵巢累及和子宫外转移证据的绝经前患者,可考虑保留卵巢,但应切除双侧输卵管。对有胚系BRCA突变、Lynch综合征或子宫内膜癌家族史的患者,不建议保留卵巢[31]。病理学结果为子宫内膜浆液性癌、透明细胞癌、癌肉瘤及未分化癌者,应同时切除大网膜或进行大网膜活检。对于子宫颈疑似或已有肿瘤累及者,若评估宫颈病变可手术,则行以全子宫切除为基础的全面分期手术。
4.2全子宫切除术+双附件切除术 ①实施其他手术步骤前,双极电凝钳凝闭双侧输卵管峡部,留取盆腹腔冲洗液送细胞学检查。②处理双侧附件:单极电器械打开盆腔侧腹膜,游离骨盆漏斗韧带,暴露同侧输尿管,双极电凝充分凝闭(或用血管夹结扎)骨盆漏斗韧带后切断。顺势打开同侧阔韧带前后叶至宫旁。同法处理对侧。③处理双侧圆韧带:将子宫体摆向对侧,使圆韧带保持一定张力,在距离宫角约2 cm处凝切圆韧带。同法处理对侧。④打开膀胱子宫腹膜反折,下推膀胱。⑤处理子宫血管:将阔韧带后叶分离处继续下推,暴露子宫动静脉,3号臂协助将子宫牵向对侧,在子宫峡部水平凝闭子宫血管。同法处理对侧。⑥处理骶、主韧带(该步骤视情况而定):将子宫向侧上方上举,暴露骶主韧带,双极电凝后用单极电铲或电剪在起始部位切断骶韧带、主韧带。⑦单极电铲或电剪环形切开阴道壁,完整取出子宫。⑧可吸收线连续或“8”字缝合阴道残端。
4.3前哨淋巴结示踪和活检术 适用于Ⅰ~Ⅱ期中低危子宫内膜癌,除外任何高危因素或仅存以下1个高危因素:深肌层浸润、G2~G3级、ⅠA期非内膜样癌无肌层浸润。若术中发现淋巴结显影,切除最先显影的淋巴结。如果一侧盆腔未检出前哨淋巴结,则该侧需行系统性淋巴结切除术。推荐对前哨淋巴结进行病理超分期。无淋巴结切除指征的子宫内膜癌患者不需行前哨淋巴结活检术。
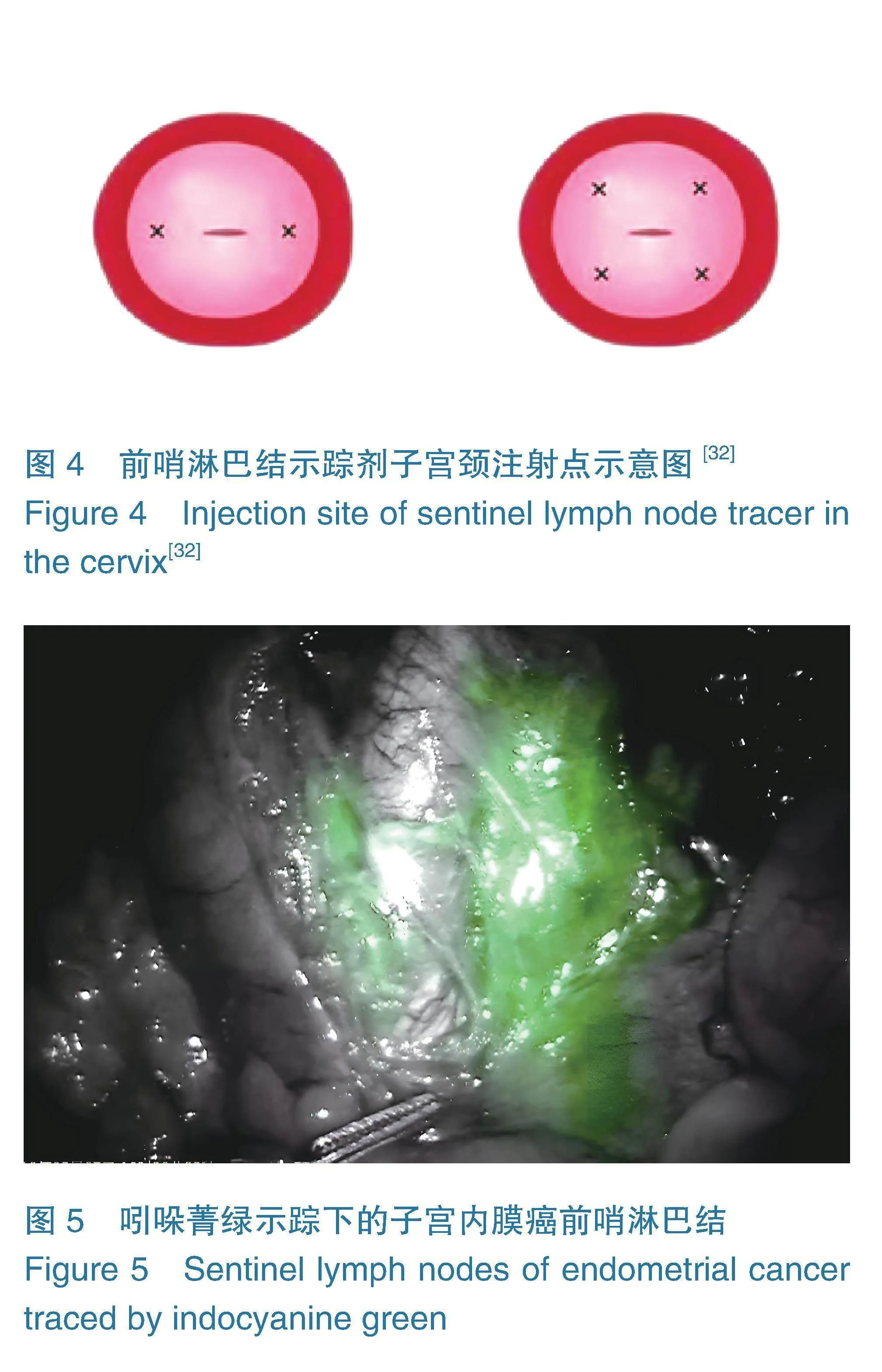
操作过程中主要以吲哚菁绿、纳米炭混悬液作为示踪剂。于子宫颈3、9点(单一示踪剂)或子宫颈2、4、8、10点(联合示踪剂)注射(如图4)[32]。先浅注射点(深度0.1~0.3 cm),后深注射点(深度1~2 cm),浓度1.25 g/L,分别缓慢推注示踪剂。采用ICG者通过机器人手术系统的荧光显示模块进行显影,术中观察并识别前哨淋巴结(如图5)[33]。
4.4系统性淋巴结切除术 系统性淋巴结切除术包括盆腔淋巴结切除和达到肾静脉水平的腹主动脉旁淋巴结切除。手术指征[32]:①Ⅰ期高中危/高危和Ⅱ期患者应行系统性淋巴结切除。②Ⅰ~Ⅱ期子宫内膜癌盆腔淋巴结受累者,只需切除肿大的盆腔淋巴结,但仍需行达到肾血管水平的系统性腹主动脉旁淋巴结切除。③Ⅰ~Ⅱ期
中低危子宫内膜癌患者选择前哨淋巴结活检替代系统性淋巴结切除,切除最先显影的淋巴结;若一侧盆腔未检出前哨淋巴结,则行该侧系统性淋巴结切除术。
术前进行子宫内膜癌风险分层有助于指导淋巴结切除。梅奥标准认为,同时符合病变局限在宫体、G1~G2级子宫内膜样腺癌、肌层侵犯lt;1/2、病灶直径lt;2 cm,可不切除淋巴结。但术前往往难以准确评估,术后有病理升级风险。术前分子分型能否指导淋巴结切除尚存在争议。分子分型重新将子宫内膜癌分为高、中、低危组[21],其中15%的患者被调整为高危,50%的患者被调整为低危,提升了早期子宫内膜癌复发风险评估的准确性[34]。分子分型与淋巴结转移有显著相关性,研究显示POLE mut型淋巴结转移率为12.2%(21/171)[35],可不切除淋巴结。NSMP型淋巴结转移率为43.1%(74/172)[35],但考虑到NSMP型的异质性,一项研究纳入1110例
NSMP型子宫内膜癌患者并进行了风险分层,将高中分化伴ER阳性者纳入低危组,发现这类人群淋巴结转移率在5%左右,是否切除淋巴结不影响预后[36]。
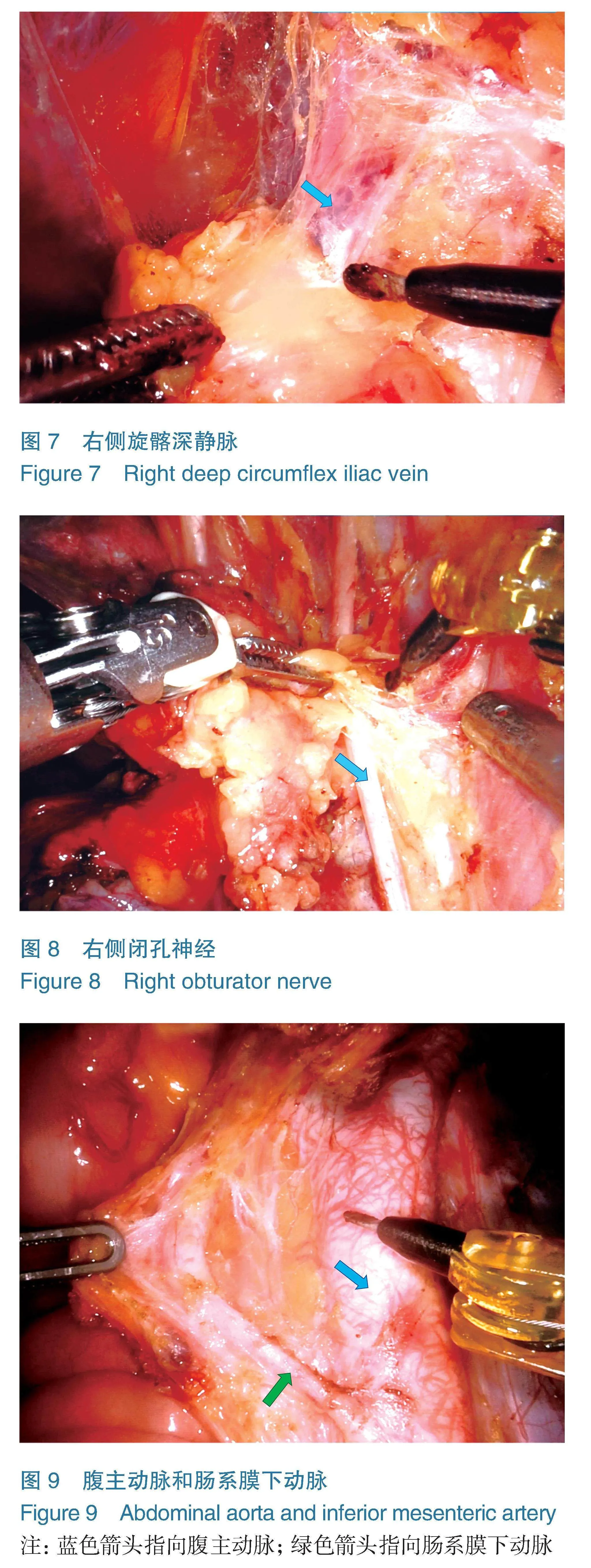
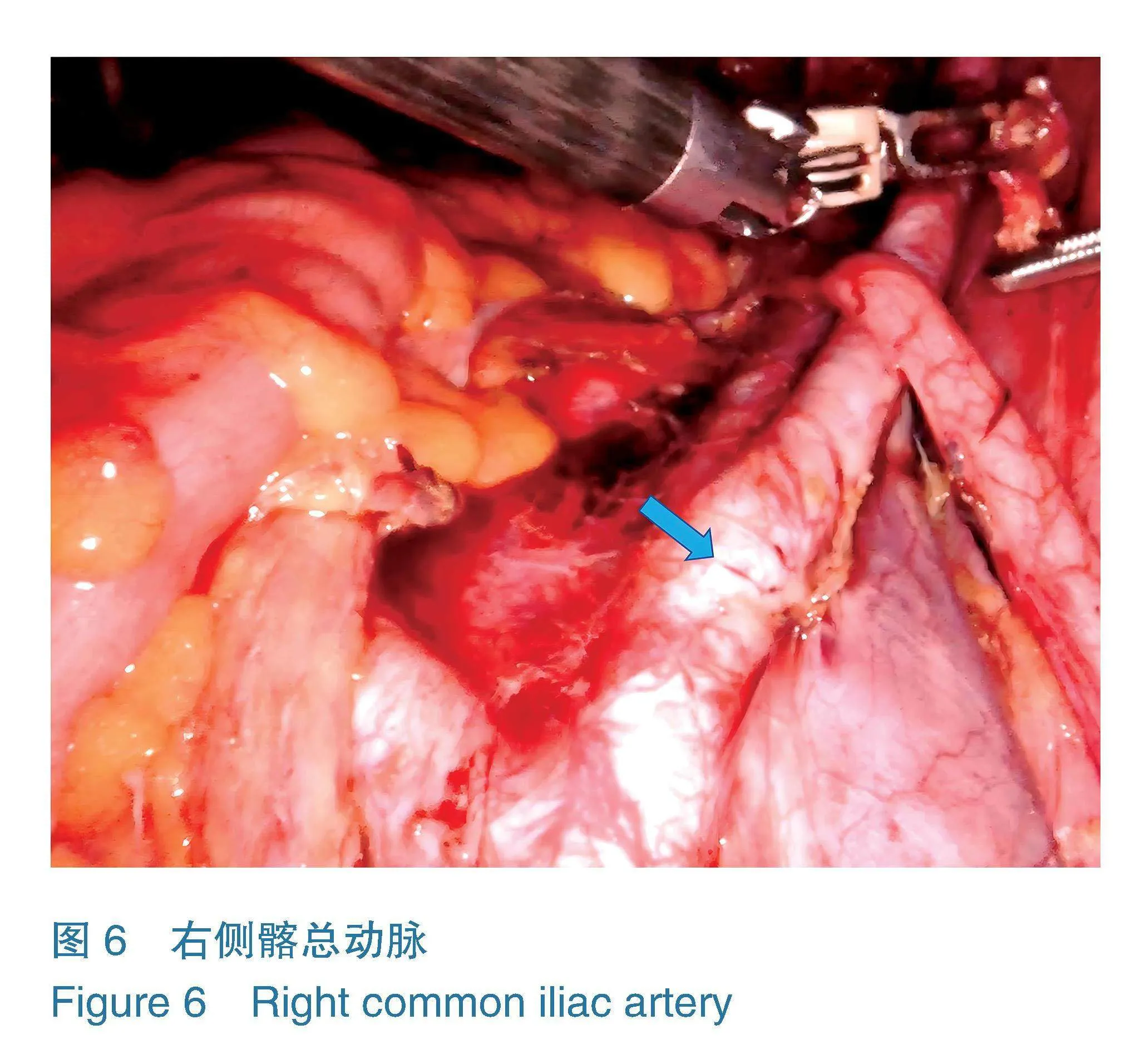
4.4.1盆腔淋巴结切除术 助手牵拉圆韧带断端(若先行淋巴结切除,则提拉圆韧带),单极电铲或电剪刀沿盆侧壁向上、向外打开侧腹膜,暴露髂外动静脉,沿髂外动静脉的表面“自上而下、由外到内、由浅入深”地清扫淋巴脂肪组织。上界达髂总动脉上2~3 cm(如图6),下界达旋髂深静脉(如图7),内侧界达髂内动脉外侧缘,外界达腰大肌内侧缘,底界达闭孔神经表面(如图8)。应整块切除各组淋巴结,避免分块切除,避免强行牵拉和撕脱。标本装袋,术毕自阴道取出。同法处理对侧。
4.4.2腹主动脉旁淋巴结切除术 使用3号臂的无损伤抓钳将小肠和大网膜向患者头侧推开并保持,暴露腹主动脉主干,以肠系膜下动脉为标记,纵行打开腹主动脉表面的腹膜,向上至十二指肠横缘下水平。沿腹主动脉主干向两侧打开,暴露下腔静脉、两侧输尿管、左肾静脉下缘。依次切除该范围内的淋巴脂肪组织,上界达肾静脉,下界达骶前区域,两侧达左右髂总血管(如图9)。注意保护腹主动脉表面的神经束。超声刀对于淋巴管的凝闭更加彻底,因机器人辅助手术多采用单双极,术中应注意确切凝闭淋巴管,以减少淋巴瘘发生。
对于腹主动脉旁淋巴结转移患者,常发生于高位腹主动脉旁,因此达到肾静脉水平的腹主动脉旁淋巴结切除术是子宫内膜癌分期的关键要素。传统腹腔镜入路对于肾下区域操作受限,且依赖于助手协助,对于肥胖患者更具有挑战性,若患者同时伴有子宫增大、盆腹腔明显粘连时,对术者的要求更高,常导致手术操作困难或不能完整切除淋巴结。机器人手术系统具备360°可腕转器械、震颤滤除、人体工学设计、更高倍数的放大术野、裸眼3D视野等优势,有利于进行精细度要求更高的腹主动脉旁淋巴结切除操作,并减少外科医生对助手的依赖。一项随机对照试验比较了RALS与LT用于Ⅰ~Ⅱ期
高危型内膜癌腹主动脉旁淋巴结切除术的优劣,结果显示RALS组手术时间较长(Plt;0.001),但总失血量更少(Plt;0.001),且住院时间更短(Plt;0.001),围手术期并发症及再入院率差异无统计学意义,认为RALS不劣于LT,是安全可行的[37]。另一项研究回顾性探讨了RALS与TLS用于腹主动脉旁淋巴结切除术的有效性和安全性,平均BMIgt;24 kg/m2,发现RALS切除的淋巴结数量更多[38]。
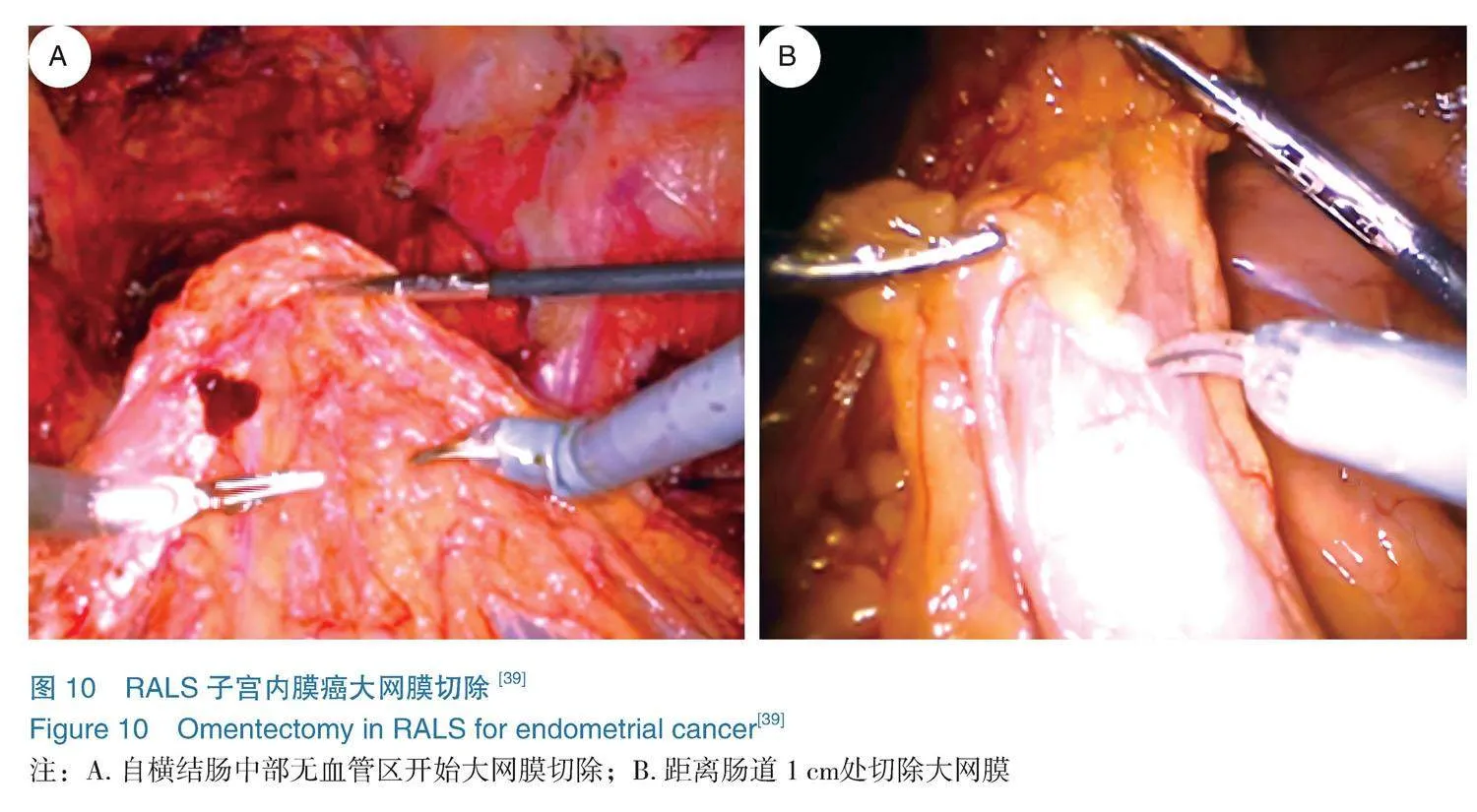
4.5大网膜切除或活检术 适应证:术前病理结果为子宫内膜浆液性癌、透明细胞癌、癌肉瘤和未分化癌的特殊病理类型患者。
3号臂或助手向足侧牵拉大网膜并保持一定张力。在横结肠中部无血管区打开(如图10A),然后沿横结肠向脾曲、肝曲两侧逐步电凝切断大网膜。应注意在距肠道1 cm处切除大网膜,以免对肠道造成电热损伤(如图10B)。
4.6关闭腹腔 检查术野无活动性出血点,用2000 mL灭菌注射用水充分冲洗盆腹腔,留置盆腔引流管。松解机器人各机械臂Trocar连接,解除气腹,去除各Trocar,缝合腹壁穿刺孔。
推荐意见:基本术式为筋膜外全子宫切除术+双侧附切除术±盆腔和腹主动脉旁淋巴结切除术。腹主动脉旁淋巴结切除应达到肾静脉水平。对于符合保留卵巢内分泌功能适应证的患者,可保留卵巢,但应切除双侧输卵管。可选择前哨淋巴结活检替代淋巴结系统切除术。对于子宫颈疑似或已有肿瘤累及者,若评估宫颈病变可手术,则行以全子宫切除术为基础的全面分期手术。(推荐等级:2A类)
5 术后处理
①保持引流管通畅,若淋巴结切除术后渗出液比较多,应在术后每日注意观察引流液的量和颜色。一般引流量在100 mL以内可以拔除引流管。②监测生命体征,特别是老年患者。术后补液量和速度控制在合理的范围内,注意监测心肺功能。③预防性应用抗生素至术后24~
48 h,观察体温、血常规、C反应蛋白、降钙素原的动态变化。④饮食:麻醉清醒6 h后,可进食少许流质以促进胃肠功能恢复。如术中涉及胃肠道手术者,则根据排气、排便情况循序渐进地调整饮食。⑤血栓风险评估:采用结合我国数据、适合妇科肿瘤患者围手术期VTE风险分级的Caprini模型进行血栓风险评分[40]。该模型确定了6个妇科手术后深静脉血栓形成的独立危险因素(年龄≥50岁、高血压、静脉曲张、手术时间≥3 h、术后卧床时间≥48 h、开腹手术),每项赋值均为1分,根据总评分分为低危(0分)、中危(1分)、高危(2分)、极高危(≥3分)。术后2~7d ,推荐对具有上述1个及以上危险因素的患者行下肢血管加压超声检查[40]。⑥防止VTE形成:VTE包括深静脉血栓形成和肺栓塞,减少VTE的危害重在预防,基于风险分级的预防可以提高预防效率。术后应补足液体量,鼓励患者尽早下床活动。依据术后血栓风险评分进行物理预防,如双下肢气压治疗、抗血栓弹力袜或分段弹力绷带等,和(或)药物预防,如低分子肝素等药物抗凝。⑦完善病理检查、分子分型、林奇综合征筛查,必要时行林奇综合征基因检测。
6 手术并发症的预防和处理
6.1血管损伤 多见于切除肿大、转移的淋巴结时,因静脉壁撕裂损伤所致。机器人手术系统缺乏触觉反馈,机械臂连接的器械可能因力度感知不当导致血管壁损伤。处理办法如下[9]:先用腔镜小方纱压迫出血点,定位出血点后用5-0无损伤血管缝合线修补静脉损伤,注意避免由于张力过大导致缝线断裂。闭孔窝淋巴结切除时出现的髂内静脉丛损伤出血,多由于操作不够轻柔、淋巴脂肪较多影响视野所致。利用机械臂、助手协助暴露闭孔窝,保持组织一定张力,双极电凝预先凝闭小静脉,避免暴力撕扯,电凝时注意避免损伤闭孔神经进入盆腔其下方的腰骶干神经。切除下腔静脉淋巴结时,常有下腔静脉穿通支与淋巴脂肪组织相连,在切除淋巴脂肪组织时若将其撕断可导致出血,且因其缩至下腔静脉表面而不易止血,应熟悉该穿通支常见的部位,预先将其凝闭再切断,则可预防。血管损伤也可发生在行腹壁穿刺置入套管时,导致腹壁血管甚至腹膜后血管损伤,应选择恰当穿刺点,行腹壁透光试验辨认腹壁血管位置,发生损伤时可予以缝合止血或中转开腹。
6.2淋巴瘘 淋巴瘘常见于切除肿大、转移淋巴结时未能将输入淋巴管彻底凝闭,或切除腹主动脉旁淋巴结时损伤左右腰干及乳糜池所致[9]。
熟悉解剖标识、凝闭粗大淋巴管可有效预防淋巴瘘。一旦发生淋巴瘘或乳糜漏,通过禁食、补液、充分引流、应用奥曲肽,以及预防性使用抗生素等非手术治疗,多数可好转,严重者可用特殊材料封堵。重度淋巴瘘仍首选非手术治疗,长时间保守治疗无效时则采用手术治疗。
6.3膀胱输尿管损伤 输尿管损伤多因热辐射导致。在腹主动脉旁淋巴结切除的过程中,预先显露左右两侧输尿管走行是避免损伤的重要手段[9]。当术中疑似有热损伤时,可于术中及时置入双J管,避免术后输尿管瘘;如术后发现输尿管阴道瘘,则可根据发生时间、发生部位请泌尿外科医师协助处理[9]。膀胱腹膜反折解剖层次不清易造成膀胱损伤,若膀胱腹膜反折中间分离层次不清时,应及时调整分离部位,避免强行操作,此时可以从两侧寻找间隙;一旦术中明确发生膀胱损伤,应立即修补,若疑似膀胱损伤,可于术中行膀胱美兰灌注观察以及延长留置导尿管的时间。若术后发现膀胱损伤,应与泌尿外科协助进行妥善处理。
6.4穿刺孔肿瘤转移 穿刺孔肿瘤转移和刺孔部位的肿瘤直接污染与种植、肿瘤细胞的雾化效应、烟囱效应、CO2气腹效应、手术操作、患者和肿瘤自身因素等有关[41]。预防措施包括正确放置穿刺器,避免套管反复出入腹腔,有条件者可采用加热、加湿的CO2气腹[41]。手术开始时先凝闭双侧输卵管防止肿瘤细胞扩散。淋巴结装袋自阴道取出。取出穿刺器前,先将腹腔内气体排出,防止“烟囱”效应。不推荐常规行预防性腹腔镜穿刺孔部位切除。
6.5神经损伤 常见于闭孔神经和生殖股神经损伤。直接损伤、牵拉或缝合均是造成损伤的常见原因。在淋巴结切除时,应充分显露神经走向,避免盲目电凝止血和粗暴牵拉组织。发现闭孔神经断裂时,可进行神经吻合术,若为部分损伤或电热损伤术后多可恢复。
6.6胃肠道损伤 因机器人手术系统缺乏触觉反馈,应注意钳夹肠系膜而非肠壁,以避免过度钳夹肠壁造成肠道损伤。在距肠道1 cm处切除大网膜。疑似肠管损伤时,应仔细检查,早期识别肠损伤对于降低术后死亡率至关重要。术后肠漏的处理原则以促进快速自行愈合为主。
其余并发症的预防和处理参照《子宫内膜癌腹腔镜技术诊治指南(2023年版)》[34]。
7 随访
一般术后2~3年内每3个月随访1次,3年后每6个月随访1次,5年后每年随访1次。随访内容包括详细询问病史、盆腔检查、阴道细胞学检查、胸部X线摄影、腹盆腔超声、血清CA125检测等,必要时可作CT及MRI检查[42]。
8 机器人辅助手术医师的培训、准入和质控
参考《机器人手术治疗子宫内膜癌中国专家共识(2021版)》[9]。
《机器人手术治疗子宫内膜癌的中国专家共识(2025年版)》执笔与讨论专家
执笔专家:
孙 丹(广西医科大学第一附属医院)
范江涛(广西医科大学第一附属医院)
张 颐(中国医科大学附属第一医院)
张师前(山东大学齐鲁医院)
讨论专家(按姓氏音序排列):
蔡丽萍(南昌大学第一附属医院)
陈必良(西安市人民医院)
陈琼华(厦门大学附属第一医院)
范江涛(广西医科大学第一附属医院)
方梓羽(广西医科大学第四附属医院)
贺红英(广西医科大学附属柳铁中心医院)
华克勤(复旦大学附属妇产科医院)
纪 妹(郑州大学第一附属医院)
康 山(河北医科大学第四医院)
李 斌(中国医学科学院肿瘤医院)
刘 畅(兰州大学第一医院)
刘淑娟(空军军医大学第一附属医院)
刘晓军(海军军医大学第二附属医院)
孟元光(中国人民解放军总医院第七医学中心)
唐 洁(湖南省肿瘤医院)
唐均英(重庆医科大学附属第一医院)
王 刚(四川省妇幼保健院)
王海琳(西安国际医学中心妇科肿瘤医院)
王建六(北京大学人民医院)
王 军(大连医科大学第二附属医院)
汪希鹏(上海交通大学医学院附属新华医院)
王小元(山东第一医科大学第一附属医院)
王永军(首都医科大学附属北京积水潭医院)
王玉东(上海交通大学医学院附属国际和平妇
幼保健院)
肖松舒(中南大学湘雅三医院)
薛 敏(中南大学湘雅三医院)
杨林青(济宁医学院附属医院)
阳志军(广西医科大学附属肿瘤医院)
张国楠(四川省肿瘤医院)
张师前(山东大学齐鲁医院)
张 蔚(武汉大学中南医院)
张 颐(中国医科大学附属第一医院)
赵 瞾(郑州大学第一附属医院)
朱前勇(河南省人民医院)
邹冬玲(重庆大学附属肿瘤医院)
利益冲突声明:所有编写组成员均声明不存在利益冲突,无商业组织向本共识编写组支付费用。
参考文献
[1] Siegel R L, Giaquinto A N, Jemal A. Cancer statistics, 2024[J]. CA Cancer J Clin, 2024, 74(1): 12-49.
[2] Forjaz G, Ries L, Devasia T P, et al. Long-term cancer survival trends by updated summary stage[J]. Cancer Epidemiol Biomarkers Prev, 2023, 32(11): 1508-1517.
[3] 赵湘铃, 段朝晖, 张敏, 等.中国子宫内膜癌疾病负担状况及流行趋势预测 [J].中国慢性病预防与控制, 2023, 31(8): 568-573.
[4] 周蓉, 王益勤, 鹿群, 等.早期子宫内膜癌保留生育功能治疗专家共识(2022年版)[J].中国妇产科临床杂志, 2023, 24(2):
215-219.
[5] Makker V, MacKay H, Ray-Coquard I, et al. Endometrial cancer[J]. Nat Rev Dis Primers, 2021, 7(1): 88.
[6] Calle E E, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults[J]. N Engl J Med, 2003, 348(17): 1625-1638.
[7] Arthur R S, Kabat G C, Kim M Y, et al. Metabolic syndrome and"risk of endometrial cancer in postmenopausal women: a prospective study[J]. Cancer Causes Control, 2019, 30(4): 355-363.
[8] FU H L, ZHANG J H, ZHAO S Y, et al. Survival outcomes of robotic-assisted laparoscopy versus conventional laparoscopy and laparotomy for endometrial cancer: a systematic review and meta-analysis[J]. Gynecol Oncol, 2023, 174: 55-67. DOI: 10.1016/j.ygyno.2023.04.026.
[9] 范江涛, 孙丹, 张师前.机器人手术治疗子宫内膜癌中国专家共识(2021版)[J].机器人外科学杂志(中英文), 2022, 3(5): 414-422.
[10] Schubert M, Mettler L, Deenadayal Tolani A, et al. Fertility preservation in endometrial cancer-treatment and molecular aspects[J]. Medicina (Kaunas), 2023, 59(2): 221.
[11] DAI Y B, WANG J Y, ZHAO L Y, et al. Tumor molecular features predict endometrial cancer patients’ survival after open or minimally invasive surgeries[J]. Front Oncol, 2021, 11: 634857. DOI: 10.3389/fonc.2021.634857.
[12] 吴迪, 李明霞, 王楠, 等.333例达芬奇机器人系统治疗子宫内膜癌的病例系列分析[J].解放军医学院学报, 2021, 42(10): 1015-1019.
[13] Lechartier C, Bernard J, Renaud M C, et al. Robotic-assisted surgery for endometrial cancer is safe in morbidly and extremely morbidly obese patients[J]. Gynecol Oncol, 2023, 172: 15-20.DOI: 10.1016/j.ygyno.2023.02.014.
[14] Raffone A, Travaglino A, Raimondo D, et al. Laparotomic versus robotic surgery in elderly patients with endometrial cancer:
A systematic review and meta-analysis[J]. Int J Gynaecol Obstet, 2022, 157(1): 1-10.
[15] Collins A, Jacob A, Moss E. Robotic-assisted surgery in high-risk surgical patients with endometrial cancer[J]. Best Pract Res Clin Obstet Gynaecol, 2024, 92: 102421.DOI: 10.1016/j.bpobgyn.2023.102421.
[16] 林珊珊, 范江涛.机器人手术系统在妇科手术中的应用优势及技巧[J].实用妇产科杂志, 2023, 39(10): 724-727.
[17] 谢玲玲, 林仲秋.《2024 NCCN子宫肿瘤临床实践指南(第1版)》解读[J].中国实用妇科与产科杂志, 2023, 39(11): 1122-1127.
[18] 许天敏, 张师前, 向阳.妇科手术术前评估与准备的中国专家共识(2022年版)[J].中国实用妇科与产科杂志, 2022, 38(6): 622-627.
[19] 中华医学会妇产科分会病理学组, 中国研究型医院学会超微与分子病理学分会妇儿学组.子宫内膜癌保育治疗前后病理评估专家共识[J].中华病理学杂志, 2022, 51(11): 1110-1114.
[20] Cancer Genome Atlas Research Network; Kandoth C, Schultz N, et al. Integrated genomic characterization of endometrial carcinoma [J]. Nature, 2013, 497(7447): 67-73.
[21] 中国抗癌协会妇科肿瘤专业委员会, 中华医学会病理学分会, 国家病理质控中心.子宫内膜癌分子检测中国专家共识(2021年版)[J].中国癌症杂志, 2021, 31(11): 1126-1144.
[22] Caprini J A. Thrombosis risk assessment as a guide to quality patient care[J]. Dis Mon, 2005, 51(2-3): 70-78.
[23] Kondrup J, Rasmussen H H, Hamberg O, et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003, 22(3): 321-336.
[24] 徐帅, 刘淑娟, 王建六, 等.妇科手术后盆腹腔粘连预防及诊断的专家共识(2020年版)[J].中国微创外科杂志, 2020, 26(6): 481-488.
[25] Lundorff P, Brölmann H, Koninckx P R, et al. Predicting formation of adhesions after gynaecological surgery: development of a risk score[J]. Arch Gynecol Obstet, 2015, 292(4): 931-938.
[26] Scutiero G, Vizzielli G, Taliento C, et al. Influence of uterine manipulator on oncological outcome in minimally invasive surgery of endometrial cancer: a systematic review and meta-analysis[J]. Eur J Surg Oncol, 2022, 48(10): 2112-2118.
[27] Padilla-Iserte P, Lago V, Tauste C, et al. Impact of uterine manipulator on oncological outcome in endometrial cancer surgery[J]. Am J Obstet Gynecol, 2021, 224(1): 65.e1-65.e11.
[28] Eoh K J, Kim Y N, Nam E J, et al. Clinical relevance of uterine manipulation on oncologic outcome in robot-assisted versus open surgery in the management of endometrial cancer[J]. J Clin Med, 2023, 12(5): 1950.
[29] Quintana-Bertó R, Padilla-Iserte P, Lago V, et al. Endometrial cancer: predictors and oncological safety of tumor tissue manipulation [J]. Clin Transl Oncol, 2024, 26(5): 1098-1105.
[30] Sallée C, Lacorre A, Despoux F, et al. Use of uterine manipulator and uterine perforation in minimally invasive endometrial cancer surgery[J]. J Gynecol Obstet Hum Reprod, 2023, 52(7): 102621.
[31] 中国抗癌协会妇科肿瘤专业委员会.子宫内膜癌诊断与治疗指南(2021年版)[J].中国癌症杂志, 2021, 31(6): 501-512.
[32] 范江涛, 刘淑娟, 孙丹, 等.子宫内膜癌腹腔镜技术诊治指南(2023年版)[J].中国实用妇科与产科杂志, 2023, 39(3): 303-309.
[33] 中国研究型医院学会妇产科专业委员会.子宫内膜癌前哨淋巴结切除临床应用专家共识[J].中国妇产科临床杂志, 2020, 21(4): 438-440.
[34] Stelloo E, Nout R A, Osse E M, et al. Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer-combined analysis of the PORTEC cohorts [J]. Clin Cancer Res, 2016, 22(16): 4215-4224.
[35] Jamieson A, Thompson E F, Huvila J, et al. Endometrial carcinoma molecular subtype correlates with the presence of lymph node metastases[J]. Gynecol Oncol, 2022, 165(2): 376-384.
[36] Jamieson A, Huvila J, Chiu D, et al. Grade and estrogen receptor expression identify a subset of no specific molecular profile endometrial carcinomas at a very low risk of disease-specific death[J]. Mod Pathol, 2023, 36(4): 100085.
[37] Salehi S, Åvall-Lundqvist E, Legerstam B, et al. Robot-assisted laparoscopy versus laparotomy for infrarenal paraaortic lymphadenectomy in women with high-risk endometrial cancer: a randomised controlled trial [J]. Eur J Cancer, 2017, 79: 81-89. DOI: 10.1016/j.ejca.2017.03.038.
[38] Lee H J, Lee Y H, Chong G O, et al. Comparison of robotic-assisted versus laparoscopy for transperitoneal infrarenal para-aortic lymphadenectomy in patients with endometrial cancer[J]. J Obstet Gynaecol Res, 2018, 44(3): 547-555.
[39] Feuer G, Briskin C, Lakhi N. Robotic omentectomy in gynecologic oncology: surgical anatomy, indications, and a technical approach [J]. J Robot Surg, 2023, 17(4): 1381-1391.
[40] 山东省临床肿瘤学会妇科肿瘤专家委员会, 中国医师微无创医学专业委员会妇科肿瘤学组.妇科肿瘤患者围手术期静脉血栓栓塞症预防的专家共识(2022年版)[J].中华肿瘤防治妇杂志, 2022, 29(10): 687-694.
[41] 王雅卓, 王延洲, 王颖梅, 等.妇科恶性肿瘤腹腔镜穿刺孔部位转移中国专家共识(2023年版)[J].中国实用妇科与产科杂志, 2023, 39 (6): 626-632.
[42] 谢幸, 孔北华, 段涛.妇产科学[M].第九版.北京: 人民卫生出版社, 2019, 310.
收稿日期:2024-05-07
编辑:张笑嫣
基金项目:国家自然科学基金(81960464);广西重点研发计划(AB22080045)
Foundation Item: National Natural Science Foundation of China (81960464); Key Ramp;D Plan Project of Guangxi Zhuang Autonomous Region (AB22080045)
通讯作者:张师前,Email:r370012@126.com;范江涛,Email:jiangtao_fan1969@163.com
Corresponding Author: ZHANG Shiqian, Email: r370012@126.com; FAN Jiangtao, Email: jiangtao_fan1969@163.com
引用格式:中国医师协会微无创医学专业委员会妇科肿瘤学组,广西医学会妇产科学分会. 机器人辅助手术治疗子宫内膜癌中国专家共识(2025年版):附手术视频[J]. 机器人外科学杂志(中英文),2025,6(1):175-186.
Citation: Gynecologic Oncology Group of Minimally Invasive and Noninvasive Medicine Committee of CMDA, Obstetrics and Gynecology Branch of Guangxi Medical Association. Chinese expert consensus on robot-assisted surgery for endometrial cancer (2025): with surgical video[J]. Chinese Journal of Robotic Surgery, 2025, 6(1): 175-186.

