低温真空长时煮制时间对猪肉肌原纤维蛋白结构和特性的影响

摘要:为探究低温真空长时煮制时间对猪肉肌原纤维蛋白结构和特性的影响,选取猪背最长肌为实验对象,进行不同煮制时间下羰基含量、总巯基含量、SDS-PAGE、微观结构及蛋白质二级结构的测定与分析。随着热处理时间的增加,肌原纤维蛋白的羰基含量呈现上升趋势(Plt;0.05),总巯基含量呈现先上升后下降的趋势(Plt;0.05)。凝胶电泳结果显示,煮制时间为30 min时,肌原纤维蛋白肌球蛋白重链和肌球蛋白轻链条带颜色更浅。由扫描电镜结果可知,60 min时,肌原纤维蛋白聚集形成大量小颗粒聚集物,其破坏程度加深。随着热处理时间的增加,α螺旋相对含量减少,β折叠相对含量先下降后上升,β转角相对含量增加,无规则卷曲相对含量先上升后下降,蛋白质的二级结构由有序向无序转变。结果表明,随着热处理时间的增加,煮制60 min时肌原纤维蛋白结构的氧化与降解明显,煮制30 min时蛋白结构变化相对较小。该研究为低温真空长时煮制工艺提高猪肉产品品质提供了理论依据。
关键词:猪肉;肌原纤维蛋白;低温真空长时煮制;煮制时间;蛋白结构
中图分类号:TS251.51 文献标志码:A 文章编号:1000-9973(2025)01-0078-07
Effect of Low-Temperature Vacuum Long-Time Cooking Time on Structure and Characteristics of Pork Myofibrillar Protein
DU Wen-qing1,2,ZHANG Jia-min1,LIU Yan-yan1,2,TANG Li1,2,BAI Ting1,REN Chun-ping3,JI Li-li1*
(1.College of Food and Bioengineering, Chengdu University, Chengdu 610106, China; 2.Key Laboratory of Meat Processing in Sichuan Province, Chengdu University, Chengdu 610106, China; 3.Sichuan Goldkinn Industry Group Co., Ltd., Suining 629000, China)
Abstract: In order to investigate the effect of low-temperature vacuum long-time cooking time on the structure and characteristics of pork myofibrillar protein, the longest dorsal muscle of pigs is selected as the experimental object, and the carbonyl content, total sulfhydryl content, SDS-PAGE, microstructure and protein secondary structure are determined and analyzed under different cooking time. With the increase of heat treatment time, the carbonyl content of myofibrillar protein shows an increasing trend (Plt;0.05), and the total sulfhydryl content shows a trend of firstly increasing and then decreasing (Plt;0.05). The results of gel electrophoresis show that the color of myofibrillar protein myosin heavy chain and myosin light chain bands is lighter when the cooking time is 30 min. According to the scanning electron microscope results, myofibrillar protein aggregates to form a large number of small particle aggregates at 60 min, and the damage degree is deepened. With the increase of heat treatment time, the relative content of α helix decreases, the relative content of β folding firstly decreases and then increases, the relative content of β angle increases, the relative content of random coil firstly increases and then decreases, and the secondary structure of protein transforms from ordered to disordered. The results show that with the increase of heat treatment time, the oxidation and degradation of myofibrillar protein structure are obvious when being cooked for 60 min, while the change of myofibrillar protein structure when being cooked for 30 min is relatively small. This study has provided a theoretical basis for improving the quality of pork products through low-temperature vacuum long-time cooking technology.
Key words: pork; myofibrillar protein; low-temperature vacuum long-time cooking; cooking time; protein structure
收稿日期:2024-07-04
基金项目:国家农业产业技术体系四川生猪创新团队(scsztd-2024-08-07);川菜工业化四川省高等学校工程中心开放基金(GCZX22-35)
作者简介:杜汶清(2000—),女,硕士研究生,研究方向:农产品加工与安全。
*通信作者:吉莉莉(1982—),女,副教授,博士,研究方向:畜产品加工与质量控制。
低温真空长时煮制(low-temperature vacuum long-time cooking,LTLT)工艺是一种将原料经过真空包装后低温煮制的新型加工工艺,相比于传统烹饪方式,对肉类产品具有提高嫩度、消除高温蒸煮产生的有害物质、减少营养成分流失等优势[1]。低温真空长时煮制工艺在实际生产应用中会受到多种因素的影响,如温度参数设定、热处理时间、包装材料的真空度等[2]。其中,热处理时间对产品的口感与品质具有极大影响,在确保足够的热处理时间使食材中心完全达到所需温度的同时,也要确保产品获得最佳的品质。肌原纤维蛋白(myofibrillar protein,MP)是一种重要的结构蛋白,占肌肉总蛋白的55%~60%,具有水结合能力、乳化特性、凝胶形成能力等,对肉品的色泽、保水性和质地等具有关键作用[3],在一定程度上能引起蛋白质功能特性的变化[4]。其中,肌原纤维蛋白凝胶形成能力可直接影响肉制品的质构、持水性与感官特性。而在影响肌原纤维蛋白凝胶形成能力的因素中,温度尤为关键[5],原因在于肌球蛋白变性温度约在40~55℃,肌动蛋白变性温度约在70~85℃[6]。
低温真空长时煮制工艺的应用目前已十分广泛,其对鹅肉、鸡肉、牛肉与猪肉[7-10]等肉制品品质的影响已有一定的基础研究。但针对该工艺对肉制品肌原纤维蛋白变化规律影响的研究较少,因此,本实验以猪背最长肌为实验对象,探究低温真空长时煮制工艺下不同热处理时间对猪肉肌原纤维蛋白结构与特性的影响,为低温真空长时煮制工艺下肉类产品的品质变化与工艺优化提供了参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
猪背最长肌:四川高金实业集团股份有限公司。
1.1.2 实验仪器
GY-2B-6202真空包装机 江西赣云食品机械有限公司;BQPJ-Ⅰ切片机、BZZT-Ⅳ-150蒸煮桶 嘉兴艾博实业股份有限公司;HHS-11-4恒温水浴锅 上海博迅实业有限公司医疗设备厂;FleA-200酶标仪 杭州奥盛仪器有限公司;5977A-7890B气相色谱-质谱联用仪、PAL-RSI-85型CTC多功能自动进样器、DB-WAX色谱柱(30 m×250μm×0.25μm)、57347-U萃取头(50/30μm DVB/CAR/PDMS) 美国安捷伦公司。
1.2 实验方法
1.2.1 样品预处理
将购买的猪背最长肌置于-4℃冰箱中冷藏12 h,顺着肌纤维生长方向分割成长、宽、高为6.0 cm×1.5 cm×1.5 cm的猪肉条,于室温25℃下完全解冻后进行低温真空长时煮制。
1.2.2 工艺设置
设置真空热封时间1.8 s、抽气时间17~18 s、真空度0.09 MPa,随后放入67℃恒温水浴锅中加热60 min。
1.2.3 取样时间点位确定
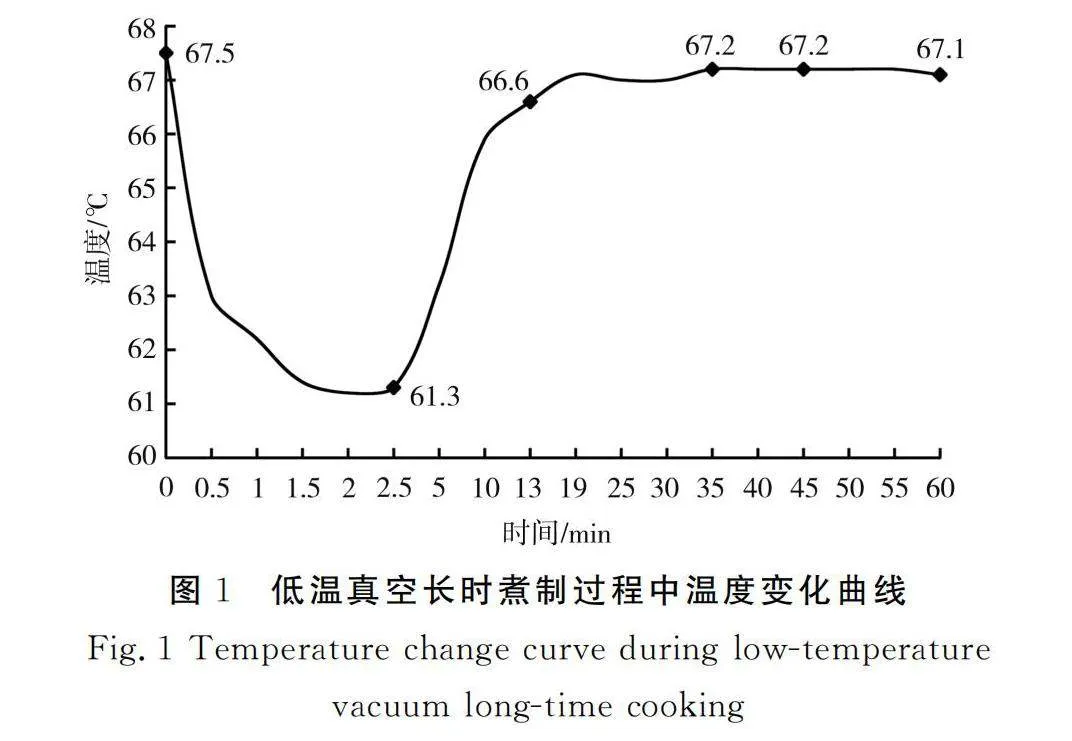
使用温度计监测煮制过程中温度的变化,根据温度变化曲线,取未热处理0 min(X)、煮制2.5 min(Y2.5)、13 min(Y13)、30 min(Y30)、45 min(Y45)、60 min(Y60)6个时间点观察猪肉的变化。
1.2.4 肌原纤维蛋白提取
肌原纤维蛋白的提取参考Xiong等[11]的方法。
1.2.5 肌原纤维蛋白羰基含量测定
取0.1 g各组肌原纤维蛋白样品,使用蛋白质羰基含量检测试剂盒测定其在412 nm处的吸光度。
1.2.6 肌原纤维蛋白总巯基含量测定
取0.1 g各组肌原纤维蛋白样品,使用总巯基含量检测试剂盒测定其在370 nm处的吸光度。
1.2.7 肌原纤维蛋白SDS-PAGE
参考Laemmli[12]的方法并稍作修改。配制5%浓缩胶与12%分离胶,并组装电泳槽后,将胶固定于槽内,缓慢加入电泳缓冲液,按照Marker、X、Y2.5、Y13、Y30、Y45和Y60的顺序依次加样。通电开始电泳,其中浓缩胶电泳条件为60 V、45 min,分离胶电泳条件为100 V、1.5 h,电泳结束后关闭电源。取出胶片置于考马斯亮蓝溶液中染色1 h,随后置于摇床,用UP水过夜脱色,最后将胶片置于BLT图像工作站成像并观察。
1.2.8 肌原纤维蛋白微观结构测定
称取适量膏状肌原纤维蛋白,使用梯度乙醇溶液各脱水10 min,然后冷冻干燥36 h,喷金,在适当SEM倍数下观察,拍照[13]。
1.2.9 肌原纤维蛋白二级结构测定
将冷冻干燥的蛋白样品与溴化钾(KBr)以1∶100的比例混合,在红外灯下用玛瑙杵和研钵将上述混合样品研磨成细粉并均匀分散在模具内,对其施加16 MPa的压力,保持1 min,将最终制成的透明片上机测试。光谱扫描范围为400~4 000 cm-1,分辨率设置为4 cm-1,扫描32次,用OMNIC 8.0 对红外图谱进行基线校正和标峰,并用Peakfit V4.12软件对1 600~1 700 cm-1范围内的酰胺Ⅰ带图谱进行去卷曲、二阶导和曲线拟合[14]。再对各二级结构对应的波长进行定位,根据每个峰的积分面积计算肌原纤维蛋白二级结构的相对含量[15-16]。
1.2.10 数据统计与分析
所有实验均重复3次,采用Microsoft Excel 2019制表,SIMCA 14.1、TBtools v1.098769和Origin 2021制图,采用IBM SPSS Statistics 26.0对数据进行显著性分析。
2 结果与分析
2.1 低温真空长时煮制时间对猪肉肌原纤维蛋白羰基含量的影响
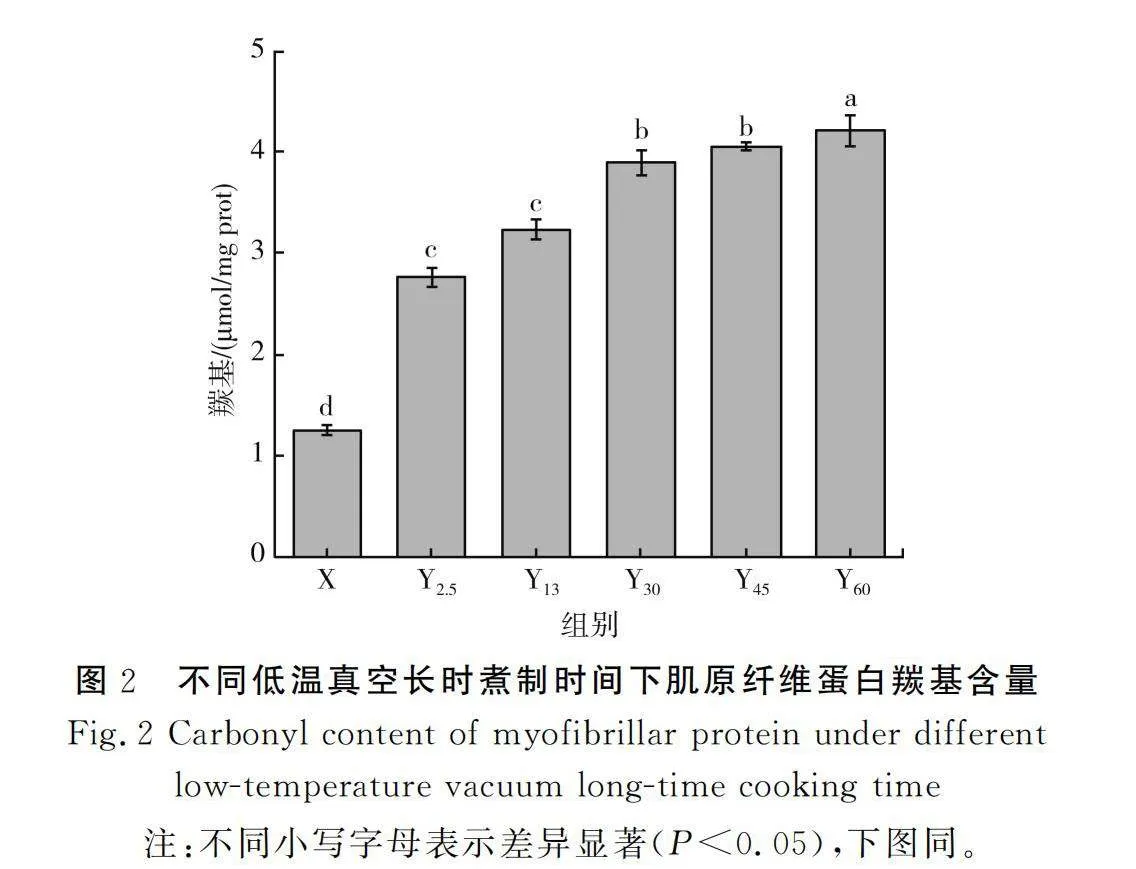
在低温真空长时煮制条件下,不同煮制时间下猪肉肌原纤维蛋白羰基含量的测定结果见图2。
由图2可知,随着煮制时间的增加,各样品羰基含量总体呈上升趋势(Plt;0.05);煮制2.5 min和13 min、煮制30 min和45 min样品之间的羰基含量无显著性差异(P>0.05);与煮制0 min的生鲜猪肉相比,煮制2.5,13,30,45,60 min的样品羰基含量分别增加了1.2,1.4,2,2.1,2.6倍,说明不同煮制时间下蛋白质的氧化变性程度不同,其中煮制60 min时样品的羰基化程度最剧烈,这与Roldan等[17]研究真空烹调羊里脊蛋白质氧化情况的结果相似。此外,Y60组的羰基含量比Y2.5、Y13、Y30和Y45组分别高59.19%、47.97%、18.57%、14.81%,说明随着煮制时间的延长,生肉变成熟肉,样品之间的羰基含量差异逐渐减小,这与Traore等[18]研究水煮猪肉蛋白氧化情况的结果相似。
2.2 低温真空长时煮制时间对猪肉肌原纤维蛋白总巯基含量的影响
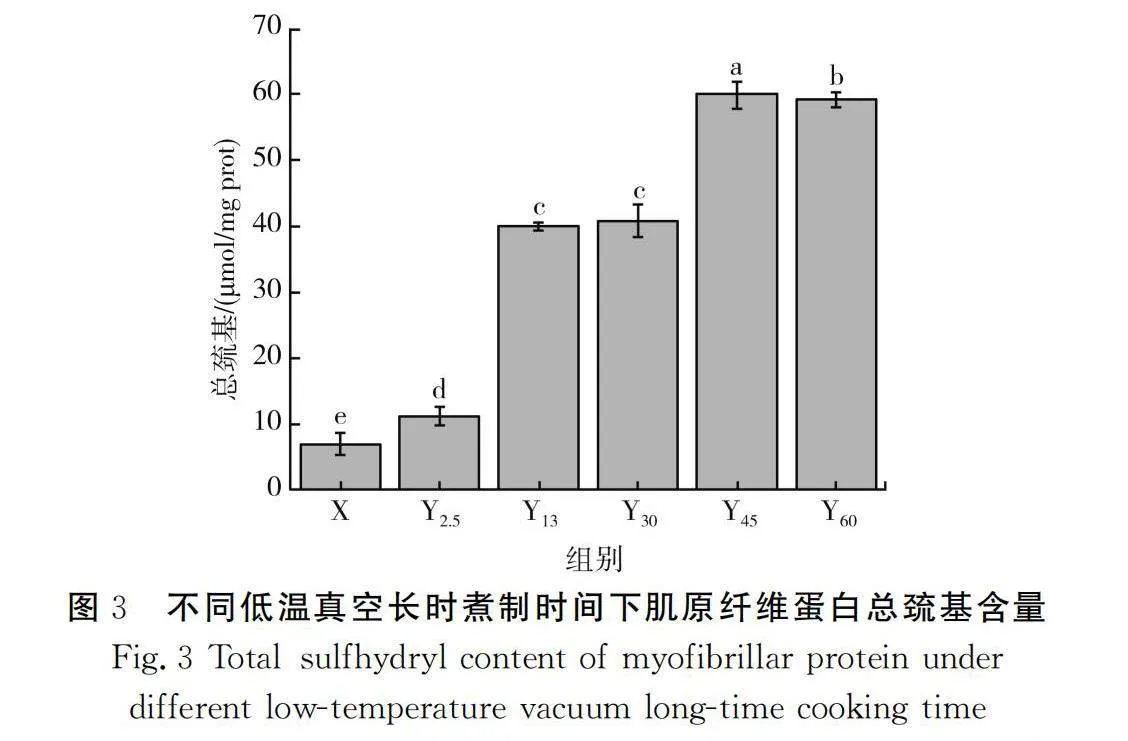
巯基是蛋白质的重要基团,蛋白质在热氧化过程中易被氧化成二硫键及多种硫氧化合物,使得巯基含量降低。不同煮制时间下猪肉肌原纤维蛋白总巯基含量的测定结果见图3。
由图3可知,随着煮制时间的增加,总巯基含量呈先上升后下降的趋势(Plt;0.05),煮制时间为45 min时,总巯基含量最高,为59.56μmol/mg prot。煮制前期总巯基含量上升可能是由于蛋白质受热变性,使蛋白质内部巯基基团暴露在外,导致总巯基含量上升[19]。但随着煮制时间的继续增加,蛋白分子内部暴露出来的巯基基团进一步被氧化成二硫键[20],导致总巯基含量降低。
2.3 低温真空长时煮制时间对猪肉肌原纤维蛋白SDS-PAGE的影响
低温真空长时煮制(0,2.5,13,30,45,60 min)下肌原纤维蛋白的SDS-PAGE电泳图见图4,可反映猪肉在低温真空长时煮制不同阶段肌原纤维蛋白的降解情况。
由图4可知,煮制时间对猪肉肌原纤维蛋白的降解和变性有显著影响(Plt;0.05)。随着煮制的开始,肌原纤维蛋白发生热变性,出现不同程度的降解和聚集,形成新的蛋白条带,同时部分蛋白条带颜色变浅或消失。
位于43 kDa和35 kDa处的肌动蛋白(Actin)和原肌球蛋白(TM)条带随着煮制时间的增加逐渐变宽、颜色加深,表明随着煮制时间的增加,提高了肌原纤维蛋白的降解程度,使之发生明显的扩散现象,促使猪肉肌原纤维蛋白溶出并降解,最终导致蛋白质分子质量改变[21]。Y30、Y45和Y60组都在60 kDa处形成了新的蛋白条带,表明随着煮制时间的延长,肌原纤维蛋白发生不同程度的变性与降解,导致新条带产生,这与孔保华等[22]的研究结果类似。对比6个泳道的肌球蛋白重链(MHC)条带,除Y30组外,其他组别所呈现的条带宽度与颜色区别并不显著,这与吴利芬等[23]的研究结果类似。同时,Y30组相比于其他5组条带宽度明显更细,可见煮制30 min时蛋白降解程度相比于其他时间更低。
2.4 低温真空长时煮制时间对猪肉肌原纤维蛋白微观结构的影响
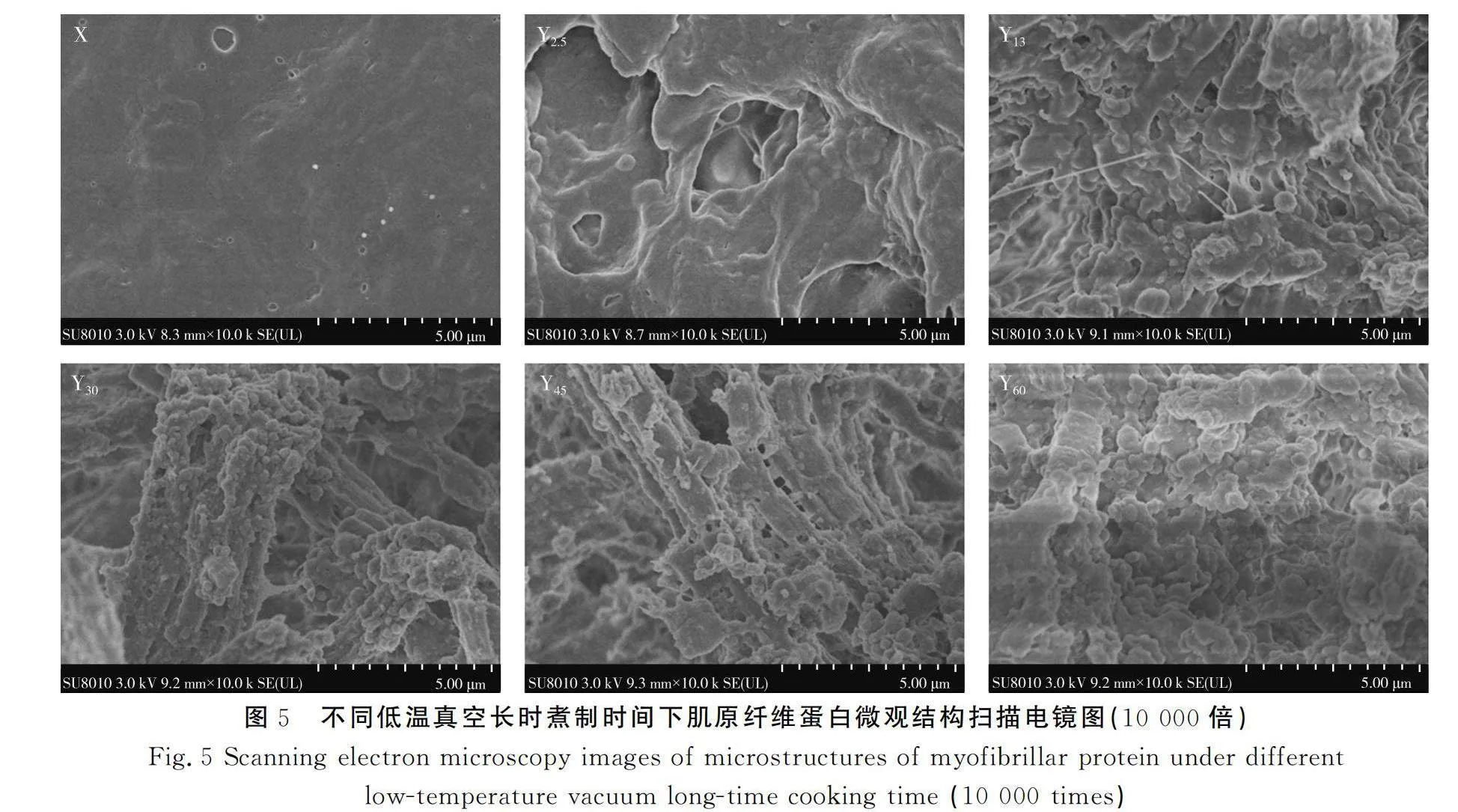
低温真空长时煮制下猪肉肌原纤维蛋白会发生不同程度的变性,导致蛋白质的结构遭到破坏。对不同低温真空煮制时间下肌原纤维蛋白的微观结构进行扫描电镜观察,结果见图5。
由图5可知,不同煮制时间下肌原纤维蛋白微观结构差异较大,X组为生鲜猪肉肌原纤维蛋白的微观结构,其肌原纤维蛋白结构饱满完整,聚集度好,表面光滑;Y2.5组肌原纤维蛋白结构发生变化,开始出现不规则孔洞,但表面相对光滑;Y13组肌原纤维蛋白呈现出大量边缘不规则的聚集物,部分表面光滑,开始变得粗糙;Y30组有类似长条状的纤维束,且表面附着大量饱满的小颗粒聚集物;Y45组能清楚观察到长条的纤维束,纤维束上的小颗粒聚集物减少,且边缘变得粗糙;Y60组的肌原纤维蛋白形成了大量不规则的小颗粒聚集物。与X组生鲜猪肉相比,其他5组的肌原纤维蛋白微观结构均有不同程度变化,表面均出现不同程度的小分子片状颗粒。
热处理对肌原纤维的微观结构具有破坏作用,由生到熟的过程中,肌内膜表面会出现小分子颗粒,可能是由于热处理会使肌浆蛋白变性而凝聚成颗粒状物质[24-25]。随着煮制时间的增加,猪肉肌原纤维蛋白的降解程度加深、变性程度更强,煮制60 min时,肌原纤维蛋白聚集形成不规则小颗粒聚集物,破坏程度加深[26]。
2.5 低温真空长时煮制时间对猪肉肌原纤维蛋白二级结构的影响
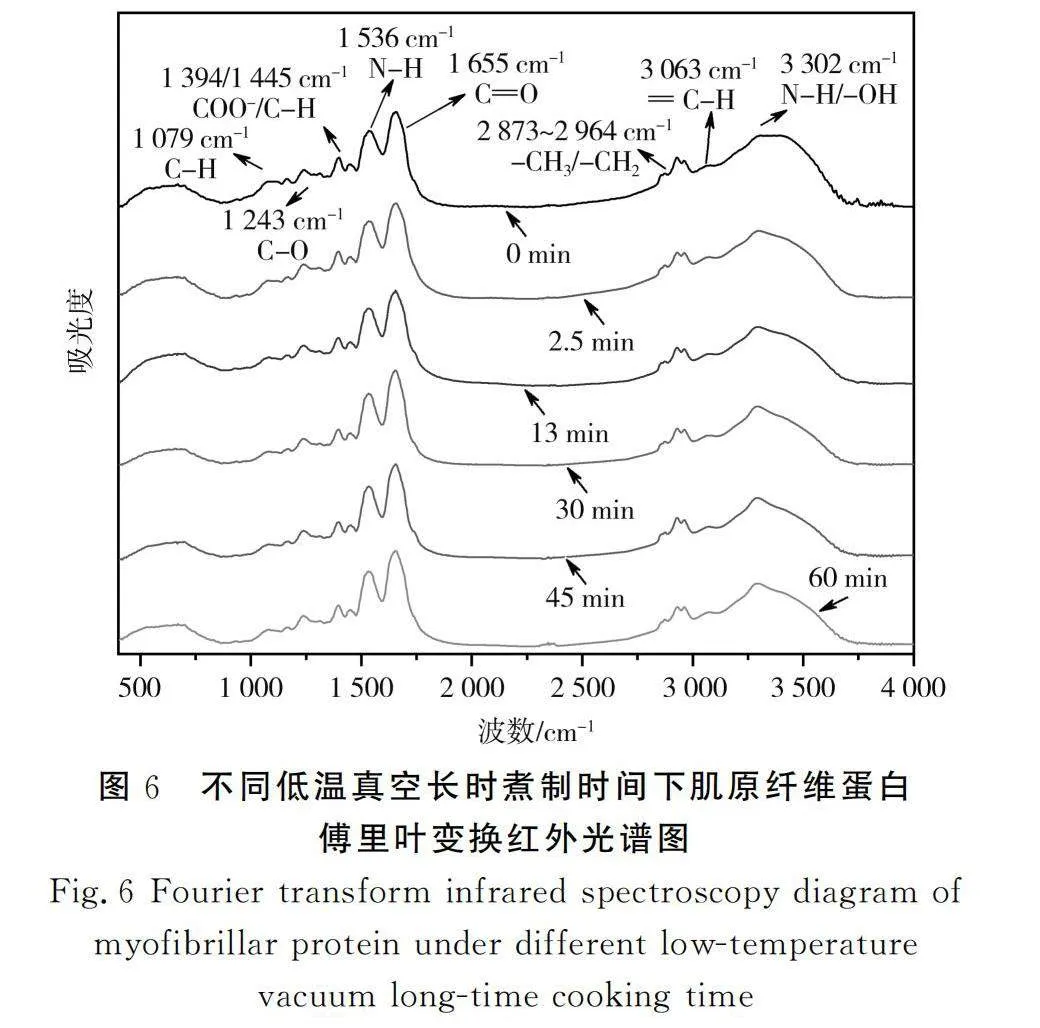
蛋白二级结构是指多肽主链骨架原子沿一定的轴盘旋或折叠而形成的特定的构象,即肽链主链骨架原子的空间位置排布,其主要形式包括α螺旋、β折叠、β转角和无规则卷曲[27]。利用傅里叶变换红外光谱仪(光谱范围400~4 000 cm-1)对各组样品的肌原纤维蛋白二级结构进行检测和分析,红外光谱图见图6。低温真空煮制0,2.5,13,30,45,60 min时样品的红外图谱特征峰并未发生明显变化,表明煮制时间并未明显改变蛋白质官能团的组成。但波长3 300 cm-1附近都有一个明显的吸收峰,这个吸收峰来源于蛋白质-OH和N—H的伸缩振动,该吸收峰的峰形较宽,且常受氢键的影响而发生偏移。3 063 cm-1附近均出现微弱吸收峰,来源于不饱和脂肪烃和芳香烃C—H的伸缩振动。2 873~2 964 cm-1波段出现的吸收峰的吸光度增加,这与蛋白质甲基和亚甲基的对称和不对称伸缩振动有关;1 600~1 700 cm-1和1 500 cm~1 600-1波段出现的特征吸收峰分别位于酰胺Ⅰ带和酰胺Ⅱ带,是蛋白质二级结构的典型特征,主要是由蛋白肽键(NH—CO)中CO的拉伸振动、N—H的弯曲振动和C—N的伸缩振动引起的;其中1 655 cm-1和1 536 cm-1附近的酰胺Ⅰ带和酰胺Ⅱ带分别属于β折叠(无序)和α螺旋(有序)。1 394 cm-1和1 445 cm-1处的特征峰包含蛋白肽键(NH—CO)中N—H的拉伸振动、氨基酸残基侧链基-COO-中CO的对称伸缩振动模式,同时还包含部分亚甲基的变形振动模式。1 243 cm-1处的特征峰主要与C—O结构的伸缩振动相关;1 079 cm-1附近的连续吸收峰主要与C—O的不对称伸缩振动相关。
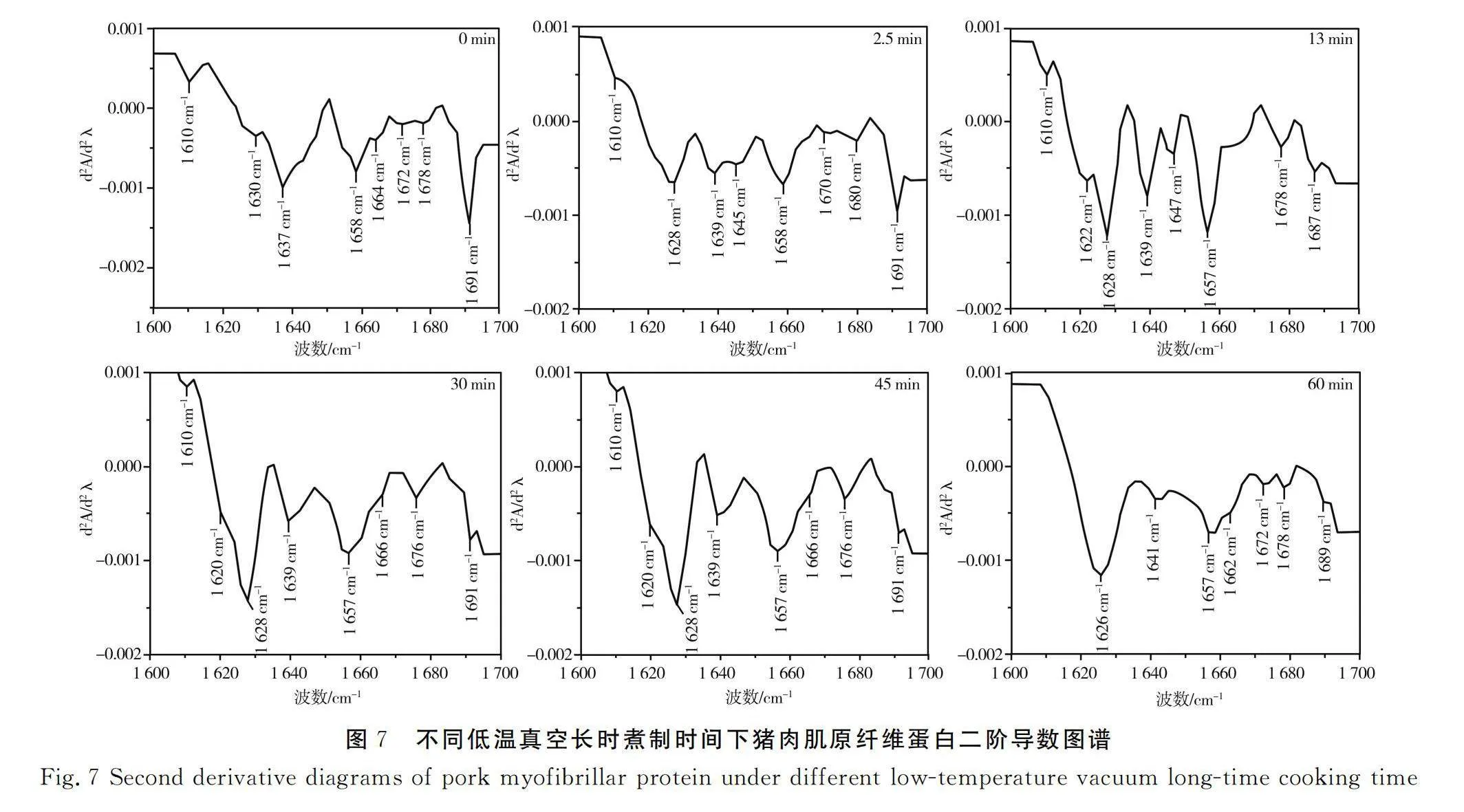
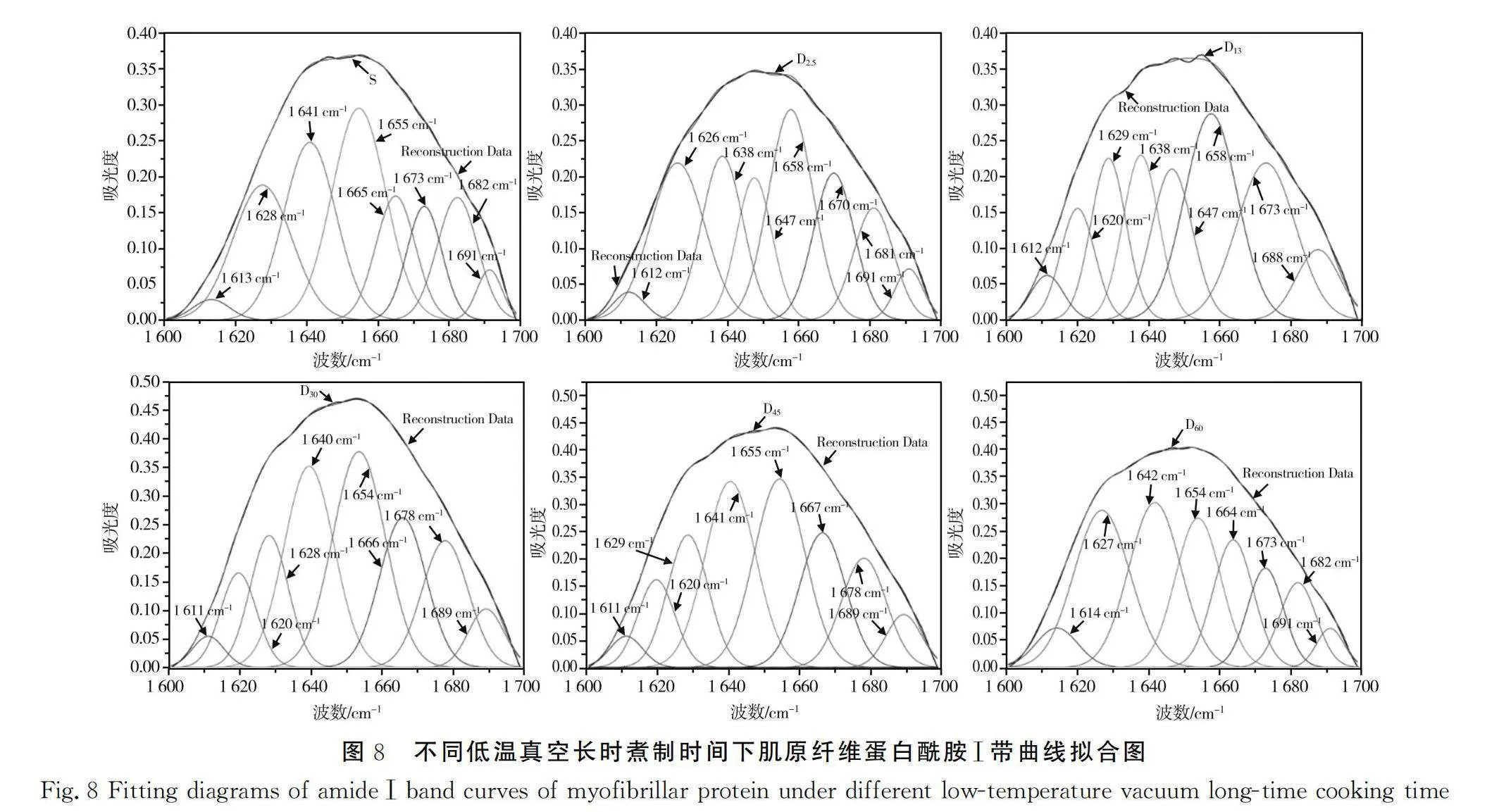
对比不同煮制时间下蛋白质二阶导数图谱,将各实验组肌原纤维蛋白的酰胺Ⅰ带放大,对其进行去卷积和平滑处理,结果见图7。由图7可知,不同煮制时间对猪肉肌原纤维蛋白二级结构产生影响,各组波数都出现红移和蓝移,还有新峰出现,说明随着煮制时间的增加,猪肉蛋白质二级结构发生变化。将不同煮制时间下蛋白样品的酰胺Ⅰ带进行拟合,计算α螺旋、β折叠、β转角和无规则卷曲的比例。
不同低温真空煮制时间下肌原纤维蛋白酰胺Ⅰ带曲线拟合图见图8。由图8可知,各样品组对应峰的宽度、高度和峰面积不同,部分重叠的峰或小肩峰明显分离,说明不同煮制时间下蛋白质的结构发生了明显变化,同时反映出不同煮制时间下各样品组蛋白结构的变化特征。因此,不同低温真空煮制时间下猪肉肌原纤维蛋白二级结构随着煮制时间的增加发生变化。
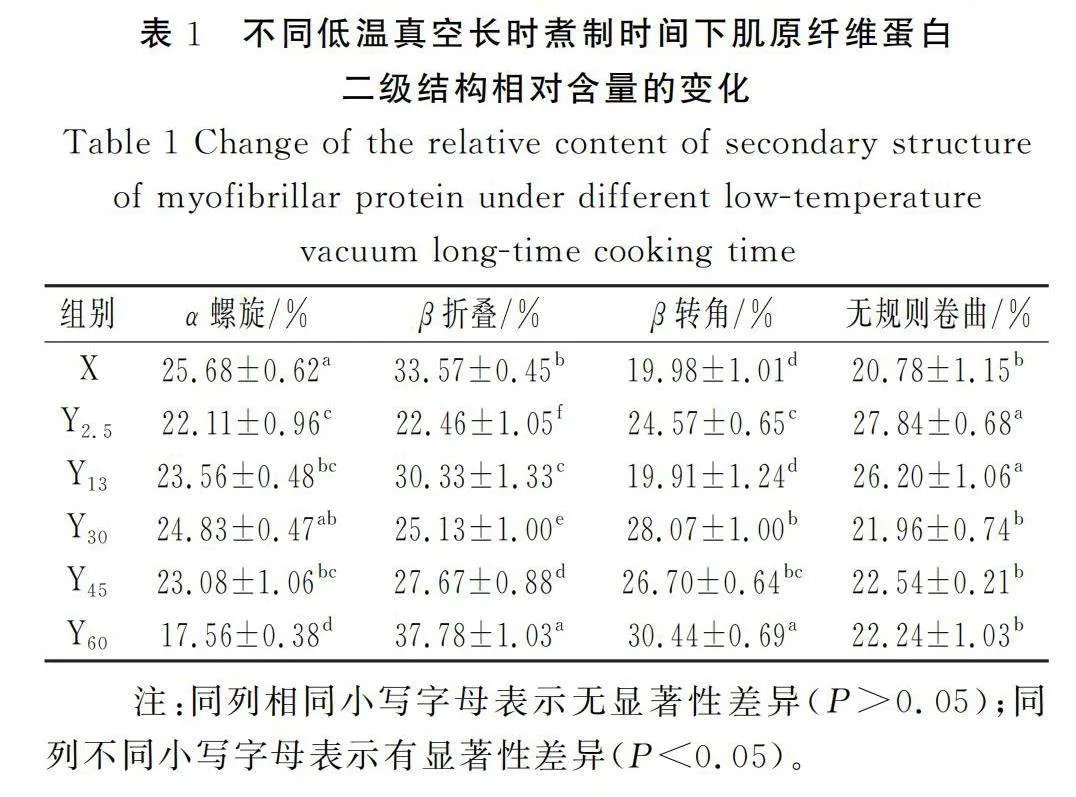
不同低温真空煮制时间下肌原纤维蛋白二级结构相对含量见表1,X组(未加热)样品蛋白质的主要结构是β折叠(33.57%),其次是α螺旋(25.68%)、无规则卷曲(20.78%)和β转角(19.98%)。随着煮制时间的延长,蛋白质二级结构的相对含量发生变化。蛋白质二级结构中α螺旋的相对含量整体呈下降趋势(Plt;0.05),其中煮制2.5,13,30,45,60 min的样品相较于X组的α螺旋相对含量分别下降了13.90%、8.26%、3.31%、10.12%、31.62%,说明在煮制60 min的条件下对有序的α螺旋影响最大;β折叠相对含量变化除煮制60 min增加12.57%(Plt;0.05)外,其他样品总体呈下降趋势(Plt;0.05),其中煮制2.5,13,30,45 min的β折叠相对含量分别下降了33.10%、9.64%、25.12%、17.55%;β转角相对含量除煮制13 min下降了0.33%(Plt;0.05)外,其他样品组(Y2.5、Y30、Y45和Y60组)呈上升趋势,分别上升了22.99%、40.52%、33.66%、52.38%(Plt;0.05);无规则卷曲相对含量的变化相较于X组呈上升趋势,其中煮制2.5,13 min上升趋势明显(Plt;0.05),分别上升了33.98%和26.08%,而其他组的相对含量相较于X组没有显著性差异(Plt;0.05)。
综合上述分析,不同煮制时间下蛋白质二级结构的变化较复杂,总体表现为α螺旋相对含量减少,β折叠相对含量先下降后上升,β转角相对含量增加,无规则卷曲相对含量先上升后下降。加热使α螺旋结构解开[28],疏水性氨基酸暴露,肌原纤维蛋白间疏水相互作用改变,蛋白质结构从有序向无序转变[29]。无规则卷曲相对含量随着热处理时间的延长呈先上升后下降的趋势,蛋白质分子结构从有序向松散状态转化。
3 结论
本研究探讨了低温真空长时煮制工艺条件下,不同煮制时间对猪肉肌原纤维蛋白的影响。相较于生鲜猪肉,随着煮制时间的增加,羰基含量呈稳步上升趋势,总巯基含量先上升后下降,羰基和总巯基含量的最大值分别为煮制60 min时的4.21μmol/mg prot和煮制45 min时的59.56μmol/mg prot。肌原纤维蛋白结构也由表面光滑且紧致的多孔结构转变为表面粗糙的网状结构,进而出现大量小分子片状颗粒。SDS-PAGE电泳结果显示,煮制30 min时蛋白降解程度相比于其他时间更低。蛋白质二级结构总体表现为随着加热时间的增加,α螺旋相对含量减少,β折叠相对含量先下降后上升,β转角相对含量增加,无规则卷曲相对含量先上升后下降,煮制60 min时α螺旋相对含量显著最低,β折叠与β转角相对含量显著最高。综上所述,低温真空长时煮制对猪肉肌原纤维蛋白产生显著影响,煮制60 min时样品的肌原纤维蛋白降解聚集程度显著最高,对蛋白结构的影响最大,煮制30 min对蛋白的影响程度相对较低。此研究为明确低温真空长时煮制工艺对猪肉蛋白质分子结构的具体影响提供了理论依据,并为猪肉制品的品质提升与研究应用提供了理论支撑。
参考文献:
[1]刘欣睿,孔保华,夏秀芳,等.低温慢煮对肉制品食用品质及货架期影响的研究进展[J].肉类研究,2022,36(12):49-56.
[2]张凯华,臧明伍,李丹,等.真空低温蒸煮技术在动物源性食品中的应用进展[J].肉类研究,2016,30(12):35-40.
[3]王发祥,张付兰,刘永乐,等.草鱼冷藏过程中肌原纤维蛋白的变化[J].食品工业科技,2015,36(18):82-86.
[4]韩格,孔保华.功率超声对肌原纤维蛋白功能特性及肉品品质的影响研究进展[J].食品科学,2022,43(13):361-369.
[5]李甜甜,谭青玲,卢家维,等.真空低温烹饪温度对肌原纤维蛋白凝胶特性和结构的影响[J].食品与发酵工业,2024,50(18):240-246.
[6]陈美玉.基于水分迁移及肌原纤维蛋白特性研究真空低温加热对牛肉品质的影响[D].杭州:浙江大学,2021.
[7]WEREN'SKA M, WOŁOSZYN J, OKRUSZEK A, et al. The effects of sous-vide, microwave cooking and stewing of goose meat on fatty acid profile and lipid indices[J].Poultry Science,2023,102(2):102337.
[8]刘欣睿,王美娟,计云龙,等.低温慢煮时间对即食鸡胸肉品质及消化特性的影响[J].食品工业科技,2024,45(3):114-122.
[9]卢雪松,彭毅秦,刘春燕,等.牦牛酸醡肉的低温慢煮工艺优化及风味轮廓分析[J].美食研究,2023,40(1):66-72.
[10]昝博文.预制调理工艺对猪肉品质特性的影响研究[D].成都:成都大学,2023.
[11]XIONG Y L, BREKKE C J. Gelation properties of chicken myofibrils treated with calcium and magnesium chlorides[J].Journal of Muscle Foods,1991,2(1):21-36.
[12]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[13]郭丽萍.超高压结合热处理对猪肉蛋白质氧化、结构及特性的影响[D].绵阳:西南科技大学,2016.
[14]YANG K, ZHOU Y H, GUO J J, et al. Low frequency magnetic field plus high pH promote the quality of pork myofibrillar protein gel: a novel study combined with low field NMR and Raman spectroscopy[J].Food Chemistry,2020,326:126896.
[15]DONG X, WANG J, RAGHAVAN V. Impact of microwave processing on the secondary structure, in-vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei) proteins[J].Food Chemistry,2021,337:127811.
[16]XIA S G, XUE Y, XUE C H, et al. Structural and rheological properties of meat analogues from Haematococcus pluvialis residue-pea protein by high moisture extrusion[J].LWT-Food Science and Technology,2022,154:112756.
[17]ROLDAN M, ANTEQUERA T, ARMENTEROS M, et al. Effect of different temperature-time combinations on lipid and protein oxidation of sous-vide cooked lamb loins[J].Food Chemistry,2014,149:129-136.
[18]TRAORE S, AUBRY L, GATELLIER P, et al. Effect of heat treatment on protein oxidation in pig meat[J].Meat Science,2012,91(1):14-21.
[19]徐永霞,王瑞,李学鹏,等.热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J].中国食品学报,2020,20(9):131-138.
[20]LIU R, ZHAO S M, XIE B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J].Food Hydrocolloids,2011,25(5):898-906.
[21]马军,古丽孜亚·吐尔斯别克,祖木来提·热西提,等.不同腌制方式对羊肉肌原纤维蛋白结构和特性的影响[J].食品与发酵工业,2024,50(22):239-245.
[22]孔保华,王宇,夏秀芳,等.加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J].食品科学,2011,32(5):50-54.
[23]吴利芬,张立彦,汪媛,等.加热温度和含水量对猪肉及其蛋白质特性的影响[J].肉类研究,2018,32(10):12-18.
[24]李美莹,高慎阳,李琳,等.不同熟制方式下调理鸡排蛋白质结构及水相分布的变化[J].现代食品科技,2022,38(11):234-239.
[25]ASTRUC T, GATELLIER P, LABAS R, et al. Microstructural changes in m. rectus abdominis bovine muscle after heating[J].Meat Science,2010,85(4):743-751.
[26]臧大存,周光宏,徐幸莲,等.加热过程中鸭肉嫩度及超微结构的变化[J].江苏农业学报,2007(5):475-480.
[27]张兴,杨玉玲,马云,等.pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J].中国农业科学,2017,50(3):564-573.
[28]CHAN J K, GILL T A, PAULSON A T. The dynamics of thermal denaturation of fish myosins[J].Food Research International,1992,25(2):117-123.
[29]LIU R, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J].Food Chemistry,2010,121(1):196-202.

