盐胁迫对白羊草幼苗线粒体抗氧化性能的影响


摘要:为探讨盐胁迫对白羊草(Bothriochloa ischaemum)幼苗线粒体抗氧化性能的影响,以期为培育耐盐白羊草新品种提供理论依据。试验以白羊草种子为材料,在Na+浓度为0(CK),10,30,90 mmol·L-1的盐胁迫下进行萌发试验,分析其幼苗线粒体抗氧化酶活性及脂质过氧化含量的变化规律。结果表明:随着Na+浓度的增加,白羊草幼苗胚根和胚芽线粒体超氧化物歧化酶(Superoxide dismutase,SOD),过氧化氢酶(Catalase,CAT),谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)活性均高于CK,谷胱甘肽巯基转移酶,谷胱甘肽还原酶活性逐渐降低,胚根线粒体抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性显著降低(Plt;0.05),而胚芽线粒体APX活性先升高后降低,H2O2和丙二醛含量逐渐升高。盐胁迫对白羊草幼苗不同部位线粒体抗氧化性能的影响存在差异,胚根线粒体比胚芽更敏感,SOD,CAT,GPX是维持盐胁迫下白羊草幼苗线粒体ROS动态平衡的关键酶。
关键词:白羊草;盐胁迫;幼苗;线粒体;抗氧化性能
中图分类号:S603.4""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2498-07
Effects of Salt Stress on Mitochondrial Antioxidant Resistance of
Bothriochloa ischaemum Seedlings
LI Yin-lin#, CHEN Yi-lin#, XIA Fang-shan*, ZHONG Hua, CEN Hui-fang
(College of Grassland Science, Shanxi Agricultural University, Taigu, Shanxi Province 030801, China)
Abstract:In order to explore the effects of salt stress on mitochondrial antioxidant resistance of Bothriochloa ischaemum seedlings and provide a theoretical basis for breeding new salt-tolerant varieties of Bothriochloa ischaemum,the seeds of Bothriochloa ischaemum were used as materials to conduct germination experiment under different concentration of Na+ (0(CK),10,30,90 mmol·L-1). The changes of mitochondrial antioxidant enzyme activities and lipid peroxidation contents in seedlings were analyzed. The results showed that the activities of superoxide dismutase (SOD),catalase (CAT) and glutathione peroxidase (GPX) in mitochondria of radicle and plumule were higher under the Na+ treatments than CK,but as the concentration of Na+ increased,the the activities of glutathione S-transferase and glutathione reductase gradually decreased,the ascorbate peroxidase (APX) activity of mitochondria in radicle decreased significantly (Plt;0.05),the APX activity of mitochondria in plumule increased firstly and then decreased,and their contents of H2O2 and malondialdehyde increased gradually. Salt stress had different effects on the antioxidant resistance of mitochondria in different parts of Bothriochloa ischaemum seedlings,and the mitochondria in radicle was more sensitive than that in plumule. SOD,CAT and GPX were the key enzymes to maintain the ROS homeostasis of mitochondria in Bothriochloa ischaemum seedlings under salt stress.
Key words:Bothriochloa ischaemum;Salt stress;Seedling;Mitochondria;Antioxidant resistance
土地盐碱化是当下农业生产面临的一个世界性难题,严重制约着全球生态建设和社会经济的高质量发展,进而影响到人类生活质量的提升[1]。中国的盐碱地分布广泛[2],并以西北、华北、东北及沿海滩涂地区最为严重[3]。盐碱地中往往伴随发生着盐胁迫和碱胁迫,但盐胁迫主要由NaCl和Na2SO4引起,而碱胁迫主要由Na2CO3和NaHCO3引起[4-5]。种子萌发及幼苗建成是植物生命周期中对逆境胁迫响应最关键的阶段[6]。轻度盐碱胁迫下,植物的种子萌发、植株生长发育及产量等都会受到影响,而严重盐碱胁迫时,植物出现早衰甚至死亡[7]。盐碱胁迫会造成植物体内营养缺失、水分缺乏及离子失衡等,并引起氧化胁迫而产生大量活性氧(Reactive oxygen species,ROS),致使植物体内抗氧化系统与ROS积累的失衡[8],从而导致细胞蛋白质、脂类、核酸和质膜的氧化损伤,甚至细胞凋亡[9-11]。近年来,关于盐碱胁迫下抗氧化能力的变化在辣椒(Capsicum annuum)[12]、番茄(Lycopersicon pennellii)[13]、碱蓬(Suaeda salsa)[14]等植物中均有研究。目前,培育耐盐碱植物新品种成为科学工作者的研究热点和重点,这对盐碱地区的农业发展具有重要的生态效益和经济效益[15]。
线粒体是植物体内最主要的细胞器之一,是细胞物质代谢和能量代谢的主要场所,也是产生ROS的最主要位点[16-17]。超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)及抗坏血酸(Ascorbic acid,AsA)-谷胱甘肽(Glutathione,GSH)循环是线粒体中清除ROS的重要途径[17]。SOD主要是催化超氧阴离子生成H2O2和O2;CAT可直接催化H2O2生成H2O和O2,AsA-GSH循环中抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)以AsA为电子供体催化H2O2还原成H2O,而GSH被脱氢抗坏血酸还原酶还原成氧化型谷胱甘肽(Glutathione oxidized,GSSG),而GSSG可以通过谷胱甘肽还原酶(Glutathione reductase,GR)还原成GSH来维持GSH库的持续还原能力;谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)则通过GSH来清除H2O[17-19]2。近年来,关于逆境对植物线粒体抗氧化性能影响的研究主要涉及低温胁迫[20]、低氧胁迫[21]、硝酸钙胁迫[22]等方面,而关于盐碱胁迫方面的影响则鲜有报道。因此,研究盐胁迫下植物线粒体抗氧化性能的变化规律,对于揭示植物响应盐碱胁迫的抗氧化机制具有重要意义。
白羊草(Bothriochloa ischaemum)为禾本科孔颖草属暖季型多年生草本植物,是干旱半干旱地区草地建植的主要禾草种质资源,也是退化草地恢复和碳储存的重要物种[23-24]。白羊草喜沙壤土环境,具有须根发达、分蘖力强、耐旱、耐践踏、固土保水力强等特性,是黄土高原丘陵区植被恢复过程中重要的乡土草种之一[25-26]。重视白羊草的开发和利用,对其种质资源的保护及山西乃至全国的畜牧业发展和生态建设提供有力保障。山西省共有盐碱地2.62×105 hm2,占平川土地总面积的9.9%[27]。因此,探究白羊草种质资源耐盐碱利用机理,对山西省及其周边区域的生态草牧业高质量发展具有至关重要的作用。目前关于耐盐碱白羊草的研究主要体现在种子活力[28]、地上部叶片生理特性方面[29],尚未发现关于其幼苗线粒体抗氧化性能方面的研究。试验分析两种盐及不同Na+浓度对白羊草幼苗胚根和胚芽线粒体抗氧化性能的影响,探究盐胁迫下白羊草幼苗胚根和胚芽线粒体内ROS产生与清除平衡的内在原因,以期为进一步开展耐盐白羊草新品种培育提供参考依据。
1 材料与方法
1.1 材料来源
供试材料为‘太行’白羊草种子,由山西农业大学草业学院草类植物育种与种子科学实验室收集于2019年10月,于-20℃条件下密封保存至2021年8月试验进行。
1.2 试验处理
1.2.1 发芽试验及幼苗获取处理 挑选去除内外稃后均匀饱满的白羊草种子,每100粒放入一个置有双层滤纸的消毒培养皿中,分别加入4 mL Na+浓度为0(CK),10,30,90 mmol·L-1的NaCl和Na2SO4溶液后称重,在25℃恒温光照培养箱中进行发芽试验,每天添加蒸馏水以保持恒重,发芽12 d后获得幼苗样品[30],在-80℃条件下密封保存以备试验。每个处理重复4次。
1.2.2 线粒体提取 分离幼苗胚根和胚芽,并分别称取0.1 g样品。参照Yin等[31]的方法,进行线粒体的提取。线粒体提取液在4℃条件下保存备用。
1.3 指标测定
SOD活性的测定参照Beyer等[32]的方法,CAT活性的测定参照Aebi[33]的方法,APX活性的测定参照Nakano等[34]的方法,GPX活性的测定参照Flohé等[35]的方法,谷胱甘肽巯基转移酶(Glutathione S-transferase,GST)活性的测定参照Nagalakshmi等[36]的方法,GR活性的测定参照Madamanchi等[37]的方法,丙二醛(Malondialdehyde,MDA)含量的测定参照Bailly等[38]的方法,可溶性蛋白及H2O2含量的测定使用南京建成科技有限公司生产的试剂盒进行。
1.4 数据处理与统计分析
采用Excel 2010软件对试验数据进行初步整理,利用SPSS 22.0软件进行单因素方差分析,多重比较用Duncans法(Plt;0.05),采用Origin 2018软件进行作图。以“平均值±标准误”表示最后结果。
2 结果与分析
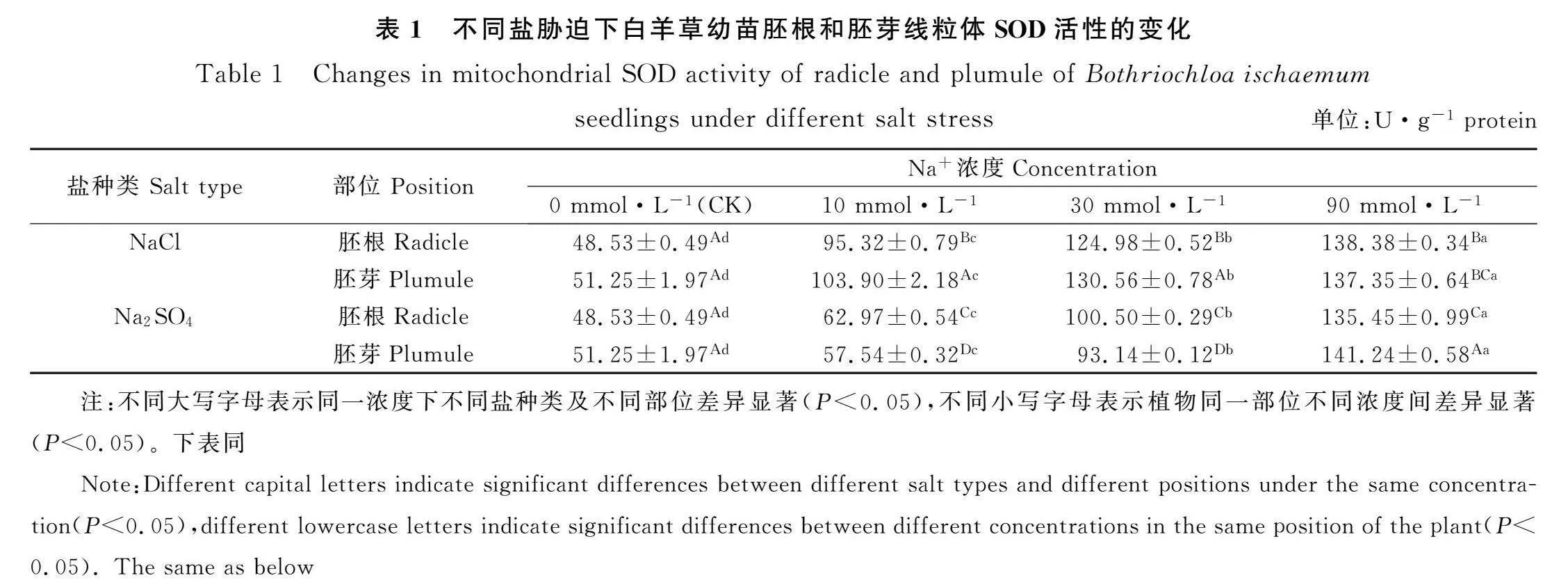
2.1 盐胁迫对白羊草幼苗线粒体SOD活性的影响
由表1可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体SOD活性随着Na+浓度的增加均呈现显著上升的趋势(Plt;0.05)。Na+浓度为0 mmol·L-1时,NaCl和Na2SO4胁迫的白羊草幼苗胚根和胚芽线粒体SOD活性差异不显著;Na+浓度为10和30 mmol·L-1时,NaCl胁迫下的白羊草幼苗胚芽线粒体SOD活性显著高于胚根线粒体SOD活性(Plt;0.05),Na2SO4胁迫下的白羊草幼苗胚根线粒体SOD活性显著高于胚芽线粒体SOD活性(Plt;0.05);Na+浓度为90 mmol·L-1时,NaCl胁迫下的白羊草幼苗胚根和胚芽线粒体SOD活性之间差异不显著,Na2SO4胁迫下的白羊草幼苗胚芽线粒体SOD活性显著高于胚根线粒体SOD活性(Plt;0.05)。
2.2 盐胁迫对白羊草幼苗线粒体CAT活性的影响
由表2可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体CAT活性随着Na+浓度的增加均呈现逐渐上升的趋势。Na+浓度为0和10 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚根线粒体CAT活性均显著高于胚芽线粒体CAT活性(Plt;0.05);Na+浓度为30 mmol·L-1时,NaCl和Na2SO4胁迫的白羊草幼苗胚根和胚芽线粒体CAT活性之间差异不显著;Na+浓度为90 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚芽线粒体CAT活性均显著高于胚根线粒体CAT活性(Plt;0.05)。
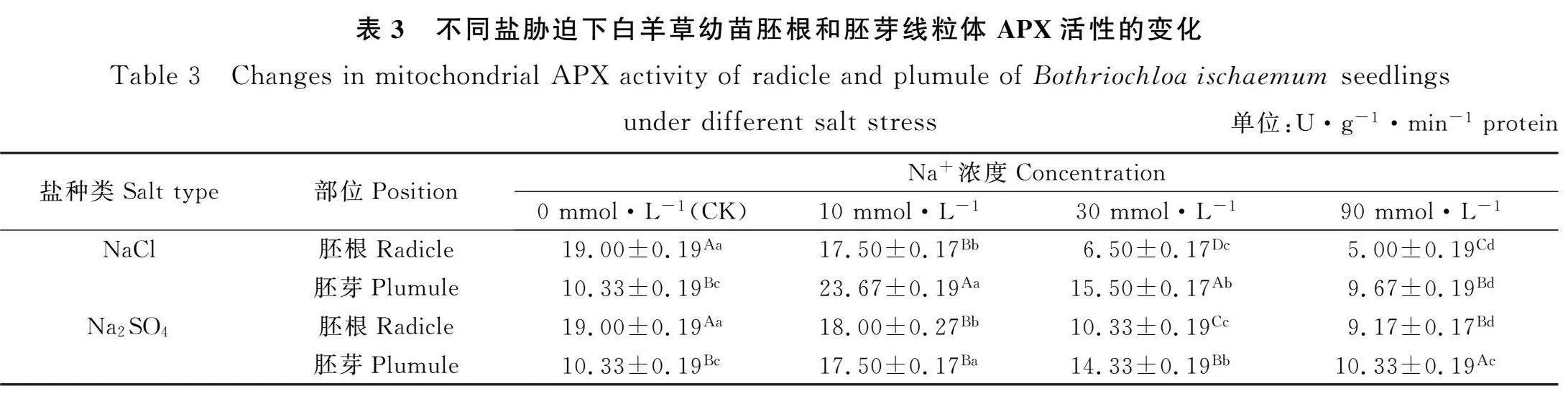
2.3 盐胁迫对白羊草幼苗线粒体APX活性的影响
由表3可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根线粒体APX活性随着Na+浓度的增加呈现显著下降的趋势(Plt;0.05),而白羊草幼苗胚芽线粒体APX活性随着Na+浓度的增加呈现先上升后下降的趋势,且Na+浓度为10 mmol·L-1时的胚芽线粒体APX活性显著高于其他浓度时(Plt;0.05)。Na+浓度为0 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚根线粒体APX活性均显著高于胚芽线粒体APX活性(Plt;0.05);Na+浓度为10 mmol·L-1时,NaCl胁迫下的白羊草幼苗胚芽线粒体APX活性显著高于胚根线粒体APX活性(Plt;0.05),Na2SO4胁迫下的白羊草幼苗胚根和胚芽线粒体APX活性之间差异不显著;Na+浓度为30和90 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚芽线粒体APX活性均显著高于胚根线粒体APX活性(Plt;0.05)。
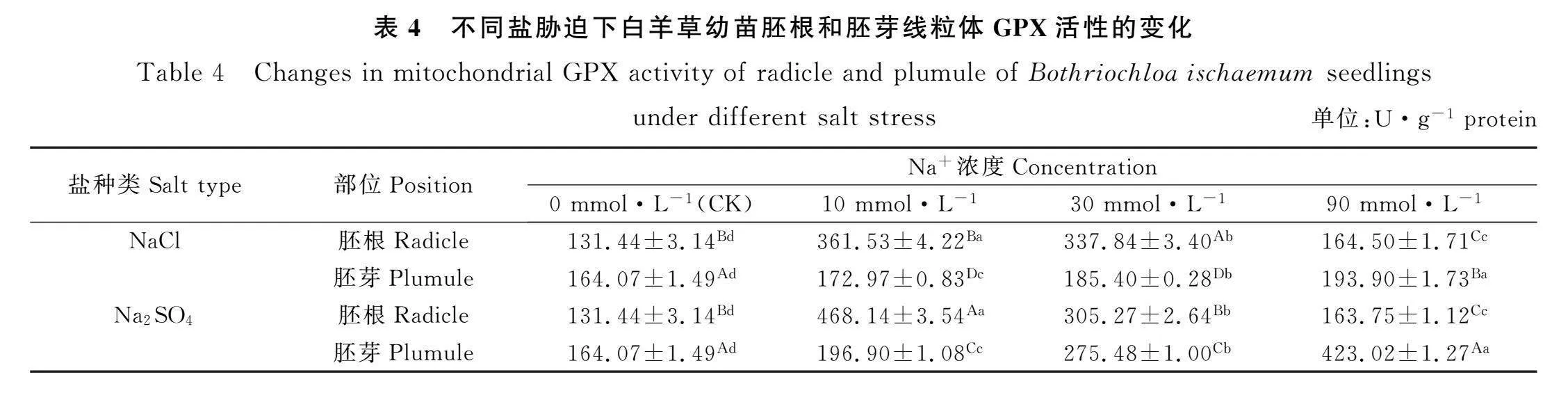
2.4 盐胁迫对白羊草幼苗线粒体GPX活性的影响
由表4可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根线粒体GPX活性随着Na+浓度的增加呈现先上升后下降的趋势,且Na+浓度为10 mmol·L-1时的胚根线粒体GPX活性显著高于其他浓度时(Plt;0.05),而白羊草幼苗胚芽线粒体GPX活性随着Na+浓度的增加呈现显著上升的趋势(Plt;0.05)。Na+浓度为0 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚芽线粒体GPX活性均显著高于胚根线粒体GPX活性(Plt;0.05);Na+浓度为10和30 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚根线粒体GPX活性均显著高于胚芽线粒体GPX活性(Plt;0.05);Na+浓度为90 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚芽线粒体GPX活性均显著高于胚根线粒体GPX活性(Plt;0.05)。
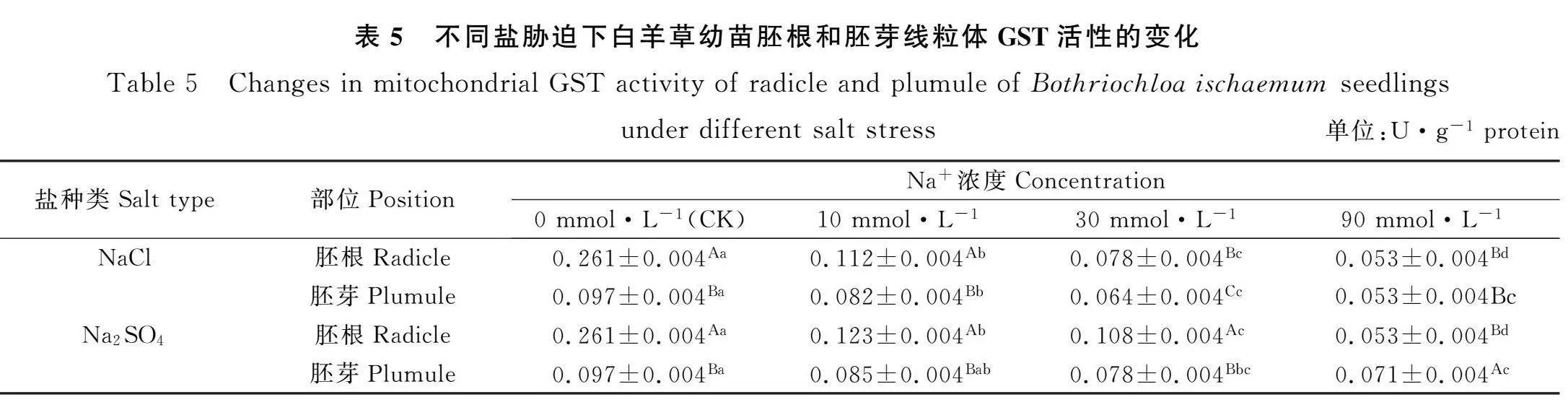
2.5 盐胁迫对白羊草幼苗线粒体GST活性的影响
由表5可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体GST活性随着Na+浓度的增加均呈现逐渐下降的趋势。Na+浓度为0,10和30 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚根线粒体GST活性均显著高于胚芽线粒体GST活性(Plt;0.05);Na+浓度为90 mmol·L-1时,NaCl胁迫下的白羊草幼苗胚根和胚芽线粒体GST活性之间差异不显著,Na2SO4胁迫下的白羊草幼苗胚芽线粒体GST活性显著高于胚根线粒体GST活性(Plt;0.05)。
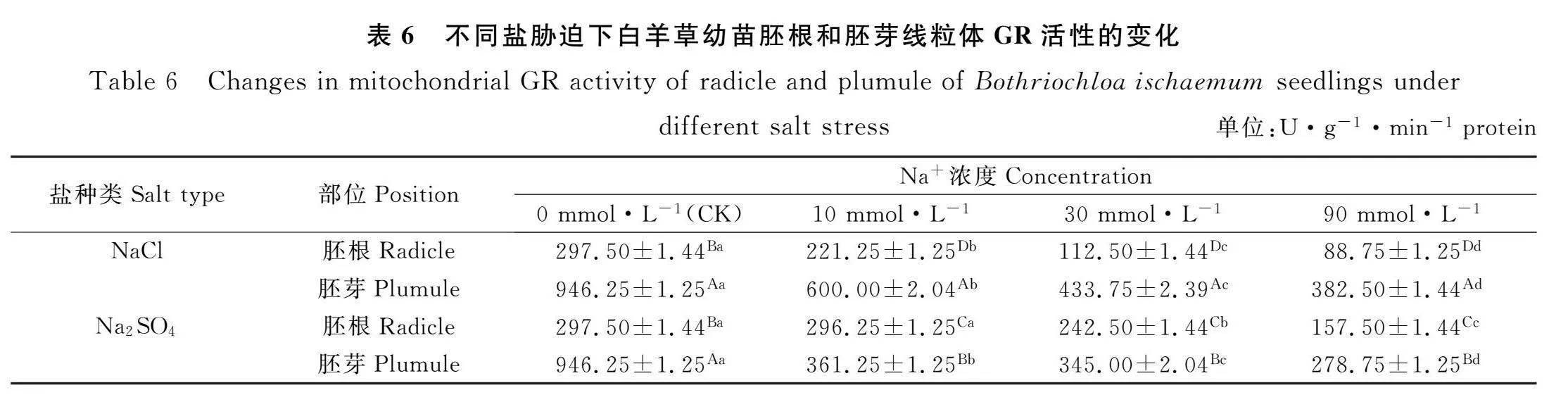
2.6 盐胁迫对白羊草幼苗线粒体GR活性的影响
由表6可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体GR活性随着Na+浓度的增加均呈现逐渐下降的趋势。Na+浓度为0,10,30和90 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚芽线粒体GR活性均显著高于胚根线粒体GR活性(Plt;0.05)。
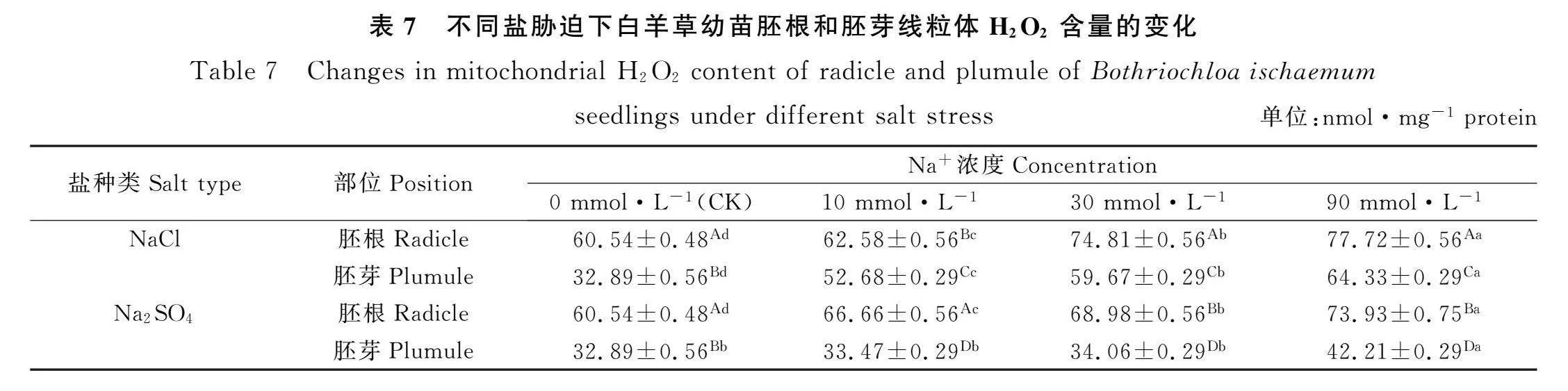
2.7 盐胁迫对白羊草幼苗线粒体H2O2含量的影响
由表7可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体H2O2含量随着Na+浓度的增加均呈现逐渐上升的趋势。Na+浓度为0,10,30和90 mmol·L-1时,NaCl和Na2SO4胁迫下的白羊草幼苗胚根线粒体H2O2活性均显著高于胚芽线粒体H2O2含量(Plt;0.05)。
2.8 盐胁迫对白羊草幼苗线粒体MDA含量的影响
由表8可知,NaCl和Na2SO4胁迫时,白羊草幼苗胚根和胚芽线粒体MDA含量随着Na+浓度的增加均呈现逐渐上升的趋势。Na+浓度为0,10,30和90 mmol·L-1时,NaCl和Na2SO4胁迫的白羊草幼苗胚根和胚芽线粒体MDA含量之间差异均不显著。
3 讨论
H2O2既是调节植物生长发育的一种小分子信号物质,又是调节其体内ROS平衡的动态核心,盐胁迫下,H2O2大量积累,植物的渗透调节、抗氧化等能力均会被破坏,进而植物生长被抑制,因而维持H2O2的动态平衡是植物适应逆境能力的一种重要表现[39]。本试验中,随着Na+浓度的增加,白羊草幼苗胚根和胚芽线粒体的H2O2含量逐渐增加,并导致其MDA含量也逐渐增加,这说明盐胁迫造成了白羊草幼苗胚根和胚芽的脂质过氧化损伤[40],因而白羊草种子的发芽率和发芽指数均显著下降(Plt;0.05)[26]。这与盐胁迫小黑麦(Triticale)[41]、盐爪爪(Kalidium foliatum)[42]结论相似。试验中,随着Na+浓度的增加,白羊草幼苗胚根和胚芽线粒体SOD,CAT,GPX活性均始终高于CK,这说明SOD,CAT和GPX在盐胁迫下白羊草幼苗线粒体的抗氧化作用中发挥主要作用,原因可能是盐胁迫引起了白羊草幼苗线粒体呼吸电子传递链紊乱,并产生了氧化胁迫,从而诱导了SOD活性的升高以催化不断产生的超氧阴离子转变为H2O2,H2O2的增加进一步诱导了CAT,GPX活性的升高以清除过量积累的H2O2,以期维持其内部H2O2的动态平衡[43-44]。然而,白羊草幼苗胚根和胚芽线粒体GST,GR活性均随着Na+浓度的增加而逐渐降低,这可能是盐胁迫抑制了GR的还原能力,却诱导了GPX活性的升高,在清除过量积累的H2O2过程中消耗了GSH,致使其GSH含量减少,因而造成GST反应的底物不足[17],从而导致了白羊草幼苗胚根和胚芽线粒体GST活性也降低,这也表明盐胁迫抑制了白羊草幼苗胚根和胚芽线粒体GST,GR活性。这与夏方山等[45]的研究结果中GR活性变化相反,可能是因为试验的材料不同,且模拟非生物胁迫也不同,细胞及线粒体内清除ROS的主要作用酶有差异。
盐胁迫对白羊草幼苗不同部位线粒体抗氧化作用的影响存在差异。试验中,白羊草幼苗胚根线粒体APX活性随着Na+浓度的增加而显著降低(Plt;0.05),其胚芽线粒体APX活性却出现先升高后降低的趋势,原因可能是因为白羊草种子萌发过程中胚根最先萌发生长,并直接与盐溶液接触,故其胚根最先表现出盐胁迫的不良反应[46],因而其线粒体APX活性对盐胁迫的响应比胚芽更为敏感。同样,白羊草幼苗胚根线粒体GPX活性随Na+浓度的增加呈现出先升高后降低的趋势,而其胚芽线粒体GPX活性则随Na+浓度的增加呈现出显著升高的趋势(Plt;0.05),这也说明胚根线粒体GPX活性对盐胁迫的响应比胚芽敏感。因此,盐胁迫下,白羊草幼苗胚根对盐胁迫响应比胚芽要更敏感。
4 结论
盐胁迫下,白羊草幼苗线粒体抗氧化作用的发挥主要依赖于超氧化物歧化酶,过氧化氢酶和谷胱甘肽过氧化物酶,其白羊草幼苗胚根和胚芽线粒体谷胱甘肽巯基转移酶和谷胱甘肽还原酶活性均被抑制,胚根线粒体过氧化物酶活性被抑制,但其不同部位线粒体抗氧化性能的响应存在差异,胚根要比胚芽更敏感。
参考文献
[1] 杜智鑫,李晓宇,施树楠,等.盐、碱胁迫对两种莲子萌发的影响及其早期幼苗生长响应[J].生态科学,2023,42(1):215-222
[2] 苏文欣,许凌欣,姜宛彤,等.不同外源物质对盐碱胁迫下紫苏种子萌发、幼苗生长及生理的影响[J].草地学报,2022,30(9):2415-2422
[3] 李嘉文,麻冬梅,苏立娜,等.外源褪黑素对盐胁迫下燕麦幼苗生长及抗氧化系统的影响[J].草地学报,2023,31(2):396-403
[4] 袁惠,张鲜花,韩禧卿,等.盐、碱胁迫对4份梯牧草苗期生物量及生理特性的影响[J].草地学报,2024,32(4):1184-1193
[5] 郑译儒,赵俊超,龚束芳,等.NaHCO3和Na2CO3胁迫对碱茅和披碱草种子萌发、幼苗生长和生理指标的影响[J].中国科学院大学学报,2021,38(2):228-239
[6] 王勃,夏方山,董秋丽,等.外源油菜素内酯引发对劣变燕麦种子抗氧化特性的影响[J].草地学报,2023,31(5):1461-1468
[7] 廉雨璇.水盐胁迫对4种耐盐植物苗期生理生化特性和成活水势阈值的影响[D].泰安:山东农业大学,2023:2-4
[8] 孙芹,徐学欣,邓肖,等.NaCl胁迫对不同小麦品种幼苗抗氧化特性的影响[J].青岛农业大学学报(自然科学版),2022,39(4):235-240,271
[9] 许盼云,吴玉霞,何天明.植物对盐碱胁迫的适应机理研究进展[J].中国野生植物资源,2020,39(10):41-49
[10]李红玉,王雅聪,曾佳,等.外源H2O2引发对燕麦种胚细胞AsA-GSH循环的影响[J].草地学报,2022,30(7):1668-1674
[11]GUO H,HU Z,ZHANG H,et al. Comparative effects of salt and alkali stress on antioxidant system in cotton (Gossypium hirsutum L.) leaves[J]. Open Chemistry,2019,17(1):1352-1360
[12]HERNáNDEZ J A. Salinity tolerance in plants:trends and perspectives[J]. International Journal of Molecular Sciences,2019,20(10):2408
[13]MITTOVA V,TAL M,VOLOKITA M,et al. Up-regulation of the leaf mitochondrial and peroxisomal antioxidative systems in response to salt-induced oxidative stress in the wild salt-tolerant tomato species Lycopersicon pennellii[J]. Plant,Cell amp; Environment,2003,26(6):845-856
[14]LI H,WANG H,WEN W,et al. The antioxidant system in Suaeda salsa under salt stress[J]. Plant Signaling amp; Behavior,2020,15(7):1771939
[15]张翼夫,李问盈,胡红,等.盐碱地改良研究现状及展望[J].江苏农业科学,2017,45(18):7-10
[16]李迎春.盐胁迫下四倍体刺槐线粒体的响应机制[D].哈尔滨:东北林业大学,2014:1-4
[17]夏方山.不同老化处理对燕麦种子线粒体结构及抗氧化系统的影响[D].北京:中国农业大学,2015:6-8
[18]蔡琪琪,王堽,董寅壮,等.不同中性盐胁迫对甜菜幼苗光合作用和抗氧化酶系统的影响[J].作物杂志,2022,1:130-136
[19]管峰.盐胁迫影响豆科牧草种子萌发的生理机制[J].南方农机,2023,54(18):41-43
[20]孙守江,唐艺涵,马馼,等.紫花苜蓿种子吸胀期胚根线粒体AsA-GSH循环对低温胁迫的响应[J].草业学报,2023,32(3):152-162
[21]陆晓民,孙锦,郭世荣,等.油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响[J].园艺学报,2012,39(5):888-896
[22]汤玲.Ca(NO3)2胁迫对黄瓜幼苗根系线粒体及氮代谢的影响[D].合肥:安徽农业大学,2018:9
[23]LIU Y,LI P,XU G C,et al. Growth,morphological,and physiological responses to drought stress in Bothriochloa ischaemum[J]. Frontiers in Plant Science,2017,8:230
[24]李晓波,夏方山,朱梦馨,等.贮藏年限对不同居群白羊草种子活力的影响[J].畜牧与饲料科学,2022,43(6):88-94
[25]苏国霞,丁文利,刘金彪,等.施氮和供水对混播和单播白羊草叶片叶绿素荧光特性的影响[J].植物资源与环境学报,2017,26(1):10-20
[26]朱梦馨,曾佳,夏方山,等.贮藏年限对不同居群白羊草种胚线粒体抗氧化性能的影响[J].草地学报,2023,31(2):404-409
[27]冯辽.山西省盐碱地改良研究[D].太谷:山西农业大学,2017:16
[28]陈奕霖,赵萍,王勃,等.不同盐碱胁迫对白羊草种子萌发及幼苗生长的影响[J].畜牧与饲料科学,2022,43(3):96-101,121
[29]刘文静,杨志青,李钰莹,等.盐胁迫对‘太行’白羊草生长与生理特性的影响[J].草业科学,2023,40(10):2651-2658
[30]夏方山,王菲,王雅聪,等.盐酸处理对白羊草种子活力的影响[J].山西农业大学学报,2019,39(4):89-94
[31]YIN G,SUN H,XIN X,et al. Mitochondrial damage in the soybean seed axis during imbibition at chilling temoeratures[J]. Plant amp; Cell Physiology,2009,50(7):1305-1318
[32]BEYER JR W F,FRIDOVICH I. Assaying for superoxide dismutase activity:some large consequences of minor changes in conditions[J]. Analytical biochemistry,1987,161(2):559-566
[33]AEBI H. Catalase[M]//Methods of enzymatic analysis. Academic press,1974:673-684
[34]NAKANO Y,ASADA K. Hydrogen peroxide scavenged by ascorbate-specific peroxidase in spinach chloroplast[J]. Plant amp; Cell Physiology,1981,22:867-880
[35]FLOH L,GNZLER W A. Assays of glutathione peroxidase[M]//Methods in enzymology. Academic Press,1984,105:114-120
[36]NAGALAKSHM N,PRASA M N V. Responses of glutathione cycle enzymes and glutathione metabolism to copper stress in Scenedesmus bijugatus[J]. Plant Science,2001,160(2):291-299
[37]MADAMANCHI N R,ALSCHE R G. Metabolic bases for differences in sensitivity of two pea cultivars to sulfur dioxide[J]. Plant Physiology,1991,97(1):88-93
[38]BAILLY C,BENAMAR A,CORBINEAU F,et al. Changes in malondialdehyde content and in superoxide dismutase,catalase and glutathione reductase activities in sunflower seeds as related to deterioration during accelerated aging[J]. Physiologia Plantarum,1996,97(1):104-110
[39]孙芹,徐学欣,邓肖,等.NaCl胁迫对不同小麦品种幼苗抗氧化特性的影响[J].青岛农业大学学报(自然科学版),2022,39(04):235-240,271
[40]李红玉,王雅聪,夏方山,等.燕麦种胚细胞和线粒体AsA-GSH循环对外源H2O2引发的响应[J].草地学报,2023,31(4):1064-1070
[41]孟晨,鲁雪莉,王菊英,等.不同类型盐胁迫对小黑麦种子萌发的影响[J].草业学报,2023,32(12):171-180
[42]李亚莉,马瑞,马彦军,等.盐旱胁迫对盐爪爪种子萌发及幼苗生长的影响[J].草地学报,2023,31(12):3715-3723
[43]BAI B,WAANG Z,GAO L,et al. Effects of selenite on the growth of alfalfa(Medicago sativa L. cv. Sadie 7)and related physiological mechanisms[J]. Acta Physiologiae Plantarum,2019,41(6):78
[44]王勃,王聪聪,夏方山,等.硒引发对不同品种紫花苜蓿种子抗氧化特性的影响[J].草地学报,2022,30(8):2037-2044
[45]夏方山,董秋丽,毛培胜,等.PEG引发对老化燕麦种胚细胞与线粒体结构及抗氧化性能的影响[J].草业学报,2018,27(5):170-177
[46]阴禹舟,王勃,夏方山,等.硒引发时间对紫花苜蓿幼苗不同部位抗氧化性能的影响[J].畜牧与饲料科学,2023,44(3):96-102
(责任编辑 彭露茜)

