低温诱导基因表达与紫花苜蓿主要农艺性状间的关系

收稿日期:2024-02-23;修回日期:2024-05-05
基金项目:财政部和农业农村部:国家现代农业产业技术体系资助(CARS-34),陕西省重点研发一般项目(2019 NY-074)资助
作者简介:
#彭嘉文(2000-),女,汉族,河南南阳人,硕士研究生,主要从事遗传资源与牧草育种研究,E-mail:pengjiawen2021@nwsuaf.edu.cn;#夏厚胤(2000-),男,汉族,湖北十堰人,硕士研究生,主要从事遗传资源与牧草育种研究,E-mail:xiahy27@163.com;*通信作者Author for correspondence,E-mail:gaojinghui@nwsuaf.edu.cn;yangpeizhi@126.com
摘要:低温限制紫花苜蓿(Medicago sativa L.)生长发育,严重影响其产量。为在作物生长早期筛选高产抗寒候选品种,本研究以4种紫花苜蓿为试验材料,利用甲基磺酸乙酯(Ethyl methanesulfonate,EMS)诱变建立T1突变群体,结合优良突变体高产相关农艺性状评价,拟探索低温诱导基因表达量与高产农艺性状间的关系。结果表明:优质抗寒苜蓿突变体植株表现为植株高大、茎秆粗壮、分枝数多、叶面积大,同时低温诱导基因MsG0180003510 (HIPP),MsG0880047253(LEA),MsG0880047531(TPS)和MsG0180005121(PM)表达水平在隶属函数分析中排位最高;其中HIPP与茎粗显著正相关(P<0.05),LEA与茎粗显著正相关、与分枝数和节间显著负相关(P<0.05),PM和茎粗、分枝数和干鲜重显著正相关(P<0.05)。研究指出苜蓿中农艺性状表现为茎秆粗壮、枝繁叶茂,且分子水平HIPP,LEA,TPS和PM基因高表达,可作为在生长早期筛选高产耐寒苜蓿品种的预测因子,为紫花苜蓿在低温胁迫下的生存策略提供依据。
关键词:紫花苜蓿;低温胁迫;农艺性状;低温诱导基因
中图分类号:S542""" 文献标识码:A"""" 文章编号:1007-0435(2024)11-3358-13
The Correlation Between Gene Expression Induced by Low-Temperature
Stress and Key Agronomic Traits of Alfalfa
PENG Jia-wen#, XIA Hou-yin#, MA Zhi-chao, CUI Yi-lin, YUAN Wang, MIAO Yu-qi, TONG Yu-tao,
WU Jia-xin, ZHANG Meng-yao, YUAN Zi-ang, GAO Jing-hui*, YANG Pei-zhi*
(College of Grass and Grassland,Northwest A amp; F University,Yangling,Shaanxi Province 712100,China)
Abstract:Alfalfa (Medicago sativa L.) is a widely cultivated forage worldwide,while the growth and production of alfalfa in cold northern regions are primarily limited by low-temperature stress. The present study aimed to investigate the integration of cold resistance identification and screening for high-yield candidate varieties during the early selection phase. Four varieties of alfalfa as experimental materials were used to establish T1 mutant populations through ethyl methanesulfonate (EMS,C3H8O3S) mutagenesis. By combining this with the selection of exceptional mutants exhibiting high-yield agronomic traits,we sought to explore the relationship between gene expression levels induced by low temperature and major agronomic traits associated with high yield. The research here revealed that main agronomic characteristics of high-quality and cold-resistant mutant alfalfa include tall plants,robust stems,and abundant branches and leaves. And low-temperature stress induced high expression of MsG0180003510 (HIPP),MsG0880047253 (LEA),MsG0880047531 (TPS),and MsG0180005121 (PM),while their expression levels exhibited major roles according to membership function analysis. Specifically,HIPP showed a significant positive correlation with stem diameter (Plt;0.05),while LEA demonstrated significant positive correlations with stem diameter but negative correlations with branch number and internode number (Plt;0.05). PM exhibited significant positive correlations with stem diameter,branch number,and dry/fresh weight (Plt;0.05). The study reveals the correlation between low-temperature-induced gene expression and agronomic traits in alfalfa;and suggests that the combination of tall plants with robust stems and abundant branches and leaves,along with the high expression of low-temperature-induced genes HIPP,LEA,TPS and PM,can be used as a predictor for selecting high-yield and cold-resistant alfalfa varieties during early growth stages,providing a foundation for survival strategies under low temperature stress.
Key words:Alfalfa;Low-temperature stress;Agronomic traits;Low-temperature-induced genes
紫花苜蓿(Medicago sativa L.)是草食家畜重要的蛋白饲草,是世界范围内仅次于玉米(Zea mays L.)、大豆(Glycine max L.)和小麦(Triticum aestivum L.)的第四大最有经济价值(7.8亿~10亿美元)的作物[1-2]。2015年甘肃、内蒙古、新疆、宁夏、黑龙江、河北等6省(区)的优质苜蓿种植面积占全国总量的89.8%[3]。随着我国北方寒冷地区苜蓿主栽区面积逐渐扩大,低温寒害严重影响苜蓿生长并使其品质显著下降[4-5],制约着畜牧业的产业发展。关于苜蓿中抗寒转基因研究、秋眠性与抗寒性关系、苜蓿响应低温的生理生化机制等方面已经进行了深入探索和研究[6],在生长早期结合抗寒基因表达,筛选具有高产农艺性状抗寒紫花苜蓿候选品种,将极大缩短育种年限,有利于加快我国抗寒苜蓿品种的选育。
植物通过合成低温诱导蛋白(Low-temperature-induced protein,LTI)[7]、积累渗透调节物质[8]、提高保护酶活性等多种方式应对低温对细胞活性的胁迫[9]。低温条件下,胚胎晚期富集蛋白(Late embriogenesis abundant protein,LEA)具有维持植物膜结构稳定、通过结合离子保持渗透压平衡、保护细胞内环境和抗氧化的作用[10],CpLEA7转基因拟南芥(Arabidopsis thaliana L.)[11]、ZmLEA3过表达转基因烟草(Nicotiana tabacum L.)低温耐受性显著增强[12]。重金属相关异戊二烯化植物蛋白(Heavy metal-associated isoprenylated plant protein,HIPP)通常与植物的胁迫反应有关[13-15],研究表明低温诱导AtHIPP26[16]和OsHIPP41[17]表达。海藻糖-6-磷酸合成酶(Trehalose-6-phosphate synthase,TPS)是海藻糖生物合成的关键酶[19],是冷胁迫下植物渗透调节的重要代谢途径[18],蒺藜苜蓿中MtTPS响应寒冷胁迫[20]。另外,小麦TaTPS11在拟南芥中的异位表达可以增强转基因拟南芥的耐寒性,-2℃处理下野生型存活率仅有2%,过表达植株的存活率均达到60%以上[21]。长期低温下植物进入休眠保障生存[22],ABA诱导质膜蛋白(ABA-induced plasma membrane protein,PM)作为渗透调节剂和伴侣蛋白保护植物免受胁迫伤害[23];细胞分裂进程也是植物周期发育的限制性因素,后期促进复合物/细胞周期体(Anaphase-promoting complex/Cyclosome,APC/C)能够识别并通过26S蛋白酶体系统靶向降解底物[24-25],其遗传失活对植物具有致死性[26]。
本试验以甲基磺酸乙酯(Ethyl methanesulfonate,EMS)诱变构建的紫花苜蓿突变群体为材料,利用苜蓿越冬期寒冷自然响应,测定低温诱导蛋白、渗透调节关键基因表达、休眠与细胞发育间的关系以及与寒冷相关基因相对表达量,拟结合群体中筛选出优良变异株的农艺性状,初步研究紫花苜蓿产量性状与抗寒相关基因表达间的关系,并探索将高产苜蓿品种筛选与早期抗寒逆境发育相结合的可能性。
1 材料与方法
1.1 试验材料
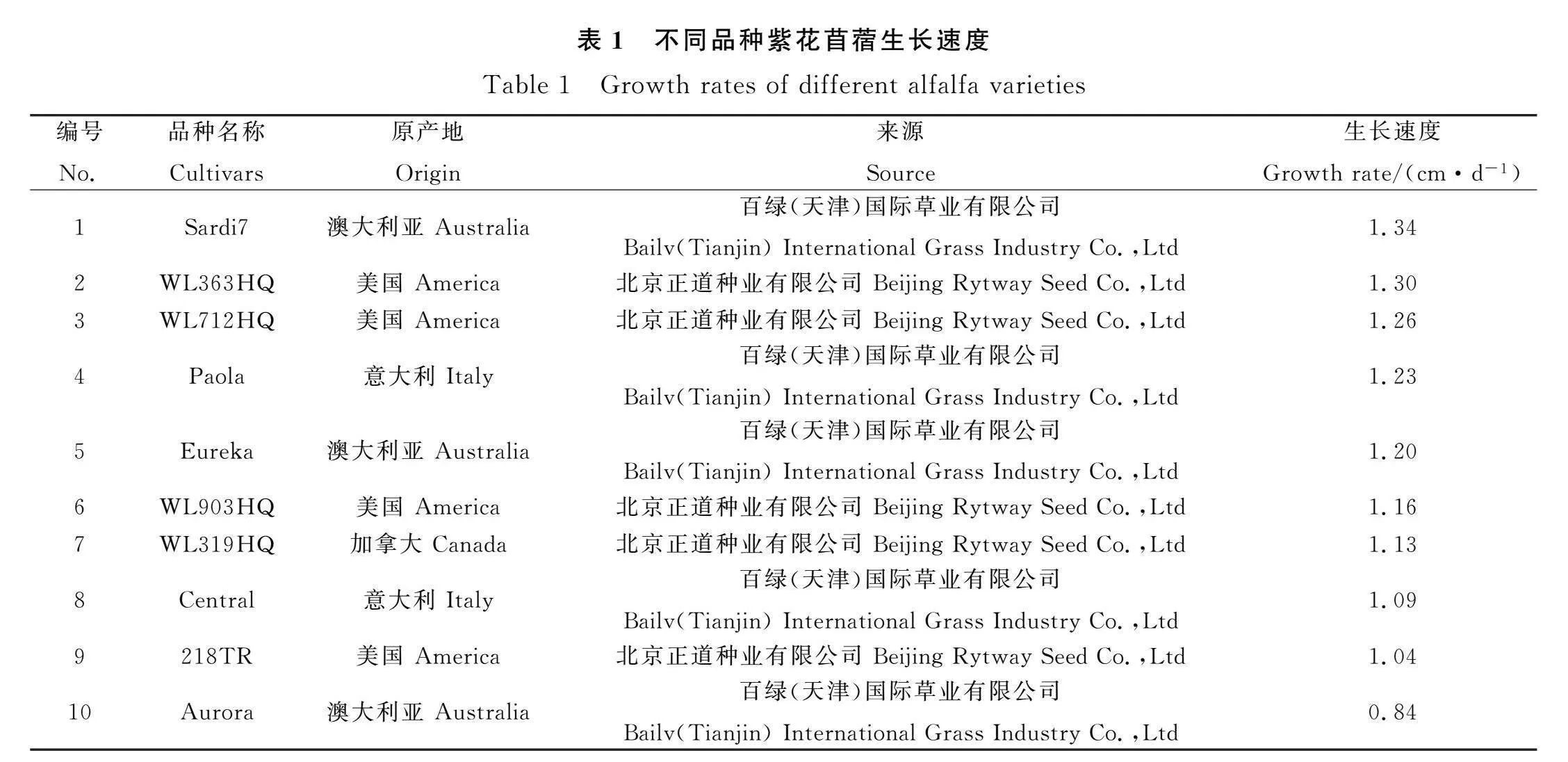
本研究田间测定10个商业化品种紫花苜蓿出苗30 d内日均生长速度(表1),初步筛选苗期生长快速的3个进口品种‘Sardi7’‘WL363HQ’‘WL712HQ’以及本地品种‘武功’,共4个品种用于EMS诱变构建突变体库。
1.2 方法
1.2.1 试验场地和设计 100 mmol·L-10.4% EMS磷酸缓冲液(pH 7.5)浸没种子,遮光密封,摇床室温缓慢振荡8 h,使种子和诱变剂充分接触。2020年9月播种于陕西省西北农林科技大学曹新庄试验基地(34°29′N,108°07′E,海拔514 m,年均温12.9℃,年降雨量660 mm),温室内育苗后移栽,移栽前对试验田进行翻地、平整、镇压等处理。采用完全随机区组设计,每个小区种植面积为2 m×2 m,3~5个重复,小区间设置1 m保护行;人工条播进行移栽,各小区种植6行,行距0.30 m,株距0.20 m。
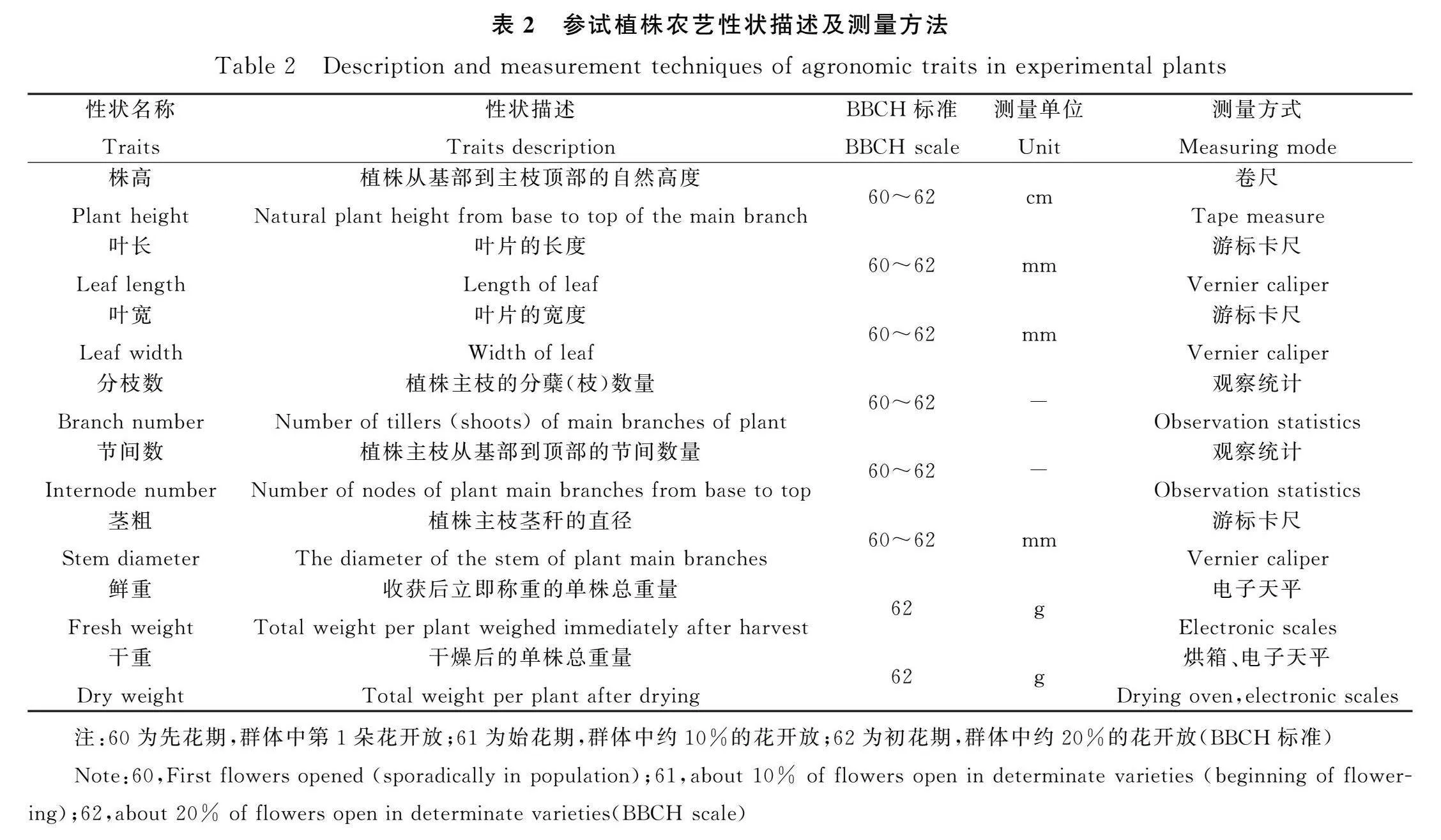
1.2.2 紫花苜蓿突变体植株农艺性状测量 2021年04月12日,根据越冬后生长状况,每个品种筛选出农艺性状优良的突变体单株并做标记,用于进一步筛选调查。2021年07月20日,分别测定标记参试材料的株高(Plant height,PH)、叶面积(Leaf area,LA)、分枝数(Branch number,BN)、节间数(Internode number,IN)、茎粗(Stem diameter,SD);完全成熟后按单株收获,每株保留两个分枝,留茬5 cm,进行干鲜重(Dry weight,DW;Fresh weight,FW)等性状的室内考种;详细测定项目及方法见表2。
1.2.3 紫花苜蓿突变体优株筛选及取样 同年冬季降温期(最低温度低于4℃),基于植株刈割后再生情况再次确定具有一定抗寒性的植株,从各品种标记植株中筛选5~6株单株植株,共22株。于2021年11月11日、2021年11月24日、2021年12月08日分3次进行田间样品的采集。各参试单株均设3个平行重复组,每组由1~3片三出复叶组成,不包括最顶端新叶和有明显非低温损伤的叶片。取样后立即置于液氮中速冻2 min,保存于—80℃,用于后续试验。
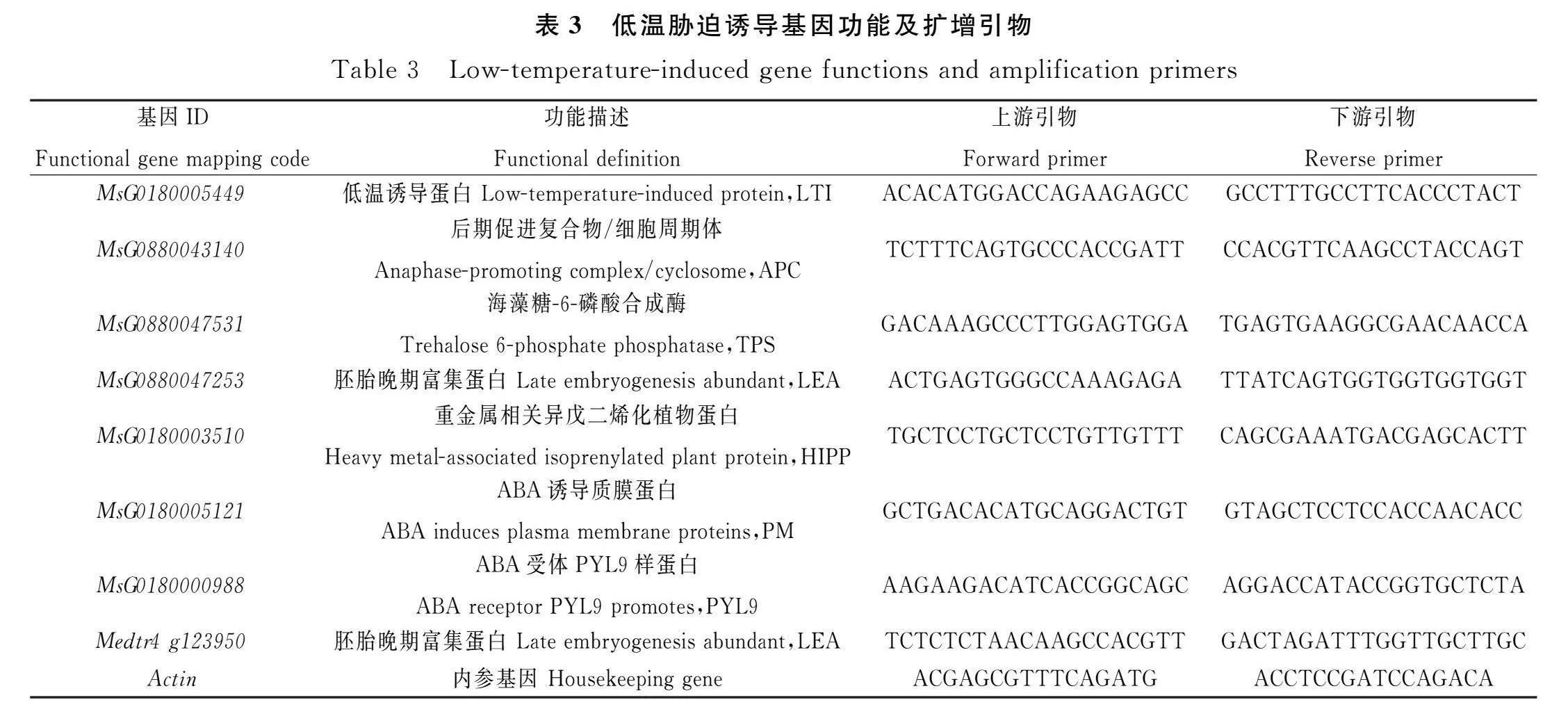
1.2.4 RNA提取和低温诱导基因相对表达量测定 使用RNA提取试剂盒(Eastep Super Total RNA Extraction Kit,天根)提取植物总RNA,反转录试剂盒(Fast Quant RT Kit with gDNase,天根)将RNA逆转录合成cDNA,—20℃保存备用。采用瑞士罗氏480 II荧光定量PCR仪(Light Cycler 480 II PCR detection system,Roche)进行实时荧光定量PCR反应(qRT-PCR)。反应体系(10 μL):ChamQ SYBR qPCR Master Mix(诺唯赞)5 μL,cDNA 1 μL,上下游引物各0.2 μL,ddH2O 3.6 μL。反应程序:预变性95℃ 300 s;循环反应95℃ 10 s,循环45次,60℃ 30 s;熔解曲线65℃ 5 s,95℃ 5 s。用于试验的低温诱导基因与引物序列信息见表3,紫花苜蓿Actin的转录水平用作对照,使用Primer 5.0软件设计并交由生工生物工程(上海)股份有限公司合成。
1.2.5 数据分析 用Excel 2016记录整理试验数据,GraphPad Prism 7 (GraphPad Software,USA)作图。描述性统计、方差分析、相关性分析等使用SPSS Statistics 27.0(IBM Corp.,Armonk,NY,USA)和R语言计算。所有试验至少重复3次。
2 结果与分析
2.1 紫花苜蓿突变体优株的农艺性状分析
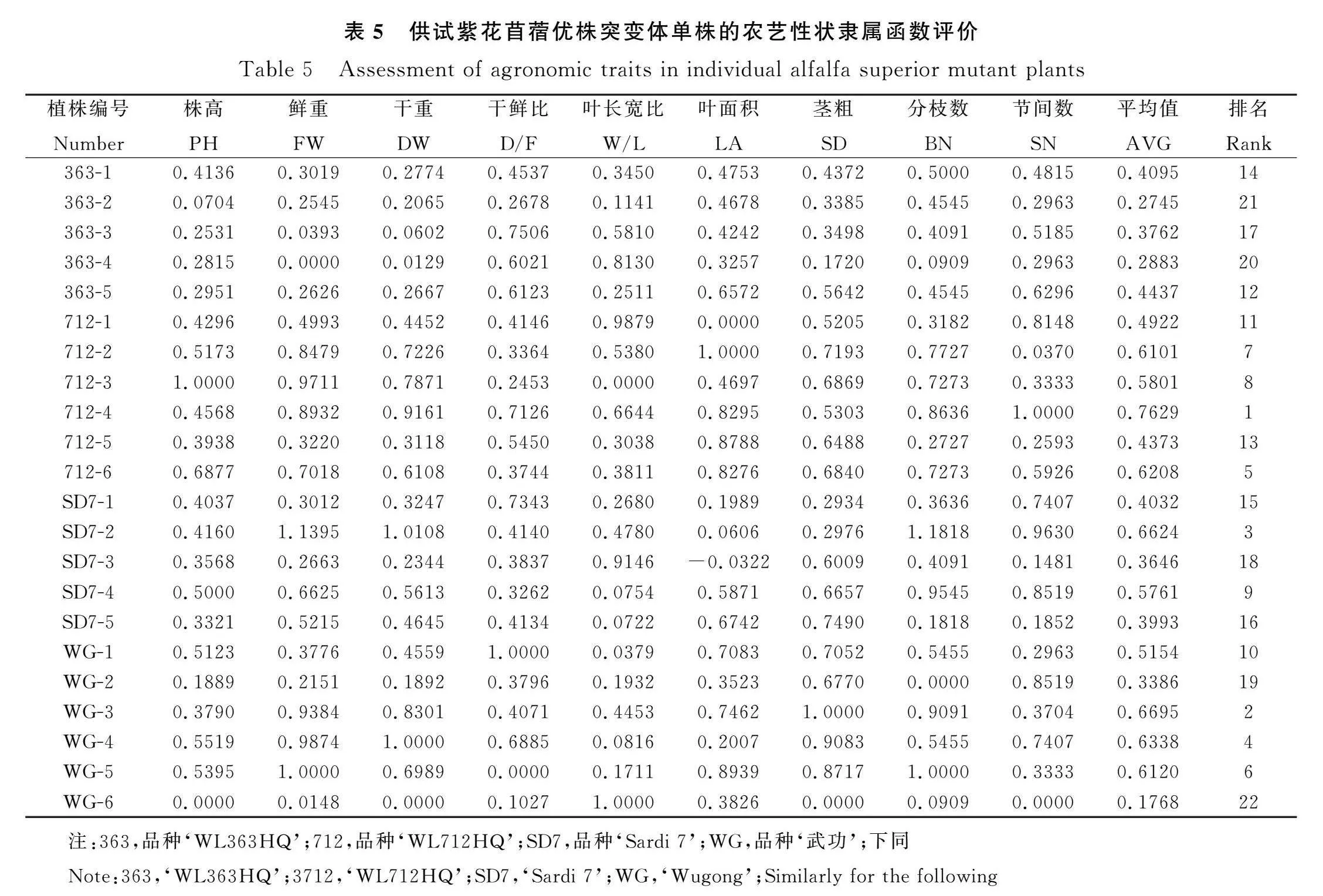
研究对供试的4个紫花苜蓿品种的生长状况进行分析评定(表4)。结果表明‘WL363HQ’生长发育迟缓、植株矮小,平均株高仅62.87 cm,低于平均水平15.80%;茎秆细弱且分枝数少,分别低于平均水平18.16%和18.98%;鲜重和干重分别低于平均水平54.79%和53.63%。‘WL712HQ’生长状况最好,株高在73.4~122.5 cm之间,平均株高为88.55 cm,高于平均水平18.76%;平均叶面积为1.96 mm2,高于平均水平16.98%;植株高大且叶面积大使其最终产量最高,平均单株鲜重和干重高于平均水平28.39%和27.93%。‘Sardi 7’的特点是叶片较小,平均叶面积仅有1.31 mm2,低于平均水平18.85%;但分枝数和节间数最多,高于平均水平11.42%和5.15%,植株呈现较为密集的长势。‘武功’株高较平均水平低5.02%,但鲜重和干重较大,分别高于平均水平9.94%和10.78%,这是由于其茎秆粗壮,高于平均水平12.20%,且叶面积较大,从而保证了较高的最终产量。
供试的紫花苜蓿种质材料9个农艺性状的变异系数(Coefficient of variation,CV)范围为10.33%~56.01%,变幅较大;植株性状中,分枝数、叶面积的变异幅度较大,分别为39.93%和31.66%;变异系数最小的是叶长宽比和节间数,分别为16.66%和18.77%。
2.2 紫花苜蓿突变体优株的模糊隶属函数评价
隶属函数法是在多指标的测定的基础上对作物品种资源的耐胁迫能力进行客观分析评价的重要方法之一。利用公式R(Xi)=(Xi-Xmin)/(Xmax-Xmin)计算各个指标的隶属值,式中Xi为指标测定值,Xmin和Xmax为所有参试材料某一指标的最小值和最大值。通过比较22份紫花苜蓿突变体种质材料9个农艺性状的隶属值总平均值大小,最终确定其农艺性状排序(表5)。4个品种的生长状况从优至劣为‘WL712HQ’>‘武功’>‘Sardi 7’>‘WL363HQ’;其中712-4,WG-3,SD7-2的生长状况最好,隶属值最高,分别为0.7629,0.6695,0.6624。
2.3 紫花苜蓿突变体优株的低温胁迫诱导基因表达量分析
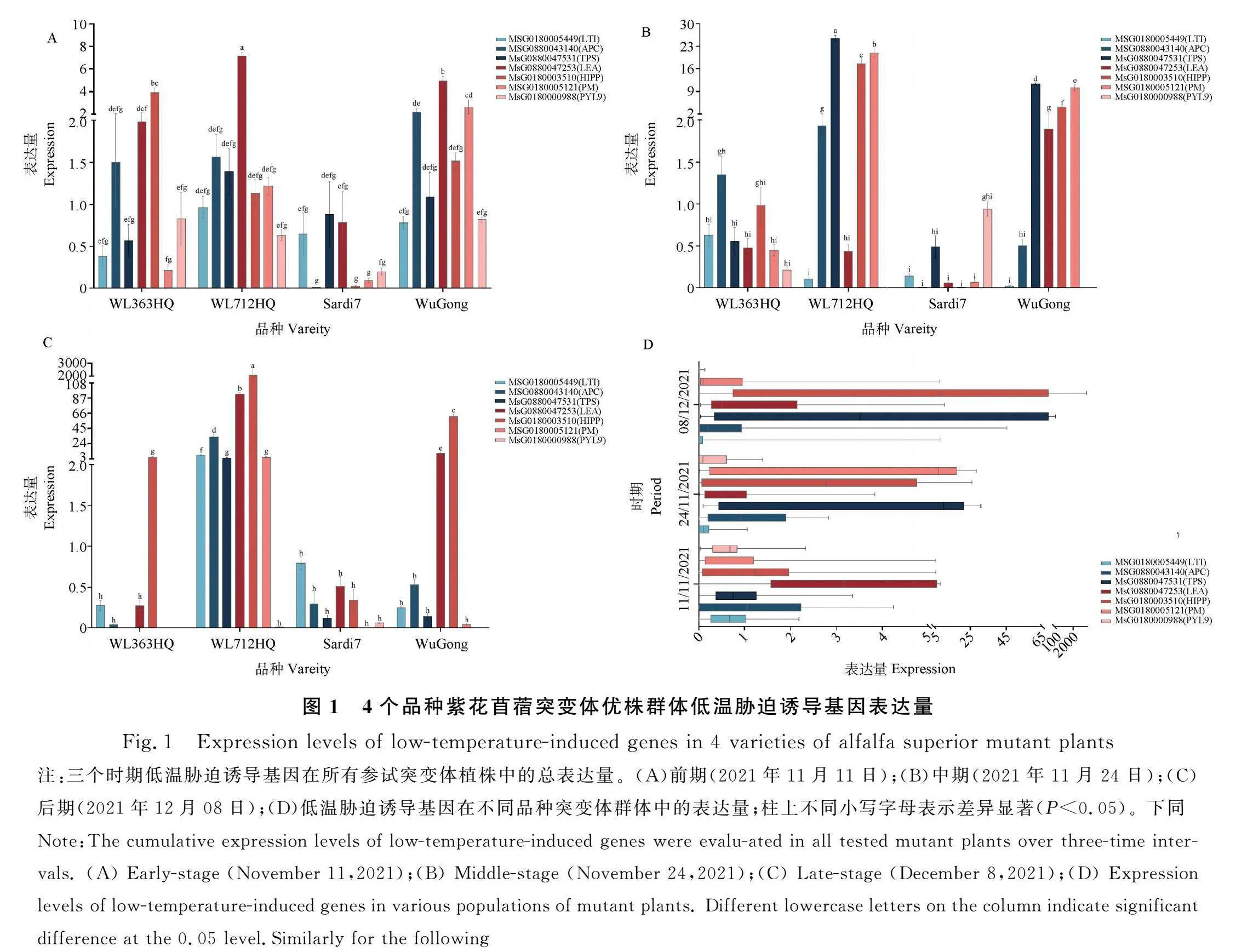
2.3.1 低温胁迫诱导基因表达量分析 将3个取样时间按先后分为前期(2021年11月11日)、中期(2021年11月24日)、后期(2021年12月08日)。在持续低温胁迫下,MsG0180000988(PYL9)表达量逐渐下降,其余6个低温胁迫诱导基因均呈上调趋势(图1A)。PYL9表达量持续显著下降(P<0.05),中期较前期表达量下降了84.16%,后期较中期表达量继续下降了85.51%。MsG0180003510(HIPP)表达量持续上调,中期较前期表达量提高4.8倍,后期较中期表达量继续显著提高98.4倍(P<0.05)。MsG0880043140(APC)和MsG0880047253(LEA)进入后期表达量分别较中期显著上调37.4倍和39.4倍(P<0.05);APC总体显著上调22.1倍,LEA显著上调6.8倍(P<0.05)。MsG0180005449(LTI)后期上调6.1倍,总体上调3.1倍。MsG0880047531 (TPS)和MsG0180005121(PM)中期时分别上调9.3倍和5.5倍,后期逐渐恢复到前期水平;总体上TPS表达量基本不变,PM上调2.8倍。
‘WL363HQ’‘WL712HQ’和‘武功’3个品种苜蓿突变群体的低温胁迫诱导基因在低温胁迫下响应迅速,但‘Sardi7’的低温胁迫诱导基因响应较弱(图1B-C)。进入12月后,‘WL712HQ’‘Sardi7’和‘武功’中TPS和PM表达量下降,其余5个基因表达情况较中期增强(图1D);‘WL363HQ’中HIPP持续响应,其余低温胁迫诱导基因基本不响应。HIPP在各品种中持续响应且上调,PYL9表达量则响应较弱且下降;‘WL712HQ’的低温胁迫诱导基因表达量总体逐渐提高,‘WL363HQ’‘Sardi7’和‘武功’总体逐渐下降。
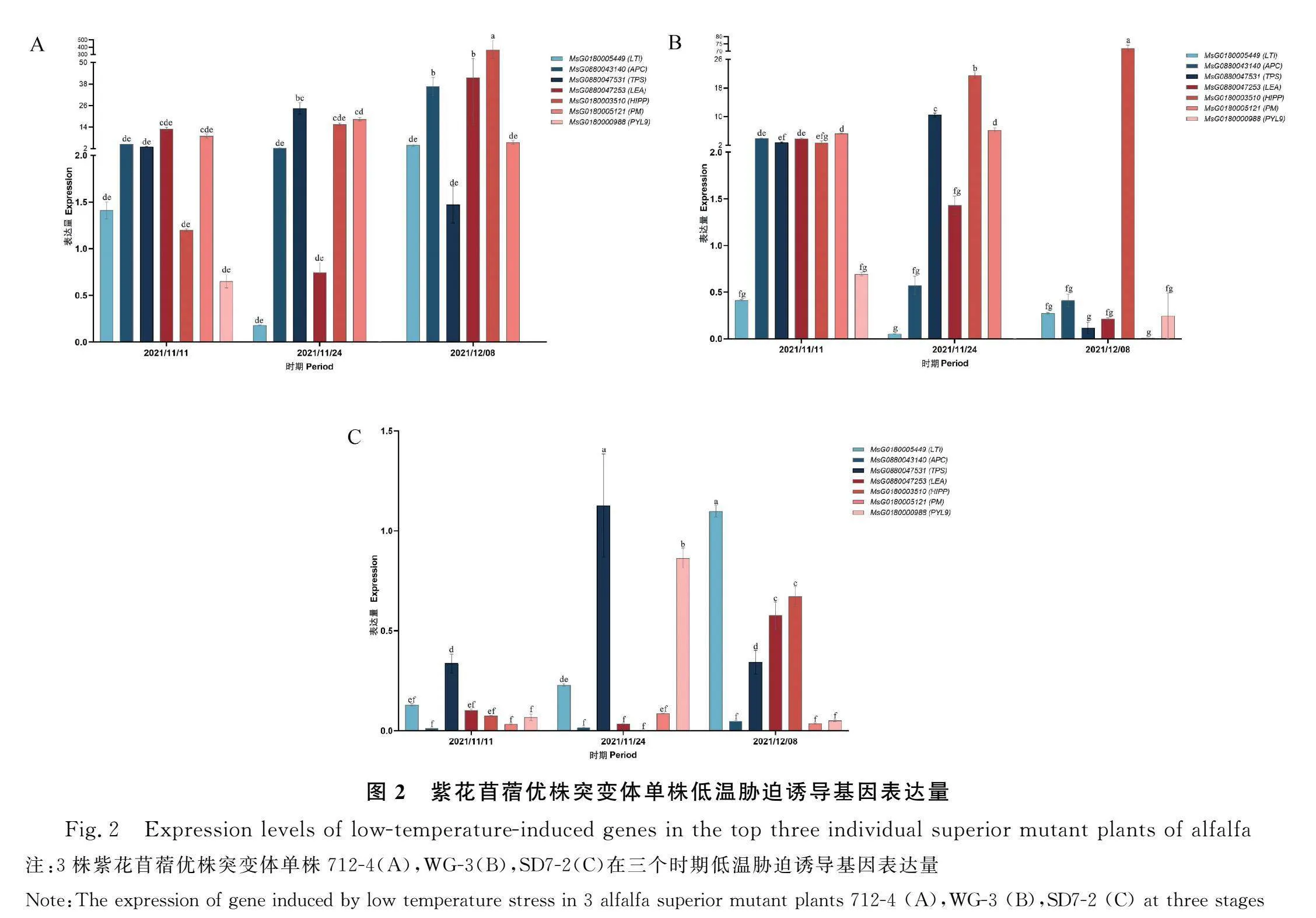
2.3.2 最佳突变体优株的低温胁迫诱导基因相对表达量分析 紫花苜蓿优株突变体中,根据隶属函数分析结果,农艺性状表现最好的单株依次为712-4,WG-3,SD7-2,低温胁迫诱导基因在这3株中的表达情况见图2。712-4中HIPP表达量最高(126.19),LEA,APC,PM,TPS的表达量也较高,分别为18.44,14.55,10.97,9.66(图2A)。WG-3中HIPP表达量最高(32.15),其次为TPS(4.47)和PM(3.85)(图2B)。SD7-2中低温胁迫诱导基因表达差异均不显著,TPS表达量最高,为0.60;LTI表达量其次,为0.49(图2C)。
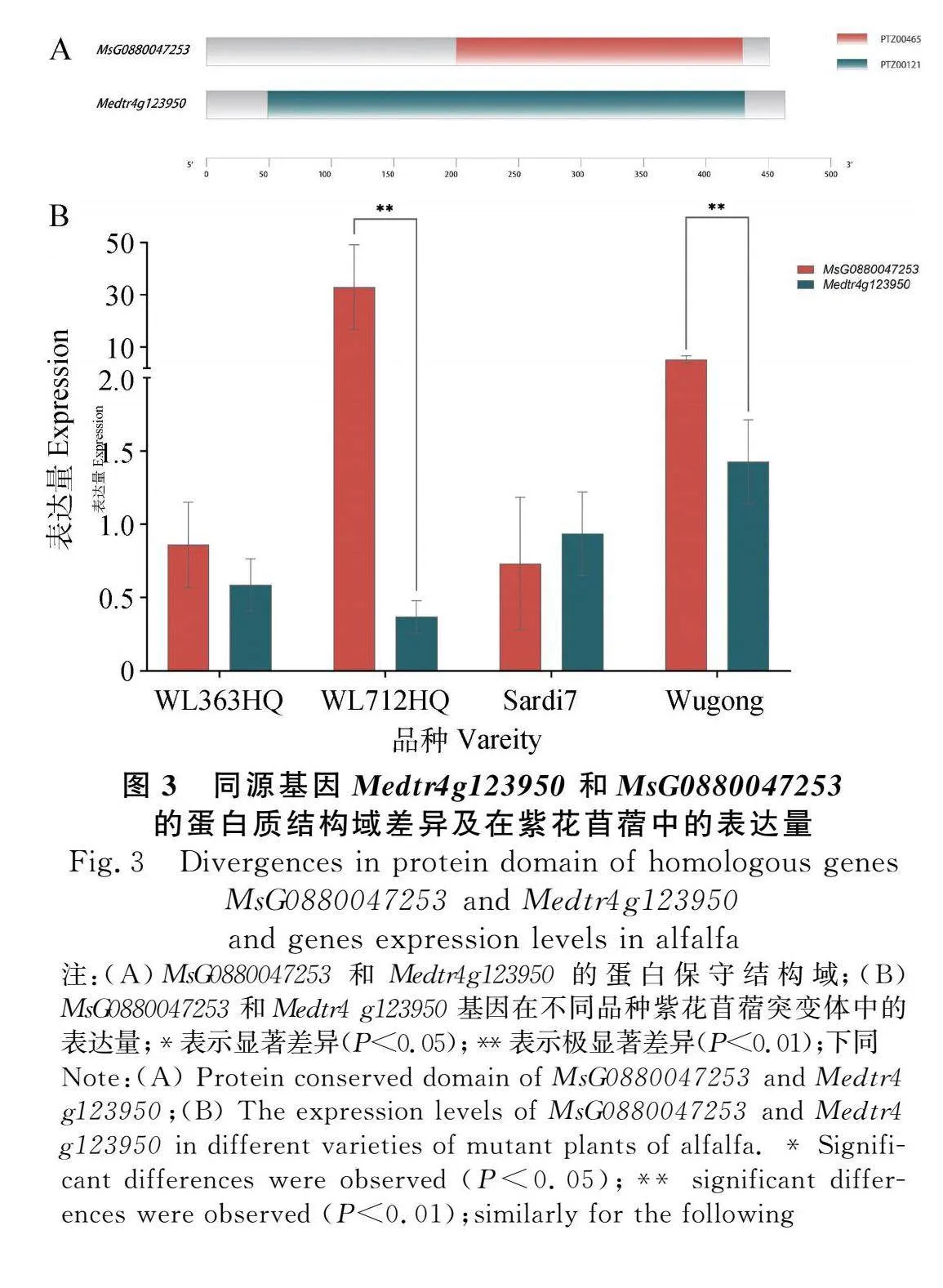
2.3.3 同源基因蛋白质结构域不同在表达量上的差异 LEA是生物体中广泛存在的一类与渗透调节有关的家族蛋白,具有高亲水性和热稳定性,在胚胎发育后期广泛表达于植物根、茎、叶等组织以及种子中。紫花苜蓿MsG0880047253被预测为蒺藜苜蓿Medtr4g123950(LEA3)的同源基因,二者表达模式类似、功能相近,但在蛋白质结构域上存在一定差异(图3A);Medtr4g123950的保守结构域包含PTZ00121超家族的唯一成员CL31754,MsG0880047253中则包含PTZ00456超家族的CL40706。持续低温胁迫下Medtr4g123950在4个紫花苜蓿品种中表达量均较低(图3B),在‘WL363HQ’,‘WL712HQ’和‘Sardi 7’中表达量均不超过1,在‘武功’中表达量略高,为1.43。‘WL712HQ’和‘武功’中MsG0880047253表达水平较高,分别为32.97和5.33,与Medtr4g123950的表达量差异极显著(P<0.01)。
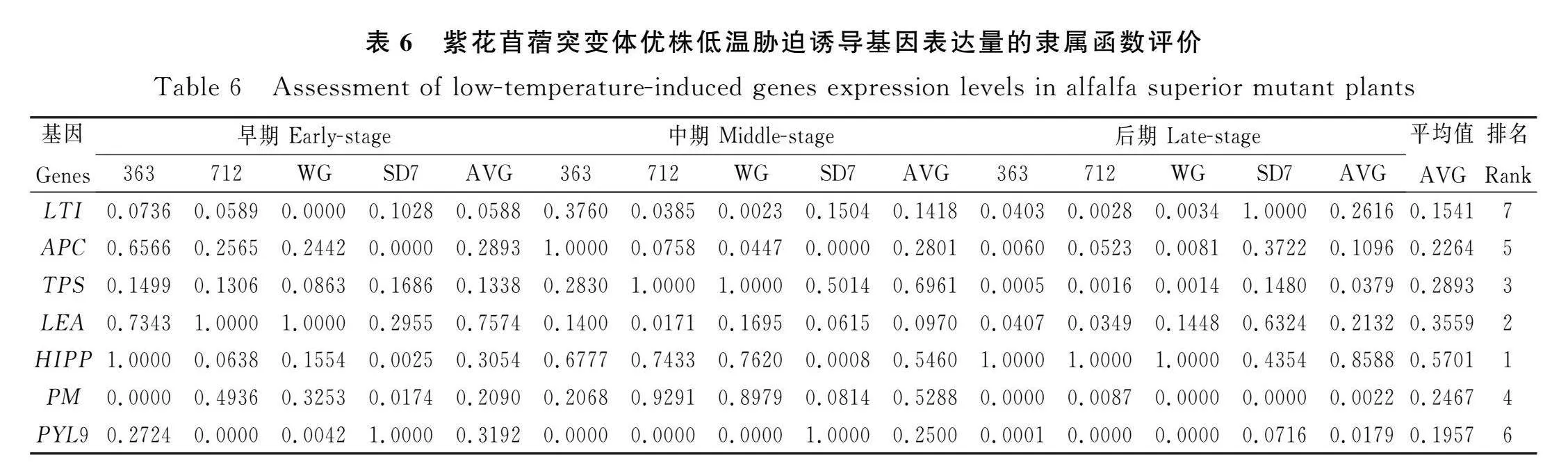
2.3.4 低温胁迫诱导基因表达量的模糊隶属函数评价 将低温胁迫诱导基因表达量作为抗寒种质的筛选依据,HIPP,LEA,TPS和PM在隶属函数分析中排位最高(表6),对筛选具有较高抗寒性的紫花苜蓿优质种质材料有着重要的意义。
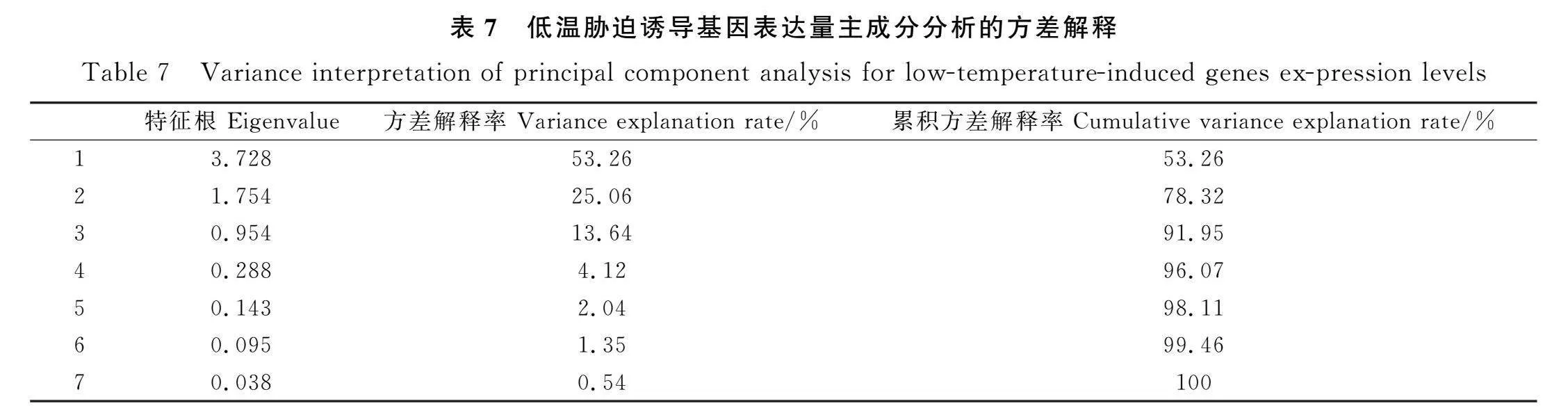
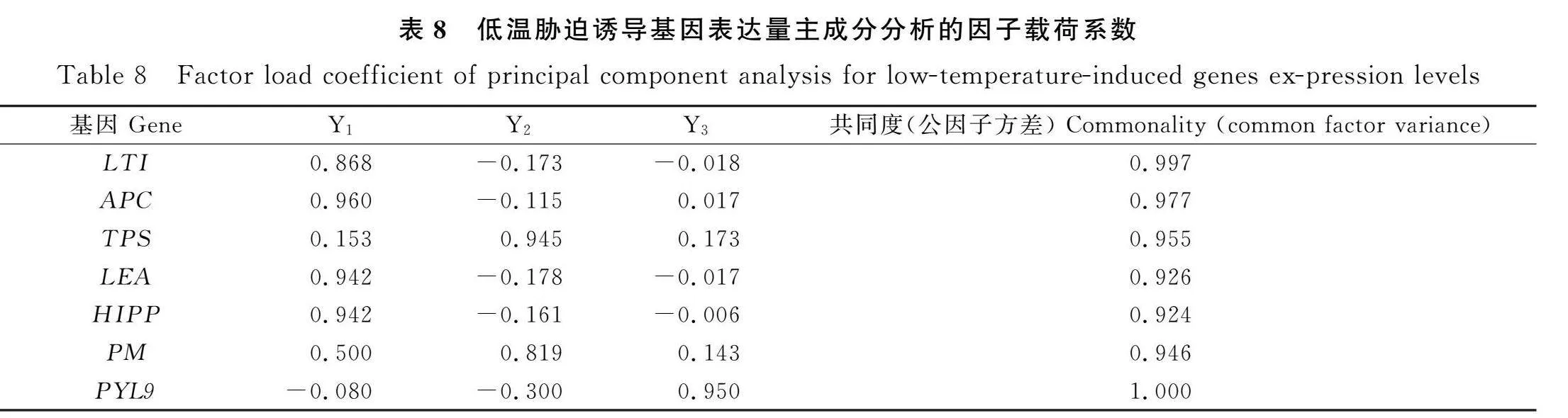
2.3.5 低温胁迫诱导基因表达量的主成分分析 对22份紫花苜蓿突变体种质材料的7个低温胁迫诱导基因表达量进行主成分分析,计算其特征值的方差贡献率和累积贡献率,并根据累积贡献率≥85%的原则提取主成分个数。本研究共取得3个主成分Y1,Y2,Y3(表7),其对应的方差贡献率分别为53.3%,25.1%和13.67%;以上3个主成分的累积贡献率为91.95%,基本包含了所测紫花苜蓿突变体种质材料低温胁迫诱导基因表达量的全部信息。其中Y1包含APC,LEA,HIPP和LTI,Y2包含TPS和PM,Y3主要是由PYL9构成。主成分表达式中各因子系数的大小可以反映因子对该主成分的贡献大小,在主成分分析中,一般认为大于0.3的载荷就是显著的。从因子载荷系数表(表8)可以看出,第一主成分中APC表达量的系数大于其他因子,第二主成分中TPS的系数较大。
2.4 紫花苜蓿农艺性状及低温胁迫诱导基因相关性
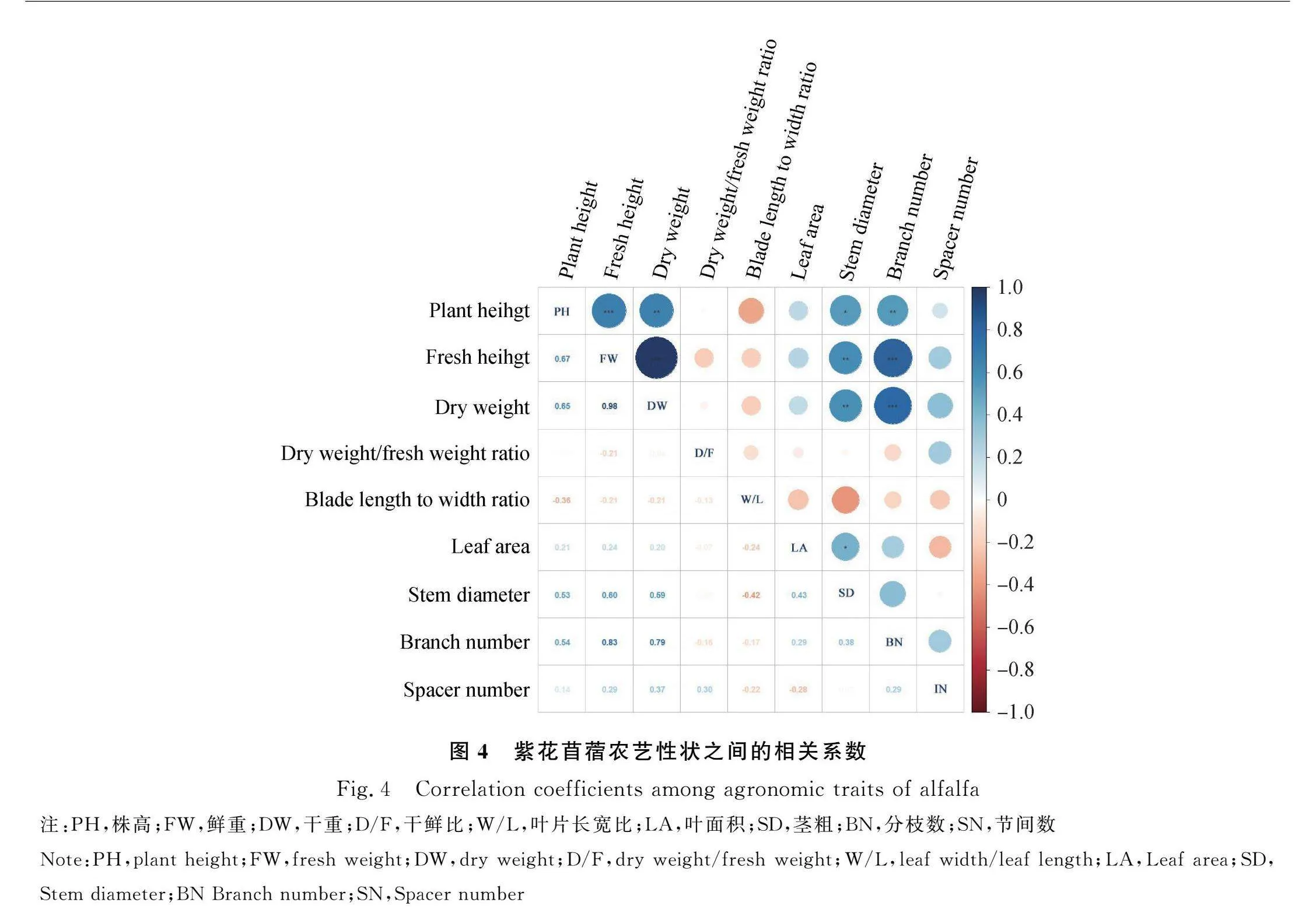
2.4.1 农艺性状相关性分析 在农艺性状中产量性状组及植株性状组组间进行相关分析,性状间的相关系数反映了各性状与产量以及每两个性状间的关联性,图4为紫花苜蓿9个农艺性状间的相关性。株高、分枝数、茎粗3个性状与干、鲜重间极显著正相关(P<0.01),分枝数和茎粗与株高间也分别存在极显著(P<0.01)或显著(P<0.05)正相关关系。叶片形状(长宽比、叶面积)与其他性状间没有显著的相关性,但茎粗与叶面积之间为显著正相关关系(P<0.05),茎粗可能通过增加叶片生物量提高紫花苜蓿最终产量。但由于各性状间存在一定的相关关系,单靠与其产量的相关系数来判别贡献大小,不能从本质上揭示其内部的联系规律,容易忽略各性状间的互作效应。
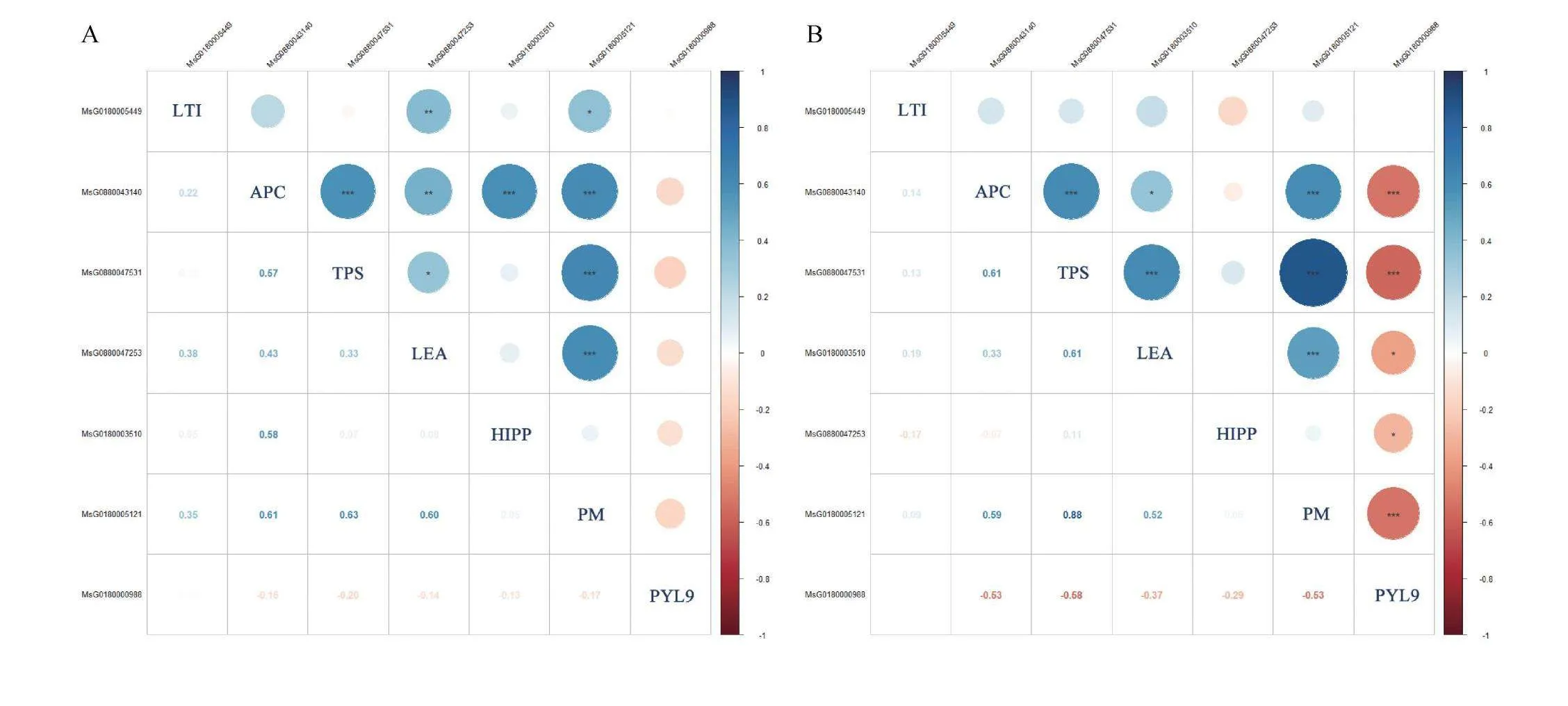
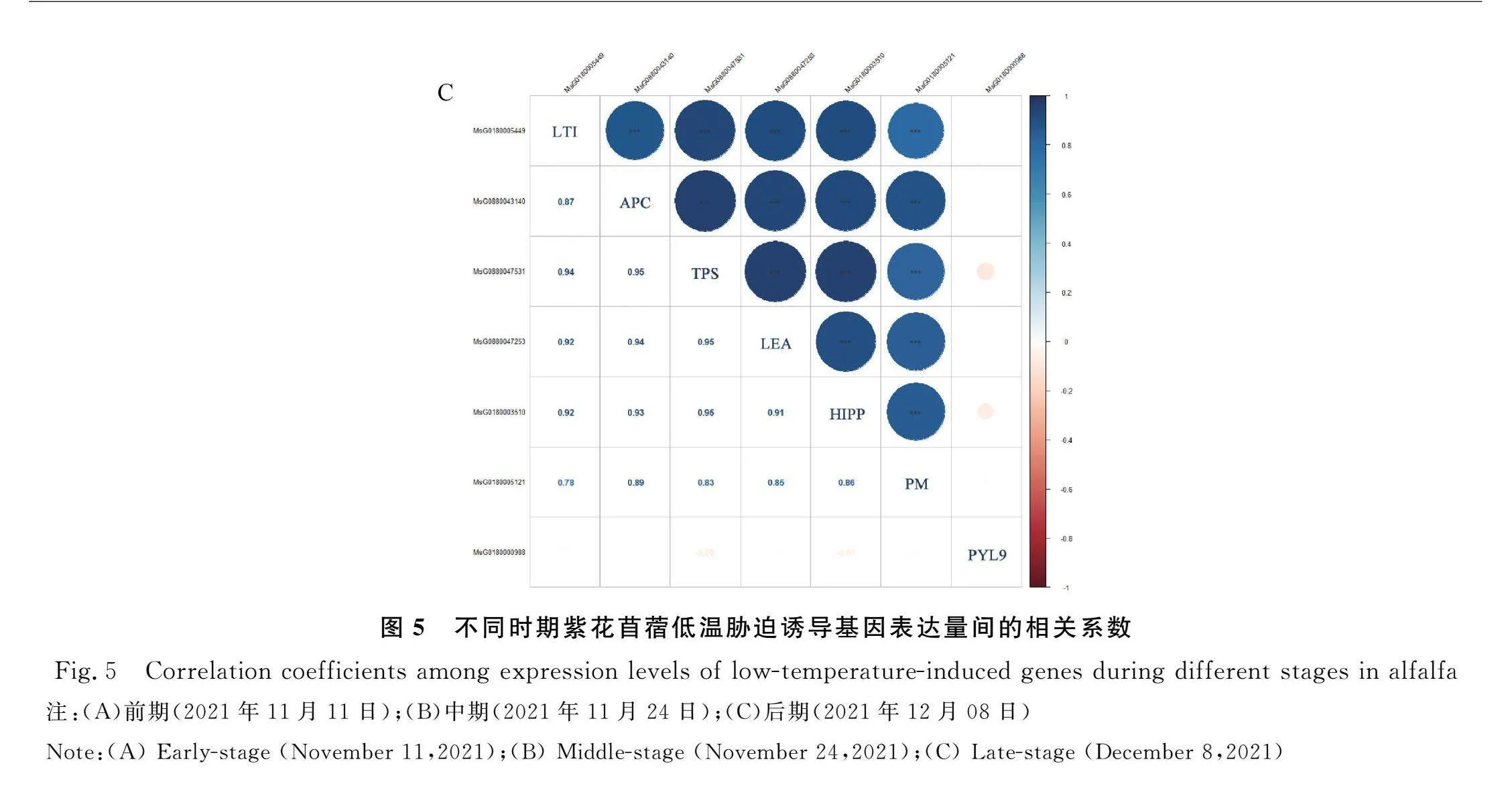
2.4.2 低温胁迫诱导基因表达量相关性分析 前期(图5A),4个低温胁迫诱导基因APC,TPS,LEA,PM表达量间互相影响,存在极显著(P<0.01)或显著(P<0.05)正相关关系;APC,TPS,LEA表达量间互为显著正相关关系(P<0.05),PM表达量和APC,TPS,LEA表达量间都呈极显著正相关关系(P<0.01);HIPP表达量和APC表达量呈显著正相关关系(P<0.05)。中期(图5B),APC,TPS,PM表达量间依旧存在显著(P<0.05)或极显著(P<0.01)正相关关系;APC表达量和TPS,PM表达量显著正相关,TPS表达量和PM表达量间为极显著正相关关系;HIPP表达量和LTI,PM表达量显著正相关,与TPS表达量极显著正相关;PYL9表达量和APC,TPS,PM表达量间存在显著负相关关系。后期(图5C)由于各基因表达量较低,互相间都呈极显著正相关关系。
3个低温胁迫诱导基因APC,TPS,PM表达量在不同时期都互相呈极显著(P<0.01)或显著(P<0.05)正相关关系,在各个时期协同表达;这3个低温胁迫诱导基因在前期与LEA的表达正相关,在中期与PYL9的表达负相关。HIPP在前期正向影响APC的表达,中期与LTI,TPS,PM的表达正相关。
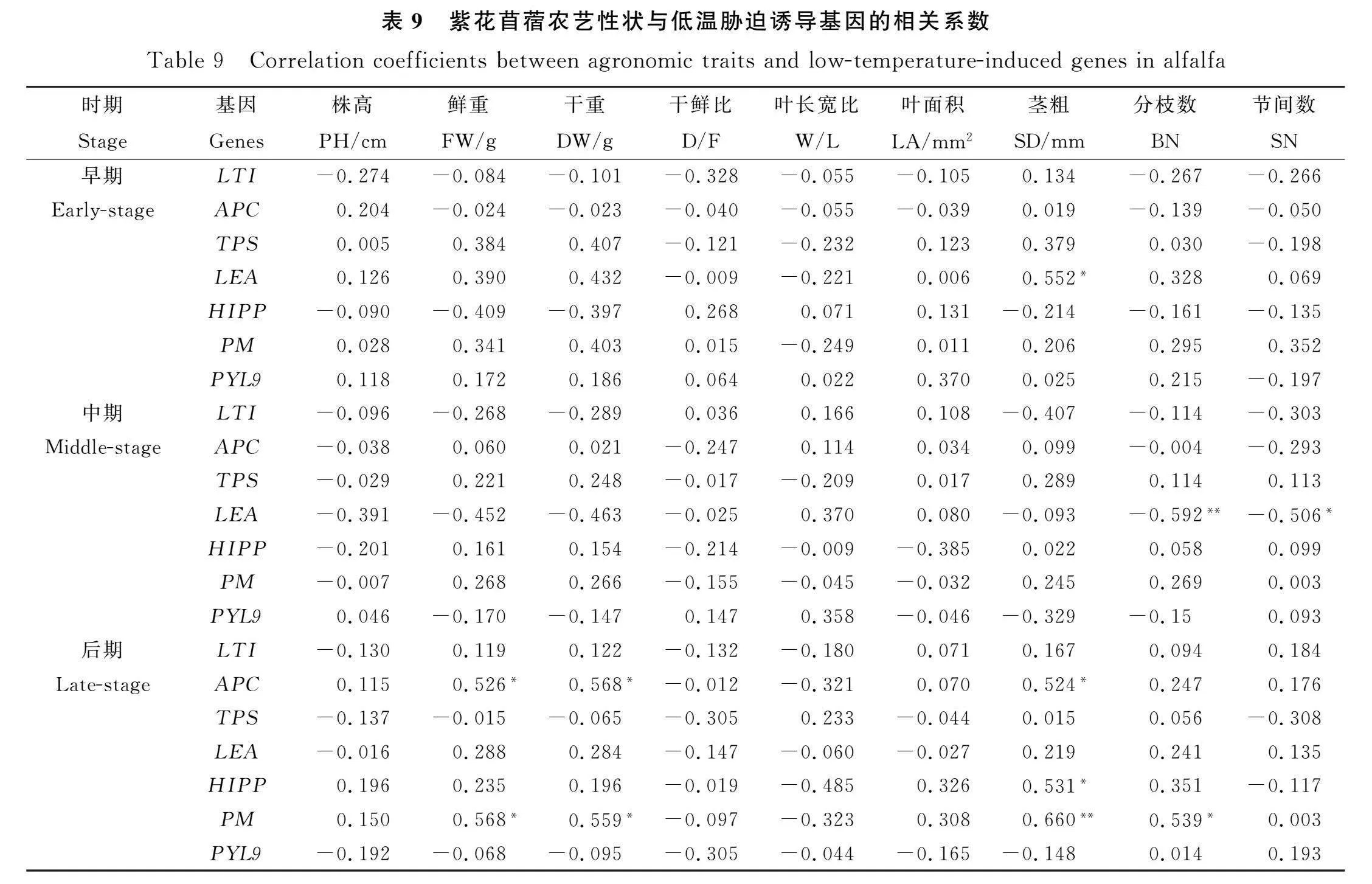
2.4.3 农艺性状与低温胁迫诱导基因间相关性分析 农艺性状和低温胁迫诱导基因表达量间存在一定的相关性(表9)。干鲜重与APC和PM间显著正相关(P<0.05);茎粗与多个低温胁迫诱导基因LEA,APC,HIPP,PM显著(P<0.05)或极显著(P<0.01)正相关;分枝数与LEA极显著负相关(P<0.01),和PM显著正相关(P<0.05);节间数与LEA显著负相关(P<0.05)。
3 讨论
植物普遍存在生长-防御拮抗机制(Growth-defense trade-off)[27],抗性的提高往往会影响产量[28-30];如何在苜蓿生长与抗逆之间取得平衡,是抗寒苜蓿品种高产稳产(抗逆)育种的重要科学问题。
3.1 优质抗寒紫花苜蓿植株的农艺性状与基因表达特征
植物增强耐冷性的冷驯化过程通常伴随着各种生理生化变化,以及复杂的分子调控机制[31];植物在面对低温胁迫时,大量低温响应基因被诱导表达并启动低温应答[7,32-34],而非单个或少数基因调控。在筛选出的22株供试紫花苜蓿突变体优株群体中,植株高大、茎杆粗壮、枝叶繁茂是其主要农艺性状特征,或可作为高产苜蓿的筛选特征;分枝数和叶量作为牧草产量的衡量依据,其广泛的变异为筛选产量较高的抗寒苜蓿种质提供了丰富的材料来源。低温胁迫诱导群体中MsG0180003510(HIPP),MsG0880047253(LEA),MsG0880047531(TPS),MsG0180005121(PM)的高表达,其中TPS,LEA,HIPP起主导作用。在3株农艺性状最佳的优株突变体单株中,HIPP和TPS也均表现出较高的表达水平,表明HIPP和TPS基因能够在维持苜蓿理想农艺性状的同时,赋予植株抵御低温胁迫的抗性。此外,LEA和PM与紫花苜蓿突变体优株的农艺性状关联紧密:LEA与植株的茎粗、分枝数和节间数间存在正相关关系,但对最终产量并无明显影响;PM则可以直接通过影响紫花苜蓿的茎粗和分枝数,最终提高植株的产量。
3.2 低温胁迫诱导基因与农艺性状存在潜在调控关系
LEA蛋白家族在植物低温胁迫的响应中起到重要作用[35-36],ABA可以显著诱导LEA的表达,通过促进LEA蛋白和脯氨酸的积累保护植物免受干旱胁迫[37]。本研究中LEA与PM在表达量上存在正相关关系且均影响植株的茎粗和分枝数,可能证明了胁迫下ABA对LEA的调控作用。此外,紫花苜蓿中蒺藜苜蓿Medtr4g123950及其同源基因MsG0880047253的表达量存在显著差异,说明蛋白质结构域的不同可能导致同源基因的差异表达,在采用异位表达的相关研究时尤其需要注意。TPS参与ABA信号转导[38],过表达ABA信号转导途径下游转录因子ScAREB4可以诱导TPS9表达,提高TPS酶活性并积累海藻糖[31]。本研究表明TPS在表达上与PM协同作用、关系紧密,同时也与LEA存在正相关关系,三者可能都是通过ABA通路的作用对植物的抗寒性产生影响,TPS则通过LEA与PM间接对紫花苜蓿在低温胁迫下的生长产生影响。
DNA复制过程决定着基因组的稳定性,影响植物的生长发育[39]。APC/Cs是细胞周期进程和植物生长的关键调节因子,可能将细胞周期进程与环境信号传导联系起来[26],其基因表达水平在水稻高增殖率的组织中更高[40]。在紫花苜蓿突变体优株群体中,APC在表达上与TPS和PM协同作用、关系紧密,同时也与LEA存在正相关关系;TPS,PM和LEA可能通过影响APC的表达,对紫花苜蓿的细胞周期进程产生间接影响。此外APC可能与ABA通路存在间接关联,其作用机制有待进一步研究。
HIPP在本研究中表现出了对突变体植株耐寒性和农艺性状的促进作用,推测可能通过其他通路间接影响紫花苜蓿低温胁迫下的生长;多样化的HIPP家族生物学功能尚不明晰[41],其在苜蓿应对低温胁迫中的作用机制有待进一步研究。低温胁迫还诱导ABA通路中的PYL9表达持续下调,过表达PYL9会使植物对ABA高度敏感[42],其表达的下调可以解除ABA对植株生长的抑制,从而使突变体优株在抗寒的同时表现出较好的农艺性状,这可能是紫花苜蓿中平衡生长-防御拮抗机制的关键基因。
低温下保障植物的生产性能,一直是寒地苜蓿品种选育的关键[43]。低温下苜蓿生长发育的差异及后期的表型分离,影响着高产抗寒候选种质在生长早期的筛选,确定并筛选出优良种质周期长、成本高。研究初步分析发现结合早期抗寒基因表达,可实现在保障生产性能的同时筛选抗寒苜蓿品种,为后续借助现代表型组学与分子生物技术,在筛选早期实现高产优质苜蓿品种抗寒性无损分析及鉴定提供科学依据。
4 结论
优质抗寒苜蓿突变体植株表型表现为植株高大、茎杆粗壮、分枝数多、叶面积大,同时在分子水平上MsG0180003510(HIPP),MsG0880047253(LEA),MsG0880047531(TPS)和MsG0180005121(PM)基因的表达水平较高。研究揭示了苜蓿中低温诱导基因表达与主要农艺性状的相关性。具有优良农艺性状的植株结合其低温诱导基因HIPP,LEA,TPS和PM的高水平表达,可作为生长早期高产耐寒苜蓿品种选择的预测因子。此外ABA通路中的PYL9在低温胁迫诱导下持续下调,可以解除ABA对植株生长的抑制,可能是紫花苜蓿中平衡抗性与生长的关键基因。通过阐明低温胁迫诱导基因与农艺性状之间的调控机制,不仅为紫花苜蓿在低温胁迫下的生存策略提供了依据,也为培育优良抗逆性紫花苜蓿提供了可能。
参考文献
[1] HADIDI M,ORELLANA PALACIOS J C,MCCLEMENTS D J,et al. Alfalfa as a sustainable source of plant-based food proteins[J]. Trends in Food Science amp; Technology,2023,135:202-214
[2] CHEN H T,ZENG Y,YANG Y Z,et al. Allele-aware chromosome-level genome assembly and efficient transgene-free genome editing for the autotetraploid cultivated alfalfa[J]. Nature Communications,2020,11(1):2494
[3] 中华人民共和国农业农村部.全国苜蓿产业发展规划(2016-2020年):农牧发[2016]15号[EB/OL].https://www.moa.gov.cn/govpublic/XMYS/201701/t20170118,2017-1-18/2024-2-20
[4] 方明月,汪溢磐,赵奕,等. 低温干旱复合胁迫对8个紫花苜蓿品种形态和生理特征的影响[J]. 草地学报,2022,30(11):2967-2974
[5] 朱爱民,张玉霞,王显国,等. 沙地生境不同苜蓿品种形态特征对低温的响应及其与抗寒性关系[J]. 草地学报,2018,26(6):1400-1408
[6] 毕盛楠,温丽,候伟峰,等. 基于Citespace的苜蓿抗寒性研究进展[J]. 草学,2022(4):1-9
[7] SHI Y T,DING Y L, YANG S H. Molecular regulation of CBF signaling in cold acclimation [J]. Trends in Plant Science,2018,23(7):623-637
[8] CHEN X X,DING Y L,YANG Y Q,et al. Protein kinases in plant responses to drought,salt,and cold stress[J]. Journal of Integrative Plant Biology,2021,63(1):53-78
[9] ZHU J K. Abiotic stress signaling and responses in plants[J]. Cell,2016,167(2):313-324
[10]ZAN T,LI L Q,LI J T,et al. Genome-wide identification and characterization of late embryogenesis abundant protein-encoding gene family in wheat:Evolution and expression profiles during development and stress[J]. Gene,2020,736:144422
[11]LIU Y L,XIE L X,LIANG X L,et al. CpLEA5,the late embryogenesis abundant protein gene from Chimonanthus praecox,possesses low temperature and osmotic resistances in prokaryote and eukaryotes[J]. International Journal of Molecular Sciences,2015,16(11):26978-26990
[12]LIU Y,LIANG J N,SUN L P,et al. Group 3 LEA protein,ZmLEA3,is involved in protection from low temperature stress[J]. Frontiers in Plant Science,2016,7:1011
[13]HLA M, ZˇRSKY′ V. Protein prenylation in plant stress responses[J]. Molecules,2019,24(21):3906
[14]RONO J K,SUN D, YANG Z M. Metallochaperones:A critical regulator of metal homeostasis and beyond[J]. Gene,2022,822:146352
[15]ZHANG H,ZHANG X,LIU J,et al. Characterization of the heavy-metal-associated isoprenylated plant protein (HIPP) gene family from Triticeae species[J]. International Journal of Molecular Sciences,2020,21(17):6191
[16]BARTH O,VOGT S,UHLEMANN R,et al. Stress induced and nuclear localized HIPP26 from Arabidopsis thaliana interacts via its heavy metal associated domain with the drought stress related zinc finger transcription factor ATHB29[J]. Plant Molecular Biology,2009,69(1/2):213-226
[17]DE ABREU-NETO J B,TURCHETTO-ZOLET A C,DE OLIVEIRA L F V,et al. Heavy metal-associated isoprenylated plant protein (HIPP):characterization of a family of proteins exclusive to plants[J]. The FEBS Journal,2013,280(7):1604-1616
[18]SARKAR A K, SADHUKHAN S. Imperative role of trehalose metabolism and trehalose-6-phosphate signaling on salt stress responses in plants[J]. Physiologia Plantarum,2022,174(1):e13647
[19]XU Y C,WANG Y J,MATTSON N,et al. Genome-wide analysis of the Solanum tuberosum (potato) trehalose-6-phosphate synthase (TPS) gene family:evolution and differential expression during development and stress[J]. BMC Genomics,2017,18(1):926
[20]SONG J B,MAO H Y,CHENG J,et al. Identification of the trehalose-6-phosphate synthase gene family in Medicago truncatula and expression analysis under abiotic stresses[J]. Gene,2021,787:145641
[21]LIU X,FU L S,QIN P,et al. Overexpression of the wheat trehalose 6-phosphate synthase 11 gene enhances cold tolerance in Arabidopsis thaliana[J]. Gene,2019,710:210-217
[22]AZEEZ A,ZHAO Y C,SINGH R K,et al. EARLY BUD-BREAK 1 and EARLY BUD-BREAK 3 control resumption of poplar growth after winter dormancy[J]. Nature Communications,2021,12(1):1123
[23]JANMOHAMMADI M,ZOLLA L, RINALDUCCI S. Low temperature tolerance in plants:Changes at the protein level[J]. Phytochemistry,2015,117:76-89
[24]WILLEMS A,HEYMAN J,EEKHOUT T,et al. The cyclin CYCA3;4 is a postprophase target of the APC/CCCS52A2 E3-ligase controlling formative cell divisions in arabidopsis[J]. The Plant Cell,2020,32(9):2979-2996
[25]WILLEMS A,LIANG Y K,HEYMAN J,et al. Plant lineage-specific PIKMIN1 drives APC/CCCS52A2 E3-ligase activity-dependent cell division[J]. Plant Physiology,2023,191(3):1574-1595
[26]WILLEMS A, DE VEYLDER L. The plant anaphase-promoting complex/cyclosome[J]. Annual Review of Cell and Developmental Biology,2022,38:25-48
[27]HE Z H,WEBSTER S, HE S Y. Growth-defense trade-offs in plants[J]. Current Biology,2022,32(12):R634-R639
[28]LI Y G,YANG Y H,HU Y L,et al. DELLA and EDS1 form a feedback regulatory module to fine-tune plant growth-defense tradeoff in Arabidopsis[J]. Molecular Plant,2019,12(11):1485-1498
[29]SUN X P,XIANG Y L,DOU N N,et al. The role of transposon inverted repeats in balancing drought tolerance and yield-related traits in maize[J]. Nature Biotechnology,2023,41(1):120-127
[30]YANG C Q,BAI Y C,HALITSCHKE R,et al. Exploring the metabolic basis of growth/defense trade-offs in complex environments with Nicotiana attenuata plants cosilenced in NaMYC2a/b expression[J]. New Phytologist,2023,238(1):349-366
[31]LIU T T,WANG J,CHEN L,et al. ScAREB4 promotes potato constitutive and acclimated freezing tolerance associated with enhancing trehalose synthesis and oxidative stress tolerance[J]. Plant,Cell amp; Environment,2023,46(12):3839-3857
[32]SONG Q P,WANG X P,WU F C,et al. StATL2-like could affect growth and cold tolerance of plant by interacting with StCBFs[J]. Plant Cell Reports,2022,41(9):1827-1841
[33]DING Y L,SHI Y T, YANG S H. Molecular regulation of plant responses to environmental temperatures[J]. Molecular Plant,2020,13(4):544-564
[34]JIANG B C,SHI Y T,PENG Y,et al. Cold-induced CBF-PIF3 interaction enhances freezing tolerance by stabilizing the phyB thermosensor in Arabidopsis[J]. Molecular Plant,2020,13(6):894-906
[35]WANG W D,GAO T,CHEN J F,et al. The late embryogenesis abundant gene family in tea plant (Camellia sinensis):Genome-wide characterization and expression analysis in response to cold and dehydration stress[J]. Plant Physiology and Biochemistry,2019,135:277-286
[36]李双铭,杨勇,胡龙兴,等.不同纬度来源结缕草叶片响应低温胁迫的转录组分析[J]. 草地学报,2023,31(10):2968-2984
[37]GENG W B,WANG Y N,ZHANG J,et al. Genome-wide identification and expression analyses of late embryogenesis abundant (LEA) gene family in tobacco (Nicotiana tabacum L.) reveal their function in abiotic stress responses[J]. Gene,2022,836:146665
[38]VISHAL B,KRISHNAMURTHY P,RAMAMOORTHY R,et al. OsTPS8 controls yield-related traits and confers salt stress tolerance in rice by enhancing suberin deposition[J]. New Phytologist,2019,221(3):1369-1386
[39]PAN T,GAO S,CUI X Y,et al. APC/C-CDC20 targets SCFFBL17 to activate replication stress responses in Arabidopsis[J]. The Plant Cell,2023,35(2):910-923
[40]LIMA M D,ELOY N B,PEGORARO C,et al. Genomic evolution and complexity of the Anaphase-promoting Complex (APC) in land plants[J]. BMC Plant Biology,2010,10:254
[41]GUO T Q,WEBER H,NIEMANN M C E,et al. Arabidopsis HIPP proteins regulate endoplasmic reticulum-associated degradation of CKX proteins and cytokinin responses[J]. Molecular Plant,2021,14(11):1918-1934
[42]ZHAO Y,CHAN Z L,GAO J H,et al. ABA receptor PYL9 promotes drought resistance and leaf senescence[J]. Proceedings of the National Academy of Sciences of the United States of America,2016,113(7):1949-1954
[43]张昭,金琪凡,史彦欣,等. 不同品种紫花苜蓿种子萌发期耐低温性综合评价[J]. 草地学报,2023,31(10):3050-3057
(责任编辑 闵芝智)

