复合酶酶解法制备中华草龟皮胶原蛋白肽的工艺优化






摘要:该研究探讨了不同种类蛋白酶对中华草龟皮胶原蛋白酶解液的水解度和DPPH自由基清除率的影响,并进一步研究了复合蛋白酶对胶原蛋白的酶解效果。此外,通过正交试验优化了复合酶酶解条件。结果表明,由胰蛋白酶和碱性蛋白酶按1∶1组成的复合酶对龟皮胶原蛋白进行酶解,可显著提高酶解液的水解度和DPPH自由基的清除率(Plt;0.05);优化的复合酶酶解工艺为复合酶添加量5 000 U/g、酶解pH值7.5、酶解温度50 ℃、酶解时间3 h,在该酶解工艺条件下,水解度达(51.19±2.45)%,DPPH自由基清除率达(51.78±2.21)%。影响复合酶酶解效果的主次顺序为酶添加量gt;酶解pH值gt;酶解时间gt;酶解温度。
关键词:中华草龟;胶原蛋白肽;复合酶酶解;胰蛋白酶;碱性蛋白酶
中图分类号:TS201.25""""" 文献标志码:A""""" 文章编号:1000-9973(2024)08-0028-06
Optimization of Preparation Technology of Chinemys reevesii Skin Collagen
Peptide by Compound Enzymes Enzymatic Hydrolysis Method
YU Dan-dan1, WEI Wen-zhi2, GUAN Li1, CHEN Wen-zhuo1, CAO Hui1*
(1.College of Tourism and Culinary Science, Yangzhou University, Yangzhou 225127, China;
2.College of Animal Science and Technology, Yangzhou University, Yangzhou 225001, China)
Abstract: In this study, the effects of different types of proteases on the hydrolysis degree and DPPH free radical scavenging rate of Chinemys reevesii skin collagen enzymatic hydrolysate are studied, and the enzymatic hydrolysis effect of compound proteases on collagen is further studied. In addition, the enzymatic hydrolysis conditions of compound enzymes are optimized by orthogonal test. The results show that the hydrolysis degree and DPPH free radical scavenging rate of enzymatic hydrolysate are significantly improved (Plt;0.05) when Chinemys reevesii skin collagen is hydrolyzed by the compound enzymes composed of trypsin and alkaline protease at 1∶1.The optimized compound enzymatic hydrolysis process is as follows: the addition amount of compound enzymes is 5 000 U/g, enzymatic hydrolysis pH value is 7.5, enzymatic hydrolysis temperature is 50 ℃, and enzymatic hydrolysis time is 3 h. Under such enzymatic hydrolysis process conditions, the hydrolysis degree reaches (51.19±2.45)%, and the DPPH free radical scavenging rate reaches (51.78±2.21)%.The primary and secondary order that affects the compound enzymatic hydrolysis effect is enzyme addition amountgt;enzymatic hydrolysis pH valuegt;enzymatic hydrolysis timegt;enzymatic hydrolysis temperature.
Key words: Chinemys reevesii; collagen peptide; compound enzymes enzymatic hydrolysis; trypsin; alkaline protease
DOI:10.3969/j.issn.1000-9973.2024.08.006
引文格式:虞丹丹,魏文志,关利,等.复合酶酶解法制备中华草龟皮胶原蛋白肽的工艺优化.中国调味品,2024,49(8):28-33.
YU D D, WEI W Z, GUAN L, et al.Optimization of preparation technology of Chinemys reevesii skin collagen peptide by compound enzymes enzymatic hydrolysis" method.China Condiment,2024,49(8):28-33.
收稿日期:2024-01-14
基金项目:苏北科技专项(2021022)
作者简介:虞丹丹(1998—),女,硕士,研究方向:食品营养与卫生。
*通信作者:曹晖(1968—),女,副教授,博士,研究方向:食品营养与加工。
龟甲胶是我国的名贵中药材,而中华草龟是加工龟甲胶的主要原料,在中国、韩国和日本分布广泛。近年来,随着中药材龟板的取用以及市场上对龟甲胶需求量的增大,产生了大量中华草龟皮,研究表明中华草龟皮富含胶原蛋白。胶原蛋白为大分子物质,具有抗氧化性,进入人体小肠后难以被吸收,但降解为多肽后较易被吸收。近年来,酶解制备胶原蛋白肽的研究表明,胶原蛋白肽具有抗氧化、抑菌、降血压等生物功能,可增强食品的保健功能;而蛋白酶酶解所制备的胶原蛋白肽含有丰富的呈味氨基酸,呈味性能较好,可用于开发新型调味品。
胶原蛋白肽的制备方法主要分为化学法、生物酶酶解法。化学法制备胶原蛋白肽,肽损失严重;生物酶酶解法制备胶原蛋白肽,污染风险低,但大多采用单酶水解,水解度较低。提高动物皮胶原蛋白的水解度及其肽的生物活性备受广大科研者的关注。现有研究表明,复合酶酶解工艺可以产生数量更多、分子量更小的多肽,于文影研究表明,单酶酶解胶原蛋白,酶解液的水解度最大为18.03%,而胰蛋白酶和碱性蛋白酶的复合酶酶解水解度提高到21.41%。彭易鑫等研究表明双酶复合酶解得到的多肽的抗氧化能力明显高于单酶酶解。
目前,使用复合酶法制备中华草龟皮胶原蛋白肽的研究较少,本研究探讨了不同蛋白酶对中华草龟皮胶原蛋白酶解效果的影响,并优化了复合酶酶解工艺,以期为新型调味品的开发利用提供理论依据。
1" 材料与方法
1.1" 试验原料与试剂
中华草龟皮胶原蛋白:实验室自制;胰蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶、碱性蛋白酶:均购于上海源叶生物科技有限公司;乙酸、氢氧化钠、1,1-二苯基-2-三硝基苯肼、邻苯二甲醛、四硼酸钠、PBS缓冲液:均购于北京索莱宝科技有限公司。
1.2" 试验设备与仪器
BBA124S/224S分析天平" 山东欧莱博仪器有限公司;PHS-3C pH计" 上海仪分科学仪器有限公司;LyoBeta冷冻干燥机" 西班牙Telstar公司;Allegra X-30R台式高速冷冻离心机" 美国贝克曼库尔特有限公司;SHZ-82A水浴恒温振荡器" 金坛市盛威实验仪器厂;Infinite M200 Pro酶标仪" 北京龙跃生物科技发展有限公司。
1.3" 试验方法
1.3.1" 中华草龟皮胶原蛋白酶解工艺流程
称取适量中华草龟皮胶原蛋白,用PBS缓冲液溶解,制备底物浓度为5 mg/mL的胶原蛋白溶液。将溶液的pH值调至蛋白酶最适pH值,酶解4 h,沸水浴10 min,冷却至室温后调pH值至中性。以4 000 r/min离心15 min,过滤,取上清液,真空冷冻干燥。
1.3.2" 水解度(DH)的测定
胶原蛋白肽的水解度采用邻苯二甲醛(OPA)法测定。
OPA试剂(现配现用):将200 mg OPA溶解于5 mL无水乙醇中,加入125 mL 0.1 mol/L四硼酸钠溶液(pH 9.75)、0.5 mL β-巯基乙醇和12.5 mL 10% SDS溶液,定容至250 mL。
酶解液水解度的测定:将50 μL胶原蛋白酶解液与3 mL OPA试剂混合,室温下静置5 min,在340 nm处测定其吸光值。
Serine NH2=A样品-A空白A标准-A空白×CSerine NH2×10-3×DX×P。
式中:CSerine NH2为每克蛋白中所含L-丝氨酸含量,0.951 6 mmol/g;D为稀释倍数;X为样品质量,g;P为样品中蛋白质含量,%。
水解度(%)=(Serine NH2-β)/αHhot×100%。
式中:Hhot为胶原蛋白中含有的肽键总数,11.1 mmol/g;α=0.8,β=0.5。
1.3.3" DPPH自由基清除率的测定
参照Huang等的方法,准确称取DPPH,配制成0.2 mmol/L DPPH溶液,于棕色瓶中避光低温保存。取2 mL样品液于试管内,加入2 mL 0.2 mmol/L DPPH溶液混合均匀,室温下避光静置30 min 后,测定其在517 nm 处的吸光值。样品的DPPH·清除率按下式计算:
清除率(%)=(1-A1-A2A3)×100%。
式中:A1为样品加DPPH溶液的吸光值;A2为样品加95%乙醇溶液的吸光值;A3为DPPH溶液加95%乙醇溶液的吸光值。
1.3.4" 单一蛋白酶的筛选
将冷冻干燥的胶原蛋白用0.02 mol/L、pH值为7.5的PBS溶液配制成5 mg/mL的胶原蛋白溶液,用恒温磁力搅拌器加热至所需温度,5种酶的最佳酶解条件见表1。在不同蛋白酶最适条件下酶解,比较各组的水解度。
1.3.5" 复合蛋白酶的筛选
将胰蛋白酶、碱性蛋白酶和中性蛋白酶两两复配,复配比为1∶1,酶添加量为4 000 U/g,复合蛋白酶的酶解条件见表2,酶解4 h后比较各组酶解液的水解度和DPPH·清除率。
1.3.6" 复合酶酶解单因素试验
1.3.6.1" 酶解pH值对酶解反应的影响
取20 mL浓度为5 mg/mL的胶原蛋白溶液,将溶液的pH值调至5.5,6.5,7.5,8.5,9.5,酶添加量为4 000 U/g,胰蛋白酶和碱性蛋白酶的复配比为1∶1,酶解温度为50 ℃,酶解时间为4 h,测定酶解液的水解度和DPPH·清除率。
1.3.6.2" 酶解温度对酶解反应的影响
取20 mL浓度为5 mg/mL的胶原蛋白溶液,将溶液的pH值调至8.5,酶添加量为4 000 U/g,胰蛋白酶和碱性蛋白酶的复配比为1∶1,分别在40,45,50,55,60 ℃的酶解温度下酶解4 h,测定酶解液的水解度和DPPH·清除率。
1.3.6.3" 酶解时间对酶解反应的影响
取20 mL浓度为5 mg/mL的胶原蛋白溶液,将溶液的pH值调至8.5,酶解温度为50 ℃,酶添加量为4 000 U/g,胰蛋白酶和碱性蛋白酶的复配比为1∶1,分别酶解2,3,4,5,6 h,测定酶解液的水解度和DPPH·清除率。
1.3.6.4" 复合酶添加量对酶解反应的影响
取20 mL浓度为5 mg/mL的胶原蛋白溶液,将溶液的pH值调至8.5,酶解温度为50 ℃,胰蛋白酶和碱性蛋白酶的复配比为1∶1,分别加入3 000,3 500,4 000,4 500,5 000 U/g的复合酶酶解4 h,测定酶解液的水解度和DPPH·清除率。
1.3.6.5" 复配比对酶解反应的影响
取20 mL浓度为5 mg/mL的胶原蛋白溶液,将溶液的pH值调至8.5,酶解温度为50 ℃,酶添加量为4 000 U/g,分别加入复配比为3∶1、2∶1、1∶1、1∶2、1∶3的胰蛋白酶和碱性蛋白酶酶解4 h,测定酶解液的水解度和DPPH·清除率。
1.3.7" 正交试验设计
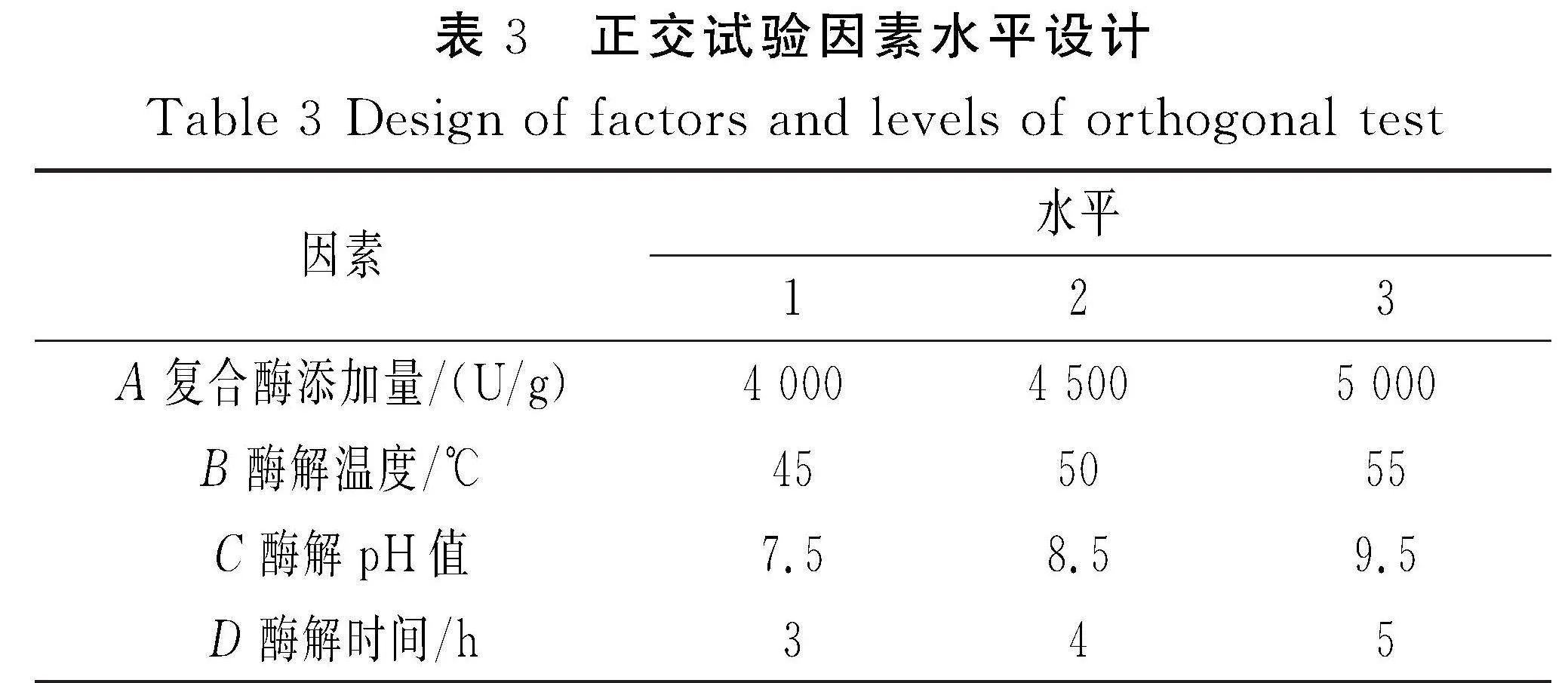
根据单因素试验结果,以水解度(DH)、DPPH·清除率的总评归一值(OD)为指标,设计复合酶添加量、酶解温度、酶解pH值、酶解时间的四因素三水平正交试验L9(34),试验方案见表3。
1.3.8" 数据处理
使用SPSS 20.0软件进行数据显著性分析,利用Excel 2016、Origin 2021软件绘制图表,所有试验均重复3次。Plt;0.05表示数据具有显著性差异。
2" 结果与分析
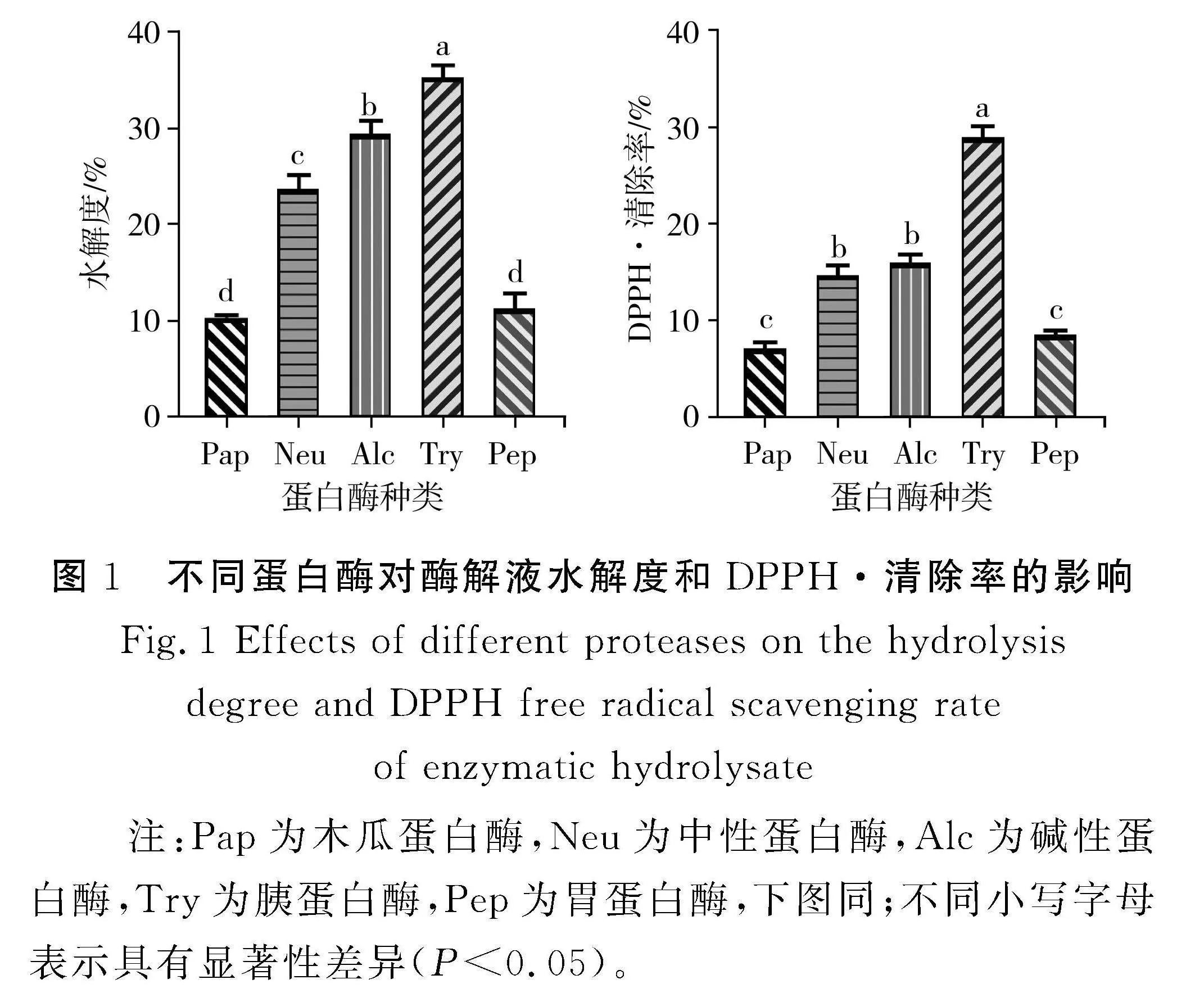
2.1" 单一蛋白酶的筛选
由图1可知,中华草龟皮胶原蛋白经胰蛋白酶酶解效果最好,水解度达35.37%,DPPH·清除率达28.98%,显著高于其他4种蛋白酶(Plt;0.05);碱性蛋白酶和中性蛋白酶的酶解效果较好,胃蛋白酶和木瓜蛋白酶的酶解效果较差。5种蛋白酶的水解度和DPPH·清除率从大到小是Trygt;Alcgt;Neugt;Pepgt;Pap。结果表明,不同蛋白酶的酶解效果不同,主要是由于蛋白酶具有专一性,单酶只能水解固定的肽键,水解程度受到限制。复合酶切断肽键的位置不同,能进一步降低产物的分子量,得到分子量合理分布的胶原蛋白肽。因此,本试验选定胰蛋白酶、碱性蛋白酶和中性蛋白酶3种蛋白酶两两复配来酶解胶原蛋白。
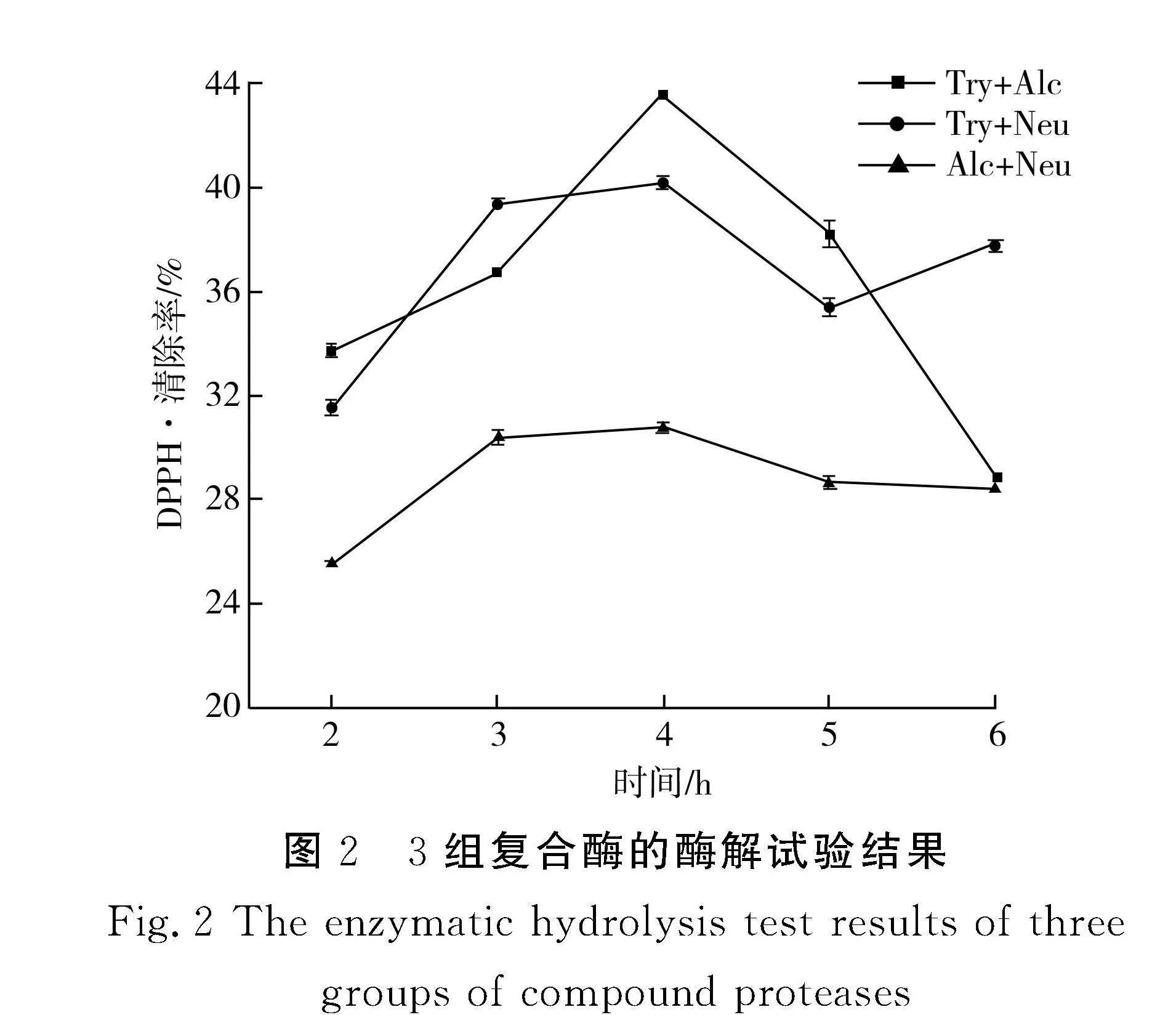
2.2" 复合蛋白酶的筛选
由图2可知,中华草龟皮胶原蛋白经胰蛋白酶和碱性蛋白酶复合酶解效果最好,其水解度明显高于其他两组复合酶,且DPPH·清除率最高可达43.54%。因此,本研究确定采用胰蛋白酶和碱性蛋白酶复配来酶解中华草龟皮胶原蛋白。
2.3" 复合酶酶解单因素试验结果
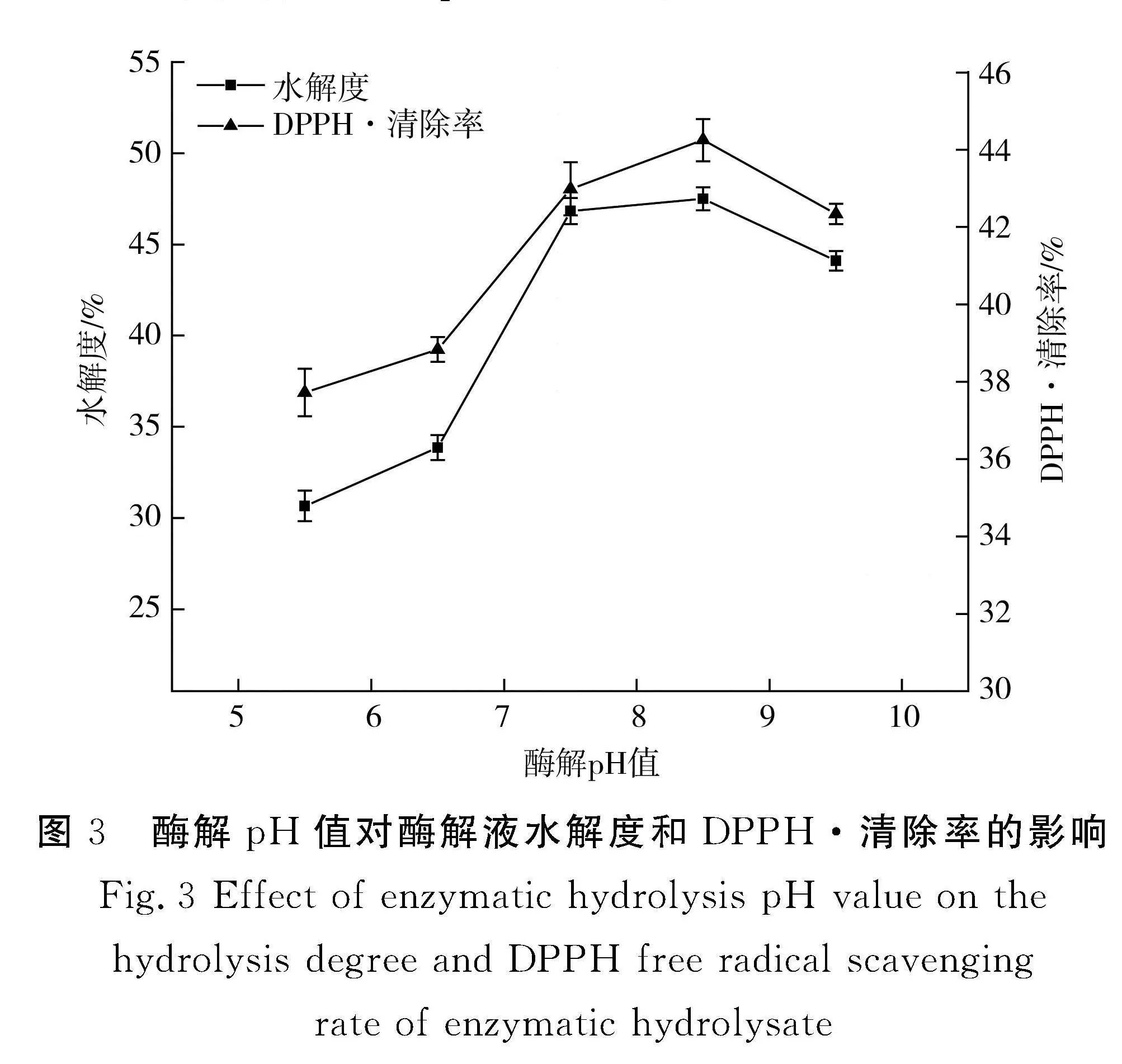
2.3.1" 复合酶酶解pH值的确定
由图3可知,pH值在5.5~8.5之间时,水解度和DPPH·清除率均呈现上升趋势;当pH值为8.5时,水解度和DPPH·清除率均达到最大;当pH值gt;8.5时,水解度和DPPH·清除率均逐渐下降。由于蛋白酶的空间构型会受pH值的影响而产生变化,当pH值不适宜时蛋白酶活力降低甚至失活;并且底物与蛋白酶的解离状态也会受到pH值的影响,从而影响蛋白质的水解度。pH值为8.5时复合酶的酶活力最强,酶解效果最好。
2.3.2" 复合酶酶解温度的确定
由图4可知,酶解温度在40~50 ℃之间时,水解度和DPPH·清除率均逐渐上升;当酶解温度为50 ℃时,水解度和DPPH·清除率均达到最大;当酶解温度大于50 ℃时,水解度和DPPH·清除率均呈下降趋势。由于蛋白酶活力会受到温度的影响,酶解温度过低时,蛋白酶活力会降低,酶解反应速率降低;酶解温度过高时,酶的空间结构会发生变化,导致酶活力下降甚至失活,从而影响蛋白质的水解度。因此,复合酶酶解的最佳温度为50 ℃。
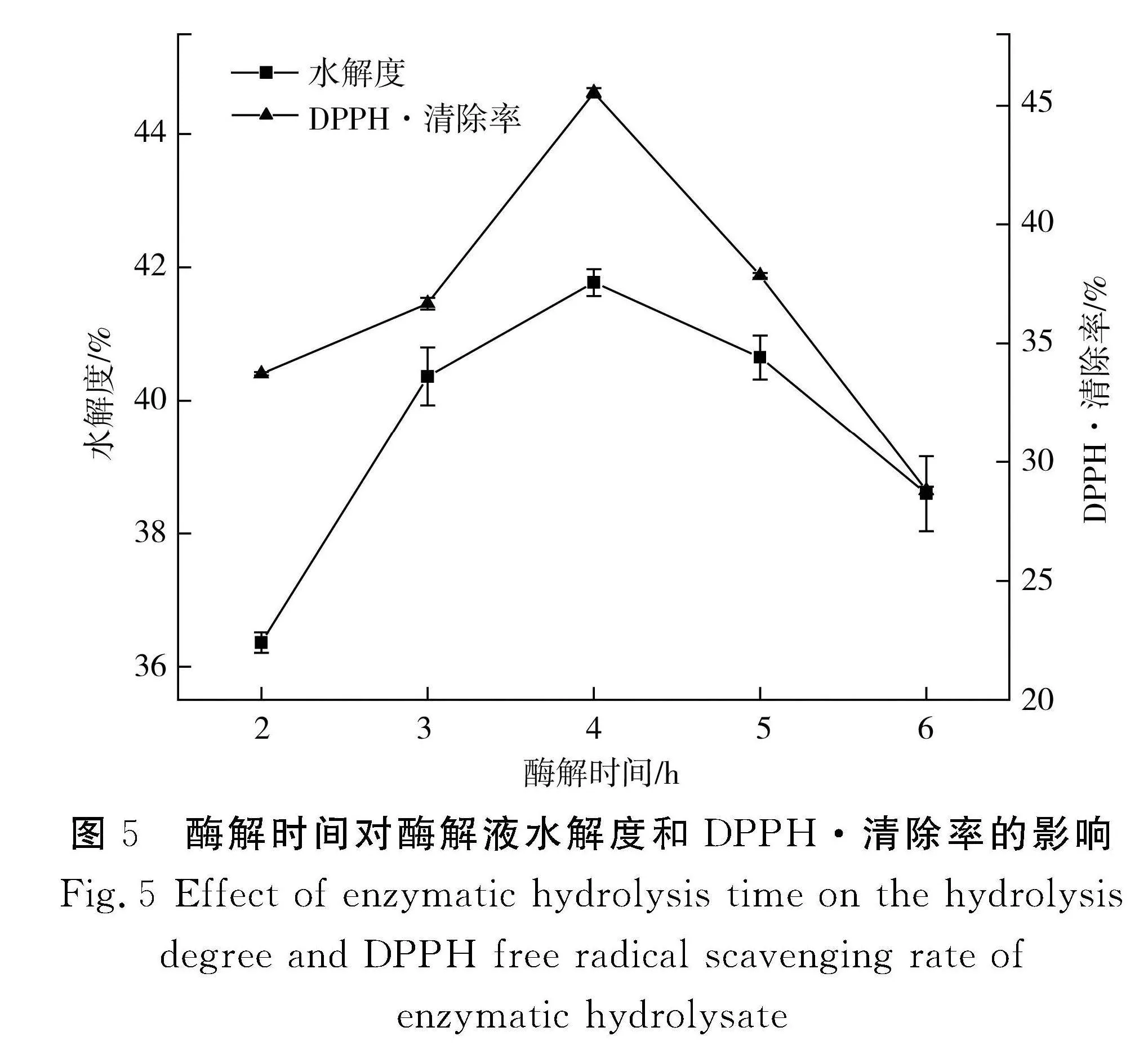
2.3.3" 复合酶酶解时间的确定
由图5可知,酶解时间在2~4 h之间时,水解度和DPPH·清除率均呈上升趋势,此时酶解反应处于加速反应阶段;当酶解时间为4 h时,水解度和DPPH·清除率均达到最大,酶与底物反应完全;当酶解时间大于4 h时,水解度和DPPH·清除率均呈下降趋势,随着酶解时间的延长,底物浓度相应降低,生成的复合物浓度增加使蛋白酶的活性中心被覆盖,抑制了酶解反应,从而导致胶原蛋白的水解度下降。因此,选择4 h为最适酶解时间。
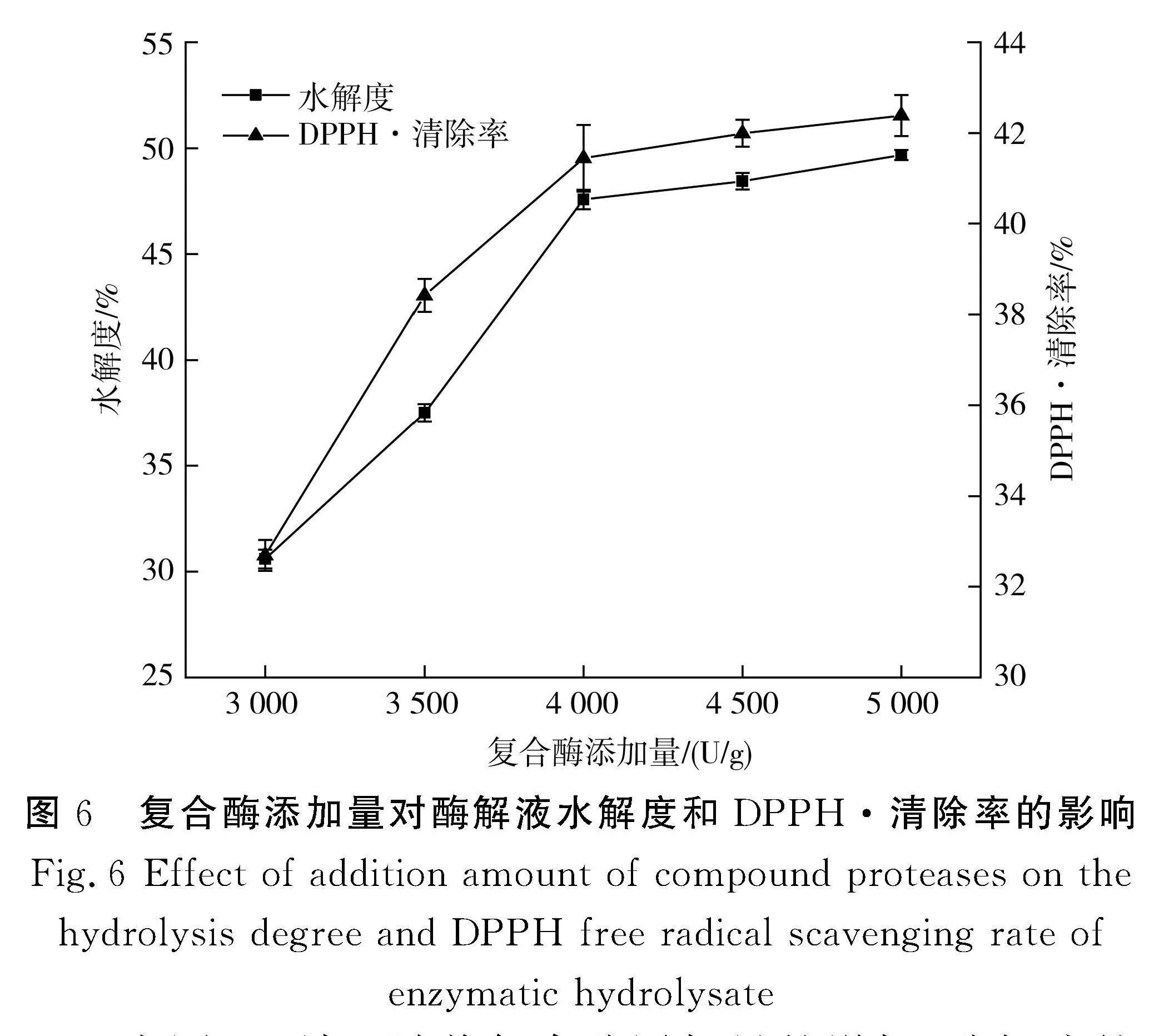
2.3.4" 复合酶添加量的确定
由图6可知,随着复合酶添加量的增加,酶解液的水解度和DPPH·清除率均呈现上升趋势。由于起初复合蛋白酶添加量增加,底物胶原蛋白得到充分水解,水解度增加。当复合酶添加量达到4 000 U/g时,水解度和DPPH·清除率均趋于平缓,由于底物胶原蛋白不足,酶用量达到过饱和状态。因此,考虑到经济成本,选择4 500 U/g为最适复合酶添加量。
2.3.5" 复合酶复配比的确定
由图7可知,随着胰蛋白酶和碱性蛋白酶的复配比逐渐减小,酶解液的水解度呈现先上升后下降的趋势。当复配比为2∶1时,水解度为48.88%,当复配比为1∶1时,水解度为48.69%,两者相差不大,且当复配比为1∶1时,DPPH自由基清除率最大,因此,选择1∶1为最适复配比。
2.4" 复合酶酶解正交试验结果
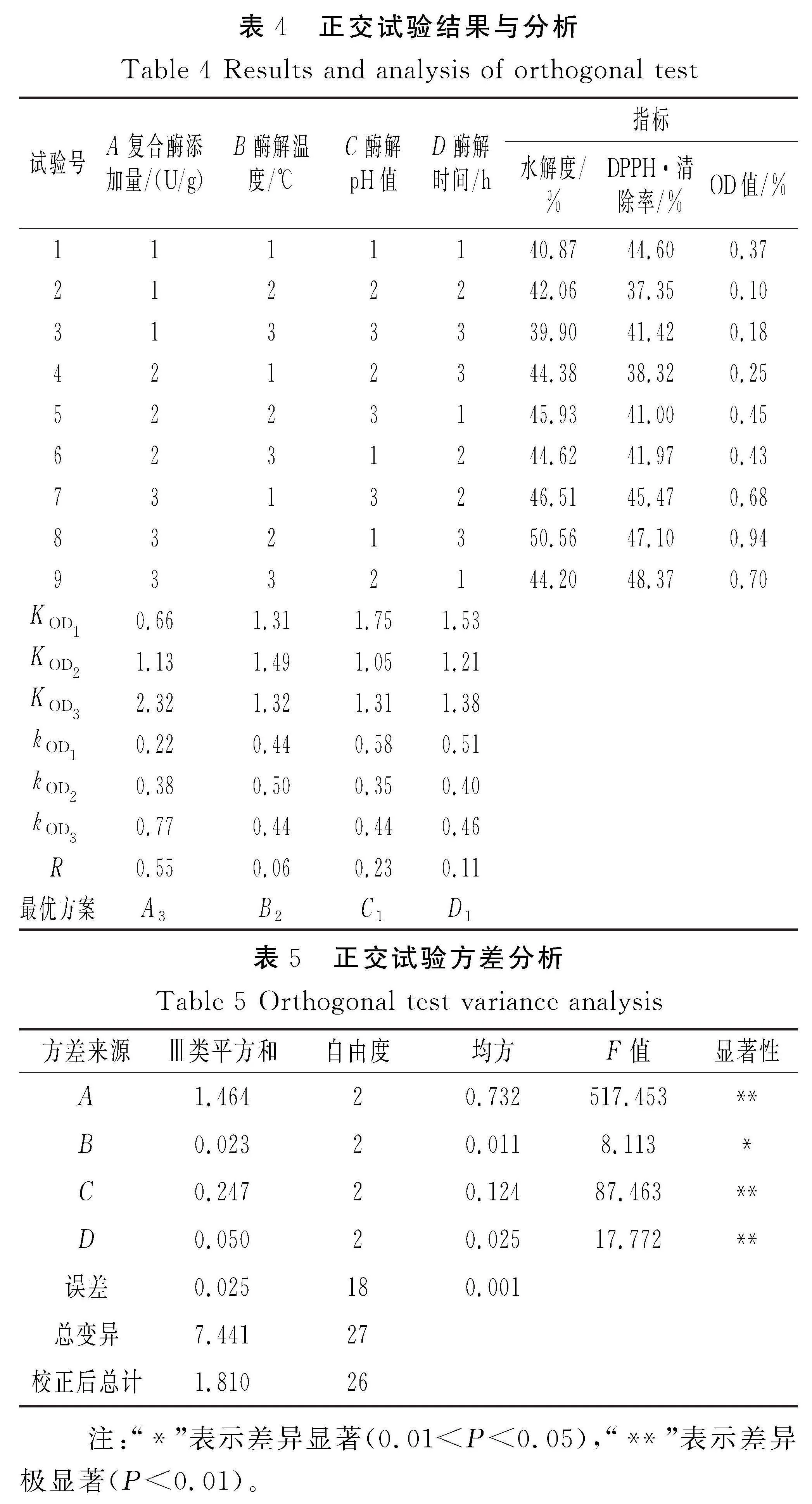
由表4可知,影响复合酶酶解效果的主次顺序为复合酶添加量gt;酶解pH值gt;酶解时间gt;酶解温度,最优组合A3B2C1D1。复合蛋白酶酶解中华草龟皮胶原蛋白的最佳酶解条件为酶解温度50 ℃、酶解pH值7.5、酶解时间3 h、复合酶添加量5 000 U/g。
由表5可知,对正交试验结果进行方差分析,复合酶添加量、酶解pH值、酶解时间对酶解效果的影响极显著(Plt;0.01),而酶解温度对酶解效果的影响显著(0.01lt;Plt;0.05)。对上述工艺条件进行验证试验,在A3B2C1D1条件下测得水解度和DPPH·清除率较好,分别为(51.19±2.45)%和(51.78±2.21)%。因此,最终确定复合酶的最佳酶解条件为复合酶添加量5 000 U/g、酶解温度50 ℃、酶解pH值7.5、酶解时间3 h。
采用最优酶解条件制备的中华草龟皮胶原蛋白多肽液冻干粉见图8,胶原蛋白肽呈粉末状,颜色呈乳白色,稍有腥味,没有肉眼可见的杂质,符合国家质量检测标准GB 31645—2018。
3" 结论
以水解度和DPPH·清除率为指标,筛选出胰蛋白酶、碱性蛋白酶和中性蛋白酶3种单一蛋白酶。胰蛋白酶酶解胶原蛋白酶解液的水解度最高,为(35.37±1.25)%,DPPH·清除率最高,为(28.98±1.12)%。最佳复合酶组合为胰蛋白酶和碱性蛋白酶按照1∶1的比例进行复配。复合酶酶解正交试验结果得出最优酶解条件为复合酶添加量5 000 U/g、酶解温度50 ℃、酶解pH值7.5、酶解时间3 h,在此条件下进行验证试验,获得水解度为(51.19±2.45)%,DPPH·清除率为(51.78±2.21)%。综上所述,采用复合酶法制备中华草龟皮胶原蛋白肽显著提高了胶原蛋白酶解液的水解度和DPPH·清除率(Plt;0.05),缩短了酶解时间,为制备新型调味品的工业化生产提供了理论依据。
参考文献:
CHANG M H, SONG J Y, KOO K S. The status of distribution for native freshwater turtles in Korea, with remarks on taxonomic position.Korean Journal of Environmental Biology,2012,30(2):151-155.
李晴,朱香梅,石雨荷,等.龟甲胶研究发展探析.河南中医,2023,43(6):968-972.
黄文,印大中,朱泽瑞.龟皮胶原蛋白的提取及结构表征(Ⅰ).湖北大学学报(自然科学版),2010,32(4):434-437.
丁琳.鹅皮胶原蛋白的提取及功能性研究.宁波:宁波大学,2015.
程进霞,李景军.食物源活性肽及其生物功能特性研究现状.新疆师范大学学报(自然科学版),2022,41(4):16-24.
WANG B,WANG Y M,CHI C F,et al.Isolation and characterization of collagen and antioxidant collagen peptides from scales of croceine croaker (Pseudosciaena crocea).Marine Drugs,2013,11:4641-4661.
万春燕,王英华,邬元娟,等.胶原蛋白在食品中的应用现状及其发展前景.中国食物与营养,2008(9):24-26.
毕琳.刺参(Stichopus japonicus)体壁胶原蛋白理化性质和生物活性研究.青岛:中国海洋大学,2006.
于文影.鹿角脱盘多肽的制备及其生物活性的研究.长春:吉林农业大学,2011.
彭易鑫,陆旭丽,代亚萍,等.响应面法优化复合酶酶解制备可口革囊星虫胶原蛋白抗氧化肽工艺研究.食品工业科技,2021,42(22):230-239.
刘晓艳,叶月华,白卫东,等.外源物质对低盐罗非鱼糜蛋白构象及体外消化特性的影响.食品工业科技,2024,45(1):80-87.
HUANG J J, LI H L, XIONG G Q, et al. Extraction, identification and anti-photoaging activity evaluation of collagen peptides from silver carp (Hypophthalmichthys molitrix) skin.LWT-Food Science and Technology,2023,173:114384.
SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: a review of their production, assessment, and potential applications.Journal of Functional Foods,2011,3(4):229-254.
严超,牟建楼,陈志周,等.栉孔扇贝酶解液制备条件优化及其抗氧化性研究.中国调味品,2017,42(12):1-6.
CHOWDARY G V, KRISHNA S H, RAO G H. Optimization of enzymatic hydrolysis of mango kernel starch by response surface methodology.Bioprocess Engineering,2000,23(6):681-685.
南学敏.羊骨胶原蛋白肽抗氧化活性及氨基酸组成分析.呼和浩特:内蒙古农业大学,2019.
XIE Z K, WANG X G, YU S Y, et al.Antioxidant and functional properties of cowhide collagen peptides.Journal of Food Science,2021,86(5):1802-1818.
张典,李龄佳,崔春,等.牡蛎酶解工艺的响应面优化研究.中国调味品,2019,44(5):12-16.
桂海佳,李江龙,李泽林,等.基于双酶水解优化牛肉酶解液工艺及其呈味成分分析.中国调味品,2022,47(10):103-109.
文章,李周,贺富强,等.双酶分步水解酱香型白酒丢糟中粗蛋白的工艺研究.食品工业,2018,39(2):79-83.
梁晓芳,牟建楼,严超,等.扇贝酶解条件的优化及其抗氧化性的研究.中国调味品,2018,43(1):61-66.
国家市场监督管理总局,国家卫生健康委员会.食品安全国家标准 胶原蛋白肽:GB 31645—2018.北京:中国标准出版社,2018.

