鲜湿豆丝中优势腐败菌的分离鉴定及ε-聚赖氨酸盐酸盐/丙酸钙复配抑菌研究

摘要:鲜湿豆丝中水分含量高,易使微生物生长繁殖,导致鲜湿豆丝腐败变质。为延长鲜湿豆丝的货架期,延缓微生物的生长速率,采用平板划线法从腐败鲜湿豆丝中分离出7株腐败菌,经鉴定为4株枯草芽孢杆菌(X1、X2、X3、X6)、1株苏云金芽孢杆菌(X4)、1株阿氏肠杆菌(X5)、1株考氏科萨克氏菌(X7)。将无菌鲜湿豆丝接种分离出的腐败菌,以菌落总数与酸度为检测指标,评价腐败菌的致腐能力。结果表明,接种了腐败菌的样品,其菌落总数与酸度均大于对照组,表明7株腐败菌均有较强的致腐能力。通过滤纸片法测定抑菌圈大小,研究不同浓度复配抑菌剂(ε-PL与CP)对7株腐败菌的抑菌效果。其中,40% ε-PL+60% CP、20% ε-PL+80% CP两种抑菌剂对腐败菌有较好的抑制作用。
关键词:鲜湿豆丝;腐败菌;致腐能力;分离与鉴定
中图分类号:TS214""""" 文献标志码:A""""" 文章编号:1000-9973(2024)08-0017-05
Isolation and Identification of Dominant Spoilage Bacteria from Fresh and Wet
Bean Shreds and Study on Antibacterial Activity of ε-Polylysine
Hydrochloride Combined with Calcium Propionate
CAO Yang1,3, HUANG Ya-qi2, XU Ping1,3, SHEN Zhang-yan4, CHEN Lei1,3*
(1.School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430048, China;
2.College of Food Science and Technology, Wuhan Business University, Wuhan 430056, China;
3.Key Laboratory for Deep Processing of Major Grain and Oil, Ministry of Education,
Wuhan 430048, China; 4.Wuhan Laoqianji Food Co., Ltd., Wuhan 430072, China)
Abstract: The high moisture content in fresh and wet bean shreds can easily promote the growth and reproduction of microorganisms, leading to the spoilage and deterioration of fresh and wet bean shreds. In order to extend the shelf life of fresh and wet bean shreds and slow down the growth rate of microorganisms, seven strains of spoilage bacteria are isolated from spoiled fresh and wet bean shreds by streak plate method, and they are identified as four strains of Bacillus subtilis(X1,X2,X3,X6), a strain of Bacillus thuringiensis(X4), a strain of Enterobacter asburiae(X5) and a strain of Kosakonia cowanii(X7). The isolated spoilage bacteria are inoculated onto sterile fresh and wet bean shreds, and the total number of colonies and acidity are used as the detection indexes to evaluate the spoilage ability of the spoilage bacteria. The resultsSymbol`@@show that the total number of colonies and acidity of the samples inoculated with spoilage bacteria
DOI:10.3969/j.issn.1000-9973.2024.08.004
引文格式:曹杨,黄雅琪,徐平,等.鲜湿豆丝中优势腐败菌的分离鉴定及ε-聚赖氨酸盐酸盐/丙酸钙复配抑菌研究.中国调味品,2024,49(8):17-21,38.
CAO Y, HUANG Y Q, XU P, et al. Isolation and identification of dominant spoilage bacteria from fresh and wet bean shreds and study on antibacterial activity of ε-polylysine hydrochloride combined with calcium propionate.China Condiment,2024,49(8):17-21,38.
收稿日期:2024-02-06
基金项目:中央引导地方专项(2022BGE247);湖北省自然科学青年基金项目(2023AFB304)
作者简介:曹杨(1987—),女,实验师,硕士,研究方向:谷物科学。
*通信作者:陈磊(1992—),男,讲师,博士,研究方向:谷物科学。
are all higher than those of the control group, indicating that the seven strains of spoilage bacteria have strong spoilage ability. The size of the antibacterial zone is measured by filtering paper method to study the antibacterial effects of different concentrations of compound antibacterial agents (ε-PL and CP) on seven strains of spoilage bacteria. Among them, 40% ε-PL+60% CP, 20% ε-PL+80% CP have good antibacterial effects on spoilage bacteria.
Key words: fresh and wet bean shreds; spoilage bacteria; spoilage ability; isolation and identification
豆丝是长江中下游地区的农家传统美食,主要分布在湖北、安徽、江西等地。制作原料主要以大米为主,也可混合小麦或荞麦等,以豆类为辅,如黄豆、绿豆、红豆、豌豆、蚕豆等食用豆子的一种或几种。原料经浸泡、磨浆、烫制、摊凉、切丝、晾晒制成豆丝。成品色泽微黄,滋味鲜美,口感绵软,营养丰富。目前,市售豆丝包括干豆丝与湿豆丝两种,其中鲜湿豆丝的口感细腻,风味浓郁,备受人们欢迎。
然而,因鲜湿豆丝水分含量高,微生物极易生长繁殖。微生物的大量繁殖是导致鲜湿豆丝腐败变质的主要原因。为延长鲜湿豆丝的货架期,需采取有效的抑菌和杀菌措施,抑制鲜湿豆丝中腐败微生物的生长繁殖,延缓其生长速率,达到延长鲜湿豆丝货架期的作用。在适宜的贮藏环境下,微生物互相竞争、拮抗、互惠共生,促进自身的生长和繁殖。一种或多种微生物会成为导致产品腐败变质的主要优势腐败菌。优势腐败菌的分离鉴定有助于发现指标菌,为后续有针对性地选择抑菌剂提供依据。
ε-聚赖氨酸盐酸盐(ε-polylysine hydrochloride,ε-PL)是链霉菌属发酵过程中的代谢产物经分离提取精制而获得的一种生物防腐剂,水溶性好、热稳定性强,具有广谱性,对革兰氏阴性菌、革兰氏阳性菌和真菌均有抑制作用,通过破坏细胞膜和细胞壁的完整性,造成物质外渗,影响蛋白质合成等正常生理功能,抑制微生物生长。丙酸钙(calcium propionate,CP)是一种新型食品添加剂,为安全、可靠的食品防霉剂,具有抑制微生物增殖和消灭微生物的作用,是天然防腐剂的重要组成部分,能参与人体正常新陈代谢,对人体无害,用于食品的防腐和防霉,在作为防腐保鲜剂的同时能为人体提供必需的钙质,起到强化食品营养的作用。对革兰氏阴性杆菌、好氧芽孢杆菌及各类霉菌有较强的抑制作用,是一种被广泛应用在富含淀粉和蛋白质的食品中的抑菌剂。根据栅栏原理,将不同种类的防腐剂综合应用,可发挥其协同效应,在增强抑菌效果的同时可降低单一防腐剂的使用量。
因此,本文拟对鲜湿豆丝中的优势腐败微生物进行分离与初步鉴定,同时选用ε-PL与CP两种防腐剂复配成不同浓度梯度的抑菌剂,对分离出来的优势腐败菌进行抑菌实验。为进一步有针对性地寻找关于鲜湿豆丝有效的防腐保鲜措施、延长鲜湿豆丝的货架期提供理论依据。
1" 材料和方法
1.1" 材料
大米、黄豆、绿豆:武汉老谦记食品有限公司。
1.2" 试剂
平板计数琼脂:北京陆桥技术股份有限公司;葡萄糖发酵培养基:杭州微生物试剂有限公司;可溶性淀粉琼脂、芽孢染色液:青岛海博生物技术有限公司;革兰氏染色液:常德比克曼生物科技有限公司;丙酸钙:河南万邦实业有限公司;ε-聚赖氨酸盐酸盐:浙江诺一生物科技有限公司;NaCl、香柏油:国药集团化学试剂有限公司;75%酒精:武汉东湖星科技有限公司。
1.3" 主要仪器设备
SW-CJ-1FD超净化工作台" 苏州净化设备有限公司;YXQ-50SⅡ立式压力蒸汽灭菌锅、SPX-250B-Z生化培养箱" 上海博迅实业有限公司医疗设备厂;SOPTOP CX40电子显微镜" 北京悦昌行科技有限公司;JM-L50立式胶体磨" 上海诺尼轻工机械有限公司;MC-JCN30S电饼铛" 广东美的生活电器制造有限公司;QL-866均质器" 海门市其林贝尔仪器制造有限公司;DZ-280/2SD多功能真空包装机" 东莞市益健包装机械有限公司。
1.4" 方法
1.4.1" 鲜湿豆丝的制备
1.4.1.1" 生产工艺流程
籼米、黄豆、绿豆→清洗→浸泡→磨浆→烫制→摊凉→切丝→包装→贮藏。
1.4.1.2" 操作要点
浸泡:将籼米、黄豆、绿豆(干基比10∶2∶1)分别用水浸泡4,8,4 h。
磨浆:将浸泡后的籼米、黄豆、绿豆沥干、混合,以1∶1.2(原料干基∶水,质量比)的比例加入清水后使用胶体磨磨浆10 min,得豆丝浆料。
烫制:在电饼铛中倒入定量浆料,于180 ℃烫制50 s后成型。
摊凉、切丝与包装:将烫好的豆丝在室温下通风设备中放置1 h,随后切成条状,进行真空包装。
贮藏:在25 ℃下贮藏。
1.4.2" 鲜湿豆丝的腐败处理
将1.4.1中的鲜湿豆丝进行普通封口包装,在25 ℃贮藏3 d至腐败变质。
1.4.3" 腐败菌的分离纯化
在无菌条件下取1.4.2中的鲜湿豆丝25 g放入225 mL无菌生理盐水中,用均质器拍打1.5 min,随后取1 mL鲜湿豆丝的悬浊液进行10倍梯度稀释,稀释至10-7,取上述稀释梯度为10-4,10-5,10-6,10-7的稀释液1 mL涂布于PCA培养基上,在37 ℃培养48 h后,挑取菌落形态不同的菌落,采用平板划线法进行纯化培养,连续纯化4~5次,直至长出单个菌落,将纯化后所得的菌种斜面培养后于4 ℃保存,备用。
1.4.4" 腐败菌的鉴定
1.4.4.1" 形态学鉴定
观察并记录分离纯化腐败菌菌株的菌落形态,包括单菌落的颜色、质地、形状、大小、表面、透明度、隆起度。挑取细菌培养物制成载片标本,观察细胞形态并记录。
1.4.4.2" 生理生化鉴定
通过革兰氏染色、芽孢染色、鞭毛染色、葡萄糖产酸、葡萄糖产气和淀粉水解实验对分离的细菌菌株进行生理生化鉴定。
1.4.4.3" 16S rDNA鉴定
将所得菌株送至武汉擎科生物技术有限公司进行测序。将所得16S rDNA序列提交至NCBI的GenBank基因库中进行同源比对,选取与目的基因序列同源性较高的菌株的16S rDNA基因序列,使用MEGA 7.0软件构建系统发育树,进一步确定菌株的种属性质。
1.4.5" 腐败菌致腐能力测定
1.4.5.1" 无菌豆丝制备
将1.4.1中制得的鲜湿豆丝在75%的酒精中浸泡1 min,用无菌风风干酒精,在紫外灯下照射30 min,得无菌豆丝。
1.4.5.2" 菌悬液制备
将1.4.3中保存的已纯化的7种腐败菌分别接种于PCA培养基上,放入生化培养箱中37 ℃培养48 h,在无菌环境下分别挑取一定量的7种腐败菌加入250 mL无菌水中,充分摇匀,得到待试腐败菌菌悬液。
1.4.5.3" 无菌豆丝染菌
将制得的无菌鲜湿豆丝置于菌悬液中浸泡30 s后取出,在无菌风下放置10 min,待晾干鲜湿豆丝表面多余的水分后,用无菌包装袋包装,即得经腐败菌接种处理过的鲜湿豆丝,每株腐败菌设置3个平行实验组。同时,取无菌水代替菌悬液作为空白对照组(CK)。
1.4.5.4" 致腐能力评价
将所有处理好的样品放入25 ℃恒温箱中贮藏72 h,每隔24 h取样,测定待测样品的菌落总数与酸度,以评价7株腐败细菌对鲜湿豆丝的致腐能力。
1.4.6" 鲜湿豆丝菌落总数测定
参照GB 4789.2—2016进行菌落总数测定。
1.4.7" 鲜湿豆丝酸度测定
参照GB 5009.239—2016中第一法酚酞指示剂法进行酸度测定。
1.4.8" 抑菌实验
1.4.8.1" 抑菌剂浓度梯度的选择
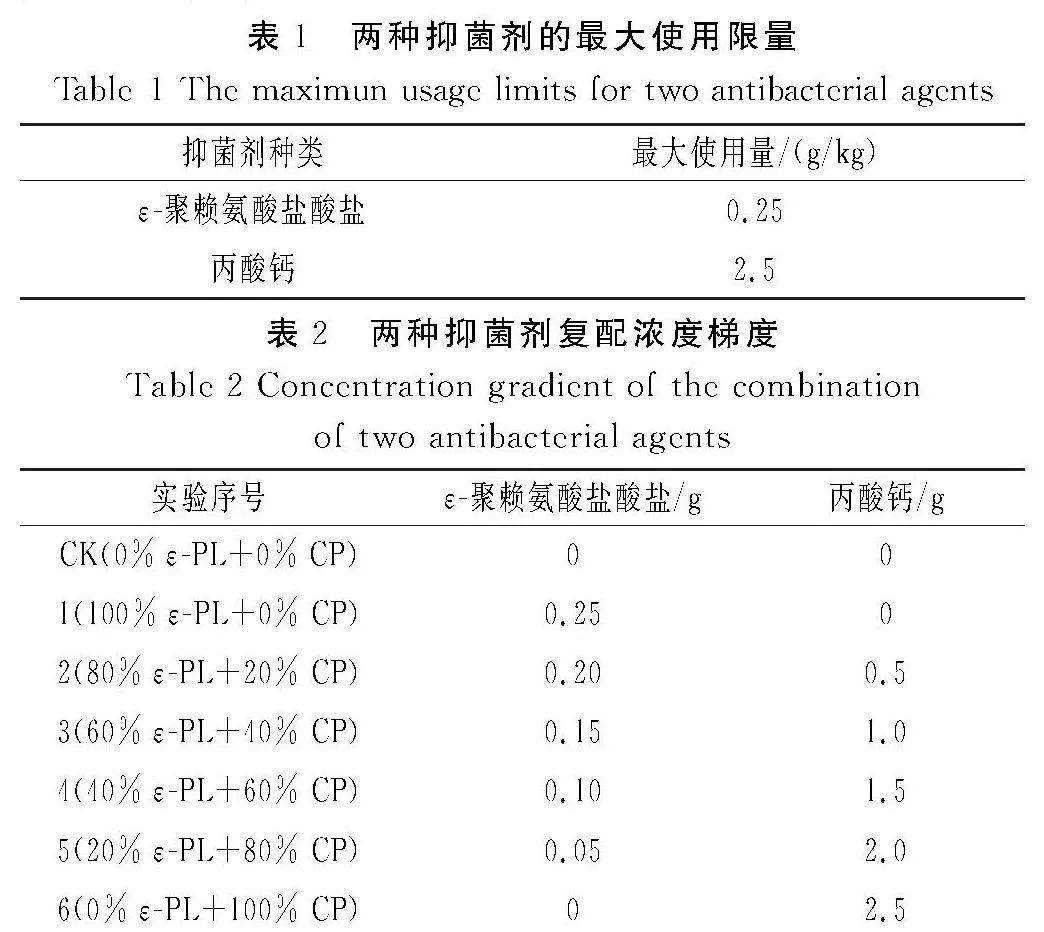
根据GB 2760—2014中的规定,所选两种抑菌剂的最大使用限量见表1,将两种抑菌剂复配使用,复配方案见表2,符合食品添加剂复配原则。将各组添加剂溶于无菌水中,得抑菌剂备用。对照组(CK)使用无菌水取代抑菌剂。
1.4.8.2" 抑菌圈法测定抑菌剂对腐败菌的抑制效果
采用滤纸片法测定抑菌圈大小。分别取一定量的腐败菌株加入225 mL无菌生理盐水中充分摇匀,制得7株供试腐败菌菌液。吸取1 mL菌液至无菌培养皿中,然后向培养皿中倾注15~20 mL冷却至50 ℃左右的PCA培养基,混合均匀,水平静置,凝固后备用。选用质地均匀的滤纸,用直径为10 mm的打孔器将滤纸打成相同大小的圆片,灭菌后备用。
待平板上的水分被琼脂完全吸收后,吸取45 μL抑菌剂滴加到滤纸片上,将含有抑菌液的滤纸片贴到平板表面,并用镊子轻压,使其贴平,不再移动位置。随后,将上述平板放入4 ℃冰箱中预扩散2 h,使滤纸片中的抑菌液扩散到培养基中。预扩散结束后,将平板取出,待恢复至室温后放置于35 ℃生化培养箱中培养18 h,测量抑菌圈大小。
1.4.9" 数据分析
采用Origin 8.5进行数据处理及作图,采用SPSS Statistics 19.0进行数据统计分析(Duncan法),采用MEGA 7.0构建系统发育树。显著差异水平取Plt;0.05。所有数据均为3次平行测量的平均值。
2" 结果与分析
2.1" 优势腐败菌的鉴定
2.1.1" 形态学与生理生化鉴定
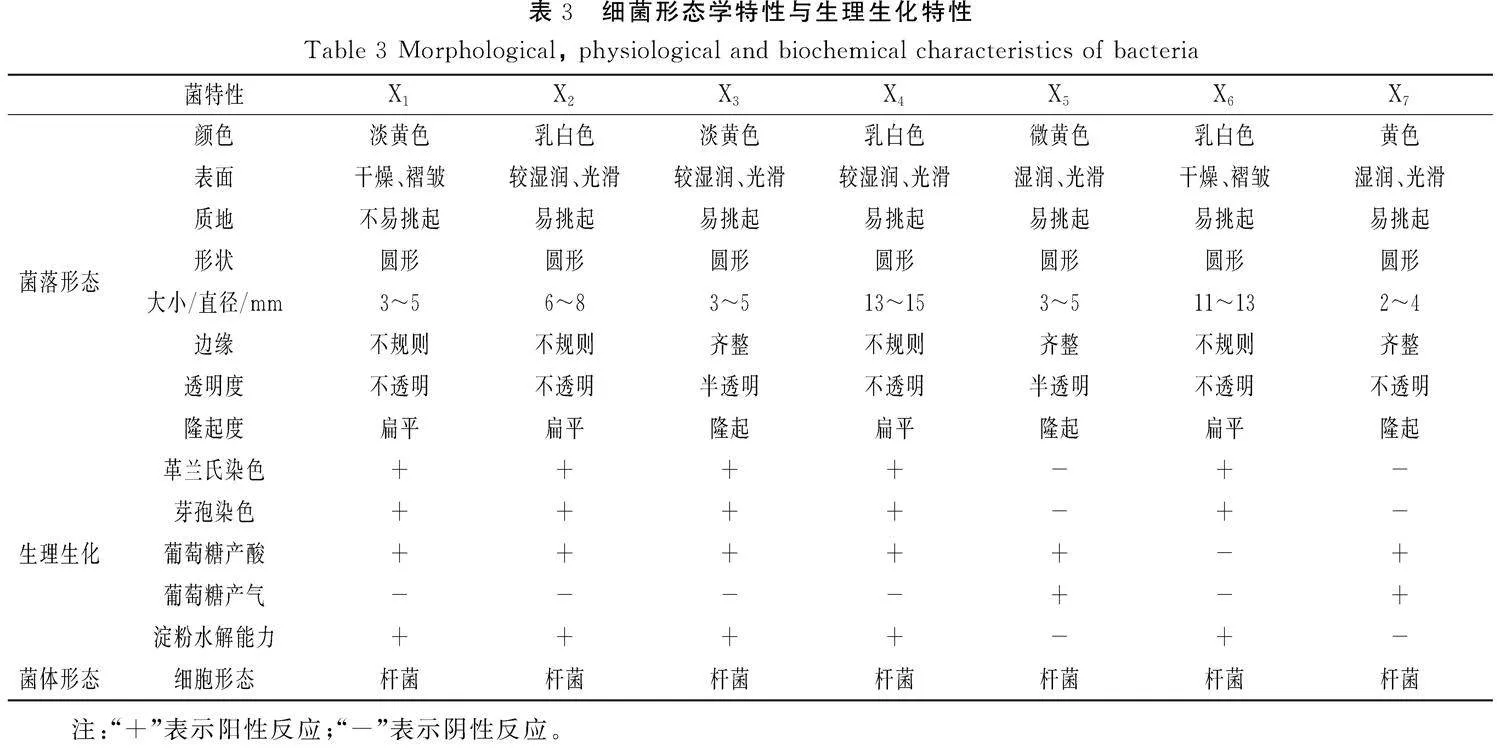
采用平板划线法分离纯化鲜湿豆丝中的腐败细菌。从鲜湿豆丝中获得7种腐败菌,分别编号为X1、X2、X3、X4、X5、X6、X7。对所获得的7株腐败菌株的菌落形态进行观察鉴定,并进行生理生化特性实验,结果见表3。将结果与《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》进行对比,初步鉴定X1、X2、X3、X4、X6为芽孢杆菌属,X5、X7为肠杆菌属,进一步采用分子生物学技术对7株腐败细菌进行菌种鉴定。
2.1.2" 分子生物学鉴定
将筛选得到的7种主要腐败细菌进行16S rDNA序列鉴定。从中选取若干个基因序列相似性高的菌株序列,使用软件MEGA 7.0构建系统发育树,见图1。
由图1可知,菌株X1、X2、X3、X6与Bacillus subtilis聚为一支,亲缘关系最近。菌株X4与Bacillus proteolyticus聚为一支,菌株X5与Enterobacter asburiae聚为一支,X7与Enterobacter sp.聚为一支。
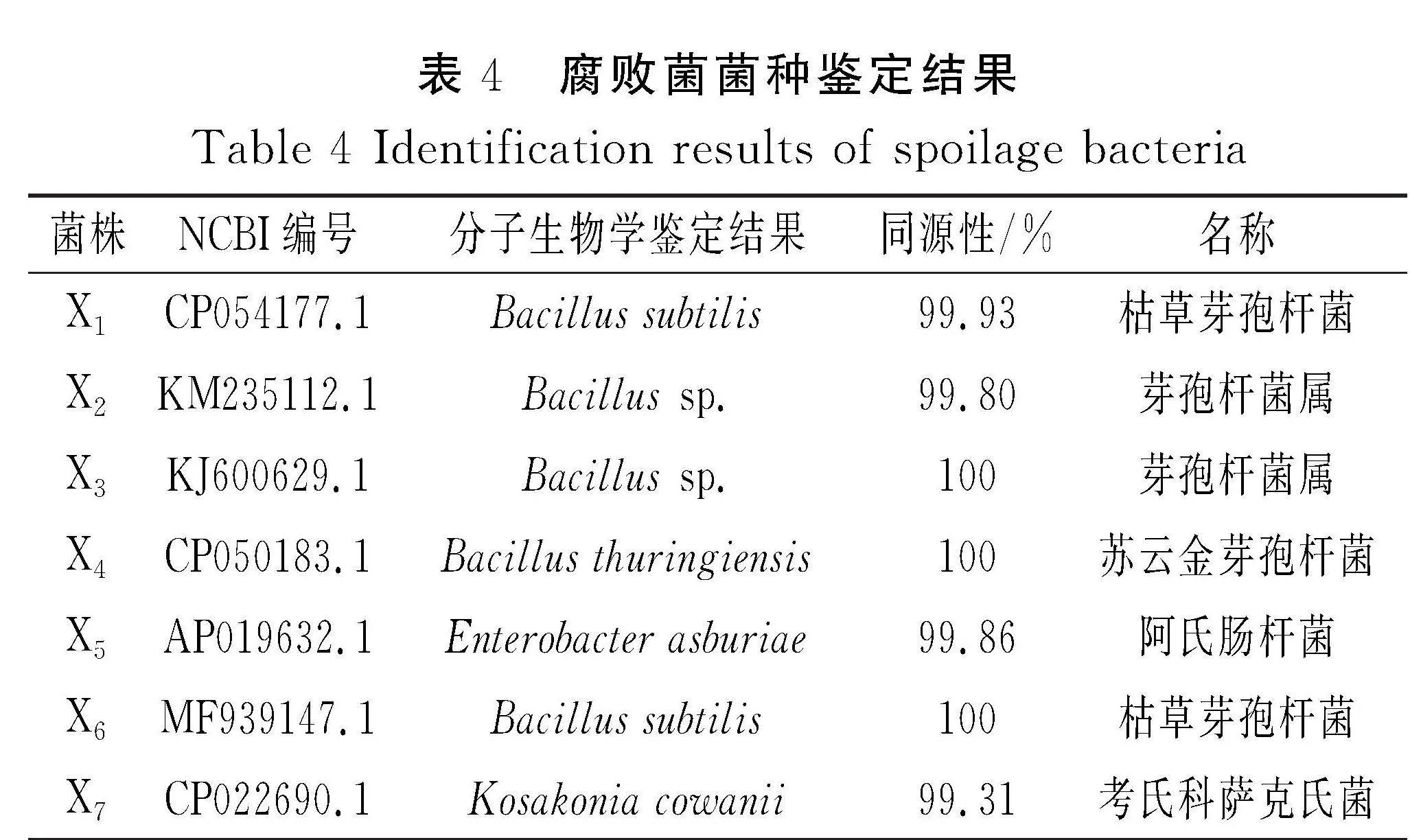
将各个菌种的16S rDNA序列在NCBI基因库中进行同源性比较,结果见表4。
由表4可知,7株菌种的序列与已知序列的同源性均在99%以上,说明鉴定结果可靠。结果显示,X1、X6为枯草芽孢杆菌(Bacillus subtilis),X2、X3为芽孢杆菌属(Bacillus sp.),X4为苏云金芽孢杆菌(Bacillus thuringiensis),X5为阿氏肠杆菌(Enterobacter asburiae),X7为考氏科萨克氏菌(Kosakonia cowanii)。
2.2" 腐败微生物致腐能力测定
分别接种7种腐败菌的鲜湿豆丝在贮藏期间均出现腐败气味,判定7种腐败菌均有较强的致腐能力,为优势腐败菌。以菌落总数与酸度为致腐能力评价指标,判断腐败菌致腐能力的强弱。
2.2.1" 菌落总数
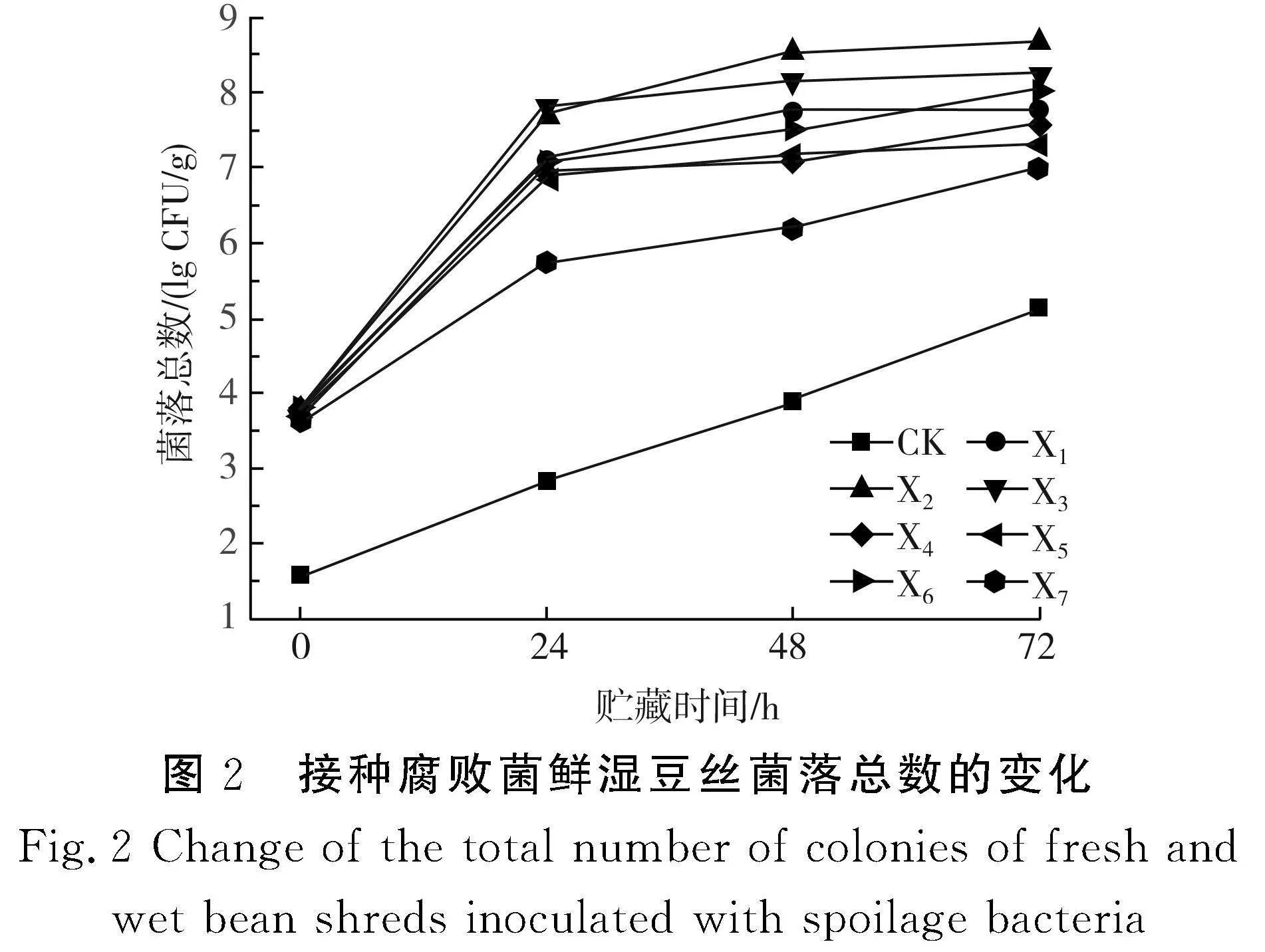
微生物的生长繁殖所产生的代谢产物是引起鲜湿豆丝腐败的主要因素之一。菌落总数的变化是其中最明显的品质指标之一。接种7株腐败菌的鲜湿豆丝在25 ℃条件下贮藏过程中菌落总数的变化趋势见图2。
wet bean shreds inoculated with spoilage bacteria
由图2可知,随着贮藏时间的延长,菌落总数呈上升趋势。其中接种菌株X2的菌落总数增长幅度最大,由贮藏0 h时的3.66 lg CFU/g增长到贮藏第72 h时的8.67 lg CFU/g,其次依次是接种X3、X6、X1、X4、X5、X7的样品。
随着贮藏时间的延长,不同菌株的生长状况呈现出一定的差异。实验组的鲜湿豆丝在0~24 h贮藏期间,菌落总数上升速率较快,随后增长速率减缓,这可能是因为贮藏前期营养物质充足,微生物大量生长繁殖,而在24 h后,胺类、酸类等代谢产物增多,从而抑制了微生物生长,且可利用的营养物质减少,微生物数量达到相对饱和状态,致使增长速率减慢。实验组初始菌落总数相差不大,但后期差异较大,这可能是由于不同微生物的生长代谢速度和致腐机制不同,从而造成了菌落总数的差异,其结果与7种腐败菌对鲜湿豆丝酸度影响的结果大致相同。
2.2.2" 酸度
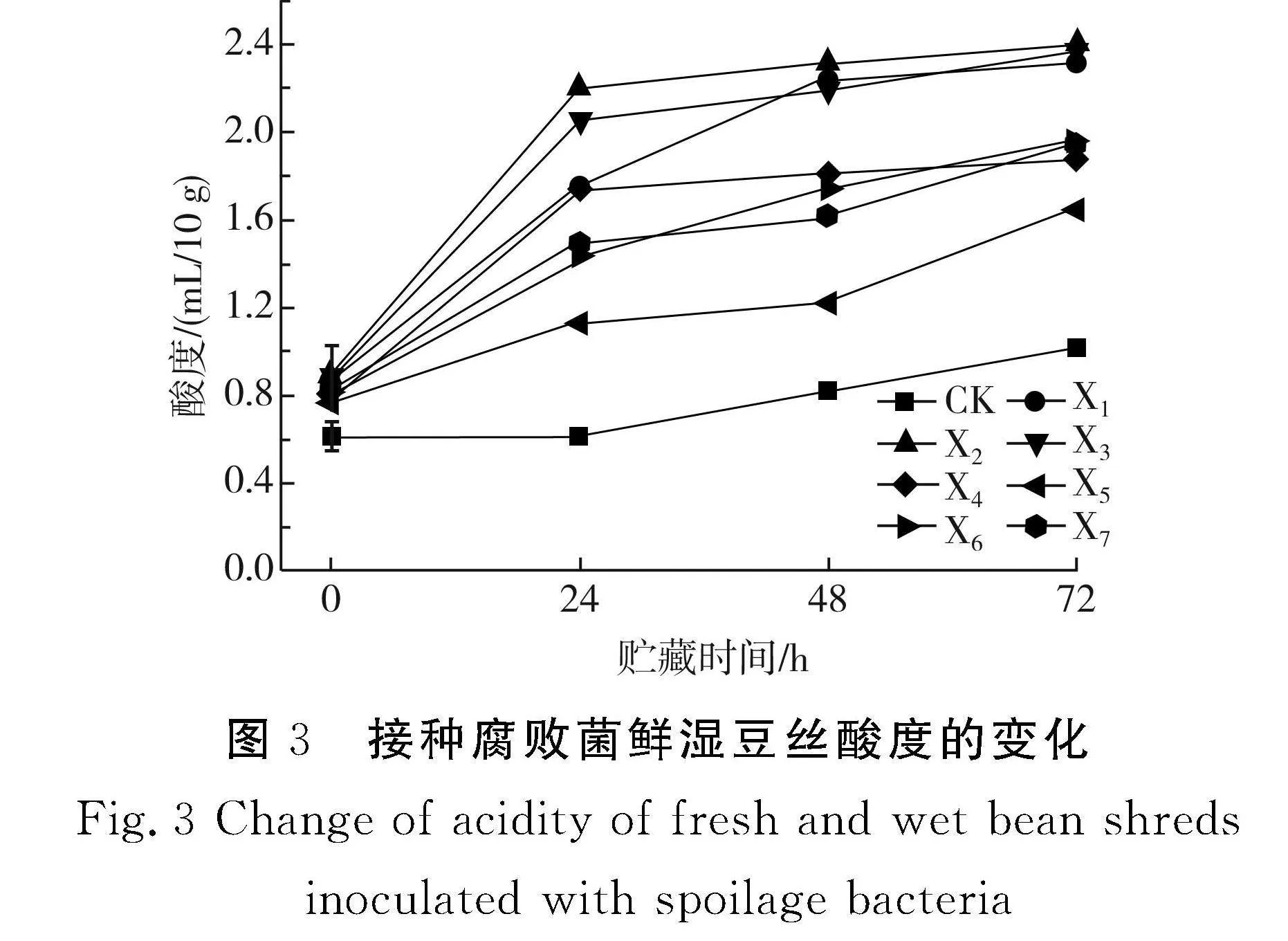
接种腐败菌的鲜湿豆丝在25 ℃条件下贮藏过程中酸度变化见图3。
由图3可知,接种了不同腐败菌株的鲜湿豆丝的酸度差异较大,且实验组的酸度值远大于CK组。随着贮藏时间的延长,所有样品的酸度均呈上升趋势,在贮藏0~24 h内,酸度上升速率最快,贮藏24 h后,上升速率减缓,在贮藏72 h时达到最大值。其中接种X2的鲜湿豆丝酸度变化幅度最大,在贮藏72 h时达最大值2.40 mL/10 g,其次依次为接种X3、X1、X6、X7、X4、X5的样品。酸度与微生物的生长呈正相关,这是因为在贮藏期间,微生物生长代谢会产生酸类物质,导致鲜湿豆丝的酸度升高。
2.3" 抑菌剂对腐败菌的抑制作用
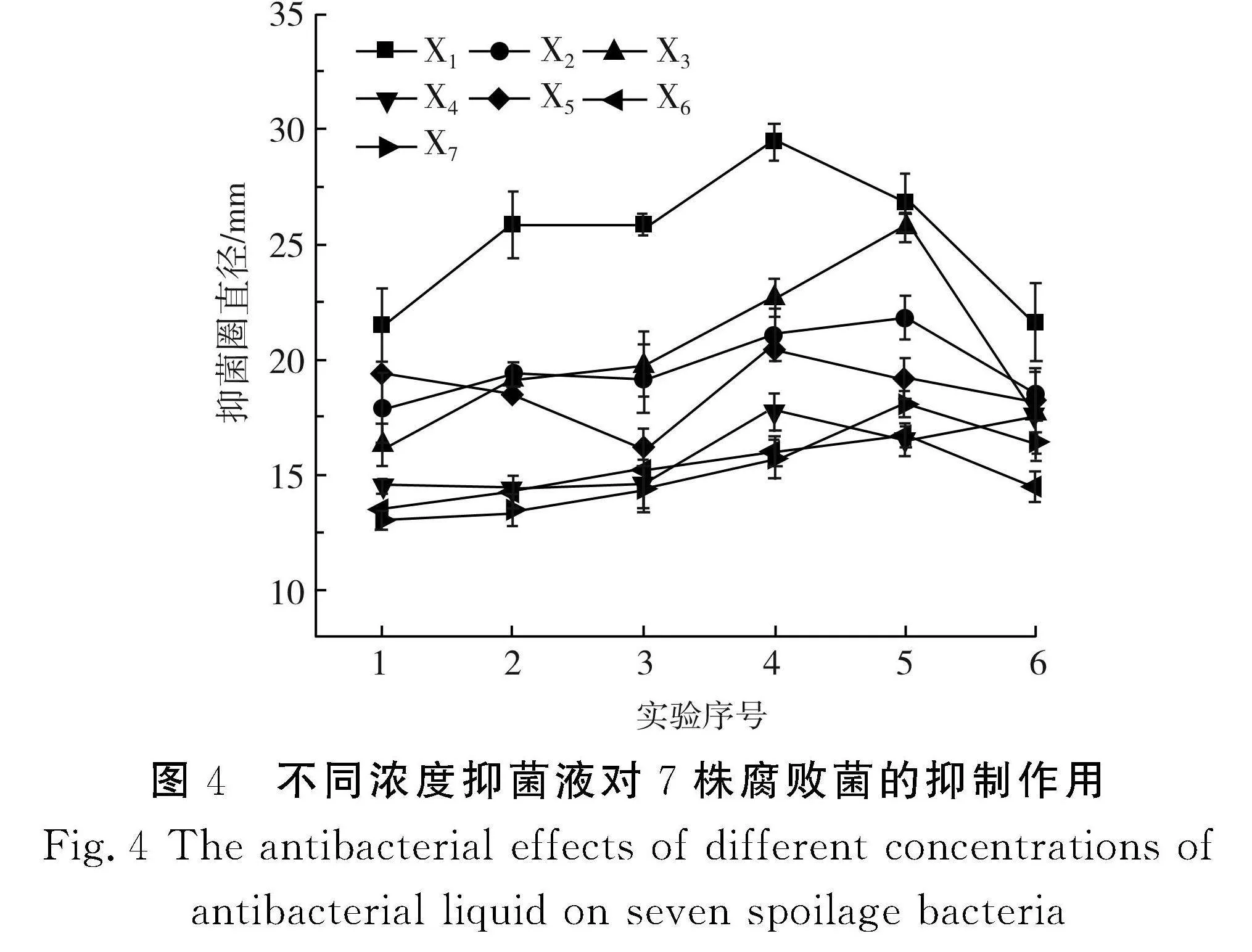
于35 ℃培养18 h后,CK组(0% ε-PL+0% CP)滤纸片周围及与培养基接触面均未出现抑菌圈。不同浓度抑菌液对7株腐败菌的抑制作用见图4。
由图4可知,抑菌剂对7株腐败菌均有抑制作用,且使用复配抑菌剂的抑菌效果优于单一抑菌剂。随着丙酸钙含量的增大,7株腐败菌的抑菌圈直径整体呈现先增大后减小的趋势。复配抑菌剂浓度为40% ε-PL+60% CP(实验序号4)时,菌株X1、X3、X2的抑菌圈较大。复配抑菌剂浓度为20% ε-PL+80% CP(实验序号5)时,菌株X1、X3、X2、X5的抑菌圈较大,对腐败菌株的抑制效果较好。ε-PL主要通过破坏细胞膜和细胞壁的完整性,造成物质外渗,影响蛋白质合成等正常生理功能,从而抑制微生物生长。丙酸钙的作用机制主要是丙酸通过抑制微生物细胞内酶的活动,使微生物蛋白质变性,从而达到抑制微生物生长的作用。
3" 结论
采用平板划线法从腐败鲜湿豆丝中分离出7株腐败细菌,经鉴定为4株枯草芽孢杆菌(X1、X2、X3、X6)、1株苏云金芽孢杆菌(X4)、1株阿氏肠杆菌(X5)、1株考氏科萨克氏菌(X7)。将无菌鲜湿豆丝接种分离出的腐败菌,以菌落总数与酸度为检测指标,评价腐败菌的致腐能力。结果显示,接种了腐败菌的样品,其菌落总数与酸度均大于对照组,表明7株腐败菌均有较强的致腐能力。通过滤纸片法测定抑菌圈大小,研究不同浓度复配抑菌剂(ε-PL与 CP)对7株腐败菌的抑菌效果。其中,40% ε-PL+60% CP、20% ε-PL+80% CP两种抑菌剂对腐败菌有较好的抑制作用。
参考文献:
蒋琼华,赵良忠,李化强,等.休闲豆制品贮藏期的品质变化及腐败机理研究.食品与机械,2015,31(1):116-119.
周文化,郑仕宏,张建春,等.生鲜湿面的保鲜与品质变化关系研究.中国粮油学报,2007,22(1):19-22.
朱科学,李洁,李曼.生鲜面和半干面的保鲜与品质调控研究进展.粮食加工,2011,36(1):54-56.
LI M, MA M, ZHU K X, et al. Delineating the physico-chemical, structural, and water characteristic changes during the deterioration of fresh noodles: understanding the deterioration mechanisms of fresh noodles.Food Chemistry,2017,216:374-381.
VELD J H H I. Microbial and biochemical spoilage of foods: an overview.International Journal of Food Microbiology,1996,33(1):1-18.
吴凡.ε-聚赖氨酸/壳聚糖的物化性能及对鲜切苹果的保鲜性研究.武汉:武汉轻工大学,2020.
SHEN X, ZHANG M, FAN K, et al. Effects of ε-polylysine/chitosan composite coating and pressurized argon in combination with MAP on quality and microorganisms of fresh-cut potatoes.Food and Bioprocess Technology,2020,13(6):145-158.
吴海霜,李亚娜,刘莉艳.ε-聚赖氨酸-壳聚糖/PE复合膜对鲜切茄子保鲜作用.中国酿造,2017,36(1):164-167.
SONG Z Y, LI F, GUAN H, et al. Combination of nisin and ε-polylysine with chitosan coating inhibits the white blush of fresh-cut carrots.Food Control,2017,74:34-44.
郁杰,谢晶.ε-聚赖氨酸和L-抗坏血酸处理对鲜切菠菜品质的影响.食品科学,2019,40(17):277-283.
ZAHI M R, EL HATTAB M, LIANG H, et al. Enhancing the antimicrobial activity of D-limonene nanoemulsion with the inclusion of ε-polylysine.Food Chemistry,2017,221:18-23.
卢兰香,孙珊珊,薛霞,等.高效液相色谱法测定食品中丙酸及其盐类.食品工业科技,2019,427(11):240-246.
张斌,钟业俊.常用有机酸保鲜的研究现状.轻工科技,2012(5):35-37.
王瑞,何涛.食品中的丙酸本底含量及产生机理研究进展.中国调味品,2015(9):104-108.
王晓明,陈洁,吕莹果,等.生鲜面在不同温度下品质变化研究.河南工业大学学报(自然科学版),2014,35(1):69-72.
PARK C S, HONG B H, BAIK B K. Protein quality of wheat desirable for making fresh white sated noodles and its influences on processing and texture of noodles.Cereal Chemistry,2003,80(3):297-303.
LI M, ZHU K X, GUO X, et al.Effect of water activity (Aw) and irradiation on the shelf-life of fresh noodles.Innovative Food Science amp; Emerging Technologies,2011,12(4):526-530.

