奶山羊睾丸支持细胞分离培养与鉴定

关键词:奶山羊;睾丸支持细胞;分离培养方法;鉴定;超微结构
中图分类号:S827 文献标识号:A 文章编号:1001-4942(2024)11-0141-07
奶山羊为重要的奶畜之一,近年来随着人们对奶类食品需求的增加,奶山羊养殖业得到快速发展。据联合国粮农组织(FAO)数据显示,2020年全球奶山羊存栏量为220 92.14万只,产奶量达206 2.96万吨,而且增产增量趋势明显。改善雄性奶山羊繁殖性能对于加快遗传改良、优化繁殖管理、提高产业经济效益具有重要意义。
睾丸是哺乳动物雄性生殖系统的重要组成部分,睾丸曲细精管复层上皮是产生精子的部位,由生精细胞和支持细胞(Sertoli cells,SCs)构成,其中SCs可为生精细胞提供营养、支持和保护,对维持精子正常发生具有重要意义。体外分离培养SCs可以模仿睾丸内部生理条件,同时可避免与周围细胞间相互作用,有助于更好地探究雄性生殖系统的生理过程及调控机制,目前已广泛应用于生殖毒理学、生殖内分泌学、发育生物学等方面的研究。
目前关于SCs分离培养方法的报道主要集中在人、小鼠、猪以及牛中,关于奶山羊的报道较少,且已报道的奶山羊SCs分离培养方法存在分离步骤繁琐、细胞纯度较低以及培养状态不稳定等问题,在一定程度上制约了对奶山羊雄性生殖系统的深入研究。因此,本研究以莎能奶山羊为实验动物对其SCs进行分离培养,比较了三种常用酶消化法的分离效率,并采用形态学及分子生物学技术对培养效果进行评估,旨在寻求经济、高效、可持续培养的奶山羊SCs分离培养方法,为深入开展奶山羊雄性生殖机能研究提供材料支撑。
1材料与方法
1.1实验材料
1.1.1实验动物 2023年3月在陕西省千阳县种羊场选出6只2月龄、体重(10.33+1.00) kg、健康的雄性莎能奶山羊,用于睾丸采集。本研究经西北农林科技大学实验动物伦理委员会审查批准(批准编号:DY2023033)。
1.1.2主要试剂 胶原酶Ⅳ、胰蛋白酶、透明质酸酶Ⅱ和DNase Ⅰ购自美国Hyclone公司;细胞专用培养基(DMEM-F12)购自美国Sigma公司;胎牛血清(FBS)购自美国Zeta Life公司;兔抗WT1、鼠抗Vimentin、DAPI购自美国Abcam公司;荧光标记二抗购自武汉三鹰生物技术有限公司:台盼蓝染色液、三抗(青霉素-链霉素-两性霉素B混合溶液)、细胞增殖毒性检测试剂盒(cell counting
kit-8,CCK-8)、苏木素-伊红染色试剂盒、油红0染色试剂盒、中性树胶、抗荧光猝灭封片剂购自北京索莱宝生物科技有限公司。
1.1.3主要仪器 倒置荧光显微镜为德国Zeiss公司产品:研究级正置显微镜为日本Nikon公司产品:透射电子显微镜为美国FEI公司产品:自动荧光显微镜、超薄切片机为德国Leica公司产品;生物安全柜、细胞培养箱和CountessⅡ自动细胞计数仪均为美国Thermo Scientific公司产品。
1.2试验方法
1.2.1奶山羊睾丸支持细胞的分离 取莎能奶山羊睾丸组织,立即放人含2%三抗的PBS中清洗2min,之后转到生物安全柜中操作。剥离睾丸被膜后将其均等分成三份放人50mL离心管中,分别标为A、B、C三组,将每组的睾丸组织剪成约1mm3组织块,放入含2%三抗的PBS中清洗2次,各组加入不同的酶进行消化。所有试剂均37℃预热后使用。
A组(胰酶消化法):将DMEM-F12培养基与0.25%胰酶等体积混合,配制0.125%胰酶消化液。睾丸组织加入0.125%胰酶消化液5mL,置于37℃振荡水浴锅中消化30 min。
B组(两步酶消化法):使用DMEM-F12培养基配制1mg/mL的胶原酶Ⅳ消化液。睾丸组织加入1mg/mL胶原酶Ⅳ消化液5 mL,置于37℃振荡水浴锅中消化40 min;随后加入完全培养基(DMEM-F12培养基+10%胎牛血清+1%三抗,下同)清洗3遍,1000r/min离心5 min后加入0.25%胰酶,于37℃振荡水浴锅中消化15min。
C组(两步混合酶消化法):使用DMEM-F12培养基配制两种酶混合液,酶混合液Ⅰ为1mg/mL胶原酶Ⅳ+1mg/mL透明质酸酶Ⅱ等体积混合,酶混合液Ⅱ为0.25%胰蛋白酶+5μg/mLDNase Ⅰ等体积混合。睾丸组织加入5 mL酶混合液Ⅰ,置于37℃振荡水浴锅中消化30 min;完全培养基清洗,1000r/min离心5 min后加入5mL酶混合液Ⅱ,于37℃振荡水浴锅中消化15min。
各组消化完成后,分别加入完全培养基终止消化,使用200目细胞过滤器过滤,1000r/min离心5 min,弃上清;用完全培养基重悬细胞,接种到培养皿中,置于细胞培养箱中培养(35℃,5%CO2。下同)。
1.2.2细胞计数 取2.5mL刚分离的细胞悬液与2.5 mL 0.4%台盼蓝染色液混合均匀,倒置显微镜观察并进行细胞计数。
1.2.3 CCK-8检测细胞活率 将细胞悬液浓度调整为2xl05个/mL,接种于96孔板中,每孔100μL,每组设置5个重复,每间隔24 h进行一次CCK-8检测。具体操作为:每孔加入CCK-8试剂10μL,置于细胞培养箱中孵育2h,用多功能酶标仪测定波长450 nm下的吸光度值。
1.2.4细胞纯化 选择B组分离的细胞进行培养,4h后弃掉培养液,加入新鲜的完全培养基,以去除精原细胞、间质细胞等杂细胞。于第一次传代前加入20 mmol/L Tris-HCl低渗处理3 min,去除多余生殖细胞。
1.2.5细胞传代培养 细胞铺至70%~80%时,弃去培养液,PBS清洗2遍,加入0.25%胰酶,于显微镜下观察,当大量支持细胞缩成圆形时加入完全培养基终止消化。收集细胞悬液,离心去除胰酶,加入完全培养基重悬细胞,调整细胞浓度至1x106个/mL并接种至培养皿中,置于细胞专用培养箱中培养。
1.2.6细胞形态观察 通过倒置荧光显微镜观察培养0、3、5、7d以及传代至第2、3、6代的细胞形态特征。
1.2.7 HE染色观察 取分离培养并传代至第3代的SCs接种到铺有细胞爬片的12孔板中,待细胞铺至70%~80%时,弃去培养基,PBS清洗3遍后用4%多聚甲醛固定液于室温下固定15 min,PBS清洗3遍。HE染色,脱水,封片,显微镜观察并拍照。
1.2.8油红O染色 用1.2.7中的方法制作细胞爬片,用60%油红O染色液进行染色,苏木素复染,自来水反蓝,甘油封片,显微镜观察并拍照。
1.2.9免疫荧光染色 用1.2.7中的方法制作细胞爬片,0.1% Triton X-100室温孵育30 min,PBS洗3遍;5% BSA室温封闭30 min后,分别加入一抗Vimentin(1:500)和WT1(1:300),4℃过夜孵育;PBST清洗3遍,加入对应种属的荧光二抗,室温避光孵育2h;PBST清洗3遍,加入DAPI避光孵育5 min;抗荧光猝灭剂封片,荧光显微镜观察并拍照。
1.2.10透射电子显微镜 取传代培养至第3代的SCs,1000r/min离心5 min清洗,2.5%戊二醛固定12h;PBS漂洗3遍,锇酸固定4 h;梯度浓度乙醇脱水,梯度浓度LR White渗透并包埋:超薄切片机切取80 nm切片,并附于铜网上;铀铅染色,室温干燥,透射电子显微镜观察并拍照。
1.3数据统计分析
试验数据以“平均值±标准误”表示,使用SPSS 20.0软件进行分析,独立样本t检验进行差异性比较,以Plt;0.05为差异显著性判断标准。
2结果与分析
2.1不同酶消化法分离的奶山羊睾丸支持细胞活性
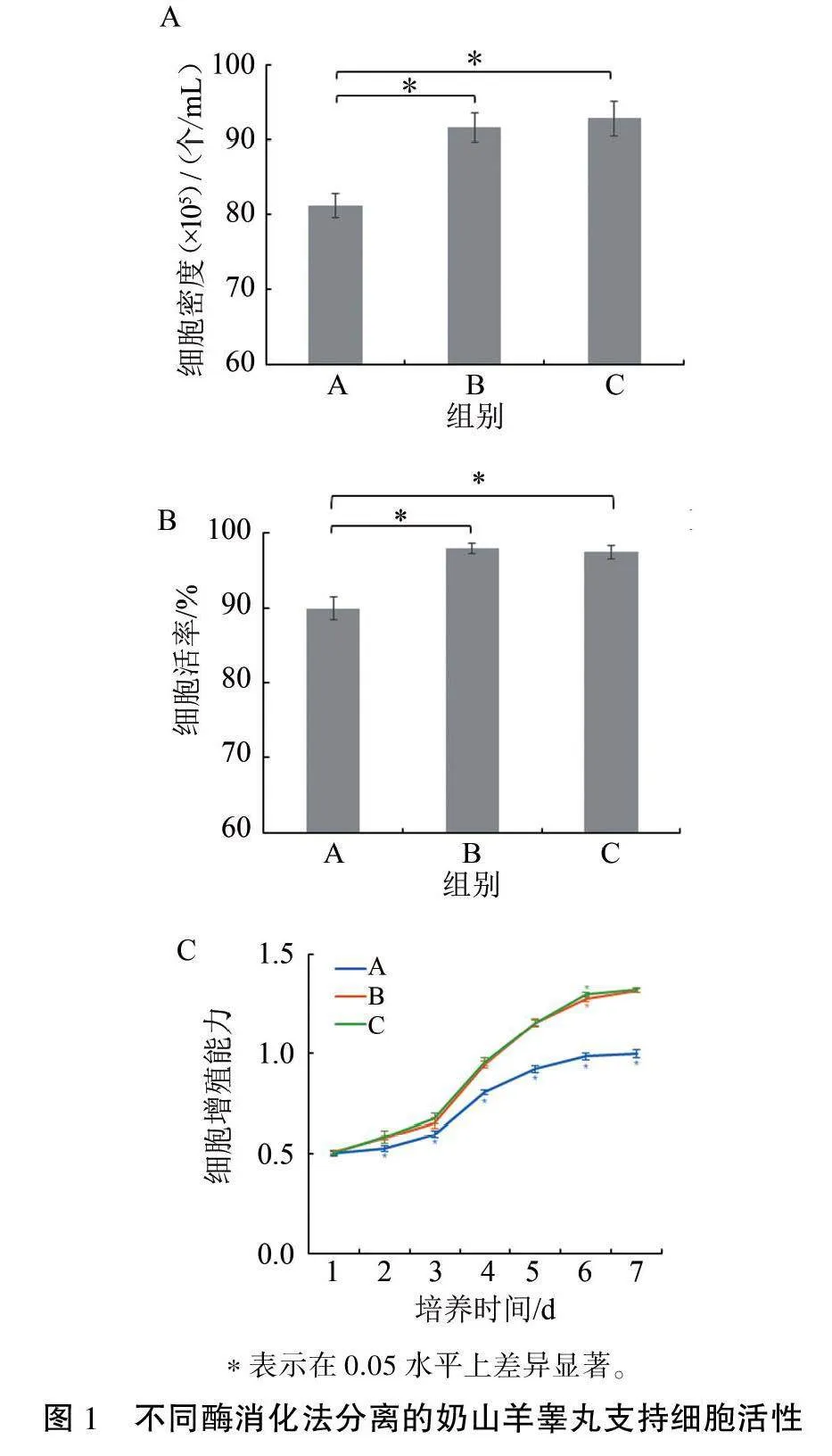
分别采用胰酶消化法(A组)、两步酶消化法(B组)和两步混合酶消化法(C组)分离莎能奶山羊SCs,并利用台盼蓝染色法检测三种分离方法获得的细胞密度和活率。结果显示:胰酶消化法获得的细胞密度为(81.2+1.61) ×105个/mL,显著低于两步酶消化法的(91.63+1.94)×105个/mL和两步混合酶消化法的(92.74+2.26)×105个/mL(Plt;0.05)(图1A);两步酶消化法和两步混合酶消化法所获细胞活率分别为(97.84+0.65)%和(97.38±0.88)%,均显著高于胰酶消化法的(89.85±1.45)%(Plt;0.05)(图1B)。进一步通过CCK-8法检测三种分离方法所获细胞的增殖能力,结果(图1C)显示,随着培养时间延长,三种分离方法得到的SCs增殖曲线呈典型“S”形,符合正常细胞增殖规律:三种消化法分离获得的细胞均于3d时进入对数生长期,6~7 d增殖速度减慢,进入生长平台期,但相较于两步酶消化法和两步混合酶消化法,胰酶消化法获得的细胞增殖活力较低。综合来看,两步酶消化法得到的细胞活力较好且步骤较为简便,因此选择两步酶消化法进行后续SCs培养效果的评估。
2.2不同培养阶段奶山羊睾丸支持细胞形态特征
利用差速贴壁法对两步酶消化法获得的SCs进行纯化,并连续传代培养,在第一次传代前使用Tris-HCl缓冲液低渗处理进一步去除生殖细胞。倒置显微镜观察不同时期细胞形态,结果显示:刚分离的细胞呈圆形,体积较小,折光性强(图2A);第3天时,大部分细胞已贴壁,细胞呈梭形,体积增大,并有多边形或星状突起(图2B);第5天时,细胞已铺满培养皿底的95%,细胞形态为扁平状,细胞质增多,体积增大,折光性减弱(图2C);第7天时,细胞已经完全铺满培养皿底,细胞形态与第5天时相似(图2D)。传代至第2代,细胞贴壁稳定,分布均匀,排列紧密,相互连接呈片状(图2E);传代至第3代,细胞贴壁速度变快,细胞形状更为扁平(图2F);传代至第6代,细胞贴壁速度变慢,细胞体积减小,细胞突起萎缩,部分细胞可见细胞质空泡化、细胞核固缩(图2G)。
2.3奶山羊睾丸支持细胞HE、油红O染色及免疫荧光染色
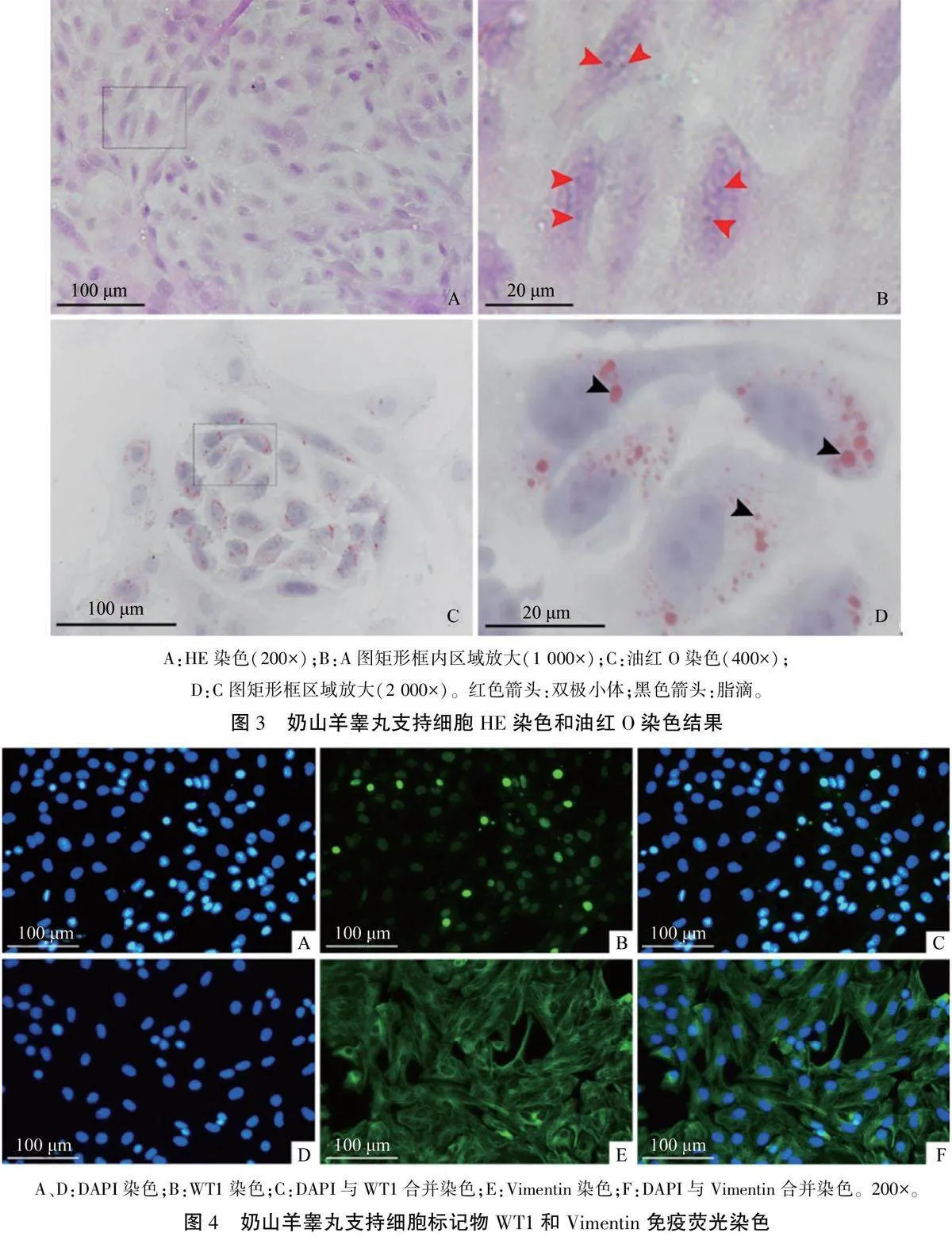
取传代培养至第3代的SCs进行染色鉴定。HE染色结果(图3A、B)显示:细胞形状不规则,具有一个或多个较粗的突起,且突起相互连接;细胞质丰富,细胞核呈圆形或椭圆形,位于细胞质中央,细胞核中可观察到双极小体。油红O染色结果(图3C、D)显示:细胞质中分布大小不一的脂滴,多位于细胞核周围或胞质两极。免疫荧光染色结果(图4)显示:WT1蛋白特异性表达于SCs的细胞核中:Vimentin蛋白覆盖细胞质,并环绕着细胞核,构成细胞骨架。细胞计数WT1和Vimen-tin抗体阳性率为(96.8±0.2)%。上述结果表明两步酶消化法所获细胞为SCs且纯度高。
2.4奶山羊睾丸支持细胞超微结构
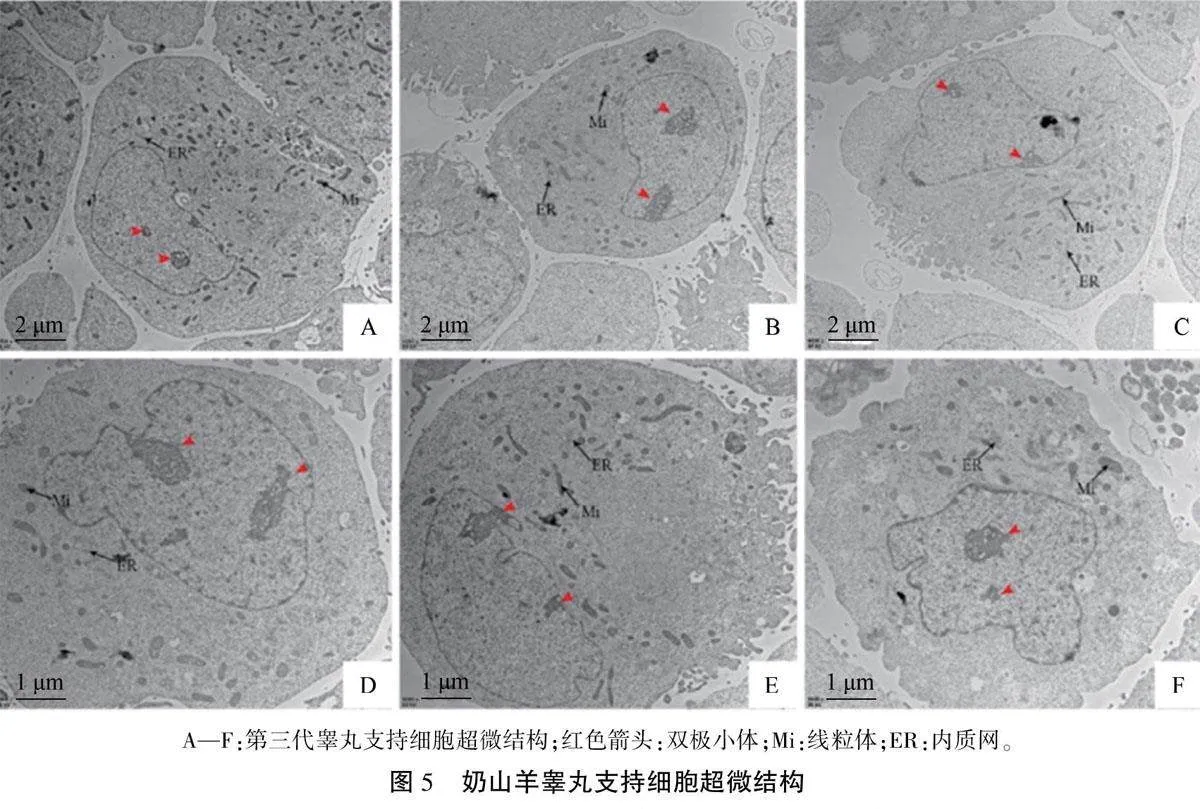
透射电镜观察第3代SCs,结果(图5)显示:细胞结构完整,呈不规则圆柱形。细胞质内细胞器丰富,线粒体呈管状,嵴结构清晰,形态结构完整;内质网数量较多且结构完整,滑面型内质网和粗面型内质网相延续;溶酶体多有髓鞘样结构;高尔基体发达,可见分泌囊泡。细胞核大且明显,形状不规则,染色质密度低,染色较浅,核仁明显,具有睾丸SCs特有的结构——双极小体。上述结果符合SCs超微结构特征。
3讨论与结论
体外培养SCs是研究雄性生殖机理的基础技术,为深入探究和阐明雄性生殖系统相关问题提供重要科研材料。本研究以2月龄雄性莎能奶山羊为试验动物,比较不同酶消化法分离SCs的效率,并评估SCs培养效果,旨在选出一种经济、高效的奶山羊SCs分离培养方法。
已有的SCs分离方法包括机械分离法和酶消化法两种。机械分离法会对细胞膜造成严重损伤,且分离效率较低,因此很少使用。而酶消化法能够利用酶特异性消化的特点温和分离细胞,具有保持细胞较高活力和维持细胞膜完整性等优点,被广泛使用。杨璐等采用胰酶消化法分离新生黑山羊SCs;Zhang等利用两步酶消化法(胶原酶Ⅳ+胰酶)分离得到纯度较高的山羊SCs;Su等通过更为复杂的两步混合酶消化法(胶原酶Ⅳ与透明质酸酶混合液+胰酶与DNase Ⅰ混合液)成功分离了绒山羊的SCs.并用于长期培养与研究。本研究比较了上述三种酶消化法分离莎能奶山羊SCs的效果,结果表明,两步酶消化法与两步混合酶消化法所获细胞数量、细胞活率和细胞增殖力均显著高于胰酶消化法。而胰酶容易过度消化,破坏细胞膜表面的膜蛋白,对细胞造成较大损伤,这可能是单独使用胰酶消化分离奶山羊SCs效果较差的原因。两步酶消化法与两步混合酶消化法分离奶山羊SCs的效果相似,但两步混合酶消化法需要酶种类较多,成本较高,相比之下两步酶消化法的可操作性与经济性较好,为三种方法中的最佳方法。
刚分离的原代SCs常会有生殖细胞污染,需对其进行纯化处理。常用的SCs纯化方法有差速贴壁法和Tris-HCl低渗法两种。差速贴壁法利用SCs贴壁能力较强的特性去除杂细胞,Tris-HCl低渗法则是利用其低渗耐受性去除生殖细胞。高艺等利用差速贴壁法获得了纯度较高的江香猪SCs,王亚营采用Tris-HCl低渗法去除了牦牛SCs中的生殖细胞:刘博通过差速贴壁法结合Tris-HCl低渗法获得了高纯度的小鼠SCs。本研究在原代SCs培养4h后使用差速贴壁法进行纯化,并在第一次传代前使用20 mmol/LTris-HCl(pH=7.4)处理,纯化后的细胞经鉴定纯度大于96%,表明该种方法可获得高纯度的奶山羊SCs。
形态学观察是衡量SCs生长特性的重要方法。本研究利用倒置显微镜对两步酶消化法分离的细胞进行观察,发现分离的细胞具有典型SCs形态,且在连续传代培养至第5代时仍保持正常SCs形态。鉴定SCs常用的方法有染色法和免疫学方法。HE染色后可明显观察到SCs形态和细胞核内深着色的双极小体,油红0染色能将富含脂滴的SCs与生殖细胞区分开,因此常采用HE和油红O染色鉴定SCs。免疫学方法则是通过免疫组化或免疫荧光等手段检测SCs的特异性标志蛋白,例如Wilms肿瘤蛋白1(WT1)和波形蛋白(Vimentin)等。本研究通过HE染色、油红0染色以及WT1和Vimentin免疫荧光染色对传代培养至第3代的SCs进行鉴定。HE染色和油红O染色观察到的细胞呈不规则形状,细胞核内有双极小体,细胞质中存在大小不一的脂滴等SCs典型特征。与王雪等的染色结果相似,WT1绿色荧光特异性表达于SCs细胞核,Vimen-tin绿色荧光特异性表达于细胞骨架。超微结构是判断SCs生物学特性的重要指标。本研究利用透射电子显微镜观察第三代SCs超微结构,结果显示SCs结构完整,内含丰富的细胞器,与Shi等观察到的黑山羊SCs超微结构一致。以上结果表明,两步酶法分离得到的细胞具有典型SCs的形态特征,可用于后续支持细胞体外培养研究。
综上,两步酶消化法(胶原酶Ⅳ+胰酶)可获得数量多、活力好、纯度高且形态特点典型的奶山羊SCs,为深入开展奶山羊雄性生殖机理研究提供良好的细胞学模型。

