程序性死亡因子1及其配体抑制剂联合放化疗对驱动基因阴性不可手术Ⅲ期非小细胞肺癌患者的疗效及免疫功能的影响

【摘要】目的 评估驱动基因阴性不可手术Ⅲ期非小细胞肺癌患者应用程序性死亡因子1(PD-1)及其配体(PD-L1)抑制剂联合放化疗治疗的临床效果,以及对其免疫功能、血清肿瘤标志物水平的影响。方法 选取东莞市人民医院2023年1月至2024年1月收治的100例驱动基因阴性不可手术Ⅲ期非小细胞肺癌患者,以随机数字表法分为对照组与研究组,各50例。对照组患者接受常规放化疗治疗,研究组患者接受PD-1/PD-L1抑制剂联合放化疗治疗。3周为1个疗程,两组均连续治疗3个疗程。比较两组患者临床疗效,治疗前后免疫功能、血清肿瘤标志物水平。结果 研究组患者治疗总有效率高于对照组;与治疗前比,治疗后两组患者CD4+百分比与CD4+/CD8+比值均升高,研究组均高于对照组;两组患者CD8+百分比及血清血管内皮生长因子(VEGF)、肿瘤特异性生长因子(TSGF)、碱性成纤维细胞生长因子(b-FGF)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段(CYFRA21-1)水平均降低,研究组均低于对照组(均Plt;0.05)。结论 驱动基因阴性不可手术Ⅲ期非小细胞肺癌应用PD-1/PD-L1抑制剂联合放化疗治疗疗效显著提升,可降低血清肿瘤标志物水平,提高患者免疫功能。
【关键词】非小细胞肺癌 ; 驱动基因阴性 ; 程序性死亡因子及其配体抑制剂 ; 免疫功能 ; 肿瘤标志物
【中图分类号】R734.2 【文献标识码】A 【文章编号】2096-3718.2024.21.0051.04
DOI:10.3969/j.issn.2096-3718.2024.21.017
驱动基因阴性不可手术Ⅲ期非小细胞肺癌指在疾病进展期间,没有发现癌细胞存在驱动基因突变的问题,且因为肿瘤的进展和转移,难以接受手术治疗,此阶段的患者以肿瘤侵袭性强、增殖速度快为主要特点,且肿瘤组织通常已侵犯周围的淋巴结和组织,临床尚无有效的靶向治疗方案,故治疗难度较大,预后不佳。放射治疗和化疗是当前临床常用的治疗措施,放射治疗可有效地遏制局部肿瘤的发展,缓解临床表现,而化疗则可以将已经出现转移的微小病灶消除,联合应用可有效控制患者的病情进展,延长患者的生存周期[1]。但是因为Ⅲ期患者的病情进展极为迅速,所以放化疗联合治疗总体治疗效果仍然受限,需要寻找更加有效的治疗方案。目前,免疫治疗已经在肺癌患者的治疗中广泛运用,通过靶向免疫检查点类药物,可以通过阻断抗程序性死亡因子(PD-1)及其配体(PD-L1)之间的相互作用来激活免疫系统,促进T淋巴细胞的活化与增殖,并且可解除对T淋巴细胞的抑制作用,强化其对于癌细胞的识别和攻击能力,提升肿瘤的免疫反应[2]。基于此,本研究旨在探讨驱动基因阴性不可手术Ⅲ期非小细胞肺癌患者应用PD-1/PD-L1抑制剂联合放化疗治疗的临床效果及对其免疫功能、血清肿瘤标志物水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取东莞市人民医院2023年1月至2024年1月收治的100例驱动基因阴性不可手术Ⅲ期非小细胞肺癌患者,以随机数字表法分为对照组与研究组,各50例。对照组中男性、女性患者分别为33、17例;年龄52~75岁,平均(62.63±4.11)岁。研究组中男性、女性患者分别为32、18例;年龄51~73岁,平均(61.25±4.28)岁。两组患者一般资料比较,差异无统计学意义(Pgt;0.05),组间可比。纳入标准:⑴符合《中华医学会肺癌临床诊疗指南(2018版)》[3]中非小细胞肺癌的诊断标准,并经病理确诊;⑵驱动基因检测结果为阴性;⑶TNM分期为Ⅲ期[4];⑷患者生存期在6个月以上。排除标准:⑴合并其他脏器衰竭;⑵存在严重感染;⑶合并其他原发性肿瘤。研究经东莞市人民医院医学伦理委员会批准后进行,患者及家属均签署知情同意书。
1.2 治疗方法 对照组患者接受放化疗治疗,放疗:应用6 MV-X射线开展放疗治疗,常规进行靶区的勾画和确定,照射的过程中,剂量控制为3 Gy/次,1次/d,5次/周,总照射剂量达到40~50 Gy时,根据病灶变化情况开展缩野照射治疗,总剂量60~70 Gy,疗程为6~7周。化疗:药物为注射用顺铂(齐鲁制药有限公司,国药准字H37021358,规格:10 mg),剂量为75 mg/m2;酒石酸长春瑞滨注射液(北京双鹭药业股份有限公司,国药准字H20067722,规格:1 mL∶10 mg),剂量为25 mg/m2;前者第1天给药,后者在第1、8天时给药。每3周为1个治疗周期。研究组患者在放化疗过程中接受PD-1/PD-L1抑制剂治疗,药物为阿替利珠单抗注射液(Roche Diagnostics GmbH,注册证号S20200004,规格:1 200 mg/20 mL),每次治疗剂量为1 200 mg,应用0.9%氯化钠注射液250 mL稀释后,静脉滴注60 min以上,每3周给药1次。3周为1个疗程,两组患者均连续治疗3个疗程。
1.3 观察指标 ⑴临床疗效。参照《实体瘤疗效评价标准简介》[5]评估治疗效果。完全缓解(CR):所有目标病灶及非目标病灶均完全消失,且持续时间不少于4周;部分缓解(PR):病灶最大直径之和减少范围≥30%,持续时间在4周以上;病情稳定(SD):病灶最大直径之和减少幅度lt;30%,或病灶最大直径之和增加lt;20%;疾病进展(PD):病灶最大直径之和增加20%以上,或发现了新的病灶。总有效率=[(CR+PR+SD)例数/总例数]×100%。⑵免疫功能。分别于治疗前后取患者静脉血5 mL,以流式细胞仪(贝克曼库尔特生物科技公司,型号:CytoFLEX SRT)测定CD4+、CD8+百分比,并计算CD4+/CD8+比值。⑶血清肿瘤标志物水平。血液采集方法同⑵,以3 000 r/min离心10 min,取上层血清,其中血管内皮生长因子(VEGF)、肿瘤特异性生长因子(TSGF)及碱性成纤维细胞生长因子(b-FGF)以固相免疫法测定;神经元特异性烯醇化酶(NSE)以电化学发光法测定;细胞角蛋白19片段(CYFRA21-1)以放射免疫法测定。
1.4 统计学方法 采用SPSS 25.0统计学软件分析数据,计数资料以[例(%)]表示,组间比较采用χ2检验,等级资料采用秩和检验;计量资料经S-W法检验证实符合正态分布,用( x ±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验。Plt;0.05为差异有统计学意义。
2 结果
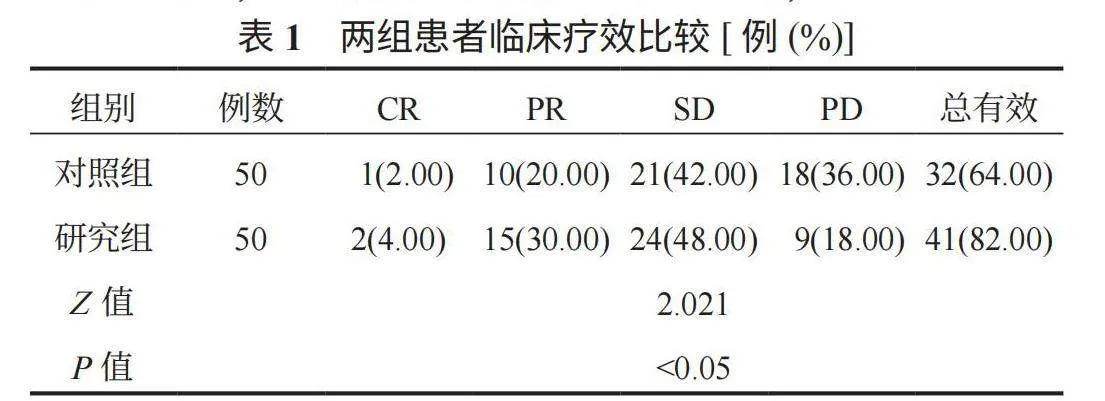
2.1 两组患者临床疗效比较 研究组患者治疗总有效率高于对照组,差异有统计学意义(Plt;0.05),见表1。
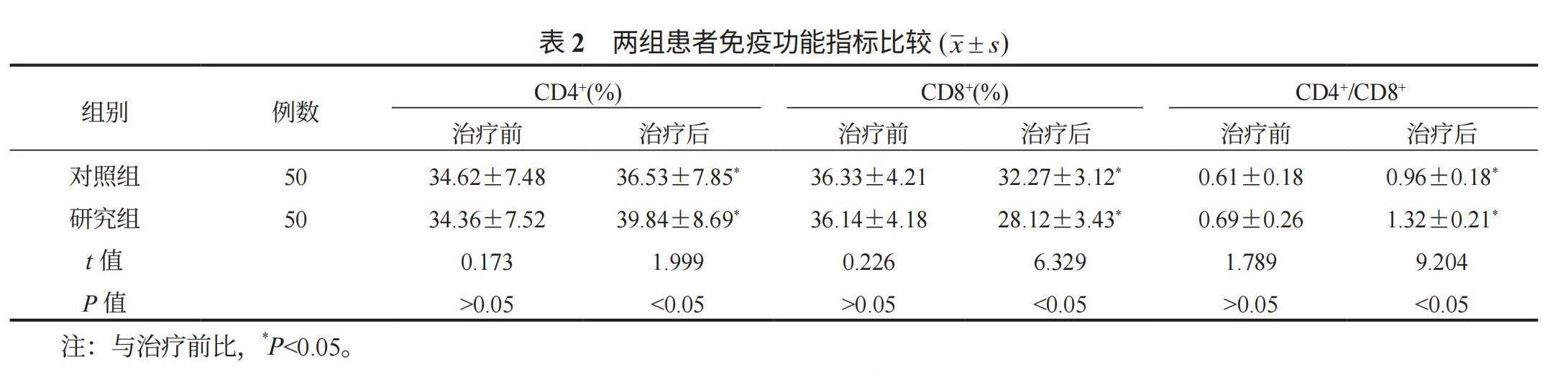
2.2 两组患者免疫功能指标比较 与治疗前比,治疗后两组患者CD4+百分比与CD4+/CD8+比值均升高,研究组均高于对照组;两组患者CD8+百分比均降低,研究组低于对照组,差异均有统计学意义(均Plt;0.05),见表2。
2.3 两组患者血清肿瘤标志物水平比较 与治疗前比,治疗后两组患者VEGF、TSGF、b-FGF、NSE及CYFRA21-1水平均降低,研究组均低于对照组,差异均有统计学意义(均Plt;0.05),见表3。
3 讨论
驱动基因阴性不可手术Ⅲ期非小细胞肺癌是一种恶性程度极高,并且非常容易出现转移的肺部恶性肿瘤疾病。大部分肺癌患者在早期阶段通常没有特异性的表现,在确诊时已经进展到中晚期阶段,难以通过手术切除原发肿瘤病变组织,放化疗便成为其临床常用手段。放化疗治疗驱动基因阴性不可手术Ⅲ期非小细胞肺癌临床应用较为广泛,两者联合应用可发挥协同增效的作用,有助于提高疾病的控制效果,延长患者的生存周期。但放化疗联合治疗也会加重患者的不良反应,其次,部分患者由于身体素质不佳,联合应用耐受性不佳且容易出现耐药性,从而给治疗效果带来了不良影响。
近年来,随着临床的不断深入研究,发现肺癌的发生、发展同肿瘤免疫逃逸存在密切的关系,故临床提出了免疫抑制疗法[6]。PD-1和其受体PD-L1是免疫系统中的重要分子,尤其在癌症免疫治疗中扮演着关键角色,通过使用抗PD-1或抗PD-L1的单克隆抗体,可以重新激活T淋巴细胞,增强免疫系统对肿瘤的攻击能力,已经成为肺癌患者的二线治疗方案,临床认为联合放化疗,可显著提高患者的治疗效果[7]。本研究中,研究组患者治疗总有效率高于对照组,这提示PD-1/PD-L1抑制剂联合放化疗治疗驱动基因阴性不可手术Ⅲ期非小细胞肺癌疗效可靠。这是因为在放射治疗的过程中,通过PD-1/PD-L1抑制剂治疗可以将免疫系统的关键指标激活,利用免疫原性的抗癌细胞效果来帮助克服治疗耐药性的问题,进而增强临床疗效。此外,放射治疗的过程中,可以直接杀伤肿瘤细胞,从而使肿瘤细胞表面PD-L1的表达水平上升,加速了新抗原的暴露,与PD-1/PD-L1抑制剂治疗发挥协同增效的作用[8]。
T淋巴细胞是免疫系统的重要组成部分,具有直接杀伤靶细胞和辅助其他免疫细胞的功能,如CD8+T淋巴细胞能够直接识别并且杀死表达特定肿瘤抗原的肺癌细胞;CD4+T淋巴细胞可以分化为1型辅助性T细胞(TH1)和2型辅助性T细胞(TH2)亚群,提高细胞免疫和体液免疫功能[9]。本研究中,与治疗前比,治疗后两组患者CD4+百分比与CD4+/CD8+比值均升高,研究组均高于对照组;两组患者CD8+百分比均降低,且研究组低于对照组,这说明PD-1/PD-L1抑制剂治疗联合放化疗可以调节患者的免疫功能,提高机体对癌细胞的免疫应答能力。这是因为PD-1属于人免疫球蛋白物质,多活化于T淋巴细胞中,PD-L1是其配体之一,通常在多种肿瘤细胞和免疫细胞表面表达。PD-1通过与PD-L1、PD-L2等配体的协同作用,解除了T淋巴细胞介导的免疫抑制,增强T淋巴细胞的活性,使免疫系统能够更有效地识别和杀伤肿瘤细胞,从而增强了机体免疫应答反应;而且PD-1/PD-L1免疫抑制剂可以广泛激活免疫系统,减少了对正常组织的损伤,降低了自身免疫应答的风险;同时,联合疗法从不同的作用机制出发,有助于患者更好地耐受放化疗,并可以有效控制单一疗法引起的不良反应,从而更加有利于患者免疫指标的改善[10]。
血清肿瘤标志物可以反映患者的抗肿瘤效果和预后效果,其中VEGF能够促进血管内皮的生长,增强血管的通透性,促进肿瘤血管的形成,因此其指标的升高可能预示着癌细胞的转移;TSGF是一种与恶性肿瘤生长相关的糖类物质和代谢物,可以反映肿瘤的存在和生长状态;b-FGF在细胞增殖、迁移及分化中起重要作用,与肿瘤的侵袭性和转移潜力有关;NSE是存在于神经和神经内分泌细胞中的酶,常用于非小细胞癌的诊断、疗效及预后评估中;CYFRA21-1属于非小细胞肺癌中的标志物之一,其表达水平的升高与肺癌的存在、病情进展及预后密切相关[11]。本研究中,研究组患者VEGF、TSGF、b-FGF、NSE及CYFRA21-1水平均低于对照组,这证实PD-1/PD-L1抑制剂联合放化疗治疗驱动基因阴性不可手术Ⅲ期非小细胞肺癌能够降低肿瘤标志物的表达水平,抑制癌细胞的生长和扩散。主要是因为,PD-1及其配体PD-L1可以传递抑制信号,可有效地调节机体免疫应答的表现,促进机体免疫系统的重建,提高其对于癌细胞的杀伤能力,进而可以更加有效地清除循环中的肿瘤细胞。此外,联合治疗能够改善肿瘤微环境,提高免疫细胞的渗透性与活性,有效抑制肿瘤细胞的生长,从而进一步降低血清肿瘤标志物的含量[12]。
综上,驱动基因阴性不可手术Ⅲ期非小细胞肺癌应用PD-1/PD-L1抑制剂联合放化疗治疗疗效显著,可降低血清肿瘤标志物水平,提高免疫功能,具有临床参考价值。
参考文献
郑杨, 帕提古力·阿尔西丁. CTLA-4和PD-1/PD-L1免疫检查点抑制剂在广泛期小细胞肺癌中的研究进展[J]. 中国临床研究, 2023, 36(6): 805-809.
陈琼, 张玉玲, 谢聪. PD-1/PD-L1抑制剂治疗非小细胞肺癌的临床研究[J]. 实用中西医结合临床, 2022, 22(8): 107-110.
中华医学会, 中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2018版)[J]. 中华肿瘤杂志, 2018, 40(12): 935-964.
刘宝东, 支修益. 肺癌第8版TNM分期解读与展望[J]. 首都医科大学学报, 2016, 37(6): 753-757.
张百红, 岳红云. 实体瘤疗效评价标准简介[J]. 国际肿瘤学杂志, 2016, 43(11): 845-847
邱鲁鹏, 赵晓, 刘茗露, 等. PD-1/PD-L1抑制剂联合抗血管生成药物治疗晚期非小细胞肺癌的临床观察[J]. 临床肿瘤学杂志, 2022, 27(5): 411-418.
金刚, 姚可盈, 神兴伟, 等. PD-1/PD-L1免疫检查点抑制剂与多西他赛治疗非小细胞肺癌有效性的系统评价与荟萃分析[J/CD]. 中华胸部外科电子杂志, 2021, 8(4): 239-246.
熊志为. 探讨程序性死亡因子(PD-1)/程序性死亡因子配体1(PD-L1)免疫检查点抑制剂治疗非小细胞肺癌(NSCLC)的临床疗效[J]. 当代医学, 2021, 27(28): 44-46.
蒋轶, 王志, 左宏波. PD-1/PD-L1免疫检查点抑制剂联合化疗治疗非小细胞肺癌的临床观察[J]. 中国医学创新, 2021, 18(24): 51-54.
付国霞, 李晓华, 郭华, 等. 奥沙利铂和多西他赛联合PD-1/PD-L1抑制剂二线治疗驱动基因阴性的Ⅳ期NSCLC的回顾性研究[J]. 肿瘤预防与治疗, 2024, 37(6): 499-504.
林喜娜, 李广秋, 何萍, 等. 非小细胞肺癌中PD-L1表达及其与肺癌相关驱动基因的关系[J]. 临床与实验病理学杂志, 2019, 35(7): 767-771.
夏经纬, 陈羽中, 沈波. 驱动基因阳性非小细胞肺癌的免疫治疗研究进展[J]. 中华肿瘤防治杂志, 2022, 29(8): 604-610.

