新辅助放化疗联合手术治疗进展期直肠癌的疗效及对患者免疫功能的影响


【摘要】目的 探讨进展期直肠癌患者应用新辅助放化疗联合手术治疗的疗效及对患者手术相关指标、免疫功能、并发症、复发率的影响。方法 回顾性分析2020年1月至2023年1月徐州医科大学附属医院收治的86例进展期直肠癌患者的临床资料,根据治疗方法不同分为A组(42例,手术联合术后辅助放化疗)、B组(44例,在A组患者治疗的基础上,术前联合新辅助放化疗治疗),两组患者均于术后随访1年,其中A组失访2例、B组失访3例,最终纳入81例:A组(40例)、B组(41例)。比较两组患者手术相关指标,术前、术后7 d免疫功能指标,以及术后随访期间并发症、复发情况。结果 B组患者术后住院时间较A组更短,保肛率较A组更高(均Plt;0.05);两组患者术中失血量、手术时间经比较,差异均无统计学意义(均Pgt;0.05);与术前比,术后7 d两组患者外周血CD3+、CD4+百分比及CD4+/CD8+比值均降低,但B组较A组均更高;与术前比,术后7 d两组患者外周血CD8+百分比均升高,但B组较A组均更低(均Plt;0.05);相较于A组,B组患者并发症总发生率、复发率均较低,但差异均无统计学意义(均Pgt;0.05)。结论 进展期直肠癌患者应用新辅助放化疗联合手术治疗有助于促进术后恢复,且对机体免疫功能的影响较小,安全性良好。
【关键词】进展期 ; 直肠癌 ; 新辅助放化疗 ; 免疫功能
【中图分类号】R735.3 【文献标识码】A 【文章编号】2096-3718.2024.21.0027.03
DOI:10.3969/j.issn.2096-3718.2024.21.009
直肠癌属于临床中较为常见的消化道恶性肿瘤疾病之一,其发病初期多无明显症状,但随着病情进展,可出现便血、大便性状改变、腹痛等临床表现,甚至累及邻近组织器官,从而严重威胁患者生存质量。现阶段,临床治疗进展期直肠癌主要采用手术方式,能够通过将病灶切除并术后辅以放化疗治疗延长患者的生存期,但其在应用中对于部分肿瘤病灶范围较大的患者,在经手术治疗时易出现病灶组织残留,从而增加复发风险,影响患者预后[1]。随着近年来临床的深入研究,新辅助放化疗已逐渐在临床中得到广泛应用,其主要是通过于术前开展放化疗治疗,以提前达到缩小肿块、杀灭转移细胞等目的,进而有助于提高手术治疗效果,临床常用于食管癌、胃癌等肿瘤疾病治疗中,且效果显著[2]。基于此,本研究通过选取进展期直肠癌患者进行研究,旨在分析其应用新辅助放化疗联合手术治疗对患者免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月至2023年1月徐州医科大学附属医院收治的86例进展期直肠癌患者的临床资料,根据治疗方法不同分为A组(42例)、B组(44例),两组患者均于术后随访1年,其中A组失访2例、B组失访3例,最终纳入81例:A组(40例)、B组(41例)。A组患者肿瘤直径1~5 cm,平均(3.04±0.25) cm;年龄23~75岁,平均(60.47±5.86)岁;TNM分期[3]:Ⅱ、Ⅲ期分别为30、10例;男、女性分别为29、11例;BMI 18~26 kg/m2,平均(22.12±0.53) kg/m2。B组患者肿瘤直径1~4 cm,平均(3.01±0.22) cm;年龄25~78岁,平均(59.47±5.85)岁;TNM分期:Ⅱ、Ⅲ期分别为32、9例;男、女性分别为31、10例;BMI 18~25 kg/m2,平均(22.09±0.48) kg/m2。两组患者一般资料比较,差异无统计学意义(Pgt;0.05),组间可比。纳入标准:⑴与《直肠癌规范化诊疗指南(试行)》 [4]中的相关诊断标准相符;⑵经病理检查、影像学检查等确诊;⑶近期未接受放化疗、手术等治疗;⑷预计生存时间gt;1年;⑸随访资料完整。排除标准:⑴重要脏器严重异常;⑵全身远处广泛转移,同时手术无法切除;⑶肿瘤阻塞肠腔并发肠梗阻;⑷合并其他恶性肿瘤。本次研究经徐州医科大学附属医院医学伦理委员会审核批准。
1.2 治疗方法 A组:于确诊后4周内,开展手术治疗,予以根治切除术(依据全直肠系膜切除术原则)治疗,术前完善各项检查,并明确无手术禁忌证,而后确定手术方案,术中注意保护盆腔自主神经丛及输尿管。于术后进行辅助放化疗治疗,放疗方式:CT引导下,俯卧位定位,采用Varian直线加速器行调强放疗,结合盆腔MRI及肠镜勾画,放疗计划:临床靶区(CTV):盆腔淋巴结引流区,包括闭孔、髂内、骶前、直肠周围系膜区淋巴引流区等;计划靶区(PTV):CTV外放5 mm;总剂量50 Gy,1.8~2.0 Gy/次,5次/周,共25~28次。化疗方案:奥沙利铂注射液(四川汇宇制药股份有限公司,国药准字H20213061,规格:20 mL∶100 mg)130 mg/m2,静脉滴注2 h,联合卡培他滨(齐鲁制药有限公司,国药准字H20133361,规格:0.5 g/片)1 000 mg/m2,2次/d,第1~14天。化疗8个周期。B组:⑴新辅助放化疗:术前患者进行新辅助放化疗治疗,放疗方式:同A组,放疗计划:肿瘤靶区(GTV):影像学所示直肠肿瘤病灶(参考术前MRI、肠镜结果勾画);CTV:GTV+盆腔淋巴结引流区,包括闭孔、髂内、骶前、直肠周围系膜区淋巴引流区等;PTV:CTV外放5 mm;总剂量50 Gy,1.8~2.0 Gy/次,5次/周,共25~28次。同步化疗方案为卡培他滨片(齐鲁制药有限公司,国药准字H20133361,规格:0.5 g/片)口服,825 mg/m2,2次/d,与放疗同步(放疗日化疗,非放疗日不化疗)。⑵新辅助放化疗结束后4~6周,予以手术(同A组);⑶术后予以辅助化疗治疗,治疗8个周期(同A组)。两组患者均于术后随访1年。
1.3 观察指标 ⑴手术相关指标。统计患者术中失血量、手术时间、术后住院时间、保肛率等指标情况。⑵免疫功能。分别于术前、术后7 d两组患者清晨空腹状态下抽取外周静脉血液3 mL,以流式细胞仪(深圳唯公生物科技有限公司,型号:EasyCell 103A0)检测外周血CD4+、CD8+百分比,并计算CD4+/CD8+比值。⑶并发症、复发率。术后随访期间,统计患者并发症(吻合口瘘、肠梗阻、切口感染、切口脂肪液化等)及复发情况。并发症总发生率为各项并发症发生率之和,复发率=(复发例数/总例数)×100%。
1.4 统计学方法 采用SPSS 26.0统计学软件分析数据,计数资料以[例(%)]表示,组间比较采用χ2检验,等级资料比较采用秩和检验;计量资料经S-W法检验证实符合正态分布,用( x ±s)表示,组间比较采用独立样本t检验,手术前后比较采用配对t检验。Plt;0.05为差异有统计学意义。
2 结果
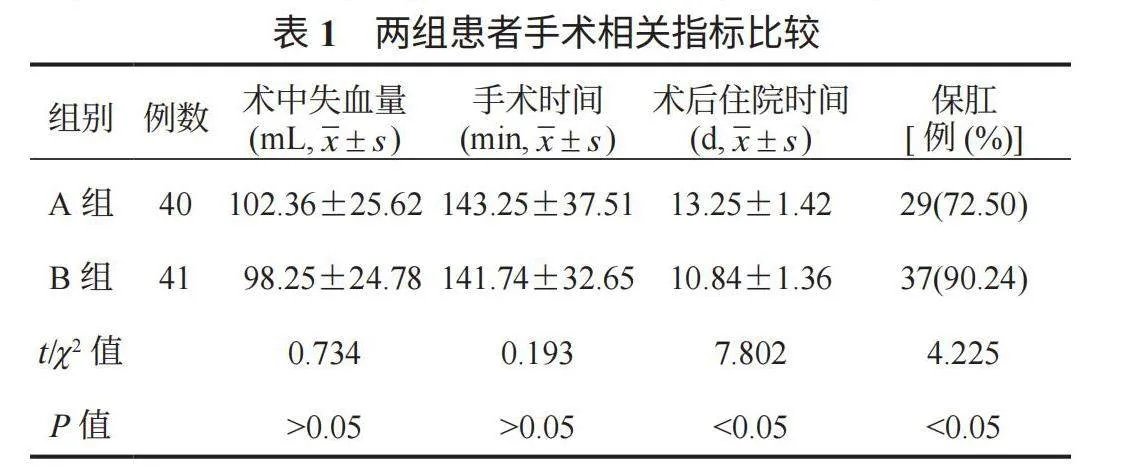
2.1 两组患者手术相关指标比较 B组患者术后住院时间较A组更短,保肛率较A组更高,差异均有统计学意义(均Plt;0.05);两组患者术中失血量、手术时间经比较,差异均无统计学意义(均Pgt;0.05),见表1。
2.2 两组患者免疫功能指标比较 与术前比,术后7 d两组患者外周血CD3+、CD4+百分比及CD4+/CD8+比值均降低,但B组较A组均更高;与术前比,术后7 d两组患者外周血CD8+百分比均升高,但B组较A组均更低,差异均有统计学意义(均Plt;0.05),见表2。
2.3 两组患者并发症、复发情况比较 相较于A组,B组患者并发症总发生率、复发率均较低,但差异均无统计学意义(均Pgt;0.05),见表3。
3 讨论
进展期直肠癌病因复杂,多与遗传、致癌物质、慢性炎症等因素有关,是消化系统常见肿瘤性疾病,已严重影响了患者的生命安全。全直肠系膜切除术原则指导下的手术治疗方案与术后辅助放化疗方式是临床针对进展期直肠癌常采用的方式,虽可控制病情进展,但其在应用中对患者免疫功能的影响较大,从而影响术后恢复[5]。
新辅助放化疗主要是指于术前开展全身性放化疗,不仅能够发挥促进癌细胞凋亡、抑制肿瘤生长的作用,还可进一步缩小肿瘤体积,降低手术难度,进而提高后期手术治疗的根治率,改善患者预后[6]。本研究中,B组患者术后住院时间较A组更短,保肛率较A组更高;两组患者术中失血量、手术时间经比较,差异均无统计学意义,这表明进展期直肠癌患者应用新辅助放化疗联合手术治疗有助于促进术后恢复。分析其原因可能为,手术治疗方案及术后辅助放化疗方式在应用中是先通过手术治疗,故此时相较于先放化疗患者的肿瘤体积较大,进而使得手术对机体造成的损伤较大,从而不利于患者术后恢复。而术前开展新辅助放化疗治疗可有助于减小病灶,以减轻手术对机体造成的损伤,提高保肛率,进而有助于促进术后恢复,缩短住院时间[7]。此外,正常情况下,术前行新辅助放化疗可通过抗肿瘤作用以减小肿瘤体积,达到降低肿瘤分期的效果,进而有助于手术操作的开展,缩短手术时间,减少术中失血量;但由于术前行新辅助放化疗的应用也可能会对机体造成一定不良反应,如局部组织水肿,进而易增加解剖层次的辨认难度,延长手术时间,增加出血量[8],故最终使得两组术中失血量、手术时间经比较,差异均无统计学意义。
免疫球蛋白可通过与抗原特异性结合发挥抗肿瘤作用,而新辅助放化疗联合手术的开展均可损伤进展期直肠癌患者的免疫功能,从而使得外周血CD3+、CD4+百分比及CD4+/CD8+比值降低,外周血CD8+百分比升高[9]。本研究中,与术前比,术后7 d两组患者外周血CD3+、CD4+百分比及CD4+/CD8+比值均降低,但B组较A组均更高;与术前比,术后7 d两组患者外周血CD8+百分比均升高,但B组较A组均更低,这表明进展期直肠癌患者应用新辅助放化疗联合手术治疗对机体免疫功能的影响较小。分析其原因可能为,相比于直接手术治疗,尽管术前实施的新辅助放化疗会损伤正常细胞,从而在一定程度上降低机体的免疫功能,但也会杀死肿瘤细胞,以缩小病灶,使手术时对机体的损伤较小,对免疫功能的影响较轻,进而有助于术后免疫系统快速恢复,使得整体上新辅助放化疗治疗对机体免疫功能的影响较小[10]。
此外,本研究中,相较于A组,B组患者并发症总发生率、复发率均较低,但差异均无统计学意义,这表明进展期直肠癌患者应用新辅助放化疗联合手术治疗安全性良好。分析其原因可能为,手术治疗方案及术后辅助放化疗方式在应用中主要是先实施手术治疗,此时病灶相对较大,进而使得手术对机体造成的损伤较大,增加术后并发症发生风险,同时肿瘤体积大,也易出现肿瘤残留,进而使得复发风险较高。而于术前开展新辅助放化疗,一方面可有助于减小肿瘤体积,以为手术的实施创造机会,同时还能提高手术质量,继而减少并发症发生风险;另一方面,新辅助放化疗后可降低肿瘤生物学活性,以使得在开展手术时有效切除肿瘤组织,进而降低术后局部复发率[11]。但由于本研究纳入研究对象样本量较小且为单中心研究等,可能导致组间比较,差异均无统计学意义。
综上,进展期直肠癌患者应用新辅助放化疗联合手术治疗效果显著,有助于促进术后恢复,且对机体免疫功能的影响较小,安全性良好。但本研究样本量较小且样本来源单一,后期需增加样本量、进行多中心研究。
参考文献
王英斌, 徐兴伟, 邵泉, 等. 新辅助化疗在局部进展期直肠癌中的应用效果[J]. 中华普通外科杂志, 2020, 35(10): 768-772.
李干斌, 韩加刚, 王振军, 等. 新辅助放化疗治疗局部进展期直肠癌疗效分析[J]. 中国实用外科杂志, 2021, 41(2): 184-189, 193.
王霄英, 容蓉, 刘荫华. 美国放射学会直肠癌分期诊断规范解读[J]. 中华胃肠外科杂志, 2011, 14(11): 839-841.
中华人民共和国国家卫生健康委员会. 直肠癌规范化诊疗指南(试行)[J]. 临床指南汇编数据库, 2019, 1(1): 31-51.
唐军, 韦维, 杨静芳. 新辅助化疗对直肠癌患者免疫功能、血管内皮功能及LEP的影响[J].海南医学院学报, 2019, 25(1): 45-49.
郑岷江, 罗斌, 王康. 新辅助放化疗对直肠癌患者三年生存率和生存质量的影响分析[J]. 实用医院临床杂志, 2021, 18(2): 152-155.
高树全, 张迎春, 张超, 等.新辅助放化疗联合TME术对Ⅲ B期直肠癌肿瘤组织内RUNX3、Survivni、ki-67的影响[J]. 现代消化及介入诊疗, 2020, 25(9): 1146-1150.
糜英华, 高登鹏, 李荣, 等. 中低位进展期直肠癌患者外周血T淋巴细胞亚群水平变化对新辅助同步放化疗效果的影响[J]. 临床和实验医学杂志, 2021, 20(17): 1850-1853.
侯良学, 王红娜, 卢渊全, 等. 术前短程放疗联合新辅助化疗治疗老年人局部进展期直肠癌的有效性和安全性[J]. 中华老年医学杂志, 2024, 43(3): 317-323.
唐丹, 储诚浩, 梁帅兵, 等. 新辅助放化疗联合手术治疗T3N+/T4Nx期直肠癌的临床研究[J]. 临床肿瘤学杂志, 2019, 24(3): 242-246.
孙涛, 安岗. 新辅助放化疗联合全直肠系膜切除术治疗局部进展期直肠癌的临床分析[J]. 贵州医药, 2022, 46(9): 1408-1409.

