高比表面积羟基磷灰石的制备及其在磷酸铁废水除氟中的应用








摘" 要: 为提高羟基磷灰石(Hydroxyapatite, HAP)对氟离子的吸附效率,采用化学沉淀法,通过优化反应温度、Ca/P摩尔比、陈化时间等合成条件制备高比表面积HAP,通过FTIR、XRD、XPS、SEM和BET等对合成的HAP进行表征,并评价HAP对模拟废水中氟离子的吸附性能。结果表明:HAP的最优制备条件为反应温度20 ℃、Ca/P摩尔比1.6、陈化时间24 h,所制备的HAP比表面积达108.0 m2/g;HAP对氟离子的吸附为自发和吸热过程,符合Langmuir吸附模型,在303 K下氟离子的最大吸附容量为13.53 mg/g,吸附过程符合准二级反应动力学模型;在酸性条件下,HAP的除氟机理为离子交换。磷酸铁废水HAP吸附除氟实验表明,出水氟离子浓度可连续32 h低于1.0 mg/L,体现了较好的除氟效果。研究结果可为高效除氟吸附剂的制备以及磷酸铁废水深度除氟提供一定的指导。
关键词: 羟基磷灰石;磷酸铁废水;除氟;吸附热力学;吸附动力学
中图分类号: X52
文献标志码: A
文章编号: 1673-3851 (2024)04-0427-09
DOI:10.3969/j.issn.1673-3851(n).2024.04.002
收稿日期: 2023-12-25" 网络出版日期:2024-03-13网络出版日期
基金项目: 浙江省重点研发计划项目(2023C03144)
作者简介: 马炳荣(1997—" ),男,广东汕头人,硕士研究生,主要从事废水处理与资源化技术方面研究。
通信作者: 俞三传,E-mail:yuschn@163.com
引文格式:马炳荣,洪子奇,易秉智,等. 高比表面积羟基磷灰石的制备及其在磷酸铁废水除氟中的应用[J]. 浙江理工大学学报(自然科学),2024,51(4):427-435.
Reference Format: MA Bingrong, HONG Ziqi, YI Bingzhi, et al. Preparation of hydroxyapatite with high specific surface and its application in defluoridation of ferric phosphate wastewater[J]. Journal of Zhejiang Sci-Tech University,2024,51(4):427-435.
Preparation of hydroxyapatite with high specific surface and its application in defluoridation of ferric phosphate wastewater
MA Bingrong, HONG Ziqi, YI Bingzhi, YU Sanchuan
(School of Chemistry and Chemical Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract:" In order to improve the adsorption efficiency of hydroxyapatite (HAP) for fluoride ion, HAP with high specific surface area was synthesized by chemical precipitation method through optimizing the preparation conditions such as reaction temperature, Ca/P molar ratio and aging time. The obtained HAP was characterized by FTIR, XRD, XPS, SEM and BET, and its adsorption performance of F- in simulated wastewater was evaluated. The results showed that the optimal preparation parameters of HAP were as follows: the reaction temperature of 20 ℃, Ca/P molar ratio of 1.6 and aging time of 24 h. The specific surface area of the HAP synthesized under the optimal conditions was up to 108.0 m2/g. The adsorption process of F- by HAP was a spontaneous and endothermic process and conformed to the Langmuir model. The maximum absorption capacity of F- by HAP at 303 K was up to 13.53 mg/g and the adsorption process conformed to the pseudo-second-order reaction kinetic model. The fluoride removal by HAP under acidic conditions was mainly through ion exchange. Continuous adsorption experiment of the prepared HAP in processing ferric phosphate wastewater demonstrated that the effluent F- concentration could be kept less than 1.0 mg/L for 32 h, showing good defluorination efficiency. The research results can provide some guidance for the preparation of high-efficiency fluoride removal adsorbents and the deep fluoride removal of iron phosphate wastewater.
Key words: hydroxyapatite; ferric phosphate wastewater; defluoridation; adsorption thermodynamics; adsorption kinetics
0" 引" 言
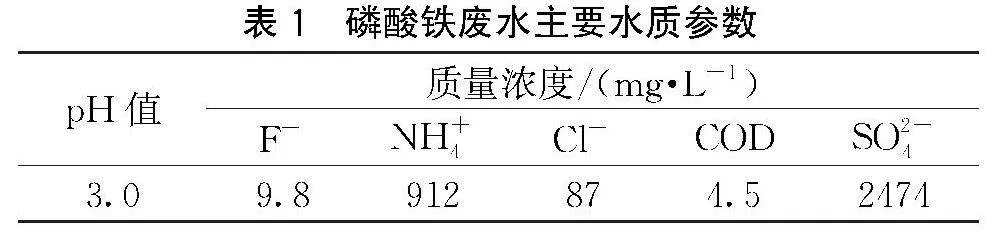
磷酸铁作为制备磷酸铁锂电池正极材料的重要前驱体,主要采用铵法制备,生产过程中会产生大量含硫酸铵和Fe2+、Mg2+、Mn2+、F-等杂质离子的废水。目前主流的废水处理方法是固化处理,通过机械式蒸发再压缩蒸发器(Mechanical vapor recompression, MVR)对废水进行蒸发结晶,回收硫酸铵[1-2]。然而,随着蒸发的进行,废水中的铵根离子会以氨气的形式挥发,废水pH值为2.0~3.0,氟离子会与氢离子结合成氢氟酸,氢氟酸与MVR钛材表面氧化膜结合成含钛氟化合物Na2TiF6,导致表面氧化膜变质,从而影响蒸发器的使用寿命[3]。因此,为了尽可能地保障MVR装置的使用寿命,需要确保进入MVR装置的废水氟离子浓度低于1.0 mg/L。
目前除氟的工艺主要有沉淀法[4]、膜法[5]、离子交换法[6]和吸附法[7]。沉淀法主要通过生成CaF2沉淀以去除水中氟离子,由于常温下CaF2的ksp为2.7×10-11,以CaF2形式除氟只能将废水中的氟离子浓度降低到10.0 mg/L左右,不能满足要求;采用膜法除氟,容易发生膜污染,不利于大规模应用;离子交换法除氟易受干扰离子影响,效率很大程度上取决于pH值,且树脂价格昂贵、再生处理繁琐;吸附法由于具有除氟效率高、成本低、操作简便、维护简单等特点,在工业废水除氟应用上更具竞争力。目前常见的吸附剂有铝基吸附剂和天然吸附剂。铝基吸附剂如氧化铝等具有良好的除氟能力,但在吸附过程中往往伴随铝离子的析出[8]。天然吸附剂如生物炭、粘土等除氟能力偏低[9],而羟基磷灰石(Hydroxyapatite, HAP)则是一种易合成且无毒的矿物,且具有较大的吸附容量,实验证明是一种应用前景较好的除氟材料[10]。与天然羟基磷灰石相比,实验室合成的羟基磷灰石,具有结晶度低、比表面积大、吸附容量高等特点,是一种潜在的高效除氟吸附剂[11]。此外,相较于水热法,化学沉淀法合成的HAP的晶粒尺寸较小,比表面积较大,且反应条件温和,制备成本较低,更适用于环境工程领域。
本文采用化学沉淀法,通过优化合成参数制备高比表面积HAP,利用FTIR、XRD、XPS、SEM和BET对合成的HAP进行表征,评价HAP对模拟废水中氟离子的吸附性能,并探究了HAP吸附氟离子的吸附热力学、吸附动力学及吸附机理,最后评价了HAP对实际磷酸铁废水的除氟性能,以期为高效除氟吸附剂的制备和磷酸铁废水的深度除氟提供思路。
1" 实验部分
1.1" 实验材料
无水氯化钙(CaCl2)购自无锡市晶科化工有限公司,磷酸氢二铵((NH4)2HPO4)购自上海展云化工有限公司,氟化铵(NH4F)购自西陇化工有限公司,氨水购自浙江汉诺化工科技有限公司,以上试剂均为分析纯;聚偏二氟乙烯(Polyvinylidene fluoride, PVDF)膜片购自海宁市德滤新材料科技有限公司;模拟水样,氟离子质量浓度为10.0 mg/L,由氟化铵与去离子水配置,实际磷酸铁废水由江西某磷酸铁企业提供,具体水质参数见表1。
1.2" 羟基磷灰石制备
采用化学沉淀法制备HAP方法参考文献[12]。与传统方法直接将配置好的磷盐溶液滴加入钙盐溶液不同,本文在滴加前先用氨水将磷酸二氢铵溶液的pH值调到10.5,具体流程如下:取Ca/P摩尔比为1.2、1.4、1.6、1.8和2.0的CaCl2和(NH4)2HPO4,分别用纯水配置成0.025 mol溶液1、0.030 mol溶液2。用氨水分别将溶液1和溶液2的pH值调到11.0和10.5;接着将盛放溶液1的烧杯放置在油浴锅中搅拌,控制一定的反应温度(10、20、30、40 ℃和60 ℃);同时将溶液2以2 mL/min的速度滴入溶液1中,滴加完毕后,继续反应1 h。在室温下陈化一定时间(3、12、24、48 h和72 h)后,将沉淀物在80 ℃烘箱内干燥12 h,经研磨过200目的标准筛,得到HAP。
1.3" 吸附容量测定
在150 mL烧瓶中加入质量浓度为10.0 mg/L氟离子溶液100 mL,并用HCl将pH值调为3.0,用0.1 g的HAP入烧杯中,在磁力搅拌器下搅拌3 h,温度保持在30 ℃。反应完成后直接用PVDF膜片过滤,用氟离子选择电极法测试过滤液氟离子浓度;吸附容量(qe)由式(1)[13]计算得到:
qe=V(Co-Ce)m(1)
其中:qe为吸附容量,mg/g;Co为初始浓度,mg/L;Ce为吸附后浓度,mg/L;m为HAP用量,g;V为溶液体积,L。
1.4" 吸附热力学与动力学测定
吸附热力学试验:称取0.1 g HAP放置在150 mL的烧杯当中。加入100 mL不同质量浓度的含氟溶液(由NH4F配置,分别为5、10、15、20、25、30、35 mg/L和40 mg/L,pH值为3.0)。在不同温度(30、40 ℃和50 ℃)下反应3 h。反应完成后用PVDF膜片过滤,吸附容量按式(1)计算。
吸附动力学试验:在150 mL的烧杯当中,加入100 mL质量浓度为10.0 mg/L的含氟溶液,用HCl将pH值调为3.0,称取0.1 g HAP加入烧杯。在30 ℃下反应,每隔一段时间(5、30、60、120、180 min和240 min)取样测试氟离子浓度。
1.5" 连续除氟测定
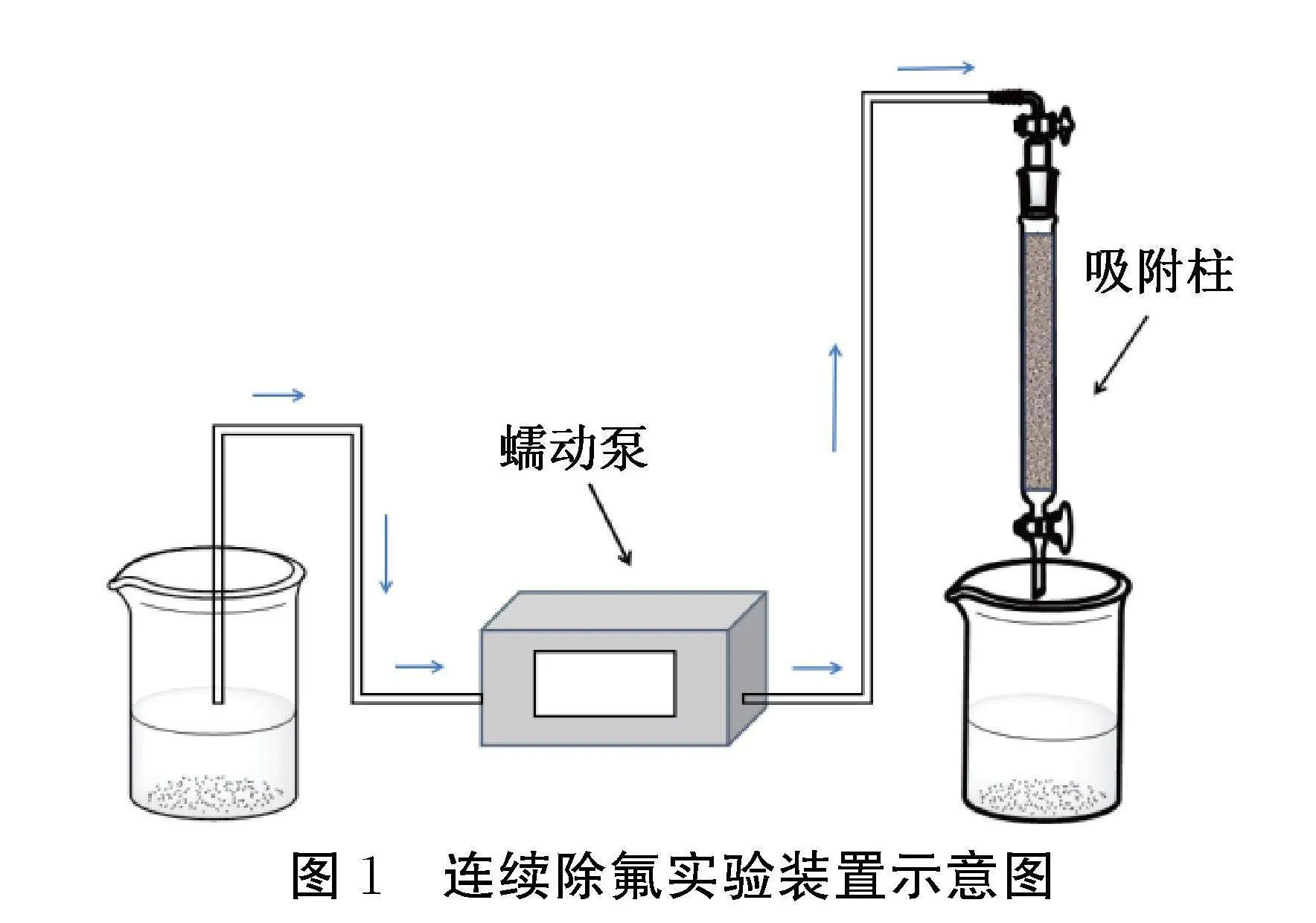
采用固定床工艺考察HAP连续除氟性能,实验装置如图1所示,吸附柱内径为20 mm,高度300 mm,HAP的颗粒大小为0.15 mm,吸附柱内填充10.0 g HAP。使用蠕动泵将磷酸铁废水由烧杯输送至吸附柱顶部,利用出水口截止阀开合大小来控制流速,流速为3.4 mL/min。实验过程中每隔2 h取样测试出水氟离子浓度。
1.6" 测试与表征
利用Rigaku Ultima IV X射线衍射仪(日本理学株式会社)表征HAP晶体结构,扫描速度2(°)/min,扫描范围10°~80°;利用Nicolet iS10傅里叶红外光谱仪(Thermo Fisher Scientific 公司)表征HAP分子结构,扫描范围为4000~500 cm-1;利用Hitachi Regulus 8100扫描电子显微镜(日本HITACHI)观察HAP表面形貌,加速电压为5 kV;利用麦克ASAP 2600全自动比表面积及孔隙度分析仪(美国Micromeritics公司)表征HAP的BET比表面积及BJH孔径分布,测试时脱气温度为120 ℃,脱气时间为8 h;利用K-Alpha X射线光电子能谱仪(Thermo Fisher Scientific 公司)表征HAP的化学状态,能谱仪为AI Ka靶,出射的X射线能量为1350 eV。
2" 结果与讨论
2.1" 合成条件对HAP吸附容量的影响
2.1.1" 反应温度
在Ca/P摩尔比1.5、陈化时间30 h下,反应温度对吸附容量的影响如图2(a)所示。从图2(a)中曲线变化可知,随着温度的上升,吸附容量呈先上升后下降趋势,当反应温度为20 ℃时,吸附容量达到最大9.21 mg/g。反应温度过低,不利于HAP晶体的形成,导致产物中钙的损失,进而影响吸附容量[14]。反应温度过高,由于HAP结晶的驱动力为Gibbs自由能差,而Gibbs自由能与温度成正比,随着温度的上升,HA的结晶驱动力增大,生成的HAP的晶粒尺寸越来越大,HAP的比表面积随之减少,吸附容量下降[15]。采用XRD对不同温度合成的HAP进行表征,表征结果如图2(b)所示;HAP平均晶粒尺寸按谢乐公式计算:
D=0.89λ/βcosθ(2)
其中:D为平均晶粒尺寸,nm;λ为入射光波长,nm;θ为衍射角度,(°);β为衍射峰的半宽高,(°)。经计算,20、30、40 ℃和60 ℃合成的HAP平均晶粒尺寸分别为15.9、16.4、19.8 nm和30.4 nm,证实了晶粒尺寸随反应温度上升变大。综上所述,反应温度控制为20 ℃时最为合理。
2.1.2" Ca/P摩尔比
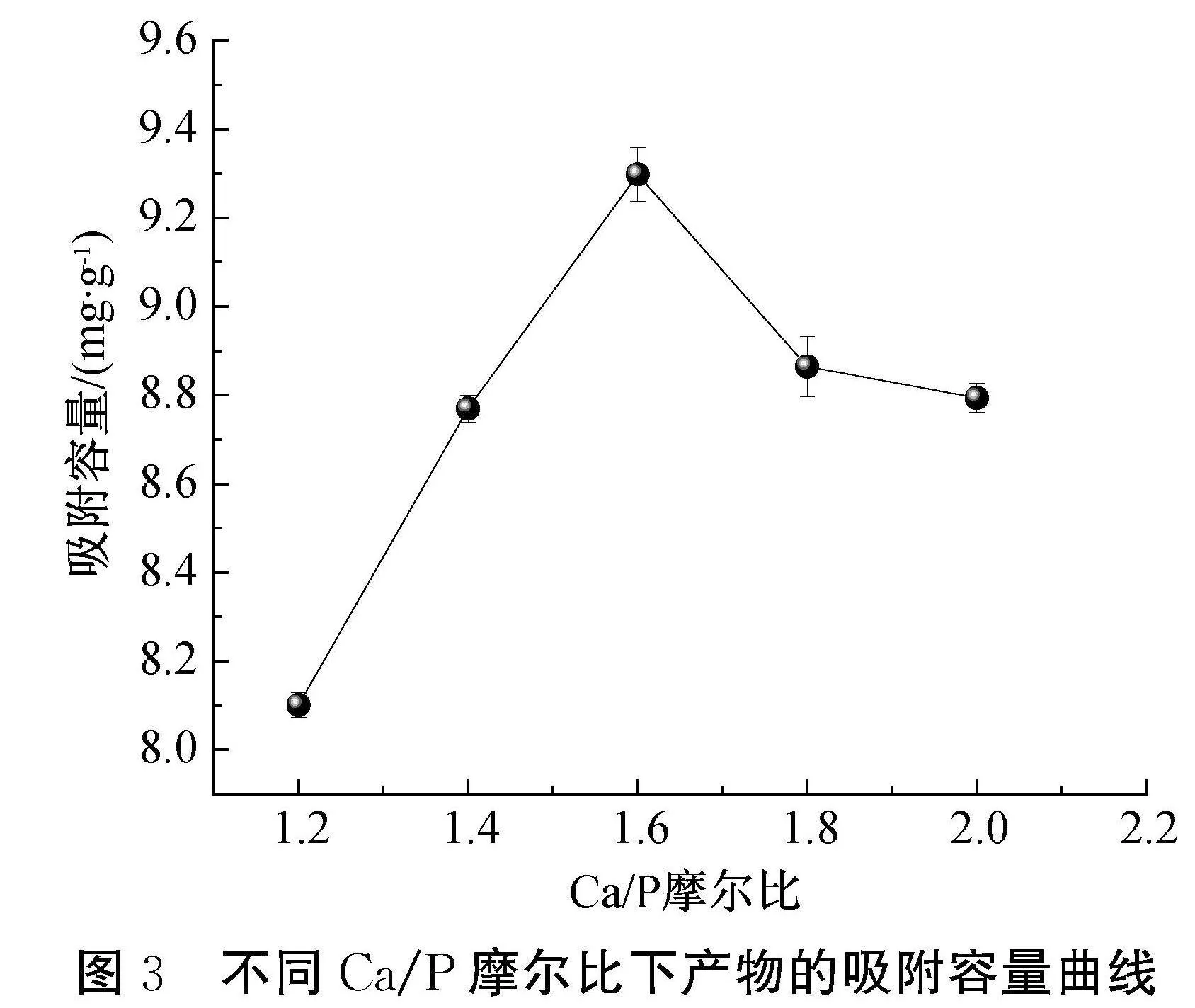
在反应温度为20 ℃、陈化时间为30 h条件下,Ca/P摩尔比对吸附容量的影响如图3所示。图3显示:随着Ca/P摩尔比的上升,吸附容量呈先上升后下降趋势,在Ca/P摩尔比为1.6时,吸附容量达到最高9.32 mg/g,此时的Ca/P摩尔比与HAP中Ca和P的化学计量比1.67较为接近。当Ca/P摩尔比小于1.6时,HAP为缺钙状态,缺钙的HAP存在杂质相磷酸三钙(Tricalcium phosphate, TCP),导致吸附容量降低[16]。当Ca/P摩尔比超过1.6时,HAP中的钙离子含量增高,较高的钙离子含量将增强HAP对OH-的锚定效应,使OH-难以离开晶格,离子交换能力变差,导致吸附容量减小[17]。因此,Ca/P摩尔比控制为1.6时最为合理。
2.1.3" 陈化时间
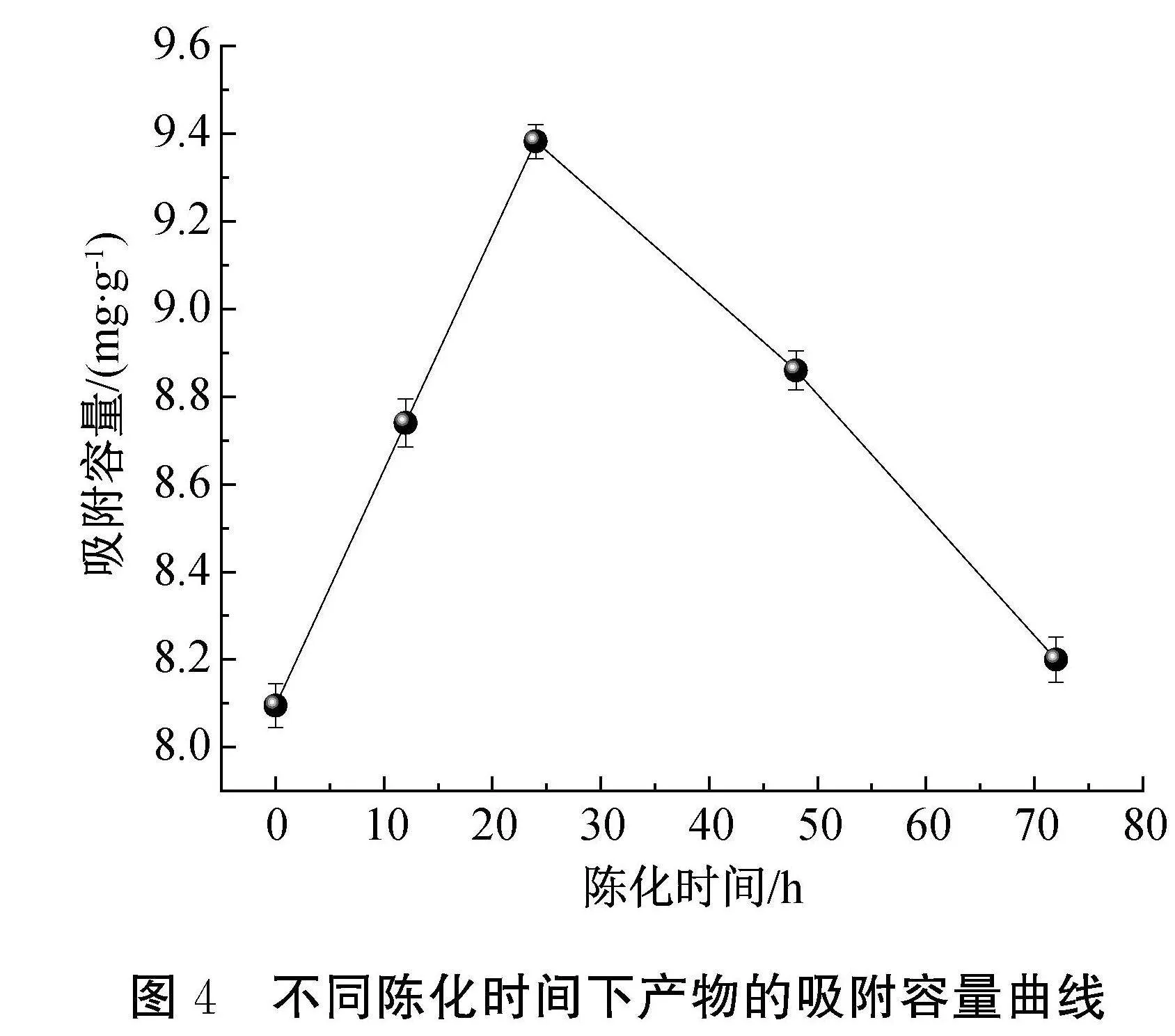
在反应温度为20 ℃,Ca/P摩尔比为1.6的条件下,陈化时间对吸附容量的影响如图4所示。由图4可知:随着陈化时间的延长,吸附容量呈先上升后下降的趋势;陈化时间为24 h时,HAP的吸附容量达到最大9.41 mg/g。陈化时间过短,生成的HAP中存在中间产物TCP相,TCP相没有通道结构,导致HAP吸附容量较低[18];陈化时间过长(大于24 h),HAP的晶粒逐渐生长完美,晶体结构不断趋于完整且致密,晶粒尺寸随之变大,比表面积则随之减小,吸附容量呈现下降趋势[19]。因此,陈化时间为24 h时最为合理。
2.2" HAP表征
本文对在反应温度20 ℃、Ca/P摩尔比1.6、陈化时间24 h条件下合成的HAP进行表征。
2.2.1" 形貌与晶体结构
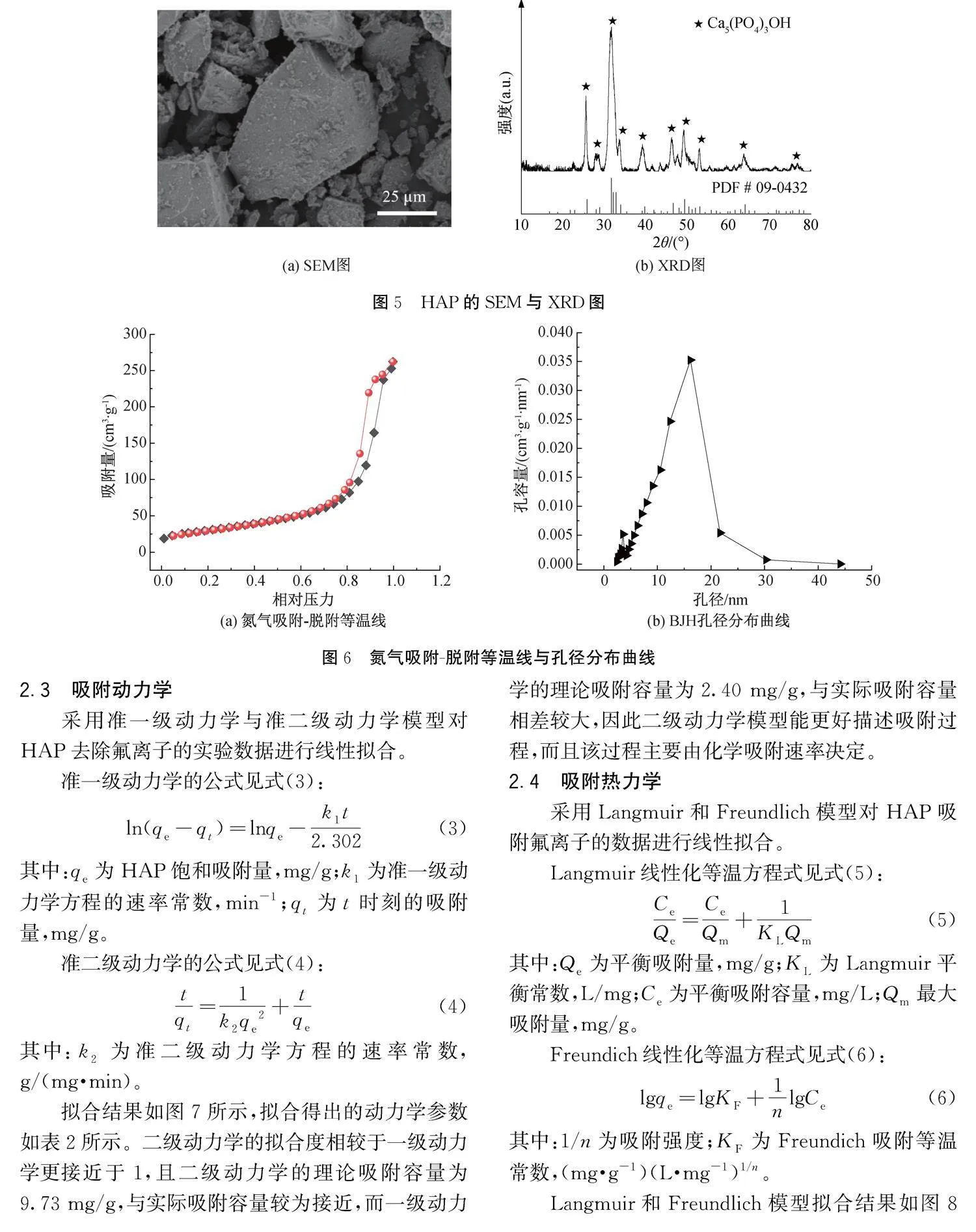
扫描电镜对合成的HAP形貌进行表征,结果如图5所示。制备的HAP表面呈无规则多边形,具有致密的多孔表面纹理和较大的比表面积,因此具备较多的吸附位点,有利于对氟离子的捕捉,合成的HAP有着轻微的团聚性(见图5(a))。XRD分析表明,与HAP标准卡片对比,产物XRD图没有出现其他相的特征峰(见图5(b)),表明产物的主要成分为HAP,纯度较高。此外,通过式(2)计算得到合成的HAP平均晶粒尺寸为15.8 nm,晶粒尺寸较小。
2.2.2" 比表面积分析
采用BET对HAP的比表面积和孔径分布进行了分析,结果如图6所示。HAP的氮吸附-解吸等温线均为Ⅳ型,具有明显的滞后回线(见图6),表明存在介孔[20]。BJH孔径分布(图6(b))进一步证实了这一点,合成HAP的平均孔径为13.7 nm,比表面积为108.0 m2/g,高于文献[21-22]报道的40.0~100.0 m2/g。这主要是由于合成过程采用pH值10.5的磷酸二氢铵溶液,磷元素主要以PO3-4形式存在,反应的过饱和度随之上升,成核速率与晶体长大速率比增加,导致生成产物的晶粒尺寸较小、比表面积较高,有利于离子的吸附、交换和扩散。
2.3" 吸附动力学
采用准一级动力学与准二级动力学模型对HAP去除氟离子的实验数据进行线性拟合。
准一级动力学的公式见式(3):
ln(qe-qt)=lnqe-k1t2.302(3)
其中:qe为HAP饱和吸附量,mg/g;k1为准一级动力学方程的速率常数,min-1;qt为t时刻的吸附量,mg/g。
准二级动力学的公式见式(4):
tqt=1k2qe2+tqe(4)
其中:k2为准二级动力学方程的速率常数,g/(mg·min)。
拟合结果如图7所示,拟合得出的动力学参数如表2所示。二级动力学的拟合度相较于一级动力学更接近于1,且二级动力学的理论吸附容量为9.73 mg/g,与实际吸附容量较为接近,而一级动力学的理论吸附容量为2.40 mg/g,与实际吸附容量相差较大,因此二级动力学模型能更好描述吸附过程,而且该过程主要由化学吸附速率决定。
2.4" 吸附热力学
采用Langmuir和Freundlich模型对HAP吸附氟离子的数据进行线性拟合。
Langmuir线性化等温方程式见式(5):
CeQe=CeQm+1KLQm(5)
其中:Qe为平衡吸附量,mg/g;KL为Langmuir平衡常数,L/mg;Ce为平衡吸附容量,mg/L;Qm最大吸附量,mg/g。
Freundich线性化等温方程式见式(6):
lgqe=lgKF+1nlgCe(6)
其中:1/n为吸附强度;KF为Freundich吸附等温常数,(mg·g-1)(L·mg-1)1/n。
Langmuir和Freundlich模型拟合结果如图8所示,拟合得到的不同温度下的热力学参数如表3所示。图8和表3显示:在温度为30、40 ℃和50 ℃时,Langmuir的拟合度更接近于1,且不同温度下Langmuir模型的理论吸附容量更接近实际吸附容量,表明Langmuir模型可以更好地描述这个吸附过程,即吸附为单分子吸附,而且以化学吸附为主。
为了进一步探讨反应过程中的能量变化,根据式(7)计算不同温度下HAP对氟离子的吸附过程的热力学平衡常数(Kc),通过式(8)绘制出范德霍夫曲线(图9),根据曲线的斜率计算焓变ΔH和熵变ΔS,最后结合式(9)得到吉布斯自由能变ΔG:
Kc=QeCe(7)
lnKc=-ΔHRT+ΔSR(8)
ΔG=ΔH-TΔS(9)
其中:Qe为平衡吸附容量,mg/g;Ce为吸附平衡时溶液中氟离子的浓度,mg/L;R为气体常数,8.314 J/mol/K;T为温度,K。
表4给出了30、40 ℃和50 ℃的ΔH、ΔS和ΔG。由表4中数据可知:30、40 ℃和50 ℃温度下的ΔG均为负值,表明吸附是一个自发过程;ΔG的绝对值与温度呈正相关,因此温度越高,越有利于吸附。ΔH的正值表明吸附为吸热过程,高温有利于反应进行,这主要由于溶质运动的增加,吸附剂孔隙的自由体积增加[23]。ΔS的正值可归因于HAP中OH-与F-置换增强系统的混乱程度。
2.5" 吸附机理探究
2.5.1" FTIR分析
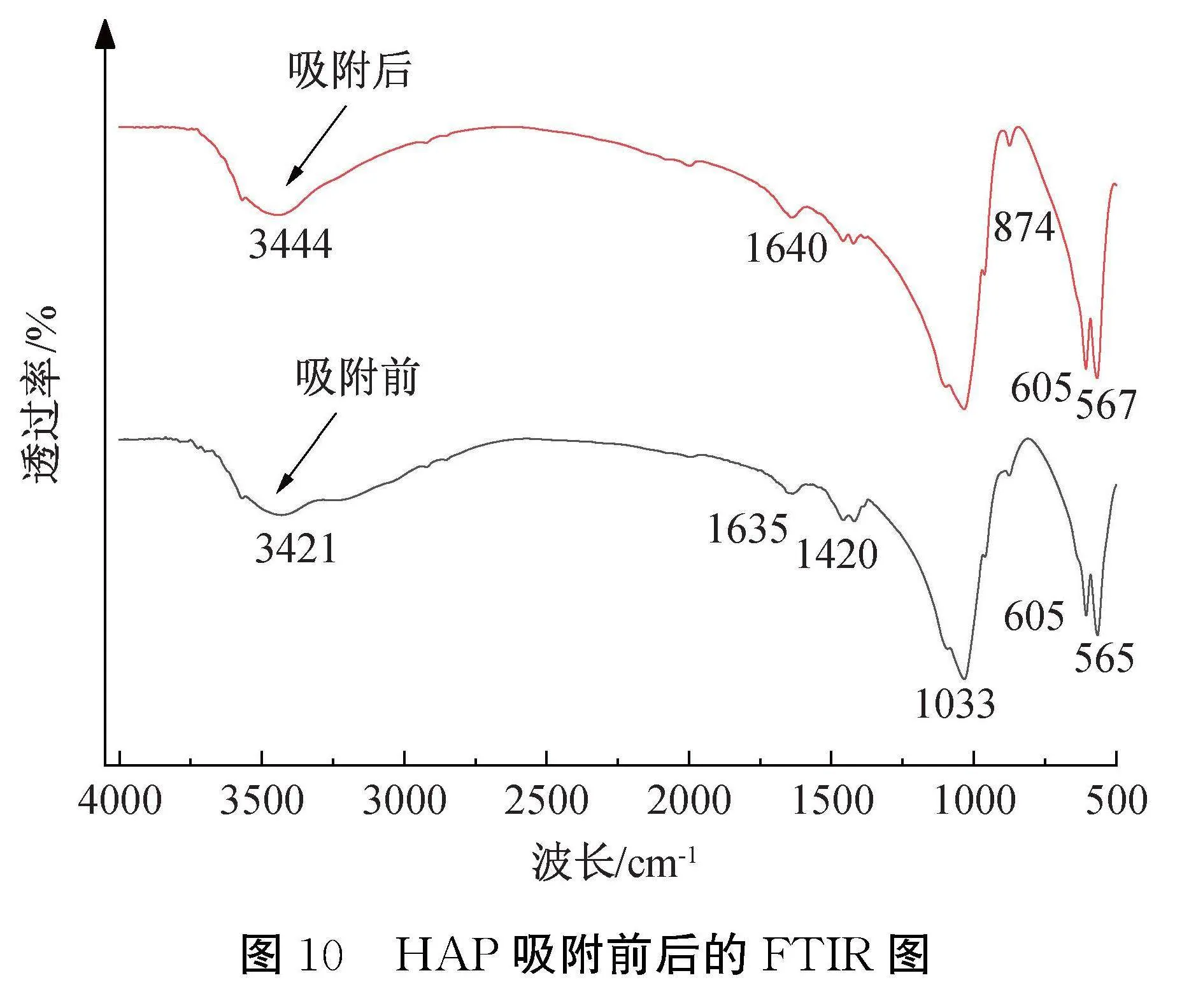
HAP吸附模拟废水中氟离子前后的红外光谱如图10所示。图10表明:对于吸附前HAP,3421 cm-1处的峰归属于—OH的拉伸振动,1630 cm-1处的峰归属于吸附水的拉伸和弯曲振动,1033 cm-1处的峰为PO2-4不对称拉伸振动,605 cm-1和565 cm-1处的峰为PO2-4的弯曲振动,1420 cm-1处的尖峰归因于C—O基团拉伸振动,这主要由于碳酸根占据了磷酸根的位点,碳酸根的存在可以归因于从水中吸收二氧化碳[24];对于吸附后HAP,—OH吸收峰强度明显减弱,表明在吸附过程中,部分氢氧根离子被氟离子所取代;—OH的特征峰从3421 cm-1偏移至3444 cm-1,这主要是由于形成OH2+…F-的原因[25]。
2.5.2" XPS分析
采用XPS对HAP吸附模拟废水中氟离子前后的化学状态和组成进行分析,探究氟离子在HAP表面的吸附机理。HAP吸附氟离子前后的全谱以及窄谱如图11所示。由XPS全谱(见图11(a))中发现,HAP吸附后在约683.58 eV处出现了一个归属于F 1s的峰,证明了氟离子已成功吸附在吸附剂上,吸附后的F 1s精细谱(见图11(b))中进一步证实了氟离子的存在。氟离子吸附前后的O 1s图谱(见图11(c)—(d))中结合能为529.72、530.50 eV和531.13 eV的3个峰分别归属于O2-、M—OH、H2O,吸附氟离子后,羟基的相对含量从55.2%下降到38.4%,证实了表面的羟基参与了氟离子的吸附[26]。吸附后HAP的Ca 2p峰的结合能由347.30 eV变化到347.08 eV,表明Ca—F键的形成,进一步证实了吸附过程主要为羟基与氟离子的交换[27]。
2.6" 连续除氟试验
出水氟离子浓度随运行时间的变化情况如图12所示。从图12可知,在连续32 h内,出水氟离子质量浓度均小于1.0 mg/L,表明合成的HAP对磷酸铁废水有着较好的除氟效果。通过计算得出HAP实际除氟吸附容量为7.52mg/g,为理论吸附容量的75.1%。这一方面由于磷酸铁废水中存在大量的SO2-4,SO2-4作为二价阴离子增加库仑排斥力,进而影响HAP除氟效果[28],另一方面由于连续除氟实验中流速过快,溶液在吸附剂中的平均停留时间较短,因此HAP实际吸附容量下降。因此,在实际应用中,可以通过优化流速来提高HAP实际吸附容量。
3" 结" 论
本文采用化学沉淀法制备HAP,分析了反应温度、Ca/P摩尔比和陈化时间对HAP吸附容量的影响,采用XRD、XPS、BET、XRD等对HAP材料进行了表征,探究了HAP吸附氟离子的吸附热力学、吸附动力学及吸附机理,最后评价了HAP对实际磷酸铁废水的除氟性能,得出的结论如下:
a)HAP的最佳合成条件为:合成温度20 ℃、Ca/P摩尔比1.6、陈化时间24 h。在此合成条件下制备的HAP的比表面积可达到108.0 m2/g、吸附容量为9.41 mg/g。
b)HAP吸附氟离子为自发和吸热过程,符合准二级吸附动力学模型和Langmuir模型,在303 K下样品最大吸附氟离子的容量达到13.53 mg/g,主要作用机理是羟基和氟离子之间的离子交换。
c)在固定床连续除氟实验中,在连续吸附32 h内,出水的氟离子浓度都低于1.0 mg/L,表明合成的HAP具有较好的潜在应用价值。
参考文献:
[1]乐晨,浦燕新,韩颖. 新能源行业磷酸铁锂生产废水“零排放”处理技术研究[J]. 安徽化工,2022,48(5): 91-93.
[2]郑佶,刘成,吴天,等. 磷酸铁生产废水零排放处理技术研究与应用[J]. 工业安全与环保,2023,49(S01): 83-85.
[3]Huang H H, Electrochemical impedance spectroscopy study of strained titanium in fluoride media[J]. Electrochimica Acta, 2002, 47(13/14): 2311-2318.
[4]Ezzeddine A, Bedoui A, Hannachi A, et al. Removal of fluoride from aluminum fluoride manufacturing wastewater by precipitation and adsorption processes[J]. Desalination and Water Treatment, 2015, 54(8): 2280-2292.
[5]Huang H S, Zhang H, Xiao F, et al. Efficient removal of fluoride ion by the composite forward osmosis membrane with modified cellulose nanocrystal interlayer[J]. Results in Engineering, 2023, 20: 101449.
[6]Yu T, Chen Y L, Zhang Y Z, et al. Novel reusable sulfate-type zirconium alginate ion-exchanger for fluoride removal[J]. Chinese Chemical Letters, 2021, 32(11): 3410-3415.
[7]Wang Z, Gu X Y, Zhang Y F,et al. Activated nano-Al2O3 loaded on polyurethane foam as a potential carrier for fluorine removal[J]. Journal of Water Process Engineering, 2021, 44: 102444.
[8]Sankannavar R, Chaudhari S. An imperative approach for fluorosis mitigation: Amending aqueous calcium to suppress hydroxyapatite dissolution in defluoridation[J]. Journal of Environmental Management, 2019, 245: 230-237.
[9]Mondal P, George S. A review on adsorbents used for defluoridation of drinking water[J]. Reviews in Environmental Science and Bio Technology, 2015, 14(2): 195-210.
[10]Rathnayake A, Hettithanthri O, Sandanayake S, et al. Essence of hydroxyapatite in defluoridation of drinking water: A review[J]. Environmental Pollution, 2022, 311: 119882.
[11]Fernane F, Boudia S, Aiouache F. Removal Cu(Ⅱ)and Ni(Ⅱ)by natural and synthetic hydroxyapatites: a comparative study[J]. Desalination and Water Treatment, 2014, 52(13/14/15): 2856-2862.
[12]赵帅帅,梁福根,杨飞,等. 羟基磷灰石吸附材料的制备及其锑吸附性能[J]. 浙江理工大学学报(自然科学版),2021,45(6): 717-723.
[13]赵佳昕,李文博,王吉坤. 柠檬酸优化水热合成羟基磷灰石及矿井水除氟性能[J]. 洁净煤技术,2022,28(2): 175-185.
[14]Lee I H, Lee J G, Lee J H, et al. Effects of pH and reaction temperature on hydroxyapatite powders synthesized by precipitation[J]. Journal of the Korean Ceramic Society, 2020, 57(1): 56-64.
[15]Jin X Y, Chen X H, Cheng Y T, et al. Effects of hydrothermal temperature and time on hydrothermal synthesis of colloidal hydroxyapatite nanorods in the presence of sodium citrate[J]. Journal of Colloid and Interface Science, 2015, 450:151-158.
[16]Zhang L H, Lu T L, He F P, et al. Physicochemical and cytological properties of poorly crystalline calcium-deficient hydroxyapatite with different Ca/P ratios[J]. Ceramics International, 2022, 48(17): 24765-24776.
[17]Huang S M, Zhang X Y, Wang L P, et al. Enhanced water defluoridation using ion channel modified hydroxyapatite: Experimental, mechanisms and DFT calculation[J]. Applied Surface Science, 2023, 615: 156351.
[18]宋健平. 磷灰石除氟剂的制备和除氟性能研究[D]. 景德镇: 景德镇陶瓷大学,2020: 22-24.
[19]刘纯玮,冯莉,刘忆玲,等. 制备条件对掺镁羟基磷灰石结构及除氟性能的影响[J]. 硅酸盐学报,2019,47(7): 933-941.
[20]Jiang S D, Yao Q Z, Zhou G T, et al. Fabrication of hydroxyapatite hierarchical hollow microspheres and potential application in water treatment[J]. The Journal of Physical Chemistry C, 2012, 116(7): 4484-4492.
[21]Fernando M S, Wimalasiri A K D V K, Ratnayake S P, et al. Improved nanocomposite of montmorillonite and hydroxyapatite for defluoridation of water[J]. RSC Advances, 2019, 9(61): 35588-35598.
[22]Chen L, Zhang K S, He J Y, et al. Enhanced fluoride removal from water by sulfate-doped hydroxyapatite hierarchical hollow microspheres[J]. Chemical Engineering Journal, 2016, 285: 616-624.
[23]Ho Y S, McKay G. Sorption of dyes and copper ions onto biosorbents[J]. Process Biochemistry, 2003, 38(7): 1047-1061.
[24]Zeng R Y, Tang W Q, Ding C X, et al. Preparation of anionic-cationic co-substituted hydroxyapatite for heavy metal removal: Performance and mechanisms[J]. Journal of Solid State Chemistry, 2019, 280: 120960.
[25]Nayak B, Samant A, Patel R, et al. Comprehensive understanding of the kinetics and mechanism of fluoride removal over a potent nanocrystalline hydroxyapatite surface[J]. ACS Omega, 2017, 2(11): 8118-8128.
[26]Gao M, Wang W, Yang H B, et al. Hydrothermal synthesis of hierarchical hollow hydroxyapatite microspheres with excellent fluoride adsorption property[J]. Microporous and Mesoporous Materials, 2019, 289: 109620.
[27]Ke F, Peng C Y, Zhang T, et al. Fumarate-based metal-organic frameworks as a new platform for highly selective removal of fluoride from brick tea[J]. Scientific Reports, 2018, 8(1): 939.
[28]Mohan R, Dutta R K. Continuous fixed-bed column assessment for defluoridation of water using HAp-coated-limestone[J]. Journal of Environmental Chemical Engineering, 2020, 8(4): 103840.
(责任编辑:张会巍)

