氢氧化亚铁性质的再讨论






基金项目:
本文系广西教育科学“十四五”规划2023年度专项重点课题“基于志趣的拔尖创新人才早期培养实践探索”(2023ZJY1322)的研究成果。
摘" 要:2019年人教版高中化学必修第一册描述“白色氢氧化亚铁絮状沉淀迅速变成灰绿色,过一段时间还会有红褐色的物质生成”,过一段时间究竟是多长?绿色物质究竟是什么?绿色物质的稳定性怎么样?本文详细综述绿色物质即“绿锈”的类型、结构、稳定性和颜色变化。进而分析、探讨和总结Fe(OH)2的主要化学性质,并为Fe(OH)2的制备实验提供一些实际操作的建议。
关键词:氢氧化亚铁;绿色物质;绿锈
文章编号:
1008-
0546(2024)14
-0035-03
中图分类号:
G632.41
文献标识码:
B
一、绿锈的引出
Fe(OH)2的研究主要集中在以下两个方面:①纯净白色Fe(OH)2的制备[1];②绿色成分的实验探究及理论研究。[2][3]
纯净白色的Fe(OH)2究竟如何制备?中学教师对控制反应体系中的条件,如Fe3+的含量、NaOH溶液的浓度和用量、体系的pH、反应溶液的密度及如何隔离空气等展开了广泛的讨论,并且设计了装置避氧型、试剂避氧型和操作避氧型等多种制备方案。[4]
Fe(OH)2由白色变为绿色,关于绿色成分的实验证实和理论分析集中在以下两个方面:①氧化成Fe3+混合型;②Fe(OH)2胶体吸附Fe2+型。
绿锈(以下简称GRs)主要成分是我们中学演示实验制备的絮状Fe(OH)2变色反应中的绿色物质。笔者从国内外研究Fe(OH)2的文献出发,梳理出“绿色物质”的类型、结构、稳定性和颜色变化,总结了Fe(OH)2的主要化学性质,并对制备Fe(OH)2的实验提出一些实践建议。
二、绿锈的结构
中学实验采用FeCl2溶液与NaOH溶液反应得到的绿色固体主要成分是GR1,FeSO4溶液与NaOH溶液反应得到的绿色固体主要成分是GR2。
Fe(OH)2悬浊液空气法是制备GRs的方法之一。自然状态下形成的GRs虽是亚温状态,但实验室制备的绿色Fe(OH)2固体(GRs)在溶液底部能稳定存在数周且颜色基本不变。
关于Fe(OH)2悬浊液组成的研究,尤其是绿色物质变色成分研究,1928年Schikorr指出绿色物质的成分是Fe(OH)2·FeOOH,1935年Girard认为绿色物质组成是水合磁铁。[5]随着技术进步,近年广泛的光谱学技术包括红外光谱、穆斯堡尔光谱、紫外—可见光谱、X射线衍射技术、X射线精细结构光谱,已经可以准确表征GRs的组成和结构。
GRs是铁(氢)氧化物形成与转化过程中亚稳定态的中间产物,形成于土壤、沉积物或铁溶蚀产物等厌氧或缺氧环境中,易向针铁矿、磁铁矿、水铁矿、纤铁矿等高价铁(氢)氧化物转化。GRs主要成分的化学式为Fe2+xFe3+y(OH-)2x+3y-z(A-)z,A=Cl-或12CO2-3或12SO2-4。因外界阴离子(Cl-、CO2-3、SO2-4等)的不同,以及FeOOH类型(α、β、γ等)不一样,称之为绿锈(Ⅰ)(GR1)和绿锈(Ⅱ)(GR2)。根据阴离子不同也称之为碳酸盐绿锈、硫酸盐绿锈和氯绿锈。GRs为类水镁石层状结构,GR1层间填充的是平面型阴离子,如CO2-3、Cl-、OH-和SO2-3等;GR2层间填充的是立体型阴离子,如SO2-4、SeO2-4等。GR1为菱形结构,GR1(CO2-3)的空间群为R-3m,晶胞参数 a=2
d(110)和c=3d (003)(d=7.57 )。GR2为六边形结构,GR2(SO2-4)的空间群为 P-3m,晶胞参数a=2d(110)和 c=d(001)(d=10.97 )。不同的阴离子填充在GRs夹层,对GRs稳定性有不同的影响。[6]例如,阴离子填充是Cl-,则GR1分子式表示为Fe2+3-xFe3+1+x(OH)8Cl1+x·nH2O,Fe2+部分氧化成Fe3+使得Fe(OH)2片层带正电,为保持电中性,片层之间吸附有Cl-构成中间层。GR1可以氧化成稳定性差的β-FeOOH和稳定性好的γ-FeOOH。在一定条件下,GRs最后会转化为稳定的铁氧矿结构。在70℃、N2气氛下,pH约为7.8,GRs自动变黑,此时已没有绿锈存在,全部转化为Fe3O4。
三、绿锈的颜色
GRs主要成分的化学式为Fe2+xFe3+y(OH-)2x+3y-z(A-)z,化学式不固定,Fe2+和Fe3+的比值范围从3到0.12。中学用演示实验制备的GRs无论反应试剂数量如何变化,GR1中x和y的比值一般是xy=3,GR2中x和y
的比值一般是xy=2。GR1主要成分化学式可表达为Fe2+3Fe3+(OH)8Cl·nH2O,GR2主要成分化学式可表达为Fe2+4Fe3+2(OH)12SO4·nH2O。在Fe2+和Fe3+有序堆叠的层结构中,Mccool在1976年通过电子顺磁共振证明了Fe3+- Fe3+耦合离子对,并指出耦合离子对跃迁是产生黄色的基本原因。[7]相邻的八面体中心Fe2+和Fe3+的3d轨道发生重叠,Fritsch[8]在1993年指出Fe2+-Fe3+电荷转移对蓝色成因有一定贡献。Nikolskaya等[9]测试出Fe3+-O2-电荷转移,对黄色产生有一定的贡献。所以不同比例的蓝黄组合是绿色附近色,在成分一定的比率范围内GRs都是绿色,或者深绿色。
四、Fe(OH)2性质总结
1. 溶度积
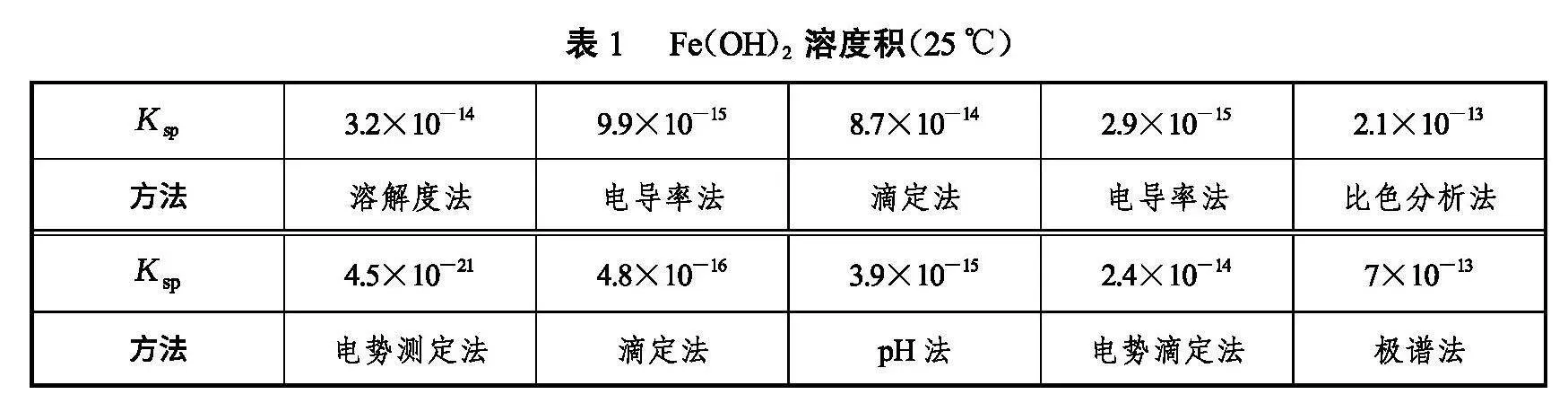
Fe(OH)2溶度积一般是在25℃时测定。测定方法有溶解度法、电导率法、滴定法、比色分析法、pH法等。Leussing和Kolthoff[10]总结了前人10种方法(见表1)并测定出自己的修正结果为2.7×10-14。Fe(OH)2溶液的行为复杂,外界无氧环境较难保证,都影响测量的准度和精度。从表1可以看出,采用不同方法数据出入较大,Leussing在文章中进行了讨论。旧版本大学教材、文献和习题引用数据多采用8×10-16,兰氏化学手册收集的数据是4.87×10-17。[11]最新经典大学教材均采用4.87×10-17(见表2)。
2. 固体的稳定性
关于Fe(OH)2稳定性研究,Shipico和Douglas[12]认为Fe(OH)2固体在无氧气的条件下稳定性高达316℃。在25℃无空气的条件下,白色的Fe(OH)2连同母液能稳定存在数个星期,甚至更长的时间,在保护膜下可以保存10个月。[13]
3. 悬浊液的析氢反应
室温下,Fe(OH)2悬浊液在20世纪初期进行了广泛的研究,Schikorr最早指出Fe(OH)2能被水或者痕量的氧气氧化,并且Schikorr研究发现过量的FeSO4溶液与NaOH溶液(碱过量没有析氢反应)反应得到Fe(OH)2悬浊液,在固体表面有氢气析出,即发生反应:3Fe(OH)2△Fe3O4+2H2O+H2↑或者4Fe(OH)2△Fe3O4+Fe+4H2O。Evans等[14]曾提到即使加热到100℃都没有析出氢气的迹象。后来大多数学者用色谱仪证实了在金属离子过量条件下的析氢反应,张经坤等[15]对Fe2+及一些金属盐过量情况下固体表面析出氢气的反应进行了详细的研究,并且指出Fe(OH)2可以在Ni2+、Co2+等金属盐催化作用下会发生析氢反应。
综上所述,Fe(OH)2补充说明的化学性质有两个方面:①Schikorr歧化反应,即3Fe(OH)2△Fe3O4+2H2O+H2↑或者4Fe(OH)2△Fe3O4+Fe+4H2O。②GRs反应,Fe(OH)2在微碱性溶液中变成GRs,GRs又氧化生成不同晶型的铁氢氧矿(FeOOH)或者不同晶型的铁氧矿(Fe2O3、Fe3O4)。[16]
五、Fe(OH)2制备建议
关于白色Fe(OH)2制备实验改进方案的文献很多,大致从装置除氧气、试剂除氧气和操作除氧气三个方面展开讨论和设计。
1. 除氧方法
(1)装置除氧气。
简单的装置除氧气是采用溶液充满密闭空间,类似注射器反应器和稳定气体排除法等,文献往往采用通入N2或Ar的方法;实验室可以利用纯铁与稍过量的酸(盐酸或硫酸)反应制备新的亚铁盐,一方面可以排出溶液中的氧气,另一面也可以用H2排出装置中的氧气。
(2)试剂除氧气。
反应溶液如何除去氧气,这是制备的关键。最简单的办法是蒸馏水煮沸法,文献提出要对溶剂水进行去离子和去氧气处理,中学演示实验可以用一些简单方法替代。如氢气排除法、盐效应法等,盐效应法把试剂水换成NaCl浓溶液。另外还可以考虑提高亚铁溶液本身的稳定性,或者降低体系的还原能力。用(NH4)2FeSO4代替FeSO4或FeCl2。用浓氨水和Na2SO3代替NaOH溶液,氨水体系可以降低亚铁盐的氧化速率。
(3)操作除氧气。
在具体操作方面,为了尽可能减少与氧气的接触,可以考虑将溶液两两反应改为一种浓溶液和一种固体接触反应,如浓碱中加入固体亚铁盐,甚至可以采用固体表面结晶法,在亚铁盐表面生长Fe(OH)2。
总的来讲,诸多讨论和设计没有充分考虑中学课堂演示实验的特点、实验室专业制备的要求和基于Fe(OH)2与GRs二者的性质展开研究和设计。
2. 制备建议
实验室专业制备纯净白色的Fe(OH)2建议采用N2保护、水去离子和去氧气处理、膜电解法。课堂演示实验制备可以采用张元双老师介绍的硫酸亚铁表面固体生长法,该法操作简单,现象明显、独特。笔者重复了文献的方法,制备出的固体如图1(a)和(b)所示,图1(a)中FeSO4裸露,图1(b)中FeSO4用白色纱布包裹。本文结合演示实验的特点和基于对Fe(OH)2与 GRs二者性质的认识,设计一种简单、快速,课堂制备白色Fe(OH)2的方法:新亚铁盐浓碱法。
新亚铁盐浓碱法制备方法如下:①砂纸打磨过的铁丝绕成螺旋状放入3 mol/L的H2SO4溶液中。②煮沸已投入铁丝的H2SO4溶液,待pH接近3,冷却至50℃,即为新制备的FeSO4溶液。③另一试管中加入2 g NaOH固体,加入煮沸的蒸馏水5mL,冷却至50℃,即为新制备的NaOH溶液。④用长胶头滴管取新制FeSO4溶液滴入NaOH溶液中。⑤产生白色絮状沉淀迅速往上浮,立即滴入煮沸过的蒸馏水2mL,防止沉淀上浮到液面被氧化。这样可以得到悬浮在溶液中长时间维持稳定白颜色的Fe(OH)2絮状物,如图2所示。
静置半小时后白色沉淀聚沉到试管底部,白色氢氧化亚铁固体在溶液中能稳定存在数小时。课堂演示采用新亚铁盐法,演示效果贴近教材要求,两种新制备的溶液在课前准备好,能节省课堂时间。文献中介绍的硫酸亚铁表面固体生长法,可以作为对比实验让学生看到类似“钟乳石”状的氢氧化亚铁沉淀,缺点是时间需要长点,不太符合课堂常规演示的要求,但可以作为对比学习。
参考文献
[1] 张宏艳.基于X射线衍射分析方法改进氢氧化亚铁制备实验[J].化学教学,2021(5):77-81.
[2] 刘炎昭,潘益民,陈鹏.灰绿色Fe(OH)2成因的实验探析[J].中学化学教学参考,2014(9):51-52.
[3]吴文中.氢氧化亚铁变为灰绿色的理论探究——由一次意外的实验引起的思考与分析[J].化学教学,2016(9):60-63.
[4]张元双,许九奎,马薇.氢氧化亚铁的制备与氧化方法实验创新[J].中学化学教学参考,2020(21):47-48.
[5]Mayne, J E O. The Oxidation of Ferrous Hydroxide[J]. Journal of the Chemical Society, 1953:129-132.
[6]王小明.几种亚稳态铁氧化物的结构、形成转化及其表面物理化学特性[D].武汉:华中农业大学,2015.
[7]吴瑞华,刘琼林.Fe3+在蓝宝石中作用的研究[J].长春科技大学学报,2000(1):39-42.
[8]Fritsch, E. Letters[J]. Gems Gemology,1993(3):151.
[9]Nikolskaya, L V, Terekhova, V M, Samoilovich, M I. On the Origin of Natural Sapphire Color[J]. Physics and chemistry of Minercls, 1978(3):213-224.
[10]Leussing, D, Kolthoff, I. The Solubility Product of Ferrous Hydroxide and the Ionization of the Aquo-Ferrous Ion[J]. Journal of the American Chemical Society, 1953(75):2476-2479.
[11]J. A. 迪安. 兰氏化学手册(第二版)[M]. 魏俊发等译. 北京:科学出版社,2003.
[12]Shipico, F J, Douglas, D L. Stability of Ferrous Hydroxide Precipitates[J]. The Journal of Physical Chemistry, 1956(60):1519-1523.
[13]Castle, J E, Thompson, R G. Stability of Ferrous Hydroxide in Aqueous Suspension at 300℃[J]. Journal of Applied Chemistry, 1967(17):177-178.
[14]Evans, U R, Wanklyn, J N. Evolution of hydrogen from ferrous hydroxide[J]. Nature, 1948(162):27-28.
[15]张经坤,鲜于玉琼,亻儿音海.Fe(OH)2水悬浮液放氢机理的研究[J].高等学校化学学报,1982(4):567-569.
[16]吴美春.铁与水蒸气反应固体产物的实证分析[J].中学化学教学参考,2022(9):48-49.

