当归多糖对小鼠的抗疲劳作用研究


摘要:为研究当归多糖(Angelica polysaccharide,APS)对小鼠的抗疲劳作用,将试验小鼠随机分为游泳对照组、安静对照组和当归多糖高剂量组(750 mg·kg−1)、中剂量组500(mg·kg−1)、低剂量组(250 mg·kg−1),药物组给予28 d灌胃处理,对照组均给予等体积的生理盐水处理,测定各组小鼠体重变化及小鼠游泳试验后血尿素氮、血乳酸、肝糖原、肌糖原、脑内谷氨酸、脑内γ-氨基丁酸的含量变化。结果表明:ASP对小鼠体重无显著影响(P>0.05);各剂量组APS均能明显延长小鼠游泳的力竭时间(P<0.05);250~750 mg·kg−1剂量的ASP能减少小鼠运动后血乳酸和尿素氮的累积(P<0.01);低剂量APS能显著促进小鼠力竭运动60 min后脑内谷氨酸水平的升高和γ-氨基丁酸水平的下降(P<0.05),且随着APS剂量的增加,GLU/GABA比值增大;750 mg·kg−1剂量的APS对小鼠肝糖原的储备量有显著增强作用(P<0.05)。综上分析表明,一定剂量的当归多糖能有效降低小鼠中枢和外周疲劳。
关键词:当归多糖;抗疲劳;尿素氮;血乳酸;糖原
中图分类号:TS201.4文献标志码:A文章编号:0253−2301(2024)10−0043−06
DOI:10.13651/j.cnki.fjnykj.2024.10.007
曹树洪,官翔仪,朱晓皓,等.当归多糖对小鼠的抗疲劳作用研究[J].福建农业科技,2024,55(10):43−48.
Study on the Anti-fatigue Effect of Angelica Polysaccharide on Mice
CAO Shu-hong,GUAN Xiang-yi,ZHU Xiao-hao,ZHU Zhi-hao,TANG Bo,YANG Jun,XU Shi-jing*
(Bengbu College,Bengbu,Anhui 233000,China)
Abstract:In order to study the anti-fatigue effect of Angelica polysaccharide(APS)on mice,the experimental mice were randomly divided into the swimming control group,the sedentary control group,the high dosage group of polysaccharide(750 mg·kg−1),middle dosage group(500 mg·kg−1)and low dosage group(250 mg·kg−1).The mice in the drug group were treated with intragastric administration for 28 days,and the mice in the control group were treated with the same volume of normal saline.Then,the changes of body weight and the contents of blood urea nitrogen,blood lactic acid,hepatic glycogen,muscle glycogen,glutamic acid andγ-aminobutyric acid in the brain of mice in each group were measured after the swimming test.The results showed that ASP had no significant effect on the body weight of mice(P>0.05).APS in each dosage group could significantly prolong the exhaustive swimming time of mice(P<0.05).ASP at the dosage of 250−750 mg·kg−1 reduced the accumulation of blood lactic acid and urea nitrogen in mice after exercise(P<0.01).The low dosage of APS could significantly promote the increase of glutamic acid level and the decrease ofγ-aminobutyric acid level in the hindbrain of mice after the exhaustive exercise for 60 min(P<0.05),and the ratio of GLU to GABA increased with the increase of APS dosage.APS at the dosage of 750 mg·kg−1 significantly enhanced the storage of hepatic glycogen in mice(P<0.05).In conclusion,the analysis showed that a certain dose of angelica polysaccharide could effectively reduce the central and peripheral fatigue in mice.
Key words:Angelica polysaccharide;Anti-fatigue;Urea nitrogen;Blood lactic acid;Glycogen
疲劳是指运动能力和机体功能暂时下降的一种状态。现代医学表明机体长期处于疲劳状态将引发一系列生理问题和疾病。因此,抗疲劳相关的研究倍受关注,其主要聚焦于通过营养干预缓解疲劳,其中天然多糖组分具有良好的抗疲劳、抗氧化作用,可帮助机体迅速恢复疲劳状态下糖类的损耗。
大量研究表明,不同来源的多糖组分可能通过改变糖类和蛋白质代谢[1]、调节红细胞的携氧能力[2]、改善血清乳酸[3]、肌酸激酶[4]、脑内L-谷氨酸(Glutamate,Glu)和γ-氨基丁酸(Aminobutyric Acid,GABA)[5]等生化指标,减少氧化应激,提高抗氧化损伤的能力[6],进而达到抗疲劳的效果。当归作为一种生物活性广泛的伞形科植物,造血活血、抗炎、抗衰老、抗氧化、保肝护肾的功效成为中医领域的共识,其主要活性成分为多糖,但其是否具有抗疲劳效果,目前尚未证实。当归多糖(Angelica polysaccharide,APS)组分复杂,包含中性多糖、弱酸性多糖和果胶多糖,结构可以分为α和β两种类型。其中,α型结构是一种线性结构,由D-葡萄糖和L-阿拉伯糖交替排列而成,每个单糖分子之间通过1-4键连接。而β型结构则是一种支链结构,由D-葡萄糖、L-阿拉伯糖和D-半乳糖等单糖分子组成,其中的支链是由D-半乳糖分子连接而成的[7]。周涛[8]对当归多糖可能存在的构效关系进行了研究,结果显示多种结构的APS具有良好的体外抗氧化活性,且能对氧化损伤的Hep G2细胞产生一定的保护作用。但总体来讲,其体内抗疲劳的作用机制尚不十分清晰。本试验研究饲养小鼠28 d且连续口服当归粗多糖,在力竭运动过程中,小鼠的运动耐力、血乳酸、血尿素氮(Blood Urea Nitrogen,BUN)、肝糖原、肌糖原、脑内谷氨酸、脑内γ-氨基丁酸等指标的变化,评价APS抗疲劳作用及可能的作用机制,为APS在保健食品领域进一步的开发利用提供参考。
1材料与方法
1.1材料与试剂
SPF级KM系小鼠,雌雄各半,体质量(25±2)g,试验动物合格证号:NO.410000000000004008;当归多糖,纯度60%,购自陕西云奇生物科技有限公司,甘肃省岷县当归材料;γ-氨基丁酸,浙江一诺生物科技有限公司,CAS:56-12-2);L-(+)-乳酸标品,酷尔生物,CAS:79-33-4);健康盘片,批号:21953-15.9-0146-0227-55-200958-6665等);L-谷氨酸标准品,CAS:56-86-0;0.1%乙醛标准溶液,ZCB012021,广州检测科技有限公司;乙腈,色谱级;三氯乙酸、高氯酸、浓硫酸、蒽酮、无水乙醇,均分析纯,由国药沪试提供。
1.2仪器设备
752紫外可见分光光度计,上海菁华科技仪器有限公司;BS224S型电子天平,塞多利斯科学仪器有限公司;HH-2恒温水浴锅,淄博博纳科技有限公司;LC-LCE05D高速冷冻离心机,上海力辰仪器科技有限公司;FL9510气相色谱工作站,浙江福立分析仪器股份有限公司;SMT-120Pro全自动生化分析仪,天津微纳芯科技有限公司。
1.3试验方法
1.3.1动物分组及给药方式将试验小鼠按随机数字法分为5组,即当归多糖高剂量组(750 mg·kg−1)、中剂量组(550 mg·kg−1)、低剂量组(250 mg·kg−1)、游泳对照组和安静对照组(对照组均为生理盐水处理),每组20只,固定时间、等剂量灌胃给药,每日1次,连续灌胃28 d。
1.3.2不同剂量组小鼠体重的变化在小鼠的饲养管理周期,每7 d称量1次各组小鼠体重,高、中、低剂量组小鼠体重变化与对照组分别进行统计学的差异性分析,探索多糖灌胃剂量与小鼠体重变化之间的相关性。
1.3.3小鼠耐力的测定灌胃周期末次给药30 min后,进行力竭游泳试验和负重游泳。将小鼠置于28~30℃、水深30~40 cm的自制水槽中自由游泳,记录小鼠自游泳开始至沉没10 s仍不能浮出水面的时间,作为小鼠的力竭游泳时间[9]。负重游泳则是每只小鼠按小鼠体质量4%在其尾根部绑扎铅丝,记录自游泳开始至沉没10 s仍不能浮出水面的时间[10]。高、中、低剂量组小鼠力竭游泳时间、负重游泳时间分别与游泳对照组进行统计学的差异性分析。
1.3.4小鼠血乳酸含量测定小鼠力竭游泳90 min后,眼内眦静脉丛采血不低于2 mL,置于5 mL肝素钠抗凝Ep管中,8 000 r·min−1低温离心10 min,取上层血清20μL,加入10%三氯乙酸1.5 mL,调节pH 3~4,震荡混匀,3 000 r·min−1离心10 min,取上清液100μL,加入乙腈400μL及5μL 20%高碘酸,迅速混合均匀,制备为色谱待测液[11]。
乳酸标准曲线的制作:称取1 g乳酸标准品,溶于乙腈,定容至100 mL容量瓶,制成浓度为10 g·L−1储备液,稀释为1、2、3、4、5 mg·mL−1的标准溶液。该标准溶液同条件高碘酸处理后进行色谱分析。
乳酸色谱条件:KB-5色谱柱,0.32 mm,进样温度220℃,柱温40℃,分流比30∶1,尾吹30 mL·min−1,程序升温保持时间5 min,FID 200℃检测,进样1μL。
1.3.5小鼠脑GLU、GABA含量测定待测液的制备:药物组和游泳对照组的小鼠力竭游泳60 min,1 min内断头取整脑组织,称取1 g,加蒸馏水0.5 mL,匀浆,振摇1 min,再加蒸馏水3 mL,继续振摇1 min,在9 000 r·min−1、4℃的条件下离心10 min,取上清液0.22μm滤膜过滤作为待测溶液[12]。
γ-氨基丁酸标准曲线的制作:称取1 gγ-氨基丁酸标准品,制成浓度为10 g·L−1储备液,稀释为0.2、0.4、0.6、0.8、1.0 mg·mL−1的标准溶液。
L-谷氨酸标准曲线的制作:称取1 g L-谷氨酸标准品,制成浓度为10 g·L−1储备液,稀释为0.4、0.8、1.2、1.6、2.0 mg·mL−1的标准溶液。
色谱条件:γ-氨基丁酸检测时柱温60℃,L-谷氨酸柱温40℃,其他色谱条件相同,均为CD-WAX色谱柱,0.32 mm,进样温度220℃,分流比30∶1,尾吹30 mL·min−1,程序升温保持时间5 min,FID检测器,检测温度200℃,进样1μL。
1.3.6小鼠肝糖原、肌糖原测定小鼠力竭游泳60 min,立即处死小鼠,分别取肝脏200 mg、大腿肌肉组织1 g,碾碎,用0.9%生理盐水冲洗,吸干水分,放入3 mL 30%氢氧化钾溶液中,置沸水浴煮20 min,取出冷却后,转移至50 mL容量瓶中,用水多次冲洗,一并转入容量瓶,加水定容到刻度,摇匀。置沸水浴中10 min,冷却后用硫酸蒽酮比色法测定糖含量[13]。
1.3.7血尿素氮含量的测定小鼠力竭游泳90 min,休息60 min后采血,8 000 r·min−1离心10 min,分离出血清[14],立即采用全自动生化分析仪测定尿素氮含量。方法:健康盘片,进样100μL,具体操作见设备说明书。
上述色谱过程采用外标法分析,峰高与质量浓度线性回归,用GraphPad Prison 5统计软件处理,采用成组方差检验的方法。
2结果与分析
2.1 APS对小鼠体重变化的影响
由表1可知,连续灌胃28 d后,各组小鼠体重没有显著差异,表明250~750 mg·kg−1的APS对小鼠体重没有明显影响。此外,在给予受试物期间,小鼠没有不良反应,活动正常,没有出现异常死亡,表明当归多糖在250~750 mg·kg−1剂量范围内未发现有毒副作用。
2.2 APS对小鼠耐力的影响
由表2可知,与安静对照组相比,低剂量组小鼠负重游泳时间和力竭游泳时间均显著延长(P<0.05),中、高剂量组负重游泳时间和力竭游泳时间则极显著延长(P<0.01)。表明给予250 mg·kg−1以上剂量的APS可以明显延长小鼠力竭时间,提高运动耐力。
2.3 APS对脑GLU、GABA含量的影响
由表3可知,游泳对照组小鼠脑内GLU含量、GABA含量和GLU/GABA比值均极显著高于安静对照组(P<0.01)。这表明在经历疲劳运动60 min后,小鼠脑内的兴奋性神经地质GLU和抑制性神经递质GABA均增高。药物组小鼠脑内GLU含量高于游泳对照组,且低剂量组达显著水平(P<0.05),中、高剂量组达到极显著水平(P<0.01),表明给与250 mg·kg−1以上剂量的APS有助于提高小鼠力竭运动开始后的60 min内脑GLU水平,在一定程度上维持了小鼠的兴奋性,且剂量越高,GLU水平也越高,表明作用越强。
低剂量组小鼠GABA含量显著低于游泳对照组(P<0.05),中、高剂量组GABA含量则极显著低于游泳对照组(P<0.01),表明250~750 mg·kg−1的APS均有助于促进小鼠剧烈运动后脑内GABA水平的下降。刘雅娜等[15]在沙棘多糖对小鼠的抗疲劳作用研究中显示,GLU/GABA比值更能反应小鼠中枢的兴奋性,认为两者比值越高,抗疲劳能力越强。在本试验中,250~750 mg·kg−1剂量的APS能明显升高GLU/GABA比值,说明APS具有改善脑机能,推迟疲劳发生的作用。
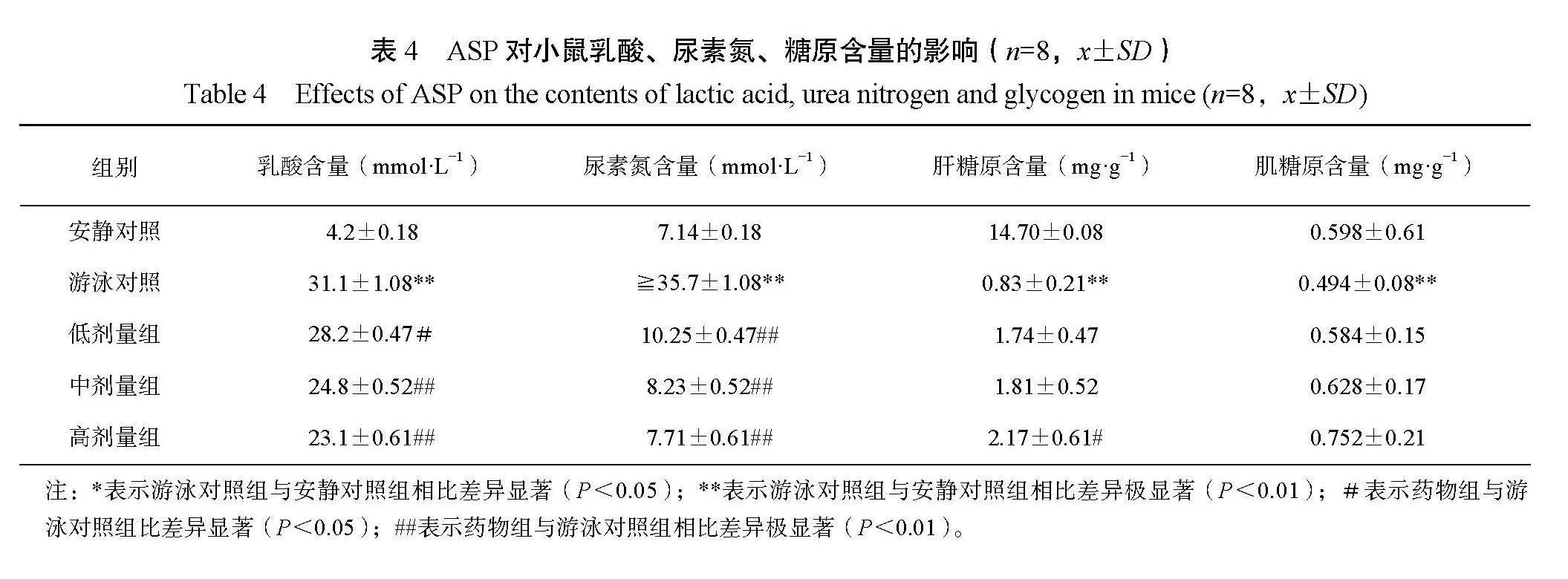
2.4 APS对血乳酸、尿素氮及糖原的影响
由表4可知,游泳对照组小鼠乳酸含量极显著高于安静对照组,表明在疲劳运动过程中,血液中存在明显的乳酸堆积。250 mg·kg−1剂量组的小鼠乳酸显著低于游泳对照组(P<0.05),500、750 mg·kg−1剂量组则极显著低于游泳对照组(P<0.01),表明在上述剂量范围内,APS有助于抑制血液中乳酸的堆积。乳酸是运动和保持体温而消耗热量的过程中产生的废弃物,超出正常值的范围,机体会有沉重、酸痛、疲劳的感觉。综上分析可知,APS能有效减少剧烈运动过程中血乳酸的生成。
采用生化自动分析仪测定血尿素氮含量,其医学参考范围为4.9~10.4 mmol·L−1。由表4可知,与安静对照组比,游泳对照组小鼠血中BUN水平极显著升高(P<0.01),且超出了健康小鼠的最大范围。表明小鼠在疲劳运动过程中,血液中的尿素氮水平持续升高,这可能与机体蛋白质的分解代谢加强有关。但是,给药组小鼠尿素氮水平均能维持在正常范围内,这表明持续给予超过250 mg·kg−1剂量的ASP能有效促进小鼠运动疲劳后BUN的清除,较快地降低至正常水平。
由表4可知,游泳对照组与安静对照组相比,肝糖原和肌糖原的水平均极显著降低(P<0.01);不同剂量组与游泳对照组相比,APS对小鼠运动后肌糖原的变化没有观察到显著影响,但是对于肝糖原而言,中、低剂量无影响,高剂量组糖原水平则显著高于游泳对照组(P<0.05)。结果表明,高剂量的APS有助于缓解小鼠运动过程中肝糖原水平的下降,对肌糖原的变化影响不明显。
3讨论与结论
外周运动疲劳的主要表现为代谢产物积累引起肌肉张力和运动耐力下降,血尿素氮和血乳酸含量越高,表明蛋白质分解代谢增加,机体处于缺氧状态,发生了糖的无氧酵解,生成大量的乳酸,引发疲劳和炎性因子的释放,自由基氧化损伤加重。中枢的疲劳则是大脑的兴奋性活动下降,可观察到脑内兴奋性氨基酸含量水平较低,抑制性氨基酸含量则增高,其中最具有代表性的兴奋性GLU和抑制性GABA的比值被认为在一定程度上可以反映机体的疲劳状态,比值越高,抗疲劳能力越强[16]。
本研究结果表明,连续服用不同剂量的APS对小鼠体重没有明显影响,但能有效降低小鼠剧烈运动后血乳酸和血尿素氮的积累,促进脑内GLU的升高和GABA的下降,提高两者比值。APS通过提高肝糖原的储备量,增加小鼠的运动耐力,且具有潜在的量效关系。给予250 mg·kg−1的剂量有助于减少血乳酸和尿素氮的堆积并提高耐力,有助于抑制疲劳过程中的脑内GLU的下降和GABA的上升,进而维持大脑的兴奋性;750 mg·kg−1剂量的APS能提高肝糖原的储备量,延迟疲劳的发生,连续服用28 d效果最佳。
虽然许多研究表明,APS可能是通过提高机体对运动负荷的适应能力、延迟疲劳的发生或者加速疲劳的消除等方面来发挥生物学活性,但是其作用机制可能并不仅限如此。武铮等[17]认为APS能通过抑制小鼠SA B Gal基因的表达,安方玉等[18]则认为APS能增强抗氧化损伤酶活性,这两种途径均能减少自由基的生成,提高衰老小鼠的抗氧化能力。阮治寰等[19]研究发现APS提取物能减少血乳酸的堆积,其作用机制是APS在正常范围内增加红细胞数量,减少IL-6的生成,进而减少炎性因子引发的细胞死亡;APS能提高血红蛋白Hb含量,且呈剂量依赖性增高,同时还能增强骨骼肌Hb的携氧能力和运输能力,提高机体对运动缺氧的抵抗力。但是刘芳等[20]在海带多糖对小鼠的抗疲劳研究结果中显示,多糖能显著提高Hb含量,但其作用并不随剂量增加而加强。
本研究中测定的各项数据,在力竭运动的时间上有固定性。实际上,在运动疲劳发生的不同时间阶段,随着耗氧状态的改变,机体的自我调节功能会发生变化,上述生化指标也会有较大波动。当归药理学活性虽然多,但在本试验中未观察到当归多糖对小鼠带来健康危害,表明APS应用到抗疲劳食品开发领域有潜在的应用价值。此外,上述各项生化指标之间的相关性以及当归多糖各组分的功能,尚值得进一步研究。
参考文献:
[1]PENG Y F,ZHAO L L,HU K,et al.Anti-Fatigue Effects of Lycium ba rbarum Polys accharide and Effervescent Tablets by Regulating Oxidativ e Stress and Energy Meta bolism in Rats[J].International Journal of Mo lec ular Sciences,2022,23(18):10920.
[2]SUN H H,SHU F,GUAN Y,et al.Study of anti-fatigue activity of polysaccharide from fruiting bodies of Armillaria gallica[J].International Journal of Biological Ma cromolecules,2023,241:124611.
[3]李佳凝,龙虎,蔡自建,等.熟地黄多糖的抗疲劳作用研究[J].生物化工,2021,7(5):71−74.
[4]乔德才,李许贞,杨东升,等.力竭运动前后活体大鼠纹状体谷氨酸和γ-氨基丁酸水平的动态变化[J].中国运动医学杂志,2011,30(10):921−925,971.
[5]刘兴龙,赵迎春,陈雪艳,等.黑参多糖抗疲劳作用的分子机制[J].食品科学,2020,41(5):173−179.
[6]NAI J J,ZHANG C,SHAO H L,et al.Extraction,structure,pharmacological activities and drug carrier applications of Angelica sinensis polysaccharide[J].International Jour nal of Biological Macromolecules,2021,7(183):2337−2353.
[7]张玉,王凯平.当归多糖的研究进展[J].中国药学杂志,2023,58(12):1065−1073.
[8]周涛.当归多糖分离分析、结构鉴定及生物活性的研究[D].武汉:华中科技大学,2018.
[9]续延军.白灵菇多糖对力竭运动大鼠抗疲劳及抗氧化作用探析[J].中国食用菌,2020,39(2):49−51.
[10]杨占群,王星慧,杨丽,等.黑糯玉米多糖对小鼠的抗疲劳作用及其机制的研究[J].粮食与油脂,2020,33(2):88−90.
[11]姜吉刚.气相色谱法测定小鼠血清中乳酸的含量[J].广东化工,2018,22(45):105−106.
[12]徐小平,郭平,宋玉如,等.脑内γ-氨基丁酸的毛细管气相色谱测定法[J].华西药学杂志,1990,5(2):107−109.
[13]陈津津,冯嘉诚.杏鲍菇多糖的抗疲劳活性研究[J].中国食用菌,2020,39(4):46−48.
[14]熊勃,聂玉芝,吴珍,等.中药沙苑子抗疲劳作用研究[J].西北大学学报(自然科学版),2017,47(1):87−91.
[15]刘雅娜,包晓玮,王娟,等.沙棘多糖抗运动性疲劳及抗氧化作用的研究[J].食品工业科技,2021,42(10):321−326.
[16]顾坤.γ-氨基丁酸与运动疲劳的相关性研究[J].食品安全质量检测学报,2021,12(8):3153−3158.
[17]武铮,程木子,安士恩,等.当归多糖对D-半乳糖致衰老模型小鼠的影响[J].中国临床药理学杂志,2021,37(12):1577−1580.
[18]安方玉,刘雪松,李雪燕,等.当归多糖对衰老模型小鼠胸腺指数、脑组织SOD活性的影响及其抗疲劳作用[J].中医研究,2013,26(10):78−80.
[19]阮治寰,杜丝雨,张桓硕,等.当归提取物对小鼠抗疲劳抗氧化作用的研究[J],黄河科技学院学报,2021,5,23(5):73−77.
[20]刘芳,李卓能,庞雅琴,等.海带多糖对小鼠动脉血气影响及其抗疲劳作用[J].中国公共卫生,2003(12):58−59.
(责任编辑:林玲娜)

