乳酸菌素PlnJ(G5)缓解LPS诱导肠上皮细胞及小鼠肠道炎症的作用机制


摘要:为探索实验室前期改造保存的乳酸菌素PlnJ(G5)对脂多糖LPS诱导下肠上皮细胞IPEC-J2与小鼠肠道炎症的作用机制。选取肠上皮细胞IPEC-J2及模式动物小鼠作为研究载体,利用LPS建立炎症模型,并通过添加PlnJ(G5)进行处理,采用cck-8检测细胞活力以及实时荧光定量PCR检测炎症相关细胞因子的表达变化。结果表明:5.0μg·mL−1的LPS对IPEC-J2细胞活力的影响较小,且该浓度作用下IPEC-J2细胞IL-1、IL-6、TNF-α、IFN-α及IFN-β的mRNA表达量显著高于空白对照组,证明LPS对IPEC-J2细胞致炎造模成功;CCK-8检测结果显示PlnJ(G5)对IPEC-J2细胞的安全添加剂量为20.0μg·mL−1;qPCR检测结果表明IPEC-J2细胞在经5.0μg·mL−1的LPS作用4 h后,添加20.0μg·mL−1未经热处理的PlnJ(G5)对IL-1、IL-6、TNF-α、IFN-α及IFN-β的mRNA表达量的抑制效果最佳;添加乳酸菌素处理对LPS诱导模式动物小鼠肠炎试验发现灌服未经热处理的PlnJ(G5),对小鼠的抗炎效果最好。
关键词:乳酸菌素;脂多糖;诱导;肠上皮细胞;炎症
中图分类号:S852文献标志码:A文章编号:0253−2301(2024)10−0036−07
DOI:10.13651/j.cnki.fjnykj.2024.10.006
许丽惠,严梦涵,王全溪.乳酸菌素PlnJ(G5)缓解LPS诱导肠上皮细胞及小鼠肠道炎症的作用机制[J].福建农业科技,2024,55(10):36−42.
Mechanism of Lactobacillin PlnJ(G5)on Alleviating the Intestinal Epithelial Cells and IntestinalInflammation in Mice Induced by LPS
XU Li-hui,YAN Meng-han,WANG Quan-xi*
(College of Animal Science,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
Abstract:In order to explore the mechanism of lactobacillus PlnJ(G5)modified and preserved in the laboratory on the intestinal epithelial cells IPEC-J2 and the intestinal inflammation in mice induced by lipopolysaccharide LPS,the intestinal epithelial cell IPEC-J2 and model animal mice were selected as the research carriers.LPS was used to establish an inflammatory model,and PlnJ(G5)was added for the treatment.Then,the cell viability was detected by cck-8 and the expression changes of inflammatory cytokines was detected by the real-time fluorescence quantitative PCR.The results showed that 5.0μg·mL−1 LPS had little effect on the cell viability of IPEC-J2,and the mRNA expression levels of IL-1,IL-6,TNF-α,IFN-αand IFN-βin IPEC-J2 cells treated with this concentration were significantly higher than those in the blank control group,which proved that the inflammatory model of IPEC-J2 cells induced by LPS was successful.The results of CCK-8 detection showed that the safe additive dosage of PlnJ(G5)for IPEC-J2 cells was 20.0μg·mL−1.The results of qPCR detection showed that after IPEC-J2 cells treated with 5.0μg·mL−1 LPS for 4 h,the addition of 20.0μg·mL−1 unheated PlnJ(G5)had the best inhibitory effect on the mRNA expression of IL-1,IL-6,TNF-α,IFN-αand IFN-β.The experimental results showed that PlnJ(G5),which was not heat treated,had the best anti-inflammatory effect on mice induced by LPS.
Key words:Lactobacillin;Lipopolysaccharide;Induce;Intestinal epithelial cells;Inflammation
肠道不仅是畜禽获取营养物质的主要器官,也是畜禽机体很重要的天然黏膜免疫器官,可在病原入侵机体时发挥重要的阻挡作用[1]。在畜禽的整个饲养过程中,畜禽所受到的各种应激易对肠道的黏膜屏障造成不同程度的损伤而产生炎症。随着“禁抗令”的全面实施,寻求饲料中抗生素替代品以维持畜禽的肠道健康已成为当前的研究热点,乳酸菌微生态制剂作为替抗产品的重要一员,其研究应用也得到了广泛的开展。
目前关于乳酸菌对宿主健康的有益作用主要通过抑制病原体的繁殖[2]、改善肠道黏膜上皮的屏障功能[3−4]、诱导机体的免疫调节[5]等途径发挥作用。现有研究表明乳杆菌具有应对机体炎症反应的潜力,可降低炎症细胞白细胞介素1β(Interleukin-1β,IL-1β)、白介素-6(Interleukin-6,IL-6)的分泌[6],且多种乳杆菌已被证明可通过抑制促炎细胞因子肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、IL-6、干扰素-γ(Interferon-γ,IFN-γ)的表达而发挥抗炎作用[7]。Jang等[8]研究也表明乳杆菌可以通过抑制IL-1β、IL-6与TNF-α的分泌从而缓解小鼠的肠炎。而有关乳杆菌分泌产生的乳酸菌素的针对性研究报道并不多见。本实验室保存有前期经耐热性改造的乳酸菌素PlnJ(G5)[9],其在机体炎症发生时所发挥的作用机制尚不清晰。本研究从细胞水平(肠上皮细胞IPEC-J2)、模式动物水平(小鼠)两个方面阐明乳酸菌素PlnJ(G5)对LPS诱导炎症损伤的保护机制,为PlnJ(G5)在畜禽生产中的应用提供重要理论依据。
1材料与方法
1.1试验材料
猪肠上皮细胞(IPEC-J2)由本实验室保存,ICR清洁级小鼠购自福州言蹊生物科技有限公司。
1.2仪器与试剂
1.2.1主要仪器超净台购自苏州安泰空气技术有限公司,二氧化碳培养箱购自青岛海尔生物医疗股份有限公司,酶标仪购自上海帝肯实验器材有限公司,实时荧光定量PCR仪购自北京罗氏生物科技发展有限公司。
1.2.2主要试剂乳酸菌素PlnJ、改造后乳酸菌素PlnJ(G5)均为本实验室前期体外表达得到,蛋白浓度均调整至0.45 mg·mL−1。DMEM/F12完全培养液购自美国Gibco公司,脂多糖(LPS)购自美国Sigma公司,总RNA提取试剂盒购自北京全式金生物技术有限公司,Promega反转录试剂盒购自北京普洛麦格生物技术有限公司,CCK-8试剂盒购自美国APE×BIO公司。
1.3试验方法
1.3.1 IPEC-J2细胞的复苏与培养将存有猪小肠上皮细胞(IPEC-J2)的细胞冻存管从液氮罐取出后于37℃水浴锅中解冻;待冻存液完全融化后擦干管外的水珠,于4℃离心机中1 000 r·min−1离心5 min;离心结束后弃去上清,加入DMEM/F12完全培养液将管中细胞重悬后,转移至细胞培养瓶中,补足培养液后置于37℃、5%CO2培养箱中培养,待细胞密度达80%以上进行传代培养备用。
1.3.2 LPS对IPEC-J2细胞活力的影响试验分组:空白对照组(不含细胞,100μL细胞培养基+10μLCCK-8)、0加药组(细胞+100μL细胞培养基+10μL CCK-8)、LPS药物处理组(细胞+100μL细胞培养基+10μL CCK-8+0.1、0.5、1.0、5.0或10.0μg·mL−1LPS)。在96孔板中加入的细胞数量约1×104个·孔−1,每个处理组设3个平行孔,置于37℃、5%CO2培养箱培养至细胞贴壁后。按试验分组加入等量相应浓度的LPS对PEC-J2细胞进行处理,每个处理孔加入CCK-8后,37℃孵育4 h后,使用酶联免疫检测仪检测其在450 nm的吸光值。
1.3.3 qPCR检测LPS诱导IPEC-J2细胞相关细胞因子mRNA表达量的影响按1.2.2的方法再培养一批细胞后用RNA提取试剂盒提取细胞总RNA,用于荧光定量PCR(qPCR)试验。
用表1中的引物(由北京擎科生物技术公司合成)进行扩增,扩增体系为20μL:模板2μL、上下游引物各1μL、预混液10μL、无菌水6μL,扩增条件为:预变性95℃5 min,循环条件:95℃5 s,60℃30 s,72℃15 s,循环数为45;72℃延伸5 min。选用β-actin作为内参基因,用2−△△CT进行计算IL-1、IL-6、TNF-α、IFN-α、IFN-βmRNA的相对表达量,试验重复数为3。
1.3.4 PlnJ(G5)对IPEC-J2细胞活力的影响试验设计分组如下:空白对照组(不含细胞,100μL细胞培养基+10μL CCK-8)、0加药组(细胞+100μL细胞培养基+10μL CCK-8)、添加PlnJ(G5)处理组(细胞+100μL细胞培养基+10μL CCK-8+5、10、20、40、80或160μg·mL−1 PlnJ(G5))。方法同1.2.2。1.3.5 PlnJ(G5)对LPS处理下IPEC-J2细胞相关细胞因子mRNA表达量的影响根据1.2.2、1.2.3和1.2.4筛选出来的最适PlnJ(G5)和LPS作用剂量,检测PlnJ(G5)对LPS处理下IPEC-J2细胞相关细胞因子mRNA表达量的影响。用5.0μg·mL−1的LPS对IPEC-J2细胞刺激处理4 h后,弃去LPS后,按空白对照组(无LPS刺激处理)、阳性对照组(不加PlnJ(G5)处理)、未经热处理的PlnJ(G5)(20.0μg·mL−1)、100℃加热30 min处理的PlnJ(G5)20.0μg·mL−1对IPEC-J2细胞继续处理4 h后,收集各处理组细胞,经RNA提取试剂盒提取细胞总RNA,用于后续荧光定量PCR检测。
荧光定量PCR检测的引物序列、反应体系及条件参照1.2.3。
1.3.6 PlnJ(G5)对LPS处理下小鼠肠道相关细胞因子mRNA表达量的影响将30只体重在20±2 g的ICR雌性小鼠,随机分成5组,每组6个重复,试验处理为空白对照组、LPS处理组、LPS+PlnJ(100℃热处理30 min)组、LPS+PlnJ(G5)组、LPS+PlnJ(G5)(100℃热处理30 min)组,PlnJ及PlnJ(G5)经处理后调整浓度至0.02 mg·mL−1,每天每只小鼠的灌喂量为0.5 mL,空白对照组、LPS处理组均灌服同等剂量的灭菌PBS,连续灌服7 d后,于第8 d给空白对照组腹腔注射200μL的灭菌生理盐水、其余处理组均腹腔注射200μL浓度为1μg·uL−1的LPS,注射24 h后,对小鼠经断颈处理后,无菌获取小鼠结肠组织用于炎症细胞因子mRNA的检测。
荧光定量PCR检测的引物序列、反应体系及条件参照1.3.3。
1.3.7数据处理数据使用Excel 2021进行计算处理,数据以平均值±标准偏差作图,使用SPSS软件以one-way ANOVA方法进行显著性分析,P<0.05表示为差异显著。
2结果与分析
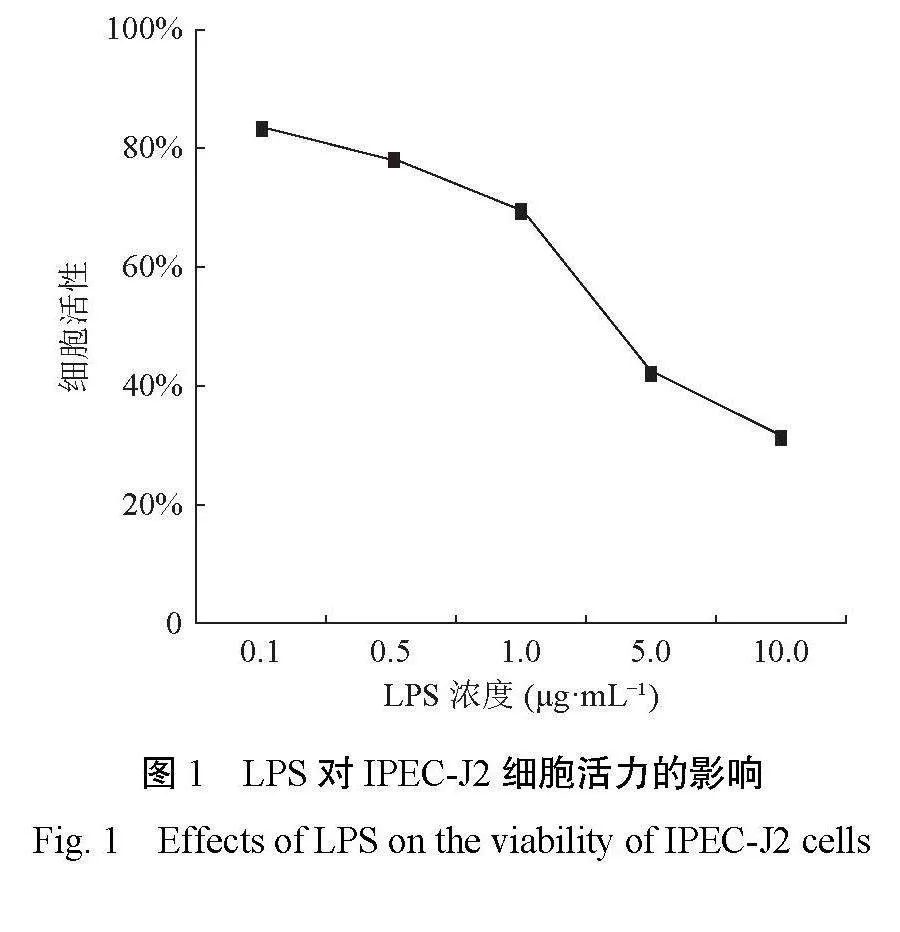
2.1 LPS对IPEC-J2细胞活力的影响
由图1可知,当LPS浓度在0.1~1.0μg·mL−1范围内,IPEC-J2细胞活力都在60%以上,但当LPS浓度上升为5.0μg·mL−1时,其细胞活力在40%左右,而LPS浓度达到10.0μg·mL−1时,细胞活性则降到40%以下,影响较大。
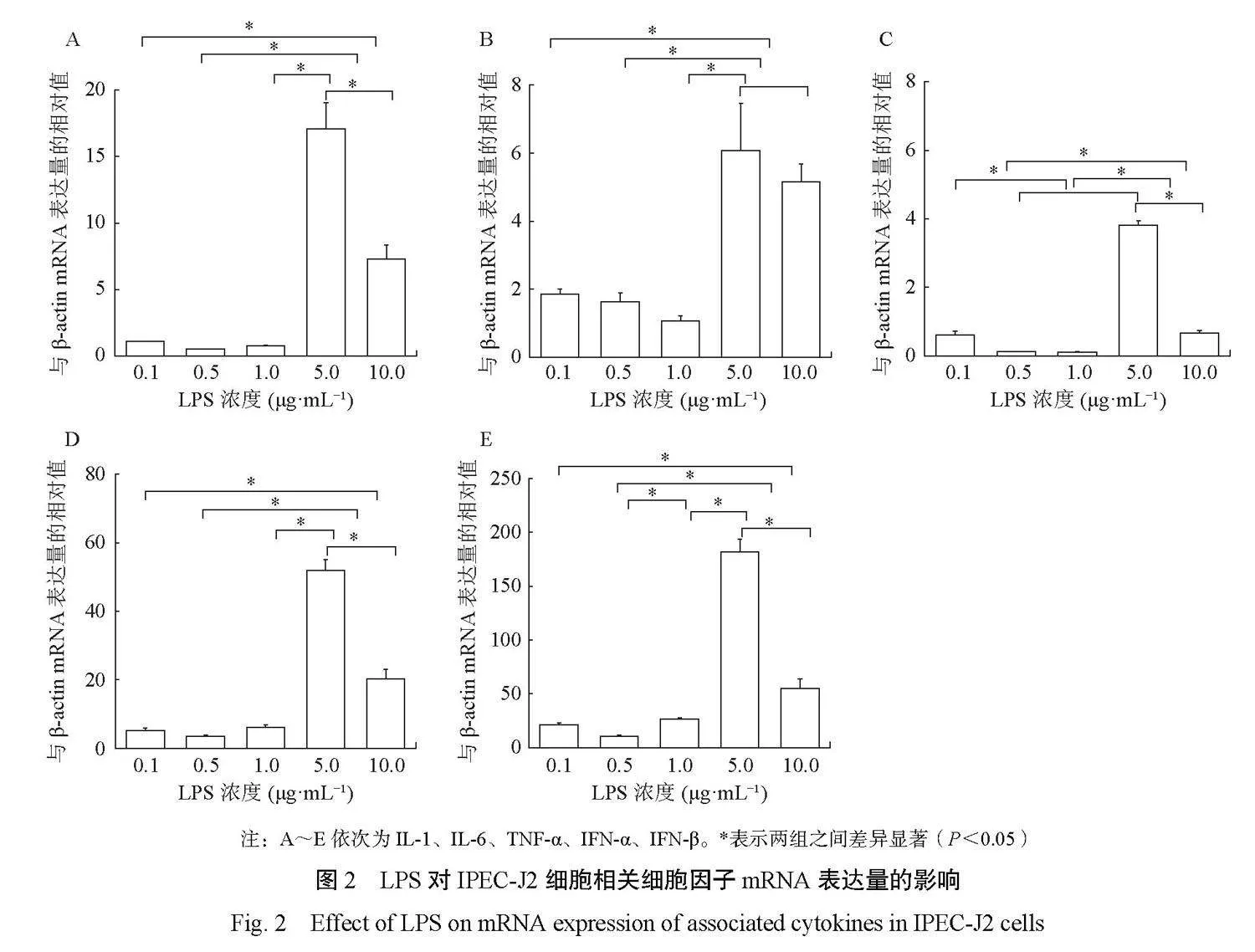
2.2 qPCR检测LPS对IPEC-J2细胞相关细胞因子mRNA表达量的影响
将不同浓度的LPS作用IPEC-J2细胞4 h后,收集细胞,检测其炎性细胞因子IL-1、IL-6、TNF-α、IFN-α、IFN-β的mRNA表达量,由图2(A-E)可知,当LPS浓度为5.0μg·mL−1时,炎性细胞因子的mRNA表达量显著上调,LPS浓度为10.0μg·mL−1和5.0μg·mL−1相比炎性细胞因子的mRNA表达量显著性降低。因此,选择5.0μg·mL−1的LPS来建立炎症细胞模型。
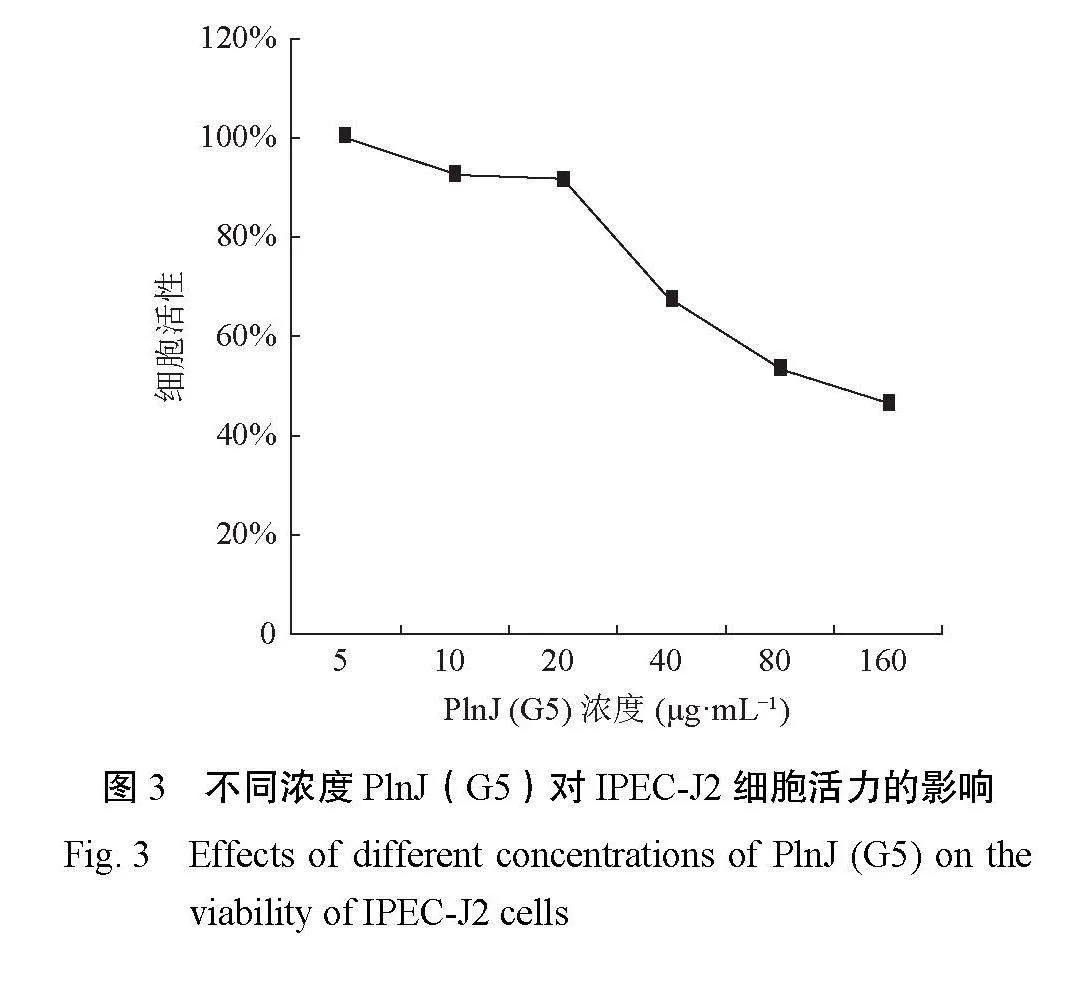
2.3 PlnJ(G5)对IPEC-J2细胞活力的影响
由图3可知,当PlnJ(G5)的浓度低于(含)20μg·mL−1时,IPEC-J2细胞的活力均在80%以上,说明其对细胞的培养影响不大,但当其浓度达到40μg·mL−1以上,IPEC-J2细胞的活力迅速降到60%左右甚至更低,说明其对细胞的培养产生了不利影响。因此,选择20μg·mL−1的PlnJ(G5)作为后续试验的使用浓度。
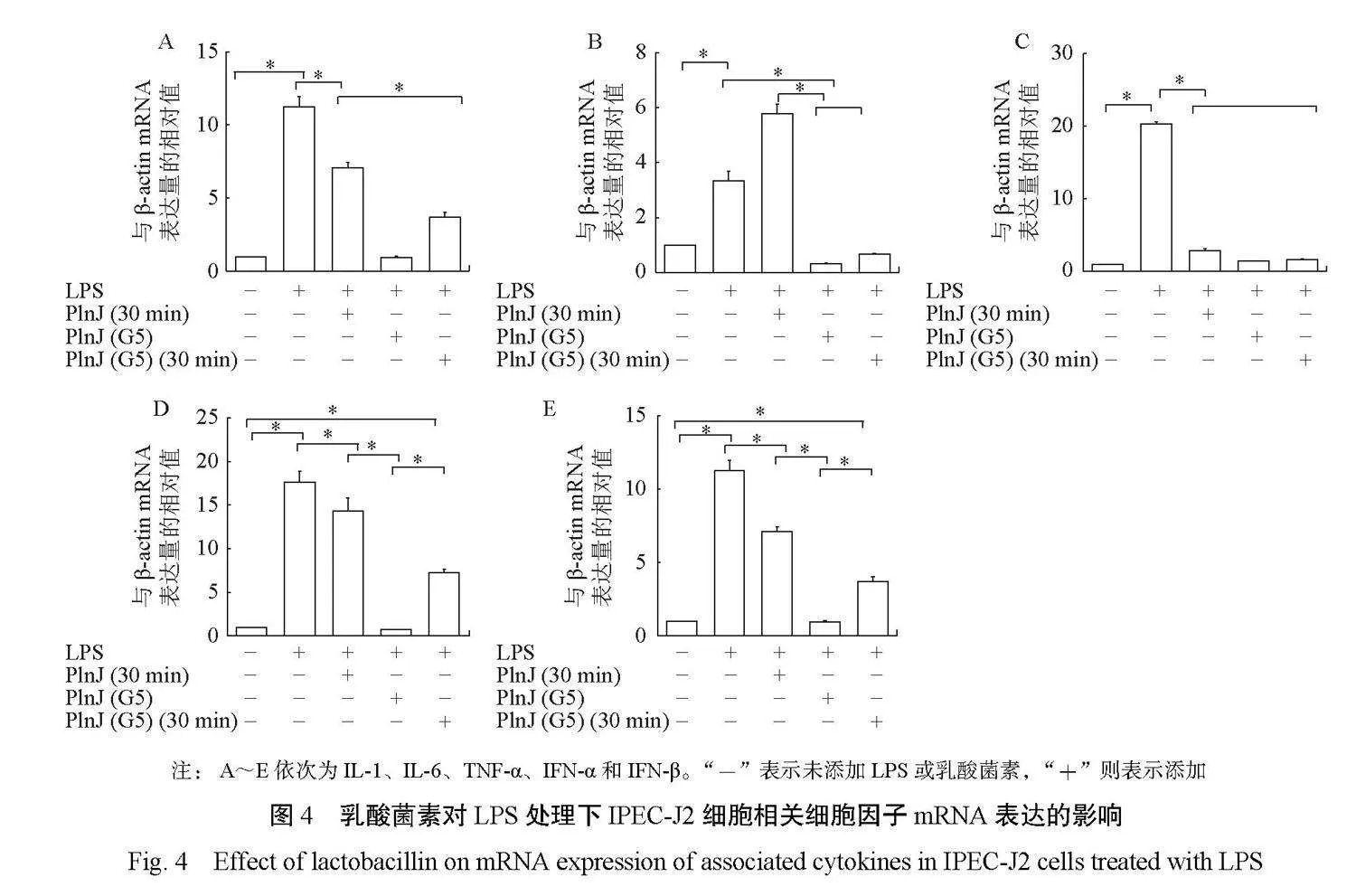
2.4 PlnJ(G5)对LPS处理下IPEC-J2细胞相关细胞因子mRNA表达量的影响
由图4可知,同LPS处理组相比,添加PlnJ(G5)(未加热或加热)的处理组对IL-1、TNF-α、IFN-α、IFN-β的mRNA水平表达量均起到了抑制(r<0.05),说明PlnJ(G5)均对LPS作用下的IPEC-J2细胞具有保护作用,但加热处理对其仍有一定影响。PlnJ与PlnJ(G5)在同样进行100℃加热30 min的处理后,PlnJ(G5)对IL-1、IL-6、TNF-α、IFN-α的mRNA水平表达量更低(r<0.05),说明了PlnJ(G5)的耐热性能得到了提升。
2.5 PlnJ(G5)对LPS处理下小鼠肠道相关细胞因子mRNA表达量的影响
由图5可知,同LPS处理的小鼠相比较,饲喂不同处理的乳酸菌素试验组的炎性因子IL-1、IFN-α、TNF-α的mRNA表达水平均受到了显著抑制(P<0.05)。在100℃加热30 min处理下,与饲喂PlnJ处理组相比,PlnJ(G5)处理组在对IL-1、IL-6、TNF-α、IFN-α、IFN-β的mRNA表达水平抑制作用显著(P<0.05),说明PlnJ(G5)保持了对炎性因子的抑制作用。而同未经加热处理的PlnJ(G5)相比,经加热处理后的PlnJ(G5)在对炎性因子IL-1、IL-6、TNF-α的mRNA表达抑制效果并无差异,这说明基因改造可以较好地在高温条件下维持其在加热处理前的活性。
3讨论
肠道对动物机体来说不仅仅是重要的消化吸收器官,同时也是重要的免疫器官,其健康程度对动物的生长态势具有重要的影响。随着集约化养殖的飞速发展,畜禽在高密度养殖环境中更易受到不良应激以及病原体的侵袭,引起肠道炎症,使机体的营养消化吸收受阻,造成生长性能降低,甚至导致死亡,引发经济损失[10]。脂多糖(LPS)亦称内毒素,是革兰氏阴性菌(G-)外膜的重要组成[11]。研究表明低剂量的LPS在动物体内的暴露,可经紧密连接使肠道的通透性增加,进而诱发肠道炎症的发生,可用于肠道功能障碍模型的建立[12]。杨丽萍[13]、刘燕蓉[14]等均采用LPS建立肠道损伤模型进行研究。本研究利用不同浓度的LPS处理IPEC-J2细胞,细胞存活率及炎症因子mRNA表达量的检测结果均表明当添加的LPS浓度为5.0μg/mL时,IL-1、IL-6、TNF-α、IFN-α、IFN-β的mRNA表达量显著增加,这与孙丽[15]等的研究结果相似,可以建立较好的炎症模型。
LPS可激发炎症反应的发生,引起机体免疫系统的紊乱,刺激免疫细胞分泌过量的炎性因子如IL-1β,IL-6、TNF-α等[16−17]。TNF-α既可以提升中性粒细胞的吞噬功能,激活相关的信号传导,促进内皮细胞分泌IL-1α和IL-6,也会加剧机体炎症反应[18−19];还可以协同IL-1β一起诱导内皮细胞表达黏附分子,对白细胞的黏附起到促进作用,进而加重肠道组织的损伤[20−21]。干扰素IFN作为糖蛋白不仅具有抗病毒作用,还具有免疫调节作用,炎症反应可促进IFN的分泌。
在探讨耐热性改造的乳酸菌素PlnJ(G5)作用于IPEC-J2细胞的安全浓度试验中,筛选得出PlnJ(G5)对IPEC-J2细胞的最佳处理浓度为20.0μg·mL−1。细胞试验中,将浓度均为20.0μg·mL−1的PlnJ(加热30 min)、PlnJ(G5)、PlnJ(G5)(加热30 min)作用于经LPS浓度为5.0μg·mL−1处理的IPEC-J2细胞,结果表明乳酸菌素均可抑制LPS诱导的IL-1、IL-6、TNF-α、IFN-α、IFN-βmRNA水平,虽然加热30 min的PlnJ(G5)效果不如未做加热处理的PlnJ(G5),但仍优于做加热30 min处理的PlnJ,说明PlnJ(G5)耐热性得到提高,可保持其良好的功能。动物试验中,乳酸菌素对LPS刺激下的IL-1、IL-6、TNF-α、IFN-α、IFN-βmRNA水平也均起到了抑制作用,说明经PlnJ(G5)在100℃加热处理30 min后仍保持了较好的蛋白活性。
4结论
PlnJ(G5)能够显著抑制LPS诱导的炎症因子IL-1、IL-6、TNF-α及Ⅰ型干扰素mRNA的表达,可作为PlnJ(G5)在畜禽生产中应用的理论基础。
参考文献:
[1]FAWKNER-CORBETT D,ANTANAVICIUTE A,PARIKH K,et al.Spatiotemporal analysis of human intestinal development at single-cell resolution[J].Cell,2021,184(3):810−826(e23).
[2]KIM Y,KIM S H,WHANG K Y,et al.Inhibition of Escherichia coli O157:H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells[J].Journal of Microbiology and Biotechnology,2010,18(7):1278−1285.
[3]SUEZ J,ZMORA N,SEGA E,et al.The pros,cons,and many unknowns of probiotics[J].Nature Medicine,2019,25(5):716−729.
[4]王丽君,徐静雅,赖欣宇,等.乳酸菌素对肉鸡生长性能、血清指标和肠道健康的影响[J].动物营养学报,2024,36(2):908−920.
[5]RABIA A,NAGENDRA P S.Immune system stimulation by probiotic microorganisms[J].Critical Reviews in Food Science and Nutrition,2014,54(7):938−956.
[6]崔鹏月,彭灿,刘松玲,等.具有潜在改善炎症反应益生菌的筛选[J].食品工业科技,2020,41(9):314−319.
[7]JANG S E,MIN S W.Lactobacillus sakei S1 Improves Colitis Induced by 2,4,6-Trinitrobenzene Sulfonic Acid by the Inhibition of NF-κB Signaling in Mice[J].Journal of Microbiology and Biotechnology,2020,30(1):71−78.
[8]DOTAN I,RACHMILEWITZ D.Probiotics in inflammatory bowel disease:Possible mechanisms of action[J].Current Opinion in Gastroenterology,2005,21(4):426−430.
[9]严梦涵,许丽惠,游泽龙,等.乳酸菌素PlnJ第5位氨基酸(赖氨酸)定点突变对其热稳定性的影响[J].福建农林大学学报(自然科学版),2023,52(4):546−553.
[10]娄文芳,吕承勇,郭浩能,等.呕吐毒素和T-2毒素对热应激蛋鸡产蛋性能、肠道抗氧化及免疫功能的影响[J].中国家禽,2023,45(4):44−49.
[11]付玉蓉.槲皮素缓解玉米赤霉烯酮与脂多糖联合作用对MAC-T和IPEC-J2细胞损伤的研究[D].长春:吉林大学,2023.
[12]GIL-CARDOSO K,COMITATO R,GINÉS I,et al.Protectiveeffect of proanthocyanidins in a rat model of mild intestinal inflammation and impaired intestinal permeability induced by LPS[J].Molecular nutrition&food research,2019,63(8):e1800720.
[13]杨丽萍,宋娜丽,陈普,等.地榆对脂多糖诱导的肠道屏障损伤模型的保护作用[J].世界科学技术(中医药现代化),2022,24(12):4969−4976.
[14]刘燕蓉.丁香酚缓解LPS诱导的仔猪肠道炎症作用[D].杨凌:西北农林科技大学,2023.
[15]孙丽,夏日炜,殷学梅,等.LPS诱导条件下猪小肠上皮细胞TLR4及其信号通路基因表达变化分析[J].畜牧兽医学报,2015,46(7):1095−1101.
[16]TIAN M Y,LI K,LIU R N,et al.Angelica polysaccharide attenuates LPS-induced inflammation response of primary dairy cowclaw dermal cells via NF-κB and MAPK signaling pathways[J].BMC Veterinary Research,2021,17(1):1−9.
[17]WANG Z,LIANG Y,YU J,et al.Guchang Zhixie Wan protects mice against dextran sulfate sodium-induced colitis through modulating the gut microbiota in colon[J].Journalof Ethnopharmacology,2020,260:112991.
[18]黄显辉,张炎,胡美娜,等.TNF-α敲除对创伤弧菌血流感染小鼠肝脏和脾脏中性粒细胞的影响[J].中华微生物学和免疫学杂志,2020,40(5):365−371.
[19]ARTONO,BAKTI S,NYILO P,et al.The association of IL-1 alpha level and TNF alpha expressions on bone destruction in chronic suppurative otitis media and cholesteatoma[J].Indian Journal of Otolaryngology&Head&Neck Surgery,2020,72(1):1−7.
[20]WANG L L,AN J,SONG S N,et al.Electroacupuncture preserves intestinal barrier integrity through modulating the gut microbiota in DSS-induced chronic colitis[J].Life sciences,2020,261:118473.
[21]SHI L,DAI Y,JIA B Y,et al.The inhibitory effects of Qingchang Wenzhong granule on the interactive network of inflammation,oxidative stress,and apoptosis in rats with dextran sulfate sodium-induced colitis[J].Journal of cellular biochemistry,2019,120(6):9979−9991.
(责任编辑:柯文辉)

