肺炎克雷伯菌肝脓肿小鼠模型的建立

摘要:为构建稳定可靠的肺炎克雷伯菌肝脓肿(KPLA)动物模型,选取18 g左右健康ICR小鼠,以高毒力动物源肺炎克雷伯菌临床分离株KP001为造模菌株,分别从接种方式(灌胃、滴鼻和腹腔注射,接种菌数为1×107 CFU)和接种剂量进行摸索,并对造模成功小鼠的血清样品进行谷丙转氨酶、谷草转氨酶、碱性磷酸酶、γ-谷氨酰转移酶、白蛋白、乳酸脱氢酶、总胆红素等生化指标的测定。结果表明:灌胃小鼠存活率100%,但肝脏未出现脓肿;滴鼻小鼠死亡率100%,肺脏病变明显,40%死亡小鼠肝脏出现脓肿;腹腔注射1×106 CFU细菌后,小鼠存活率为75%以上,且存活小鼠肝脏均出现脓肿,成模率100%。病理切片显示造模成功小鼠肝细胞排列紊乱,中央静脉周围有大量炎性细胞浸润。生化指标检测显示,与对照小鼠相比,造模成功小鼠的血清样品中γ-谷氨酰转移酶极显著升高(P<0.01),碱性磷酸酶极显著下降(P<0.01),谷丙转氨酶、白蛋白显著下降(P<0.05)。综上分析表明,通过腹腔注射方式,接种1×106 CFU KP001菌株后可成功构建KPLA小鼠模型,γ-谷氨酰转移酶和碱性磷酸酶等生化指标可用于评估模型建立效果。
关键词:肺炎克雷伯菌;肝脓肿;动物模型;生化指标
中图分类号:S575.4文献标志码:A文章编号:0253−2301(2024)10−0029−07
DOI:10.13651/j.cnki.fjnykj.2024.10.005
陈紫怡,路佳臻,万兆丰,等.肺炎克雷伯菌肝脓肿小鼠模型的建立[J].福建农业科技,2024,55(10):29−35.
Establishment of the Mouse Model of Klebsiella pneumoniae Liver Abscess
CHEN Zi-yi1,LU Jia-zhen1,2,WAN Zhao-feng1,WEN Hui-ya1,2,WEI Jing-yun1,ZHANG Xin-yi1,ZENG Xu-jian1,HUANG Cui-qin1,3*,BAO Yin-li1,3*
(1.College of Life Science,Longyan University,Longyan,Fujian 364012,China;2.College of Animal Science,FujianAgriculture and Forestry University,Fuzhou,Fujian 350002,China;3.Fujian University Engineering Research Centerfor the Prevention and Control of Animal Original Zoonosis,Longyan,Fujian 364012,China)
Abstract:In order to construct a stable and reliable animal model of Klebsiella pneumoniae liver abscess(KPLA),about 18 g healthy ICR mice were selected,and the highly virulent animal-derived Klebsiella pneumoniae clinical isolated strain KP001 was used as the model strain.Then,the inoculation methods(including the gastric irrigation,nasal drip and intraperitoneal injection,with the number of inoculated bacteria was 1×107 CFU)and the inoculation dosage were explored.The biochemical indexes of serum samples from the mice with successful modeling were determined,including the alanine aminotransferase,aspartate aminotransferase,alkaline phosphatase,γ-glutamyl transferase,albumin,lactate dehydrogenase,and total bilirubin.The results showed that the survival rate of mice treated with gastric irrigation was 100%,but there was no abscess in the liver.The mortality rate of mice treated with nasal dripping was 100%,with obvious lung lesions,and the liver abscess occurred in 40%of the dead mice.After the intraperitoneal injection of 1×106 CFU bacteria,the survival rate of mice was more than 75%,and the liver abscesses appeared in the surviving mice,with the modeling rate of 100%.The pathological sections showed that the liver cells of the successfully modeled mice arranged in disorder,and a large number of inflammatory cells infiltrated around the central vein.The detection of biochemical indicators showed that compared with the control mice,theγ-glutamyl transferase in the serum samples of the successfully modeled mice was significantly increased(P<0.01),the alkaline phosphatase was significantly decreased(P<0.01),and the alanine aminotransferase and albumin were significantly decreased(P<0.05).In conclusion,the analysis showed that the KPLA mouse model could be successfully construct-ed by the intraperitoneal injection of 1×106 CFU KP001 strain.The biochemical indexes such asγ-glutamyl transferase and alkaline phosphatase could be used to evaluate the effect of model establishment.
Key words:Klebsiella pneumoniae;Liver abscess;Animal model;Biochemical indicators
肺炎克雷伯菌(Klebsiella pneumoniae,KP)是一种重要的人畜共患条件致病菌,属于肠杆菌科克雷伯菌属。通常情况下,这种菌在健康人和动物的呼吸道和肠道中存在而不具致病性,然而,当宿主免疫功能减弱、身体虚弱或长期使用抗生素时,其可转变为致病菌,引发人和动物发病[1]。20世纪80年代,高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,hvKP)在我国台湾地区被首次报道,随后亚洲、欧洲、北美等多个国家和地区相继报道[2−3]。与经典型肺炎克雷伯菌(classic Klebsiella pneumonia,cKP)相比,hvKP具有更强的致病性、侵袭力和转移性,并可导致原发性肝脓肿[3]。
肝脓肿(Liver abscess,LA)是由病原体侵入肝脏而引起的一种严重的化脓性疾病。导致肝脓肿发生的病原体较多,包括细菌、阿米巴、真菌、寄生虫等,其中细菌占比最高,达80%[4]。目前,KP已经超过大肠杆菌成为独立导致肝脓肿的首要病原菌[5−6]。数据显示,在从肝脓肿感染者分离的病原菌中,KP约占50%[5−6]。此外,KP导致的肝脓肿(Klebsiella pneumoniae liver abscess,KPLA)具有一定的迁移性。HvKP可以从肝脏迁移至其他脏器或组织,引发感染,如肺、胸膜、前列腺、骨、关节、肾脏、脾脏、肌肉、筋膜、软组织、皮肤、眼睛以及中枢神经系统等,在临床防治中难度更大[7]。
目前,KPLA的发病机制仍未阐释清楚,限制了新的防治技术的开发,降低了从源头遏制疾病发生的可能性。缺乏稳定的、便于操作和获得的KPLA动物模型在一定程度上影响了相关工作的开展。因此,本研究以1株动物源hvKP临床分离株为造模菌株,通过接种方式和接种剂量的摸索,建立稳定的KPLA小鼠模型,并进一步测定谷丙转氨酶、谷草转氨酶等多个肝功能相关生化指标,以期为研究KPLA发病机制提供良好的动物模型,并便于评估模型建立效果。
1材料与方法
1.1菌株和试验动物
本研究所用菌株KP001为hvKP,由兽医公共卫生研究室分离和保存。18 g左右SPF级健康ICR小鼠购自上海斯莱克实验动物有限责任公司,试验中按组饲养于洁净动物房中,并每日给予洁净饮用水和饲料。
1.2主要试剂
酵母提取物、胰蛋白胨购自OXOID公司;琼脂粉、革兰氏染色试剂盒购自青岛海博生物技术有限公司;氯化钠、PBS缓冲液、琼脂糖、无菌无酶ddH2O购自上海生工生物工程股份有限公司;4%多聚甲醛购自武汉赛维尔生物科技有限公司;碱性磷酸酶测试盒、谷草转氨酶测试盒、谷丙转氨酶测试盒、乳酸脱氢酶测试盒、γ-谷氨酰转移酶测试盒、总胆红素测试盒、白蛋白测试盒、总蛋白定量测定(BCA法)试剂盒均购自南京建成生物工程研究所有限公司;PCR Mix和核酸染料购自南京诺唯赞生物科技股份有限公司。
1.3菌株复苏及培养
以三区划线法,将菌株KP001甘油冻存菌转接至LB固体培养基上,37℃倒置培养18 h。次日取出,挑取典型单菌落转接至LB试管中,37℃、180 r·min−1过夜培养,4℃保存备用。
1.4动物模型的建立
1.4.1接种方式的摸索按照1:100的比例将过夜培养的菌株KP001转接至LB试管中,37℃、180 r·min−1培养至OD600≈1.0。4℃、5 000 r·min−1离心富集菌体,用无菌PBS缓冲液清洗菌体3遍,并调整菌数至5×107 CFU·mL−1。将30只健康ICR小鼠随机分成6组,每组5只,分别标记为A1~A6。其中A1~A3组分别以灌胃、滴鼻和腹腔注射的方式接种0.2 mL菌液,A4~A6组分别以相应的方式接种等量PBS缓冲液。接种后0~7 d内定时观察小鼠临床症状及存活情况。期间死亡小鼠立即剖检,并观察组织病变。存活小鼠于观察期结束后采用颈椎脱臼法处死,并剖检观察肝脏是否出现脓肿。
1.4.2接种剂量的摸索参照1.4.1培养菌株KP001并富集菌体,调整菌数分别至5×108、5×107、5×106、5×105、5×104、5×103 CFU·mL−1。将56只健康ICR小鼠随机分为7组,每组8只,分别标记为B1~B7。其中,B1~B6组以腹腔注射的方式接种0.2 mL菌液,接种菌数分别为1×108、1×107、1×106、1×105、1×104、1×103 CFU;B7组作为对照组,以腹腔注射的方式接种等体积PBS缓冲液。参照1.4.1方法观察小鼠。
1.4.3肝脓肿模型的建立参照1.4.1培养菌株KP001并富集菌体,调整菌数至5×106 CFU·mL−1。选择13只健康ICR小鼠,随机分成2组,分别标记为KP感染致肝脓肿组(KPLA组)和对照组(CON组)。其中KPLA组8只小鼠,腹腔接种0.2 mL菌液;CON组5只小鼠,腹腔接种0.2 mL PBS。接种后0~7d内定时观察小鼠临床症状及存活情况。存活小鼠通过眼球摘除法采集血液,并将全血于25℃孵育2 h后置于4℃过夜,次日吸取血清至1.5 mL EP管中,−80℃保存。随后采用颈椎脱臼法处死小鼠,剖检并肉眼观察肝脏有无脓肿形成以及脓肿大小、分布等情况。取肝脏固定于4%多聚甲醛,送至杭州厚爱生物科技有限公司进行标本包埋、石蜡切片和HE染色。
1.5肝脓肿小鼠病原菌的鉴定
用无菌一次性接种环蘸取肝脏脓肿部位,三区划线法接种于LB固体培养基上,37℃倒置培养18 h后,挑取代表性单菌落进行革兰氏染色镜检及KP特异性鉴定PCR。引物序列为F:5'-TGAT TGCATTCGCCACTGG-3';R:5'-GGTCAACCCAAC GATCCTG-3',由南京金斯瑞生物科技有限公司合成[7]。反应体系为2×PCR Mix 12.5μL、上下游引物各1μL、ddH2O 10.5μL,蘸取菌落与PCR反应液混合。反应程序为95℃预变性5 min;95℃变性30 s,52℃退火30 s,72℃延伸30 s,共30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳后于紫外凝胶成像系统仪观察。
1.6肝功能相关生化指标的测定
参照试剂盒说明书,对KPLA组和CON组中存活小鼠血清样品进行谷丙转氨酶、谷草转氨酶、碱性磷酸酶、γ-谷氨酰转移酶、白蛋白、乳酸脱氢酶、总胆红素等生化指标的测定。
1.7数据统计
采用GraphPad Prism 8.0进行数据统计,两组间数据差异性分析采用两独立样本t检验进行。
2结果与分析
2.1小鼠肝脓肿模型接种方式的摸索
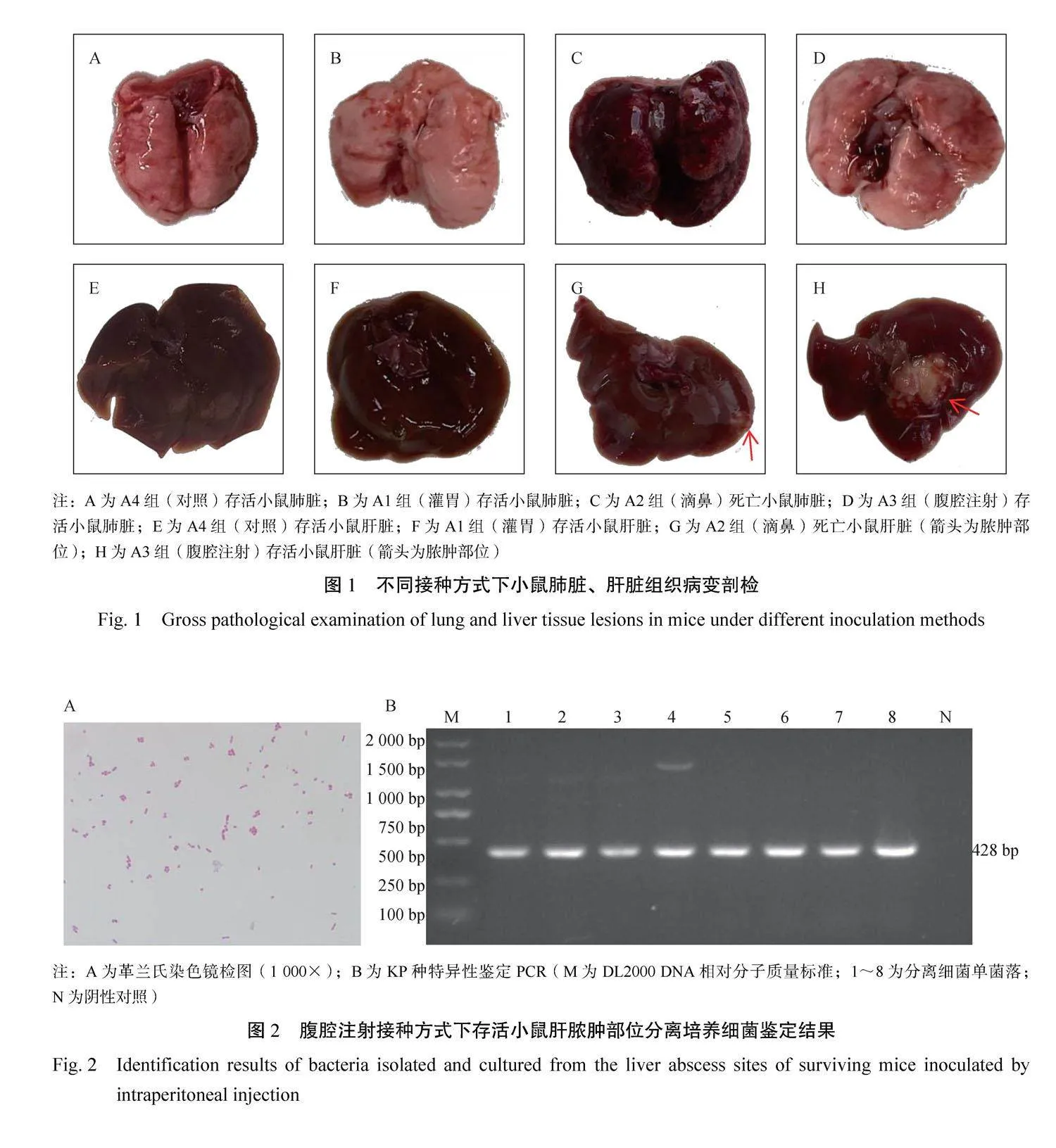
分别采用灌胃(A1组)、滴鼻(A2组)和腹腔注射(A3组)3种方式接种小鼠,接种菌数为1×107 CFU;对照组(A4~A6组)分别以相同方式接种等体积PBS缓冲液。接种后观察7 d,结果显示A1组和A4~A6组小鼠均未发生死亡,剖检未见明显病理变化,肺脏正常(图1A、1B),肝脏未出现脓肿(图1E、1F)。A2组在接种后4 d内小鼠全部死亡,剖检可见肺脏严重肿胀、淤血(图1C),其中2只小鼠肝脏边缘可见轻微脓肿(图1G)。A3组小鼠存活2只,剖检肝脏可见明显脓肿(图1H),肺脏无明显变化(图1D);死亡小鼠剖检可见肺脏淤血、肿胀,肝脏无脓肿。脓肿部位细菌分离鉴定见图2A,菌体为两端钝圆的革兰氏阴性短杆菌,呈单个或成对排列;KP特异性鉴定PCR结果(图2B)显示,挑取的多个单菌落在428 bp处扩增出与预期大小一致的目的条带,证实该脓肿是由KP感染导致的。因此,后续试验选择腹腔注射方法用于肝脓肿模型的建立。
2.2小鼠肝脓肿模型接种剂量的摸索
采用腹腔注射方法,B1~B6组分别接种1×108、1×107、1×106、1×105、1×104、1×103 CFU细菌,B7组接种等体积PBS。接种后观察7 d,由图3可知,B6组和B7组未发生小鼠死亡;B1组小鼠死亡6只,存活率为25%;B2组小鼠死亡5只小鼠,存活率为37.5%;B3组小鼠死亡2只,存活率为75%;B4、B5组小鼠各死亡1只,存活率均为87.5%;说明小鼠存活率与接种菌数呈负相关。存活小鼠剖检可见,B1、B2、B3组小鼠肝脏均出现脓肿,B4组存活的7只小鼠中3只小鼠肝脏出现脓肿,B5、B6组存活小鼠肝脏未出现脓肿,说明肝脓肿出现的概率与接种菌数呈正相关。因此,后续试验选择接种剂量为1×106 CFU。
2.3小鼠肝脓肿模型的建立
以最佳接种剂量(1×106 CFU)腹腔注射8只小鼠(KPLA组),并观察7 d。结果显示,1只小鼠死亡,存活7只小鼠剖检可见肝脏出现脓肿,但不同小鼠之间脓肿部位和大小存在差异。5只对照小鼠(CON组)全部健活,剖检肝脏正常,未见肉眼可见的病理变化。
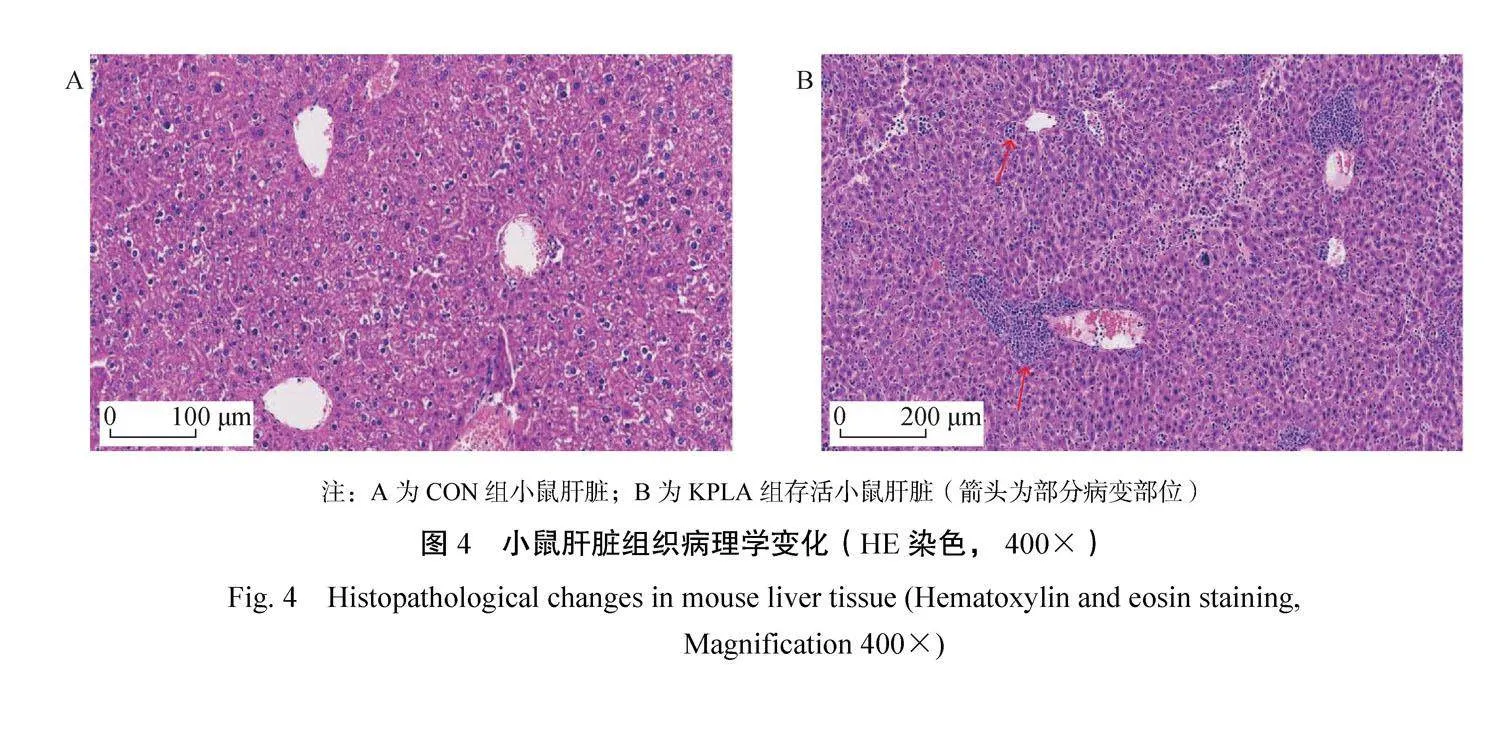
2.4小鼠肝脏组织切片观察
由图4可知,CON组小鼠肝脏组织结构紧密,肝小叶紧凑有序,肝细胞形态正常,中央静脉周围无炎性细胞(图4A);KPLA组小鼠在腹腔注射1×106 CFU细菌7 d后,肝脏出现脓肿,肝细胞排列紊乱,少量肝细胞坏死溶解,大量炎性细胞浸润,尤其是在中央静脉周围(图4B)。
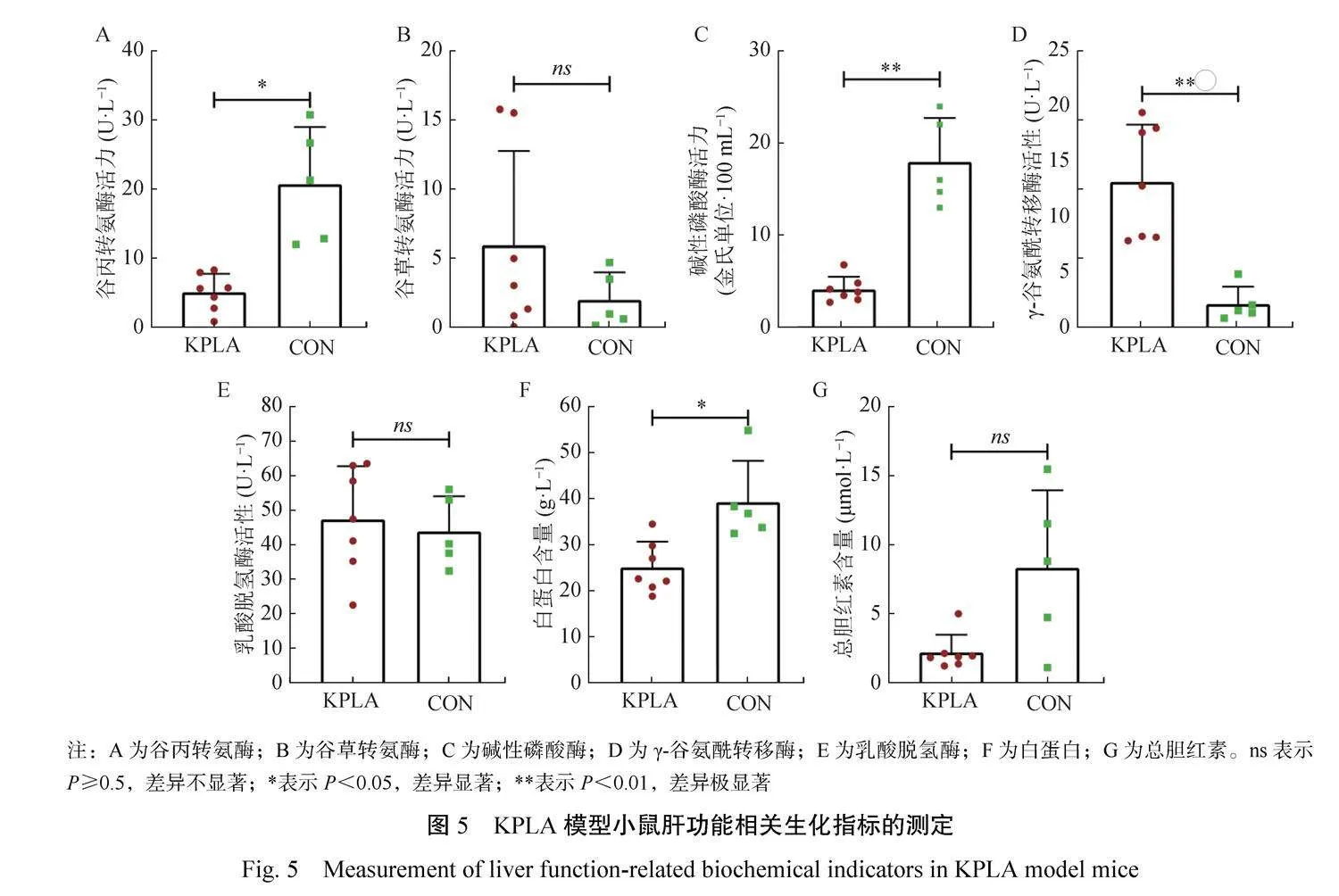
2.5小鼠肝功能相关生化指标的测定
分别对KPLA组和CON组小鼠血清样品进行谷丙转氨酶、谷草转氨酶、碱性磷酸酶、γ-谷氨酰转移酶、白蛋白、乳酸脱氢酶、总胆红素的测定。由图5可知,与CON组相比,接种1×106 CFU细菌7 d后,KPLA组小鼠血清样品中γ-谷氨酰转移酶极显著升高(P<0.01),碱性磷酸酶极显著下降(P<0.01),谷丙转氨酶、白蛋白显著下降(P<0.05),谷草转氨酶、乳酸脱氢酶和总胆红素差异不显著(P>0.05)。
Fig.5 Measurement of liver function-related biochemical indicatorsin KPLA model mice
3讨论与结论
动物模型的建立对研究KPLA的发病机制、防治效果的评价具有重要的意义。本试验以健康ICR小鼠为研究对象,通过腹腔注射1×106 CFU hvKP菌株KP001,成功构建了KPLA小鼠模型,为hvKP致病机理研究和疗效评价奠定了基础。
试验动物、病原微生物以及造模方式是动物模型构建的三大主要因素。以往的研究中,KPLA动物模型常采用免疫力缺陷小鼠进行,如在糖尿病小鼠基础上灌胃KP菌株等,但存在“造模成功率低”“无法排除高糖干扰”等问题[8]。本试验以免疫力正常的健康小鼠为对象,成功构建了KPLA模型,小鼠存活率75%以上,存活小鼠脓肿成模率为100%。在健康小鼠中成功造模,这可能与优质的菌株密切相关。大量研究表明,引起肝脓肿的KP大多为hvKP[9]。本研究所用KP001菌株分离自1例急性死亡华南虎幼虎的肺脏细支气管。前期试验发现,其具有较强的致病力,LD50为3.21×106 CFU,并携带黏液表型调节基因A(rmpA)、铁载体相关毒力基因(iroB、aerobactin、iucA)、假定转运蛋白编码基因(peg344)等与hvKP高度相关的毒力基因。这些毒力基因的存在,可以帮助细菌抵抗宿主补体系统介导的杀菌作用,竞争组织血液中的铁,并通过生成催化羟基自由基发挥抗氧化作用,从而增强菌株毒力,加重菌株对宿主组织的损伤[10−12]。此外,正确的造模方式也是关键因素。KP研究中常通过鼻腔注射、气溶胶感染、尾静脉注射等方法构建基于呼吸道感染模型,并进一步用于KP的评价[13−14]。但这些模型无法适用于KPLA的研究。本研究摸索了灌胃、滴鼻和腹腔注射3种方法,结果显示灌胃小鼠存活率最高,但无法产生肝脓肿;滴鼻小鼠死亡率最高,肺脏病变明显,少量小鼠可产生肝脓肿,成模率低;腹腔注射小鼠在接种适量菌液后,存活率较高,大部分存活小鼠可产生肝脓肿,成模率高。
肝脓肿具有隐匿性。KPLA模型在临床使用时,无法通过临床症状来判定模型建立是否成功。为了便于模型建立效果的评价,本研究在病理剖检确认肝脓肿产生的情况下,进一步测定和比对了血清中谷丙转氨酶、谷草转氨酶、碱性磷酸酶、γ-谷氨酰转移酶、白蛋白、乳酸脱氢酶和总胆红素等肝脏相关生化指标,结果显示,KP感染并产生肝脓肿小鼠血清样品中γ-谷氨酰转移酶极显著升高(P<0.01),碱性磷酸酶极显著下降(P<0.01),谷丙转氨酶、白蛋白显著下降(P<0.05)。这些指标的变化,将有助于在不进行动物剖检的情况下评估KPLA小鼠模型是否成功建立。郑亚虹等利用人源K1血清型hvKP菌株建立了基于C57BL/6J小鼠的肝脓肿模型,造模小鼠谷丙转氨酶和谷草转氨酶均明显升高[15]。这与本试验的检测结果存在差异,可能是由于不同的菌株和小鼠品系所造成的,同时也提示不同种hvKP菌株导致的KPLA可能在生化指标上存在差异。
综上所述,本研究建立了基于hvKP菌株的腹腔接种KPLA小鼠模型,最佳接种剂量为1×106 CFU,同时筛选出γ-谷氨酰转移酶、碱性磷酸酶、谷丙转氨酶、白蛋白等多个评价指标可用于评估模型建立效果,为KPLA的研究提供了良好的模型基础。
参考文献:
[1]陆承平,刘永杰.兽医微生物学(第六版)[M].北京:中国农业出版社,2021.
[2]LIU Y C,CHENG D L,LIN C L.Klebsiella pneumoniae liver abscess associated with septic endophthalmitis[J].Arch Intern Med,1986,146(10):1913−1916.
[3]CHEN J J,ZHANG H,LIAO X L.Hypervirulent Klebsiellapneumoiniae[J].Infect Drug Resist,2023,16:5243−5249.
[4]李花.肝脓肿肺炎克雷伯菌血清分型及毒力基因的研究[D].辽宁:中国医科大学,2018.
[5]刘霞,陈雪娥,陈金通,等.细菌性肝脓肿的临床特点分析[J].福建医科大学学报自然版,2018,52(4):271−273.
[6]雷云生.医院细菌性肝脓肿患者病原菌分布、耐药性及危险因素分析[J].中国处方药,2022,20(4):168−170.
[7]CHUANG Y C,SU J H,LIN C N,et al.Cloning of a gene encoding a unique haemolysin from Klebsiella pneumoniae and its potential use as a species-specific gene probe[J].Microb Pathog,2002,33(1):1−6.
[8]ZHANG M L,PAN L,XU D,et al.The NF-κB signaling pathway serves an important regulatory role in Klebsiella pneumoniae liver abscesses[J].Exp Ther Med,2018,15(6):5443−5449.
[9]JUN J B.Klebsiella pneumoniae liver abscess[J].J Infect Chemother,2018,50(3):210−218.
[10]马玉兰.肺炎克雷伯菌铁载体产量与毒力和碳青霉烯类耐药的关系[D].石家庄:河北医科大学,2019.
[11]PACZOSA M K,MECSAS J.Klebsiella pneumoniae:going on the offense with a strong defense[J].Microbiol Mol Biol Rev,2016,80(3):629−661.
[12]RUSSO T A,OLSON R,FANG C T,et al.Identification of biomarkers for differentiation of hypervirulent Klebsiella pneumoniae from classical K.pneumoniae[J].J Clin Microbiol,2018,56(9):e00776−18.
[13]刘洋,李艳菊,淘奕汐,等.肺炎克雷伯菌两种感染方法小鼠模型的研究[J].中华医院感染学杂志,2018,28(19):2881−2884.
[14]张之珺,张丽丽,吕蒙,等.高毒力肺炎克雷伯菌两种金黄地鼠呼吸道感染模型比较研究[J].军事医学,2024,48(1):30−35.
[15]郑亚虹,岳程程,张慧,等.肺炎克雷伯菌肝脓肿小鼠模型的制备与评价[J].安徽医科大学学报,2021,56(11):1701−1706.
(责任编辑:林玲娜)

