慢性心力衰竭患者血清脯氨酸脱氢酶水平与左心收缩功能的关联性分析
[摘 要] 目的:探讨不同射血分数型慢性心力衰竭 (CHF) 患者血清脯氨酸脱氢酶 (ProDH) 水平差异,阐明ProDH水平对心功能的影响。方法:回顾性分析118例CHF患者的临床资料,将其分为射血分数减低型心力衰竭组(HFrEF) 组(n=39)、射血分数中间值型心力衰竭(HFmrEF) 组(n=42) 和射血分数保留型心力衰竭组(HFpEF) 组(n=37)。收集同期住院的非CHF 患者45 例,作为对照组。收集各组研究对象一般资料,检测各组研究对象血清中生化指标水平和心脏结构指标,患者血清中ProDH 水平与各生化指标的相关性采用Spearman 相关性分析和点二列相关性分析,HFrEF和HFmrEF的影响因素采用多因素Logistic回归分析。结果:与对照组比较,HFpEF组患者 β受体阻滞剂类药物使用率明显升高(Plt;0. 05);HFmrEF 组男性患者百分率、他汀类药物使用率和β 受体阻滞剂类药物使用率均明显升高(Plt;0. 05);HFrEF 组患者年龄和收缩压(SBP) 均明显降低(Plt;0. 05),他汀类药物使用率和β 受体阻滞剂类药物使用率均明显升高(Plt;0. 05)。与HFpEF 组比较,HFmrEF 组患者年龄明显降低(Plt;0. 05),男性患者百分率和他汀类药物使用率均明显升高(Plt;0. 05);HFrEF 组患者年龄明显降低(Plt;0. 05),他汀类药物使用率明显升高(Plt;0. 05)。与HFmrEF 组比较,HFrEF 组患者SBP 明显降低(Plt;0. 05)。与对照组比较,HFpEF 组和HFmrEF 组患者血清中低密度脂蛋白胆固醇(LDL-c) 水平均明显降低(Plt;0. 05),N 末端脑利钠肽前体(NT-proBNP) 水平均明显升高(Plt;0. 05);HFrEF 组患者血清中肾小球滤过率(GFR) 和ProDH 水平均明显降低(Plt;0. 05),空腹血糖(FBG) 和NT-proBNP 水平均明显升高(Plt;0. 05)。与HFpEF 组比较,HFmrEF 组患者血清中血红蛋白(Hb) 水平明显升高(Plt;0. 05);HFrEF 组患者血清中NT-proBNP 水平明显升高(Plt;0. 05),ProDH 水平明显降低(Plt;0. 05)。与HFmrEF 组比较,HFrEF 组患者血清中NT-proBNP水平明显升高(Plt;0. 05)。与对照组比较,HFpEF 组、HFmrEF 组和HFrEF 组患者左心房内径(LAD)和左心室舒张早期二尖瓣血流速度(E) /二尖瓣环舒张早期运动速度(Em) 比值均明显升高(Plt;0. 05);HFmrEF 组和HFrEF 组患者左心室舒张末期内径(LVEDD) 均明显升高(Plt;0. 05),左心室射血分数(LVEF) 均明显降低(Plt;0. 05);与HFpEF 组比较,HFmrEF 组和HFrEF 组患者LVEDD均明显升高(Plt;0. 05),LVEF 均明显降低(Plt;0. 05),HFrEF 组患者LAD 明显升高(Plt;0. 05)。与HFmrEF 组比较,HFrEF 组患者E/Em 比值明显升高(Plt;0. 05),LVEF 明显降低(Plt;0. 05)。患者血清中ProDH 水平与LVEDD 呈负相关关系(r=-0. 210,P=0. 007),与LVEF 呈正相关关系(r=0. 220,P=0. 005)。男性和FBG 水平升高为心脏功能的危险因素,血清中GFR 和ProDH 水平升高为心脏功能的保护因素。结论:ProDH在不同射血分数型CHF患者间存在差异,心功能较差的患者血清ProDH 水平较低,较高水平的ProDH 可能有利于CHF 患者左心收缩功能的提高。
[关键词] 脯氨酸脱氢酶; 慢性心力衰竭; 射血分数减低型心力衰竭; 射血分数中间值型心力衰竭;射血分数保留型心力衰竭
[中图分类号] R541.6 [文献标志码] A
心力衰竭是由于心脏结构和功能异常导致射血和(或) 充盈能力受损以致不能满足机体供血的一种临床综合征。随着人口老龄化加快,慢性心力衰竭(chronic heart failure, CHF) 的发病率逐年升高。我国CHF 患病率为1. 3%, 患病人数约为890 万例, 其中射血分数减低型心力衰竭(heartfailure with reduced ejection fraction,HFrEF)、射血分数中间值型心力衰竭(heart failure with mid-rangeejection fraction, HFmrEF) 和射血分数保留型心力衰竭(heart failure with preserved ejection fraction,HFpEF) 分别占40. 2%、21. 8% 和38. 0% [1]。脯氨酸脱氢酶(proline dehydrogenase, ProDH) 是催化脯氨酸分解代谢第一步的酶, ProDH 介导的脯氨酸代谢轴对于调节各种生物功能至关重要。ProDH 广泛存在于生物体中, ProDH 与真核生物血管生成、基因表达调节、嘌呤生物合成、细胞氧化还原状态和细胞凋亡及增殖等有关[2-3]。ProDH为催化脯氨酸分解代谢的关键酶, 研究[4] 发现:应用乙酰化的脯氨酸治疗急性心肌梗死小鼠,可减少小鼠心室扩张、改善心脏功能、减少心脏纤维化并增加心肌毛细血管密度。研究[5] 显示: 急性心肌梗死小鼠应用脯氨酸治疗后心脏射血分数升高,心肌梗死面积和心肌纤维化减少。除此之外,脯氨酸还可缓解心肌梗死诱导的氧化应激。既往关于ProDH 的研究[5]主要集中于其对癌症代谢的影响,而有关ProDH 对心脏功能影响的研究较少。本研究探讨不同射血分数型CHF 患者ProDH 的差异,并阐明ProDH 水平对心功能的影响,为CHF 的治疗提供潜在新靶点。
1 资料与方法
1. 1 研究对象 回顾性分析 2023 年 4 月 1 日—2023 年11 月30 日河北省人民医院老年心血管内科收治的118 例CHF 患者的临床资料。CHF 患者诊断标准参考《中国慢性心力衰竭和治疗指南2018》[6],其中男性患者75 例,女性患者43 例,年龄30~92 岁。依据《中国慢性心力衰竭和治疗指南2018》[6] 将CHF 患者分为HFrEF 组(n=39)、HFmrEF 组(n=42) 和HFpEF 组(n=37)。CHF 患者纳入标准: ① 有心力衰竭症状和(或)体征; ② HFrEF 组患者左心室射血分数(leftventricular ejection fraction, LVEF) lt;40%,HFmrEF 组患者40%≤LVEFlt;50%,HFpEF 组患者LVEF≥50%; ③ HFmrEF 组和HFpEF 组患者N 末端脑利钠肽前体(N-terminal brain natriureticpeptide precursor,NT-proBNP) ≥125 ng·L-1并存在左心室肥厚和(或) 左心房扩大或心脏舒张功能异常。本研究采用二元Logistic 回归分析14 个影响因素, HFpEF 组和对照组研究对象总人数不应lt;70 人, 故选择同期于河北省人民医院住院的45例非CHF 患者作为对照组,其中男性21 例, 女性24 例, 年龄56~84 岁。非CHF 患者纳入标准:①无心力衰竭症状或体征;②心动超声图未提示心脏结构和(或)功能异常, LVEFgt;50%; ③ NTproBNPlt;125 ng·L-1。排除标准: ① 存在恶性肿瘤性疾病者; ② 肝肾功能不全者; ③ 患有自身免疫性疾病、感染性疾病和传染性疾病者;④患有先天性心脏病者;⑤存在急性心力衰竭和急性心肌梗死者;⑥临床资料不全者。本研究符合医学伦理学要求,已通过河北省人民医院伦理委员会批准,伦理审查编号:(2022) 科研伦审第(24) 号。
1. 2 一般资料收集 收集所有入组研究对象的一般资料,包括年龄、性别、基础疾病史(2 型糖尿病和高血压)、用药史[他汀类药物、血管紧张素转化酶抑制剂(angiotensin-converting enzymeinhibitor, ACEI) /血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB) 类药物和β 受体阻滞剂类药物]。收集各组研究对象入院当日收缩 压(systolic blood pressure, SBP)、舒 张 压(diastolic blood pressure, DBP) 和体质量指数(body mass index,BMI)。
1. 3 生化指标水平检测 所有研究对象空腹8 h后由专业人员采集肘部静脉血, 送至检验科, 采用AU5800 全自动生化分析仪测定各组研究对象血清中白蛋白(albumin, Alb)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酸激酶 同 工 酶(creatine kinase-MB, CK-MB)、 钠(natrium, Na)、低 密 度 脂 蛋 白 胆 固 醇(lowdensity lipoprotein-cholesterol, LDL-c) 和空腹血糖(fasting blood glucose,FBG) 水平及肾小球滤过 率(glomerular filtration rate,GFR)。采 用SysmexXN-3000 血液分析仪检测各组研究对象血清中血红蛋白(hemoglobin, Hb) 和血小板(platelet,PLT) 等生化指标水平。采用电化学发光法测定各组研究对象血清中NT-proBNP 水平,试剂盒购自罗氏诊断产品(上海) 有限公司。采用酶联免疫吸附试验(enzyme linked immunosorbentassay, ELISA) 法检测各组研究对象血清中ProDH 水平,试剂盒购自北京盒子生工科技有限公司。
1. 4 心脏结构指标检测 由超声科专业医师采用彩色多普勒超声诊断仪(型号: PHILIPSQ7) 检测各组研究对象心脏结构指标, 包括左心房内径(left atrium diameter, LAD)、室 间 隔 厚 度(interventricular septal thickness, IVST)、左心室后壁厚度(left ventricle posterior wall thickness,LVPWT)、左心室舒张末期内径(left ventricularend-diastolic diameter,LVEDD)、左心室舒张早期二尖瓣血流速度(early diastolic transmitral flowvelocity, E)、二尖瓣环舒张早期运动速度(earlydiastolic mitral annular velocity,Em) 和LVEF。
1. 5 统计学分析 采用 SPSS 25. 0统计软件进行统计学分析。各组研究对象年龄和血清中Alb 水平符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t 检验。各组研究对象血清中ALT、AST、CK-MB、Na、GFR、LDL-c、FBG、Hb、PLT、NT-proBNP 和ProDH 水平及SBP、DBP、BMI、LAD、IVST、LVPWT、LVEDD、E/Em 比值和LVEF 等计量资料不符合正态分布, 以M (P25, P75) 表示, 多组间样本均数比较采用Kruskal-Wallis H 秩和检验, 组间样本均数两两比较采用Bonferroni 法。各组研究对象性别、基础疾病史和用药史为计数资料,采用例数(%) 表示,多组间比较采用χ2 检验, 组间两两比较采用Bonferroni 调整法。患者血清中ProDH 水平与年龄、SBP、GFR、LAD、LVEDD、E/Em 比值和LVEF 及血清中LDL-c、FBG、Hb 和NT-proBNP水平的相关性采用Spearman 相关性分析, 血清中ProDH 水平与性别的相关性采用点二列相关性分析, 采用多因素Logistic 回归分析HFrEF 和HFmrEF 的影响因素。以Plt;0. 05 为差异有统计学意义。
2 结 果
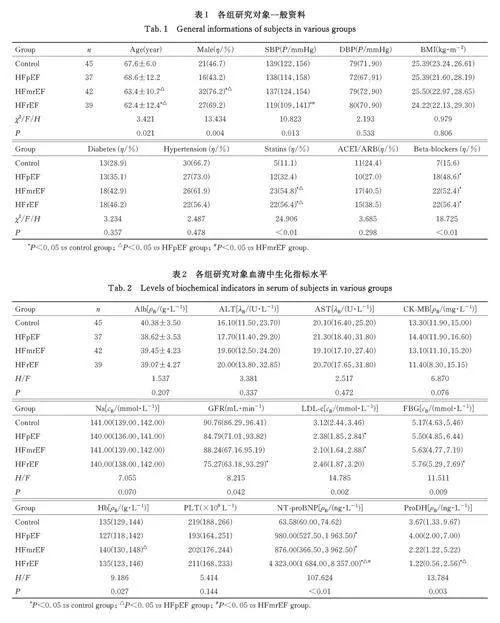
2. 1 各组研究对象一般资料 与对照组比较,HFpEF 组患者β 受体阻滞剂类药物使用率明显升高(Plt;0. 05); HFmrEF 组男性患者百分率、他汀类药物使用率和β 受体阻滞剂类药物使用率均明显升高(Plt;0. 05); HFrEF 组患者年龄和SBP均明显降低(Plt;0. 05), 他汀类药物使用率和β 受体阻滞剂类药物使用率均明显升高(Plt;0. 05)。与HFpEF 组比较, HFmrEF 组患者年龄明显降低(Plt;0. 05), 男性患者百分率和他汀类药物使用率均明显升高(Plt;0. 05); HFrEF 组患者年龄明显降低(Plt;0. 05),他汀类药物使用率明显升高(Plt;0. 05)。与HFmrEF 组比较,HFrEF 组患者SBP 明显降低(Plt;0. 05)。见表1。
2. 2 各组研究对象血清中生化指标水平 与对照组比较,HFpEF 组和HFmrEF 患者血清中LDL-c 水平均明显降低(Plt;0. 05), NT-proBNP 水平均明显升高(Plt;0. 05);HFrEF 组患者血清中GFR 和ProDH 水平均明显降低(Plt;0. 05), FBG 和NT-proBNP 水平均明显升高(Plt;0. 05)。与HFpEF 组比较, HFmrEF 组患者血清中Hb 水平明显升高(Plt;0. 05), HFrEF 组患者血清中NT-proBNP 水平明显升高(Plt;0. 05), ProDH 水平 明 显 降 低(Plt;0. 05)。与 HFmrEF 组 比 较,HFrEF 组患者血清中NT-proBNP 水平明显升高(Plt;0. 05)。见表2。
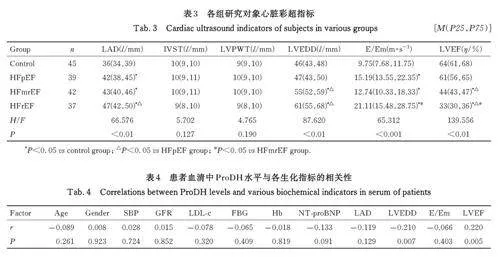
2. 3 各组研究对象心脏结构指标 与对照组比较,HFpEF 组、HFmrEF 组和HFrEF 组患者LAD 和E/Em 比值均明显升高(Plt;0. 05),HFmrEF 组和HFrEF 组患者LVEDD 均明显升高(Plt;0. 05),LVEF 均明显降低(Plt;0. 05)。与HFpEF 组比较,HFmrEF 组和HFrEF 组患者LVEDD 均明显升高(Plt;0. 05),LVEF均明显降低( Plt;0. 05),HFrEF组患者LAD明显升高(Plt;0. 05)。与HFmrEF组比较,HFrEF 组患者E/Em 比值明显升高(Plt;0. 05),LVEF 明显降低(Plt;0. 05)。见表3。
2. 4 患者血清中ProDH水平与各生化指标的相关性 患者血清中ProDH 水平与LVEDD 呈负相关关系(r=-0. 210, P=0. 007), 与LVEF 呈正相关关系(r=0. 220,P=0. 005)。见表4。
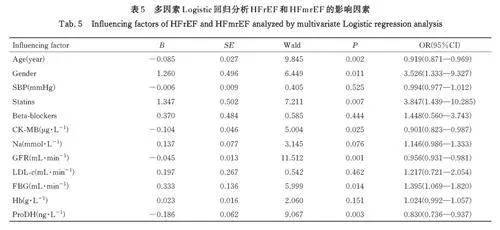
2. 5 HFrEF和HFmrEF的影响因素 以是否发生HFrEF 和 HFmrEF 作 为 因 变 量, HFrEF 组 和HFmEF 组赋值为1,HFpEF 组和对照组赋值为0,以年龄、性别(男性为1,女性为0)、SBP、是否服用他汀类药物(服用为1,未服用为0)、是否服用β 受体阻滞剂类药物(服用为1, 未服用为0)、血清中CK-MB、Na、GFR、LDL-C、FBG、Hb 和ProDH 水平作为自变量。Logistic 回归分析结果显示:男性和FBG 水平升高为心脏功能的危险因素,血清中GFR 和ProDH 水平升高为心脏功能的保护因素。见表5。
3 讨 论
心脏是人体的高耗能器官,维持正常心肌收缩的能量主要来源于线粒体氧化磷酸化和糖酵解。心肌细胞可利用多种能量底物, 包括脂肪酸、葡萄糖、酮体和氨基酸等。生理状态下,心肌细胞线粒体利用脂肪酸为其提供大部分能量, 其次为葡萄糖。当发生心力衰竭时,心肌细胞利用脂肪酸和葡萄糖的能力降低,部分酮体和氨基酸可作为心肌能量代谢的补充底物。脯氨酸为人体的一种非必需氨基酸,细胞内高浓度的脯氨酸已被证实有益于细胞生存[7]。
ProDH 是催化脯氨酸分解代谢第一步的酶,ProDH 与线粒体氧化呼吸链复合体Ⅱ 共同定位于线粒体内膜上, 通过黄素腺嘌呤二核苷酸(flavinadenine dinucleotide, FAD) 将电子转移至呼吸链中的细胞色素C[8]。ProDH 催化脯氨酸转化为1-吡咯啉-5- 羧酸盐(1-pyrroline-5-carboxylate, PC5),在此过程中,伴随着电子转移,产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP) 及活性氧[9]。TANNER 等[10] 研究发现: 胞质溶胶中的P5C 还原酶会刺激磷酸戊糖途径产生还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotidephosphate,NADPH)。
研究[11-13] 显示: ProDH 可促进机体细胞产生能量,在急性缺氧和能量不足的情况下,被AMP依赖的蛋白激酶上调ProDH 表达, 支持细胞氧化呼吸并诱导ATP 产生, 心肌缺血和缺氧后,ProDH 表达下调。研究[14] 显示:与非缺血性心力衰竭组比较, 缺血性心力衰竭组大鼠ProDH 表达水平降低,并且随着心肌细胞缺血和缺氧时间的延长,ProDH 表达水平逐渐降低。本研究结果显示:与对照组和HFpEF 组比较,HFrEF 组患者血清中ProDH 水平明显降低, 提示ProDH 有利于为心肌细胞提供能量,终末期心力衰竭患者心肌能量相对匮乏。ProDH 与病理性心脏重塑存在相关性, 本研究结果显示:患者血清中ProDH 水平与LVEDD呈负相关关系,与LVEF 呈正相关关系,提示ProDH 在心脏重塑中可能具有保护作用, ProDH对心功能有益。研究[15] 显示:特异性ProDH 基因敲除的小鼠左心室易发生代偿性扩张,且小鼠表现出更高的心脏质量, 而心脏特异性过表达ProDH的小鼠LVEF 有所改善,与本研究结果一致。
心肌细胞死亡是心力衰竭的主要病理机制,过度的DNA 损伤导致心肌细胞死亡,因此DNA 修复对保障心肌细胞基因组稳定性和细胞活性至关重要[16]。ProDH 介导的脯氨酸分解代谢与磷酸戊糖途径耦联, 支持核苷酸的生物合成, ProDH 表达下调可能会影响心肌细胞DNA 生物合成和细胞增殖[17]。研究[18] 发现:与正常细胞比较,ProDH 表达下调的细胞DNA 生物合成明显降低。当心肌细胞损伤严重时,心肌细胞会启动保护性自噬机制,该机制的保护作用表现为去除受损或错误折叠的蛋白质和细胞器。研究[19-20] 表明: 促进心肌细胞自噬是治疗心力衰竭的一种潜在策略, ProDH 在催化脯氨酸的过程中会产生活性氧,在肿瘤的生长中具有一定作用, ProDH 通过活性氧依赖的保护性自噬促进细胞存活。因此, ProDH 在心脏的保护性自噬中可能也发挥一定作用,但仍有待进一步研究。本研究结果显示: ProDH 是心脏功能的保护性因素,随着ProDH 水平升高,患者患HFrEF 和HFmrEF 的风险降低, 较高水平的ProDH 可能有利于CHF 患者左心收缩功能的提高。
本研究结果显示: 男性是HFrEF 和HFmrEF的 危 险 因 素, 与 对 照 组 和 HFpEF 组 比 较,HFmrEF 组男性患者百分率明显升高。研究[21] 发现: 女性经常患有HFpEF, 男性则更有可能患HFrEF,女性患者心脏更有可能出现向心性重塑,而少有出现离心性肥大。原因可能是男性易患冠状动脉疾病和大血管疾病,而女性易患微血管疾病和血管内皮炎症[22]。当LVEFlt;40% 时, 不同性别患者患病差异较小,当LVEF 接近正常值时,不同性别患者患病差异增大[23], 与本研究结果相似。GFR 升高是心脏功能的保护因素,FBG 水平升高是心脏功能的危险因素。本研究结果显示:与对照组比较,HFrEF 组患者GFR 明显降低,FBG 水平明显升高。研究[24] 显示:肾功能障碍患者血浆儿茶酚胺水平升高,肾素-血管紧张素-醛固酮系统激活, 体内水钠潴留增加, 导致心脏负荷增加。此外,高水平的血管紧张素促进心脏重塑和纤维化过程[25]。研究[26] 发现: 较高的FBG 变异性与较高的心力衰竭发病风险独立相关,这可能是由于高糖环境易引起心血管系统损害,进一步导致心力衰竭的发生。因此,对于CHF 患者,维持较高的肾功能和积极控制血糖可能有利于延缓心力衰竭的进展。
综上所述,ProDH 在不同射血分数型CHF 患者间存在差异, 心功能较差的患者血清中ProDH水平较低,较高水平的ProDH 可能有利于CHF 患者左心收缩功能的提高。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:杨凯同参与数据收集、统计学分析和论文撰写,和丽丽参与研究设计和论文撰写指导,左庆娟参与论文撰写指导,于鑫伟参与数据收集和统计学分析,郭艺芳参与论文审校。
[参考文献]
[1] 马丽媛, 王增武, 樊 静, 等.《 中国心血管健康与疾病
报告2022》要点解读[J]. 中国全科医学, 2023, 26(32):
3975-3994.
[2] XI X R, ZHANG M, LI Y H, et al. Identification of
PRODH as a mitochondria- and angiogenesis-related
biomarker for lung adenocarcinoma[J]. Transl Cancer
Res, 2024, 13(5): 2073-2093.
[3] HUYNH T Y L, ZAREBA I, BASZANOWSKA W,
et al. Understanding the role of key amino acids in
regulation of proline dehydrogenase/proline oxidase
(prodh/pox) -dependent apoptosis/autophagy as an
approach to targeted cancer therapy [J]. Mol Cell
Biochem, 2020, 466(1/2): 35-44.
[4] PENG H M, XU J, YANG X P, et al. N-acetyl-serylaspartyl-
lysyl-proline treatment protects heart against
excessive myocardial injury and heart failure in mice[J].
Can J Physiol Pharmacol, 2019, 97(8): 753-765.
[5] WANG J C, XUE Z M, LIN J, et al. Proline improves
cardiac remodeling following myocardial infarction and
attenuates cardiomyocyte apoptosis via redox
regulation[J]. Biochem Pharmacol, 2020, 178: 114065.
[6] 中华医学会心血管病学分会心力衰竭学组, 中国医师
协会心力衰竭专业委员会, 中华心血管病杂志编辑委
员会. 中国心力衰竭诊断和治疗指南2018[J]. 中华心血
管病杂志, 2018, 46(10): 760-789.
[7] PALKA J, OSCILOWSKA I, SZOKA L. Collagen
metabolism as a regulator of proline dehydrogenase/
proline oxidase-dependent apoptosis/autophagy [J].
Amino Acids, 2021, 53(12): 1917-1925.
[8] CHEN C, LIU Q Y, CHEN W J, et al. PRODH
safeguards human naive pluripotency by limiting
mitochondrial oxidative phosphorylation and reactive
oxygen species production[J]. EMBO Rep, 2024,
25(4): 2015-2044.
[9] XU X Y, ZHANG G T, CHEN Y J, et al. Can proline
dehydrogenase-a key enzyme involved in proline
metabolism-be a novel target for cancer therapy?[J].
Front Oncol, 2023, 13: 1254439.
[10]TANNER J J. Structural biology of proline catabolic
enzymes[J]. Antioxid Redox Signal, 2019, 30(4):
650-673.
[11]LEWONIEWSKA S, OSCILOWSKA I, HUYNH T Y L,
et al. Troglitazone-induced PRODH/POX-dependent
apoptosis occurs in the absence of estradiol or ERβ in
ER-negative breast cancer cells[J]. J Clin Med, 2021,
10(20): 4641.
[12]HANCOCK C N , LIU W , ALVORD W G , et al.
Co-regulation of mitochondrial respiration by proline
dehydrogenase/oxidase and succinate[J]. Amino Acids,
2016, 48(3): 859-872.
[13]KAZBERUK A, ZAREBA I, PALKA J, et al. A novel
plausible mechanism of NSAIDs-induced apoptosis in
cancer cells: the implication of proline oxidase and
peroxisome proliferator-activated receptor[J]. Pharmacol
Rep, 2020, 72(5): 1152-1160.
[14]WANG J C, XUE Z M, HUA C T, et al. Metabolomic
analysis of the ameliorative effect of enhanced proline
metabolism on hypoxia-induced injury in
cardiomyocytes[J]. Oxid Med Cell Longev, 2020,
2020: 8866946.
[15]LV Q B, LI D B, ZHAO L D, et al. Proline metabolic
reprogramming modulates cardiac remodeling induced
by pressure overload in the heart[J]. Sci Adv, 2024,
10(19): eadl3549.
[16]蔡美莲, 钟国强. 慢性心力衰竭治疗进展[J]. 中国实用
内科杂志, 2023, 43(11): 944-949, 954.
[17]ZAREBA I, SURAZYNSKI A, CHRUSCIEL M, et al.
Functional consequences of intracellular proline levels
manipulation affecting PRODH/POX-dependent proapoptotic
pathways in a novel in vitro cell culture
model[J]. Cell Physiol Biochem, 2017, 43(2): 670-684.
[18]ZAREBA I, CELINSKA-JANOWICZ K,
SURAZYNSKI A, et al. Proline oxidase silencing
induces proline-dependent pro-survival pathways in
MCF-7 cells[J]. Oncotarget, 2018, 9(17):
13748-13757.
[19]GAO G Y, CHEN W W, YAN M J, et al. Rapamycin
regulates the balance betweencardiomyocyte apoptosis
and autophagy in chronic heart failure by inhibiting
mTOR signaling[J]. Int J Mol Med, 2020, 45(1):
195-209.
[20]GROSSI S, BERNO E, CHIOFALO P, et al. Proline
dehydrogenase (PRODH) is expressed in lung
adenocarcinoma and modulates cell survival and 3D
growth by inducing cellular senescence[J]. Int J Mol
Sci, 2024, 25(2): 714.
[21]SCIOMER S, MOSCUCCI F, SALVIONI E, et al.
Role of gender, age and BMI in prognosis of heart
failure[J]. Eur J Prev Cardiol, 2020, 27(2_suppl):
46-51.
[22]LEE D P H. Impact of sex and diabetes in patients with
heart failure with mildly reduced ejection fraction[J].
Ann Acad Med Singap, 2022, 51(8): 458-459.
[23]MILLER R J H, HOWLETT J G. Untying the Gordian
knot of sex and heart failure therapy[J]. Eur J Heart
Fail, 2021, 23(9): 1485-1487.
[24]AJIBOWO A O, OKOBI O E, EMORE E, et al.
Cardiorenal syndrome: a literature review[J]. Cureus,
2023, 15(7): e41252.
[25]GEMBILLO G, VISCONTI L, GIUSTI M A, et al.
Cardiorenal syndrome: new pathways and novel
biomarkers[J]. Biomolecules, 2021, 11(11): 1581.
[26]WANG Y Y, ZHOU J D, QI W W, et al. Visit-to-visit
variability in fasting blood glucose predicts the new-onset
heart failure: results from two large Chinese cohorts[J].
Curr Probl Cardiol, 2023, 48(9): 101842.

