丁酸钠对脂多糖联合D-氨基半乳糖诱导小鼠急性肝损伤的保护作用及其机制
[摘 要] 目的:探讨丁酸钠 (NaB) 脂多糖 (LPS) 联合D-氨基半乳糖 (D-Gal) 诱导小鼠急性肝损伤的保护作用,并阐明其作用机制。方法:30只雄性昆明小鼠随机分为对照组、模型组和NaB组,每组10 只。NaB 组小鼠给予200 mg·kg-1·d-1 NaB,对照组和模型组小鼠给予等体积无菌水。模型组和NaB 组小鼠腹腔注射20 μg·kg-1 LPS 和600 mg·kg-1 D-Gal 诱导建立小鼠急性肝损伤模型。检测各组小鼠体质量和肝脏质量,计算肝脏指数。HE 染色观察各组小鼠肝脏组织病理形态表现,试剂盒检测各组小鼠血清中丙氨酸氨基转移酶(ALT) 和天门冬氨酸氨基转移酶(AST) 活性及肝脏组织中总超氧化物歧化酶(T-SOD) 和过氧化氢酶(CAT) 活性及丙二醛(MDA) 水平,Western blotting 法检测各组小鼠肝脏组织中核因子E2相关因子2(Nrf2)和血红素加氧酶1(HO-1)蛋白表达水平。结果:各组小鼠体质量比较差异均无统计学意义(Pgt;0. 05);与对照组比较,模型组小鼠肝脏指数明显升高(Plt;0. 01);与模型组比较,NaB 组小鼠肝脏指数明显降低(Plt;0. 01)。HE 染色观察,对照组小鼠肝脏组织结构正常,肝细胞边界清晰、大小一致,围绕中央静脉呈放射状均匀排列,且核位于细胞中央;模型组小鼠可见肝细胞排列紊乱,细胞肿胀,多发灶状肝细胞坏死,炎症细胞浸润及出血;与模型组比较, NaB 组肝细胞形态结构得到改善, 炎症浸润减少。与对照组比较, 模型组小鼠血清中ALT 和AST 活性均明显升高(Plt;0. 01);与模型组比较,NaB 组小鼠血清中ALT 和AST 活性均明显降低(Plt;0. 05 或Plt;0. 01)。与对照组比较,模型组小鼠肝脏组织中T-SOD 和CAT 活性均明显降低(Plt;0. 01),MDA 水平明显升高(Plt;0. 01);与模型组比较,NaB 组小鼠肝脏组织中T-SOD 和CAT 活性均明显升高(Plt;0. 05或Plt;0. 01),MDA 水平明显降低(Plt;0. 01)。Western blotting法检测,与对照组比较, 模型组小鼠肝脏组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 05); 与模型组比较,NaB组小鼠肝脏组织中Nrf2和HO-1蛋白表达水平均明显升高 (Plt;0. 01)。结论:NaB对LPS/D-Gal诱导的小鼠急性肝损伤具有保护作用,其机制可能与NaB 上调肝脏组织中Nrf2 和HO-1 蛋白表达和增加抗氧化酶活性,进而减轻肝脏氧化应激水平有关。
[关键词] 丁酸钠; 急性肝损伤; 氧化应激; 核因子E2 相关因子2; 血红素加氧酶1
[中图分类号] R459. 3 [文献标志码] A
肝硬化、病毒性肝炎和肝癌等肝脏疾病每年造成200 余万人死亡, 占全球死亡人数的4% [1]。急性肝损伤是指由感染、酒精中毒和药物等多种因素导致的急性肝脏功能损害及肝细胞坏死, 是肝脏疾病的重要诱因[2]。急性肝损伤发展迅速,诊治不及时可导致急性肝衰竭, 危及患者生命。急性肝损伤持续性发生将转变为慢性肝损伤, 进一步导致肝硬化和肝癌。肝损伤是一个发病率和死亡率较高的世界性健康问题,目前除肝移植外,尚无有效的治疗方法, 受肝脏供体的限制, 仅有少部分患者接受了有效的治疗[3-4]。因此,探索安全、天然和有效的急性肝损伤防治药物具有重要意义。丁酸钠(sodium butyrate, NaB) 为天然存在的短链脂肪酸盐, 是大纤维食物经细菌发酵的主要代谢产物, 结构简单且不良反应少,具有肠道屏障功能保护、抑制炎症和抗氧化等作用, 开发应用前景良好[5-7]。近期有研究[8-9] 证实NaB 在肝功能保护方面具有潜能。研究[10] 显示:氧化应激是诱发肝损伤的主要病理过程之一。肝细胞坏死会随着过氧化氢酶(catalase, CAT) 和超氧化物歧化酶(superoxide dismutase, SOD)等抗氧化酶活性的降低而恶化。因此, 抑制氧化应激可以成为缓解急性肝损伤的靶标。脂多糖(lipopolysaccharide, LPS) 联合D- 氨基半乳糖(D-galactosamine, D-Gal) 可造成肝细胞变性坏死, 其建立的小鼠急性肝损伤模型与人类急性肝损伤的病理特征相似, 常用于探索肝损伤机制和潜在防治药物。核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2) 是一种重要的转录因子, 是改善不同氧化应激和炎症相关疾病所必需的细胞因子[11]。血红素加氧酶1(heme oxygenase-1, HO-1) 是一种可诱导的酶,对暴露于多种刺激, 如病毒和细菌产物, 包括LPS、细胞因子、癌基因、丝裂原及生长因子,所引起的炎症过程和氧化组织损伤具有保护作用。Nrf2 是HO-1 表达的主要激活剂[ 12]。研究[ 13]显示: 上调Nrf2 蛋白表达可增强相关抗氧化酶的活性, 从而改善急性肝损伤。研究[14] 表明:NaB 通过促进Nrf2 的表达刺激下游抗氧化酶的转录, 从而有助于改善高脂肪饮食诱导的氧化应激。因此,本研究通过LPS/D-Gal 诱导构建急性肝损伤小鼠模型, 探讨NaB 对急性肝损伤小鼠的影响,并从氧化应激的角度阐明其可能的机制, 为NaB开发利用及急性肝损伤防治奠定基础。
1 材料与方法
1. 1 实验动物、主要试剂和仪器 30只雄性昆明小鼠,体质量(20±2) g,购于湖南省长沙市天勤生物技术有限公司,动物生产许可证号:SCXK (湘)2019-001。NaB 购于美国Sigma-Aldrich 公司,血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartateaminotransferase, AST)、总 SOD (total SOD,T-SOD)、丙二醛(malondialdehyde, MDA) 和CAT 试剂盒均购于南京建成生物工程研究所,Nrf2 和HO-1 购于武汉三鹰生物技术有限公司,β-actin 购于杭州华安生物技术有限公司,兔二抗购于美国Abclonal 公司,鼠二抗购于武汉亚科因生物技术有限公司。电泳仪电源购于北京六一仪器厂,凝胶成像仪购于上海天能科技有限公司,酶标仪购于美国Bio-Tek 仪器有限公司。
1. 2 实验动物分组和模型制备 30雄性昆明小鼠随机分为对照组、模型组和NaB 组, 每组10 只,常规饲料喂养,自由饮水,12 h 光/暗循环。各组小鼠均采用灌胃给药方式,NaB 组小鼠给予200 mg·kg-1·d-1 NaB[15], 对照组和模型组小鼠给予等体积无菌水,持续灌胃7 周。末次给药1 h 后,模型组和NaB 组小鼠腹腔注射20 μg·kg-1 LPS 和600 mg·kg-1 D-Gal 诱导建立小鼠急性肝损伤模型[16]。实验过程中,每周测定小鼠体质量,密切观察小鼠状态。取各组小鼠肝脏组织,称量肝脏质量,计算各组小鼠肝脏指数。肝脏指数=小鼠肝脏质量(g) /小鼠体质量(g)。
1. 3 HE 染色观察各组小鼠肝脏组织病理形态表现 将4% 多聚甲醛固定的肝脏组织脱水并包埋于石蜡块中,制备5 μm 厚的切片,用苏木精和伊红处理小鼠肝脏组织,切片,光学显微镜下观察各组小鼠肝脏组织病理形态表现。
1. 4 试剂盒检测各组小鼠血清中ALT和AST活性 模型小鼠建立6 h 后麻醉,采用眼球摘除法收集小鼠血液样本,分离血清,参照生化试剂盒说明书操作,检测各组小鼠血清中ALT 和AST 活性。
1. 5 试剂盒检测各组小鼠肝脏组织中 T-SOD 和CAT活性及MDA水平 取各组小鼠肝脏组织,按照1∶ 9 的比例将小鼠肝脏组织与预冷生理盐水混合匀浆,2 500 r·min-1 离心10 min,取上清,采用试剂盒检测各组小鼠肝脏组织中T-SOD 和CAT 活性及MDA 水平。
1. 6 Western blotting法检测各组小鼠肝脏组织中Nrf2和HO-1蛋白表达水平 取小鼠冷冻肝脏组织20 mg,提取组织总蛋白。样品通过SDS-PAGE 分离, 切出含有靶蛋白和内参的凝胶并转印。将PVDF 膜于5% 脱脂奶粉中封闭,并于4 ℃下与一抗孵育过夜,室温孵育二抗1~2 h,ECL 显影,采用Image J 软件分析蛋白条带灰度值, 以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1. 7 统计学分析 采用 SPSS 26. 0统计软件进行统计学分析。各组小鼠体质量和肝脏指数,血清中ALT 和AST 活性,肝脏组织中T-SOD 和CAT 活性及MDA 水平,肝脏组织中Nrf2 和HO-1 蛋白表达水平均符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
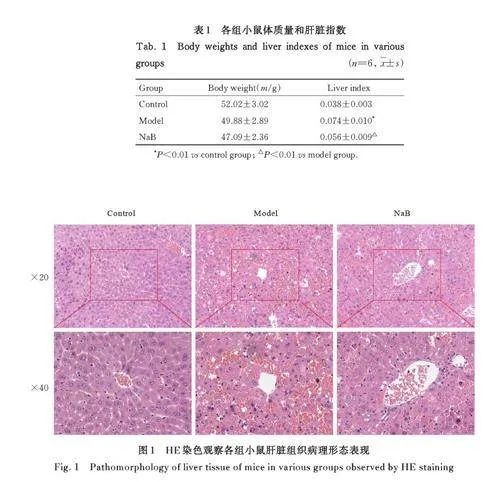
2. 1 各组小鼠体质量和肝脏指数 各组小鼠体质量比较差异均无统计学意义(Pgt;0. 05)。与对照组比较, 模型组小鼠肝脏指数明显升高(Plt;0. 01)。与模型组比较,NaB 组小鼠肝脏指数明显降低(Plt;0. 01)。见表1。
2. 2 各组小鼠肝脏组织病理形态表现 对照组小鼠肝脏组织结构正常, 肝细胞边界清晰、大小一致,围绕中央静脉呈放射状均匀排列,且核位于细胞中央。模型组小鼠可见肝细胞排列紊乱,细胞肿胀,多发灶状肝细胞坏死,炎症细胞浸润及出血。与模型组比较,NaB 组肝细胞形态结构得到改善,炎症浸润减少。见图1。
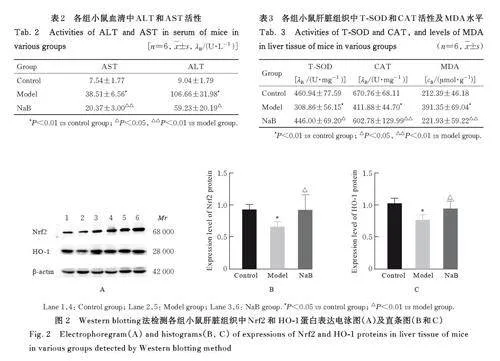
2. 3 各组小鼠血清中 ALT 和 AST 活性 与对照组比较,模型组小鼠血清中ALT 和AST 活性均明显升高(Plt;0. 01)。与模型组比较, NaB 组小鼠血清中ALT 和AST 活性均明显降低(Plt;0. 05 或Plt;0. 01)。见表2。
2. 4 各组小鼠肝脏组织中 T-SOD和 CAT活性及MDA水平 与对照组比较,模型组小鼠肝脏组织中T-SOD 和CAT 活性均明显降低(Plt;0. 01),MDA 水平明显升高(Plt;0. 01)。与模型组比较,NaB 组小鼠肝脏组织中T-SOD 和CAT 活性均明显升高(Plt;0. 05 或Plt;0. 01),MDA 水平明显降低(Plt;0. 01)。见表3。
2. 5 各组小鼠肝脏组织中 Nrf2和 HO-1蛋白表达水平 与对照组比较,模型组小鼠肝脏组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 05)。与模型组比较, NaB 组小鼠肝脏组织中Nrf2 和HO-1 蛋白表达水平均明显升高(Plt;0. 01)。见图2。
3 讨 论
肝脏在调节新陈代谢、体内平衡和免疫活动方面发挥重要作用。LPS 作为一种经典的内毒素,可诱导肝细胞凋亡和坏死。D-Gal 是一种氨基糖,是抑制肝细胞中RNA 和蛋白质合成的肝毒性物质之一,可导致肝损伤。D-Gal 可特异性地增强肝脏对LPS 细胞毒性作用的敏感性,促进急性肝损伤的发生发展[17]。本研究结果显示:与对照组比较,模型组小鼠肝脏指数明显升高,血清中ALT 和AST 活性明显升高,出现明显细胞结构紊乱、坏死及炎症细胞浸润,提示急性肝损伤模型构建成功;与模型组比较,NaB 组小鼠肝脏指数明显降低,且NaB 明显改善了广泛的细胞坏死和炎症细胞浸润。ALT 和AST 是催化氨基酸与酮酸之间氨基转移的酶, 当肝细胞受损时,ALT 和AST 由肝细胞释放至血液中, 导致血清中ALT 和AST 活性升高。AST 和ALT 的血清活性已被公认为肝脏组织损伤的敏感血清学指标, 其异常升高可引起肝细胞损伤和坏死[18]。NaB 干预后, 因腹腔注射LPS/D-Gal 小鼠血清中ALT 和AST 活性明显降低,提示NaB 可有效缓解急性肝损伤。
氧化应激与急性肝损伤的发病有密切关联,抑制氧化应激可能是急性肝损伤发展的潜在预防措施[19]。SOD 与CAT 的功能相互关联,均可通过直接清除氧自由基发挥肝细胞保护作用。MDA 是脂质过氧化的最终产物,MDA 水平可提示肝脏氧化损伤的程度[20]。研究[21] 显示:NaB 可通过提高抗氧化稳定性改善奶山羊亚急性瘤胃酸中毒。研究[22]发现:NaB 干预可减轻过氧化氢引起的氧化损伤,升高细胞中SOD 和CAT 等抗氧化酶活性,明显降低活性氧(resctive oxygen species,ROS) 和MDA水平。本研究结果显示:经过NaB 的干预,腹腔注射LPS/D-Gal 的急性肝损伤小鼠MDA 水平升高和CAT 及T-SOD 活性降低的情况被逆转。提示NaB具有抗氧化应激活性, 有助于清除ROS, 从而减轻急性肝损伤的严重程度。
抗氧化应激的机制是目前研究的热点,核因子κB(nuclear factor kappa-B,NF-κB)、沉默调节蛋白1(silent information regulator protein 1, SIRT1) /Nrf2、磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase, PI3K) - 蛋白激酶B (protein kinase B,Akt)、Akt/叉头框蛋白O1 (orkhead box proteinO1,FoxO1) 和Nrf2/HO-1 等通路受到广泛关注,其中,Nrf2/HO-1 通路作为人体最关键的内源性防护系统之一,在保护机体免受氧化应激过程中发挥关键作用。在无应激条件下, Nrf2 在蛋白酶体中以Kelch 样环氧氯丙烷相关蛋白1 (Kelch-likeECH-associated protein 1,Keap1) 依赖性方式不断泛素化和降解。在氧化条件下,Keap1 中关键半胱氨酸残基被共价修饰, 阻止其介导Nrf2 泛素化,新合成的Nrf2 可以积累并转移至细胞核中,与肌腱膜纤维肉瘤蛋白(musculoaponeurotic fibrosarcomaprotein,MAF) 蛋白二聚化,以促进细胞保护基因的转录。Nrf2 缺乏会加重小鼠原代肝细胞中ROS 的积累[23]。Nrf2/HO-1 信号传导在多种肝脏疾病中的关键作用已被证实,包括非酒精性脂肪性肝病、酒精性肝病和肝缺血再灌注损伤等[24-25]。TANG 等[26]研究发现:NaB 通过促进糖原合成酶激酶3 β(glycogen synthase kinase-3β,GSK-3β) /Nrf2 信号通路和线粒体功能,防止高脂肪饮食诱导的肥胖大鼠的氧化应激。LUO 等[27] 研究发现: NaB 通过G 蛋白偶联受体43 (G protein coupled receptor 43,GPR43) /β 抑制蛋白2(β-arrestin-2) /核因子(nuclear factor kappa-B,NF-κB) 信号通路部分减少炎症反应,明显减轻了LPS 诱导的肝损伤。本研究结果显示:与对照组比较,急性肝损伤小鼠肝脏组织中Nrf2 和HO-1 蛋白表达水平明显降低,NaB 干预可明显上调Nrf2 和HO-1 蛋白表达。
综上所述,NaB 对LPS/D-GalN 诱导的小鼠急性肝损伤具有保护作用, 其作用机制可能与NaB上调肝脏组织中Nrf2 和HO-1 蛋白表达和减少肝脏氧化损伤,进而增加抗氧化酶活性有关。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:龙毅参与研究设计、实验质量控制和论文撰写,游子怡参与实验操作、数据收集和统计学分析,谭秀英参与研究设计和实验质量控制,张柔参与实验数据收集和文献检索,张钰浛参与实验操作和数据收集整理,杨丽娜参与研究设计、实验质量控制和论文审校。
[参考文献]
[1] DEVARBHAVI H, ASRANI S K, ARAB J P, et al.
Global burden of liver disease: 2023 update[J].
J Hepatol, 2023, 79(2): 516-537.
[2] WANG F S, FAN J G, ZHANG Z, et al. The global
burden of liver disease: the major impact of China[J].
Hepatology, 2014, 60(6): 2099-2108.
[3] WANG M L, NIU J L, OU L N, et al. Zerumbone
protects against carbon tetrachloride (CCl4) -induced
acute liver injury in mice via inhibiting oxidative stress
and the inflammatory response: involving the TLR4/
NF-κB/COX-2 pathway[J]. Molecules, 2019, 24(10):
1964.
[4] LIU X K, WANG T, LIU X, et al. Biochanin A
protects lipopolysaccharide/D-galactosamine-induced
acute liver injury in mice by activating the Nrf2 pathway
and inhibiting NLRP3 inflammasome activation[J].
Int Immunopharmacol, 2016, 38: 324-331.
[5] PENG J H, LENG J, TIAN H J, et al. Geniposide and
chlorogenic acid combination ameliorates non-alcoholic
steatohepatitis involving the protection on the gut barrier
function in mouse induced by high-fat diet[J]. Front
Pharmacol, 2018, 9: 1399.
[6] CHEN G X, RAN X, LI B, et al. Sodium butyrate
inhibits inflammation and maintains epithelium barrier
integrity in a TNBS-induced inflammatory bowel disease
mice mode[l J]. EBioMedicine, 2018, 30: 317-325.
[7] LI L, WANG H H, NIE X T, et al. Sodium butyrate
ameliorates lipopolysaccharide-induced cow mammary
epithelial cells from oxidative stress damage and
apoptosis[J]. J Cell Biochem, 2019, 120(2): 2370-2381.
[8] YANG F, WANG L K, LI X, et al. Sodium butyrate
protects against toxin-induced acute liver failure in
rats[J]. Hepatobiliary Pancreat Dis Int, 2014, 13(3):
309-315.
[9] ZHANG N, QU Y F, QIN B. Sodium butyrate
ameliorates non-alcoholic fatty liver disease by
upregulating miR-150 to suppress CXCR4
expression[J]. Clin Exp Pharmacol Physiol, 2021,
48(8): 1125-1136.
[10]REYES-GORDILLO K, SHAH R, MURIEL P.
Oxidative stress and inflammation in hepatic diseases:
current and future therapy[J]. Oxid Med Cell Longev,
2017, 2017: 3140673.
[11]XU D W, XU M, JEONG S, et al. The role of Nrf2 in
liver disease: novel molecular mechanisms and
therapeutic approaches[J]. Front Pharmacol, 2018, 9:
1428.
[12]LEE J C, TSENG C K, YOUNG K C, et al.
Andrographolide exerts anti-hepatitis C virus activity by
up-regulating haeme oxygenase-1 via the p38 MAPK/
Nrf2 pathway in human hepatoma cells [J]. Br J
Pharmacol, 2014, 171(1): 237-252.
[13]YU Y F, CHEN Y H, SHI X P, et al.
Hepatoprotective effects of different mulberry leaf
extracts against acute liver injury in rats by alleviating
oxidative stress and inflammatory response[J]. Food
Funct, 2022, 13(16): 8593-8604.
[14]SUN B, JIA Y M, YANG S, et al. Sodium butyrate
protects against high-fat diet-induced oxidative stress in
rat liver by promoting expression of nuclear factor
E2-related factor 2[J]. Br J Nutr, 2019, 122(4):
400-410.
[15]王晶晶. 丁酸钠对LPS诱发的乳腺炎小鼠血乳屏障的
保护作用及其机制的初步研究[D]. 长春: 吉林大学,
2018.
[16]王 华. 细菌脂多糖诱导小鼠急性凋亡性肝损伤的分子
机制[D]. 合肥: 安徽医科大学, 2009.
[17]WANG H Y, WEI X G, WEI X, et al. 4-hydroxybenzo
[d]oxazol-2(3H)-one ameliorates LPS/D-GalN-induced
acute liver injury by inhibiting TLR4/NF-κB and MAPK
signaling pathways in mice[J]. Int Immunopharmacol,
2020, 83: 106445.
[18]CAO Y W, JIANG Y, ZHANG D Y, et al. Protective
effects of Penthorum Chinense Pursh against chronic
ethanol-induced liver injury in mice[J].
J Ethnopharmacol, 2015, 161: 92-98.
[19]RUART M, CHAVARRIA L, CAMPRECIÓS G, et al.
Impaired endothelial autophagy promotes liver fibrosis by
aggravating the oxidative stress response during acute
liver injury[J]. J Hepatol, 2019, 70(3): 458-469.
[20]YANG W C, TAO K X, ZHANG P, et al. Maresin 1
protects against lipopolysaccharide/d-galactosamineinduced
acute liver injury by inhibiting macrophage
pyroptosis and inflammatory response [J]. Biochem
Pharmacol, 2022, 195: 114863.
[21]MA N N, ABAKER J A, BILAL M S, et al. Sodium
butyrate improves antioxidant stability in sub-acute
ruminal acidosis in dairy goats[J]. BMC Vet Res, 2018,
14(1): 275.
[22]幸新干. 丁酸钠对H2O2诱导氧化应激HepG2细胞氧化
还原稳态及线粒体能量代谢的影响[D]. 无锡: 江南
大学, 2017.
[23]WU K C, LIU J, KLAASSEN C D. Role of Nrf2 in
preventing ethanol-induced oxidative stress and lipid
accumulation[J]. Toxicol Appl Pharmacol, 2012,
262(3): 321-329.
[24]QIU M Y, XIAO F Q, WANG T N, et al. Protective
effect of Hedansanqi Tiaozhi Tang against non-alcoholic
fatty liver disease in vitro and in vivo through activating
Nrf2/HO-1 antioxidant signaling pathway [J].
Phytomedicine, 2020, 67: 153140.
[25]MA H Y, YANG B Y, YU L, et al. Sevoflurane
protects the liver from ischemia-reperfusion injury by
regulating Nrf2/HO-1 pathway[J]. Eur J Pharmacol,
2021, 898: 173932.
[26]TANG X, SUN Y J, LI Y R, et al. Sodium butyrate
protects against oxidative stress in high-fat-diet-induced
obese rats by promoting GSK-3β/Nrf2 signaling pathway
and mitochondrial function[J]. J Food Biochem, 2022,
46(10): e14334.
[27]LUO Q J, SUN M X, GUO Y W, et al. Sodium
butyrate protects against lipopolysaccharide-induced liver
injury partially via the GPR43/β-arrestin-2/NF-κB
network[J]. Gastroenterol Rep, 2021, 9(2): 154-165.

