沉默CD147 基因对姜黄素抑制前列腺癌细胞增殖、迁移、侵袭和诱导凋亡的影响



[摘 要] 目的:探讨姜黄素对人前列腺癌C4-2细胞和LNCaP细胞增殖、迁移及侵袭的影响,并阐明其可能的作用机制。方法:采用慢病毒转染系统分别转染 C4-2 细胞和 LNCaP 细胞,作为shCD147-C4-2 组和shCD147-LNCaP 组。采用RNA 干扰技术制备沉默CD147 基因细胞,以转入空载体的细胞作为阴性对照,分为shNC-C4-2 组(shNC-C4-2 细胞) 和shNC-LNCaP 组(shNC-LNCaP 细胞)。取生长对数期C4-2、LNCap、shCD147-C4-2 和shCD147-LNCaP 细胞, 加入20 μmol·L-1 姜黄素,处理0 和24 h 时,显微镜观察各组细胞形态表现。噻唑蓝(MTT) 法检测各组细胞增殖活性,细胞划痕实验检测各组细胞迁移率,Western blotting 法检测各组细胞中凋亡、侵袭和迁移相关蛋白表达水平。结果:与C4-2 组比较,沉默CD147 基因后shCD147-C4-2 组细胞中CD147 蛋白表达量明显减少;与LNCaP 组比较,沉默CD147 基因后shCD147-LNCaP 组细胞中CD147 蛋白表达量明显减少。与处理0 h 比较,20 μmol·L-1姜黄素处理24 h 后C4-2 组和LNCaP 组部分细胞出现凋亡征象,且有典型凋亡小体存在;shCD147-C4-2 组和shCD147-LNCaP 组细胞凋亡现象减弱。MTT 法检测, 与C4-2+0 μmol·L-1 姜黄素组比较, C4-2+20 μmol·L-1 姜黄素组、C4-2+40 μmol·L-1 姜黄素组、C4-2+60 μmol·L-1 姜黄素组和C4-2+80 μmol·L-1 姜黄素组细胞增殖活性均明显降低(Plt;0. 01); 与LNCaP+ 0 μmol·L-1姜黄素组比较,LNCaP+20 μmol·L-1姜黄素组、LNCaP+40 μmol·L-1姜黄素组、LNCaP+60 μmol·L-1 姜黄素组和LNCaP+80 μmol·L-1 姜黄素组细胞增殖活性均明显降低(Plt;0. 01);与shNC-C4-2 组比较,shNC-C4-2+20 μmol·L-1 姜黄素组细胞增殖活性明显降低(Plt;0. 01);与shNC-C4-2+20 μmol·L-1 姜黄素组比较,shCD147-C4-2+20 μmol·L-1 姜黄素组细胞增殖活性明显升高(Plt;0. 01);与shNC-LNCaP 组比较,shNC-LNCaP+20 μmol·L-1姜黄素组细胞增殖活性明显降低(Plt;0. 01); 与shNC-LNCaP+20 μmol·L-1 姜黄素组比较, shCD147-LNCaP+20 μmol·L-1 姜黄素组细胞增殖活性明显升高(Plt;0. 01)。细胞划痕愈合实验检测,姜黄素处理24 h,与C4-2 组比较,C4-2+20 μmol·L-1 姜黄素组和C4-2+40 μmol·L-1 姜黄素组细胞迁移率均明显降低(Plt;0. 01);与LNCaP 组比较,LNCaP+20 μmol·L-1 姜黄素组和LNCaP+40 μmol·L-1 姜黄素组细胞迁移率均明显降低(Plt;0. 01);与shNC-C4-2 组比较,shNC-C4-2+20 μmol·L-1姜黄素组细胞迁移率明显降低(Plt;0. 01); 与shNC-C4-2+20 μ mol·L-1 姜黄素组比较, shCD147-C4-2+20 μmol·L-1 姜黄素组细胞迁移率明显升高(Plt;0. 05);与shNC-LNCaP 组比较, shNC-LNCaP+20 μmol·L- 1 姜黄素组细胞迁移率明显降低 (Plt;0. 01);与shNC-LNCaP+20 μmo·l L-1姜黄素组比较,shCD147-LNCaP+20 μmo·l L-1姜黄素组细胞迁移率明显升高(Plt;0. 05)。Western blotting 法检测,与C4-2 组比较,C4-2+20 μmol·L-1姜黄素组和C4-2+40 μmol·L-1姜黄素组细胞中B 细胞淋巴瘤2 (Bcl-2) 相关X 蛋白(Bax)、裂解的含半胱氨酸的天冬氨酸蛋白酶3 (cleaved Caspase-3) 和聚二磷酸腺苷(ADP)-核糖聚合酶1 (PARP1)蛋白表达水平均明显升高(Plt;0. 01), Bcl-2 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01); 与LNCaP 组比较, LNCaP+20 μmol·L-1 姜黄素组和LNCaP+40 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 和PARP1 蛋白表达水平均明显升高(Plt;0. 01),LNCaP+40 μmol·L-1 姜黄素组Bcl-2蛋白表达水平明显降低(Plt;0. 01);与shNC-C4-2 组比较,shNC-C4-2+20 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 和PARP1 蛋白表达水平均明显升高(Plt;0. 01),Bcl-2 蛋白表达水平明显降低(Plt;0. 05);与shNC-C4-2+20 μmol·L-1姜黄素组比较,shCD147-C4-2+20 μmol·L-1姜黄素组细胞中Bax 和cleaved Caspase-3 蛋白表达水平均明显降低(Plt;0. 01)。与shNC-LNCaP 组比较, shNCLNCaP+20 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 和PARP1 蛋白表达水平均明显升高(Plt;0. 05 或Plt;0. 01),Bcl-2 蛋白表达水平明显降低(Plt;0. 05);与shNC-LNCaP+20 μmol·L-1姜黄素组比较,shCD147-LNCaP+20 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 和PARP1 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01),Bcl-2 蛋白表达水平明显升高(Plt;0. 05)。与C4-2 组比较,C4-2+20 μmol·L-1 姜黄素组和C4-2+40 μmol·L-1姜黄素组细胞中E-钙黏蛋白(E-cadherin) 蛋白表达水平均明显升高(Plt;0. 01),神经钙黏蛋白(N-cadherin) 和波形蛋白(Vimentin) 蛋白表达水平均明显降低(Plt;0. 01);与LNCaP 组比较,LNCaP+20 μmol·L-1姜黄素组和LNCaP+40 μmol·L-1姜黄素组细胞中E-cadherin 蛋白表达水平均明显升高(Plt;0. 01),LNCaP+40 μmol·L-1姜黄素组细胞中N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01);与shNC-C4-2 组比较,shNC-C4-2+20 μmol·L-1 姜黄素组细胞中N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01);与shNCC4-2+20 μmol·L-1姜黄素组比较,shCD147-C4-2+20 μmol·L-1姜黄素组细胞中E-cadherin 蛋白表达水平明显降低(Plt;0. 01),N-cadherin 和Vimentin蛋白表达水平均明显升高(Plt;0. 01);与shNC-LNCaP组比较,shNC-LNCaP+20 μmol·L-1 姜黄素组细胞中E-cadherin 蛋白表达水平明显升高(Plt;0. 01),N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01);与shNC-LNCaP+20 μmol·L-1姜黄素组比较,shCD147-LNCaP+20 μmol·L-1姜黄素组细胞中E-cadherin 蛋白表达水平明显降低(Plt;0. 01),N-cadherin 表达水平明显升高 (Plt;0. 05)。结论:姜黄素对体外前列腺癌细胞增殖、迁移和侵袭有抑制作用,并诱导细胞凋亡,沉默CD147 基因可在一定程度上降低其抑制作用和诱导细胞凋亡能力。
[关键词] 姜黄素; CD147; 前列腺肿瘤; 细胞侵袭; 细胞迁移
[中图分类号] R735.25 [文献标志码] A
前列腺癌是目前最常见的实体肿瘤之一,位居男性肿瘤第2 位,特别是在发达国家,占年新发肿瘤病例的19%,且高达4% 的前列腺癌患者在诊断时已经发生了转移,这也是导致男性肿瘤相关性死亡的主要原因,严重威胁人类健康[1]。姜黄素是由姜科和天南星科植物的块根或根茎中提取的一种小分子多酚类色素,具有抗氧化、抗炎、抗动脉粥样硬化和抗肿瘤等多种药理作用[2]。研究[3] 显示:即使在较大剂量时,姜黄素仍保持低毒、安全和耐受性好的特点。姜黄素作为一种有效的抗肿瘤药物, 可以有效调节与肿瘤发生有关的多种生物学途径[4]。姜黄素通过靶向不同的多步骤分子肿瘤发生,包括多种肿瘤细胞中的肿瘤起始期和进展期,干扰癌症发生发展[5-6]。CD147 是免疫球蛋白超家族的Ⅰ型跨膜糖蛋白,在多种细胞广泛表达,包括内皮细胞和上皮细胞等,是一种多功能糖蛋白[7]。CD147 介导肿瘤与基质之间的相互作用,加速肿瘤血管生成。CD147 的过度表达可促进血管内皮生长因子和基质金属蛋白酶(matrix metallo proteinase,MMP) 的大量产生,加速肿瘤血管的生成和生长。本课题组前期预研究发现: 姜黄素对C4-2 细胞和敲除CD147 的C4-2 细胞具有作用效果,推测其可能与CD147 基因的表达有关。YU 等[8] 研究表明:过表达的CD147 与恶性肿瘤临床病理特征有关。CD147 通过核因子κB (nuclear factor-κB,NF-κB)信号转导调节肿瘤的发生和发展。FANG 等[9] 研究显示: CD147 在调节前列腺癌细胞侵袭和迁移中具有重要作用, 其中CD147 调节Wnt/β 连环蛋白(β-catenin) 通路可能与前列腺癌细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)有关, 并且可能是前列腺癌的潜在治疗靶点。然而,CD147 促进肿瘤发生的潜在机制尚不清楚。在大部分癌症中, 癌症样本中CD147 水平明显高于正常对照组,与患者的预后密切相关,提示CD147在多种癌症中具有良好的预测价值[8]。本研究探讨姜黄素对前列腺癌细胞增殖、迁移、侵袭和诱导凋亡的影响,阐明其可能的作用机制,为姜黄素的临床应用提供参考。
1 材料与方法
1. 1 细胞、主要试剂和仪器 人前列腺癌 LNCaP细胞和C4-2 细胞由北华大学基础医学院病原生物学教研室保存。姜黄素和噻唑蓝(thiazolyl bluetetrazolium bromide,MTT) 购自美国Sigma 公司,Western blotting 检测试剂盒购自北京中山生物公司,CD147 抗体购自美国Signalway Antibody 公司,含半胱氨酸的天冬氨酸蛋白酶3 (cysteinylaspartate specific proteinase-3,Caspase-3)、聚二磷酸腺苷(adenosine diphosphate, ADP) -核糖聚合酶1 [poly (ADP-ribose) polymerase-1,PARP1]、B 淋巴细胞瘤2 (B-cell lymphoma-2, Bcl-2) 和Bcl-2 相关X 蛋白(Bcl-2-related X protein, Bax)均购自成都ZEN-BIOSCIENCE 公司,E-钙黏蛋白(E-cadherin)、神经钙黏蛋白(neural-cadherin,N-cadherin)、波形蛋白(Vimentin)、GAPDH 抗体及二抗均购自美国Santa Cruz 公司。MOTICAE31 显微镜购自北京汗盟紫星仪器仪表有限公司,伯乐-550 型全自动酶标仪购自上海领成生物科技有限公司,ECL 系统购自北京中山生物公司。
1. 2 细胞培养和分组 采用慢病毒转染系统分别转染C4-2细胞和LNCaP细胞,作为shCD147-C4-2组(沉默CD147 的shCD147-C4-2 细胞) 和shCD147-LNCaP 组(沉默CD147 的shCD147-LNCaP 细胞),不作处理的C4-2 细胞和LNCap 细胞作为C4-2 组和LNCap 组。37 ℃、5%CO2条件下,于含10% 胎牛血清和1% 青- 链霉素的RPMI-1640 培养基中培养。
1. 3 采用 RNA 干扰技术制备沉默 CD147 基因细胞 采用 TRIzol法提取稳定转染的前列腺癌细胞总RNA,按照试剂盒使用说明书进行操作。以1 μg RNA 为 模 板, 进 行 逆 转 录 PCR (reversetranscription,RT-PCR) 扩增,具体操作参照One-Step RT-PCR 说明书进行。设计引物P1 和P2 作为CD147 干扰序列, 引物浓度稀释至20 μmol·L-1。所用引物根据CD147 基因特异性的区域设计,预计RT-PCR 产物长度约为480 bp。引物序列:CD147上游引物P1 5'-AAGGTGGACTCCGACGACCAGTGG-3', CD147 下游引物 P2 5'-CTTCCGGCGCTTCTCGTAGAAG-3';GAPDH 上游引物 5'-TCGGAGTCAACGGATTTGGTCGTA-3', GAPDH下游引物5'-AGCCTTCTCCATGGTGGTGAAGA-3'。以转入空载体的细胞作为阴性对照,分为shNC-C4-2 组(shNC-C4-2 细胞)和shNC-LNCaP 组(shNC-LNCaP 细胞)。转染后采用0. 5 g·L-1 的嘌呤霉素筛选稳定转染的细胞。
1. 4 Western blotting 法检测沉默 CD147 基因细胞中CD147蛋白表达水平 收集培养的细胞,采用磷酸盐缓冲液(phosphate buffered saline,PBS) 缓冲液洗涤后加入裂解缓冲液裂解细胞,裂解25 min,1. 2×104 g 离心10 min,检测上清浓度,取6 μg 蛋白进行SDS-PAGE 电泳,转膜。室温下,PVDF 在5% 非脂肪牛乳中封闭膜2 h, 加入 CD147( 1∶1 000)和GAPDH (1∶1 000) 一抗, 在4 ℃环境中过夜。次日,用PBST 溶液洗涤,以1∶10 000 稀释度将膜与二抗在室温避光条件下孵育2 h,加底物发光并拍照。采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平,实验重复3 次。目的蛋白表达水平= 目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1. 5 显微镜观察各组细胞形态表现 取生长对数期C4-2 和LNCap 细胞及shCD147-C4-2 和shCD147-LNCaP 细胞, 加入20 μmol·L-1 姜黄素,并于姜黄素处理0 和24 h 时,倒置显微镜观察各组细胞形态表现并进行图像采集。
1. 6 MTT法检测各组细胞增殖活性 将对数生长期C4-2、LNCaP、shCD147-C4-2 和shCD147-LNCaP 细胞, 胰蛋白酶消化, 显微镜下观察到70%~80% 细胞形态收缩时,加入含血清培养液终止消化,转移至离心管中,1 000 g 离心4 min,离心后计数细胞,于培养皿中加入细胞悬液,以每孔1×104个细胞的密度接种于96 孔细胞培养板,放入细胞培养箱中培养24 h。将0、20、40、60 和80 μmol·L-1姜黄素处理各组细胞24 h,加入5 g·L-1MTT 每孔20 μL,孵育细胞4 h,DMSO 溶液溶解蓝紫色结晶, 于波长490 nm 处测定各组细胞吸光度(A) 值,计算细胞增殖活性。细胞增殖活性=实验孔A 值/对照孔A 值。
1. 7 细胞划痕实验检测各组细胞迁移率 取对数生长期C4-2 和LNCaP 细胞,调整细胞悬液浓度为每孔6×105 个细胞,接种于6 孔细胞培养板中,继续培养至细胞密度达到80%。无血清RMPI-1640培养基替换完全培养基,继续培养24 h。细胞完全汇合后,使用200 μL 注射器尖端于单层细胞每个孔上划痕,采用PBS 缓冲液洗涤细胞2 次以去除细胞碎片。倒置显微镜观察和拍摄细胞在划痕边缘处的迁移情况。分别加入20 和40 μmol·L-1姜黄素,继续培养24 h。记录穿过划痕边界的细胞数量,计算细胞迁移率,实验重复3 次。细胞迁移率= (0 h 划痕面积-24 h 划痕面积) /0 h 划痕面积×100%。
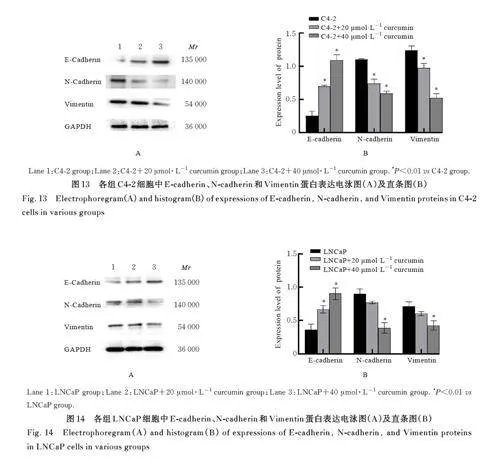
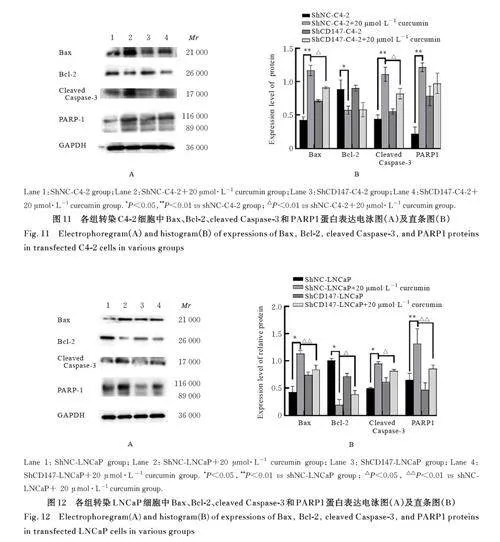
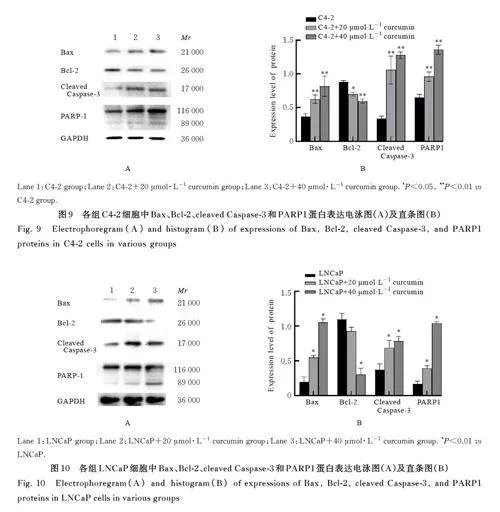
1. 8 Western blotting法检测各组细胞中凋亡、侵袭和迁移相关蛋白表达水平 收集培养的细胞,采用PBS 缓冲液洗涤后,加入裂解缓冲液裂解细胞,裂解25 min, 1. 2×104 g 离心10 min, 检测上清浓度, 取6 μ g 蛋白进行SDS-PAGE 电泳后转至PVDF 膜。室温下,于5% 非脂肪牛乳中封闭2 h,分别加入裂解的Caspase-3 (cleaved-Caspase-3)(1∶ 1 000)、PARP1(1∶ 1 000)、Bcl-2(1∶ 1 000)、Bax(1∶ 1 000)、 E-cadherin(1∶ 1 000)、 N-cadherin(1∶ 1 000)、Vimentin(1∶ 1 000)、CD147(1∶1 000)和GAPDH (1∶ 1 000), 于4 ℃ 环境中过夜。次日,用PBST 溶液洗涤,以1∶10 000 稀释度将膜与二抗在室温避光条件下孵育2 h,加底物发光并拍照。采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平,实验重复3 次。目的蛋白表达水平= 目的蛋白条带灰度值/内参蛋白条带灰度值。
1. 9 统计学分析 采用GraphPad Prism9. 0. 2统计软件进行统计学分析。各组细胞增殖活性、细胞迁移率和细胞中凋亡、侵袭及迁移相关蛋白表达水平均符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 沉默 CD147 基因后各组细胞中 CD147 蛋白表达情况 与 C4-2 组比较,沉默 CD147 基因后shCD147-C4-2 组细胞中CD147 蛋白表达量明显减少。与LNCaP 组比较, 沉 默 CD147 基 因 后shCD147-LNCaP 组细胞中CD147 蛋白表达量明显减少。见图1 和2。
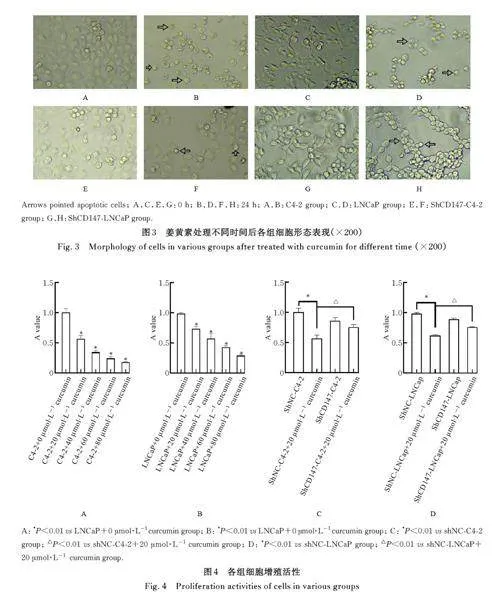
2. 2 各 组 细 胞 形 态 表 现 与 处 理 0 h 比 较,20 μmol·L-1姜黄素处理24 h 后C4-2 组和LNCaP 组细胞形态有明显变化,部分细胞出现凋亡征象,表现为细胞收缩变圆,胞体变小,与周围失去联系,胞膜形成泡状突起,胞质收缩,且有典型凋亡小体存在;shCD147-C4-2 组和shCD147-LNCaP 组细胞形态有明显变化,但细胞凋亡现象减弱。见图3。
2. 3 各组细胞增殖活性 与 C4-2+0 μmol·L-1姜黄素组比较,C4-2+20 μmol·L-1姜黄素组、C4-2+40 μmol·L-1 姜黄素组、C4-2+60 μmol·L-1 姜黄素组和C4-2+80 μmol·L-1 姜黄素组细胞增殖活性均明显降低(Plt;0. 01)。与LNCaP+0 μmol·L-1 姜黄素组比较, LNCaP+20 μ mol·L-1 姜黄素组、LNCaP + 40 μmol·L-1 姜 黄 素 组、LNCaP +60 μmol·L-1 姜黄素组和LNCaP+80 μmol·L-1姜黄素组细胞增殖活性均明显降低(Plt;0. 01)。与shNC-C4-2 组比较, shNC-C4-2+20 μmol·L-1 姜黄素组细胞增殖活性明显降低(Plt;0. 01); 与shNC-C4-2 + 20 μmol·L-1 姜 黄 素 组 比 较,shCD147-C4-2+20 μmol·L-1 姜黄素组细胞增殖活性明显升高(Plt;0. 01)。与shNC-LNCaP 组比较,shNC-LNCaP+20 μmol·L-1 姜黄素组细胞增殖活性明显降低(Plt;0. 01); 与shNC-LNCaP+20 μmol·L-1 姜黄素组比较, shCD147-LNCaP+20 μmol·L-1姜黄素组细胞增殖活性明显升高(Plt;0. 01)。见图4。
2. 4 各组细胞迁移率 姜黄素处理 24 h 后,与C4-2 组(68. 800% ± 1. 306%) 比 较, C4-2+20 μmol·L-1 姜黄素组和C4-2+40 μmol·L-1 姜黄素组细胞迁移率(44. 740%±1. 619% 和30. 230%±2. 352%)均明显降低(Plt;0. 01); 与LNCaP 组(40. 440%±5. 354%)比较, LNCaP+20 μmol·L-1姜黄素组和LNCaP+40 μmol·L-1 姜黄素组细胞迁移率(16. 540%±1. 518% 和5. 679%±2. 844%)均明显降低(Plt;0. 01)。见图5 和6。与shNC-C4-2 组(49. 980%±4. 614%) 比较,shNC-C4-2+20 μmol·L-1姜黄素组细胞迁移率(20. 540%±1. 979%) 明显降低(Plt;0. 01);与shNC-C4-2+20 μmol·L-1 姜黄素组比较, shCD147-C4-2+20 μmol·L-1 姜黄素组细胞迁移率(28. 880%±2. 174%) 明显升高(Plt;0. 05)。与shNC-LNCaP 组(51. 970%±6. 964%)比较,shNC-LNCaP+20 μmol·L-1姜黄素组细胞迁移率(11. 670%±3. 055%) 明显降低(Plt;0. 01);与shNC-LNCaP+20 μmol·L-1 姜黄素组比较,shCD147-LNCaP+20 μmol·L-1 姜黄素组细胞迁移率(24. 220%±1. 072%) 明显升高(Plt;0. 05)。见图7 和8。
2. 5 各组细胞中 Bax、Bcl-2、cleaved Caspase-3 和PARP1 蛋白表达水平 与 C4-2 组比较,C4-2+20 μmol·L-1 姜黄素组和C4-2+40 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 及PARP1 蛋白表达水平均明显升高(Plt;0. 01),Bcl-2 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01)。与LNCaP 组比较,LNCaP+20 μmol·L-1 姜黄素组和LNCaP+40 μmol·L-1姜黄素组细胞中Bax、cleaved Caspase-3及PARP1 蛋白表达水平均明显升高(Plt;0. 01),LNCaP+40 μmol·L-1姜黄素组Bcl-2 蛋白表达水平明显降低(Plt;0. 01), LNCaP+20 μmol·L-1 姜黄素组Bcl-2 蛋白表达水平差异无统计学意义(Pgt;0. 05)。与shNC-C4-2 组比较, shNC-C4-2+20 μmol·L-1姜黄素组细胞中Bax、cleaved Caspase-3和PARP1 蛋白表达水平均明显升高(Plt;0. 01),Bcl-2 蛋白表达水平明显降低(Plt;0. 05); 与shNC-C4-2 + 20 μmol·L-1 姜 黄 素 组 比 较,shCD147-C4-2+20 μmol·L-1 姜黄素组细胞中Bax和cleaved Caspase-3 蛋白表达水平均明显降低(Plt;0. 01),Bcl-2 和PARP 蛋白表达水平差异均无统计学意义(Pgt;0. 05)。与shNC-LNCaP 组比较,shNC-LNCaP+20 μmol·L-1 姜黄素组细胞中Bax、cleaved Caspase-3 和PARP1 蛋白表达水平均明显升高(Plt;0. 05 或Plt;0. 01),Bcl-2 蛋白表达水平 明 显 降 低(Plt;0. 05); 与 shNC-LNCaP +20 μmol·L-1 姜黄素组比较, shCD147-LNCaP+20 μmol·L-1 姜 黄 素 组 细 胞 中 Bax、cleavedCaspase-3 和PARP1 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01),Bcl-2 蛋白表达水平明显升高(Plt;0. 05)。见图9~12。
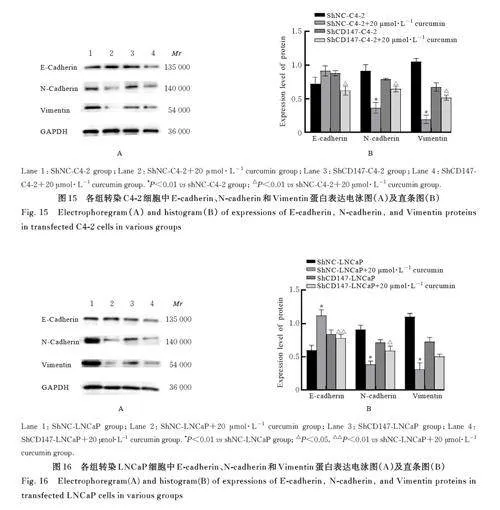
2. 6 各 组 细 胞 中 E-cadherin、N-cadherin 和Vimentin蛋白表达水平 与 C4-2组比较,C4-2+20 μmol·L-1 姜黄素组和C4-2+40 μmol·L-1 姜黄素组细胞中E-cadherin 蛋白表达水平均明显升高(Plt;0. 01), N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01)。与LNCaP 组比较,LNCaP+20 μmol·L-1姜黄素组和LNCaP+40 μmol·L-1姜黄素组细胞中E-cadherin 蛋白表达水平均明显升高(Plt;0. 01), LNCaP+40 μmol·L-1 姜黄素组细胞中N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01), LNCaP+20 μmol·L-1 姜黄素组细胞中N-cadherin 和Vimentin 蛋白表达水平差异均无统计学意义(Pgt;0. 05)。与shNC-C4-2组比较,shNCC4-2+20 μmol·L-1 姜黄素组细胞中N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01),E-cadherin 蛋白表达水平差异无统计学意义(Pgt;0. 05); 与shNC-C4-2+20 μmol·L-1 姜黄素组比较, shCD147-C4-2+20 μmol·L-1 姜黄素组细胞中E-cadherin 蛋白表达水平明显降低(Plt;0. 01),N-cadherin 和Vimentin 蛋白表达水平均明显升高(Plt;0. 01)。与 shNC-LNCaP 组 比 较, shNCLNCaP+20 μmol·L-1 姜黄素组细胞中E-cadherin蛋白表达水平明显升高(Plt;0. 01),N-cadherin 和Vimentin 蛋白表达水平均明显降低(Plt;0. 01);与shNC-LNCaP+20 μmol·L-1 姜黄素组比较,shCD147-LNCaP+20 μmol·L-1 姜黄素组细胞中E-cadherin 蛋白表达水平明显降低(Plt;0. 01),N-cadherin 表 达 水 平 明 显 升 高(Plt;0. 05),Vimentin 蛋白表达水平差异无统计学意义(Pgt;0. 05)。见图13~16。
3 讨 论
目前, 前列腺癌患者的治疗选择取决于肿瘤性质、前列腺特异性抗原(prostate specific antige,PSA) 水平、临床TNM 分期和Gleason 评分[10]。前列腺癌患者表现为局限病变或晚期病变,对于局限性前列腺癌患者,主要为根治性切除治疗,包括前列腺癌切除术和放疗期联合或不联合辅助雄激素剥夺, 但三分之一的患者可能会出现复发[11]。对于已扩散到前列腺以外晚期病变并复发的癌症患者,多采用雄激素剥夺疗法,但相关疗法最终会对初始治疗产生耐药性,可用的治疗方案价格昂贵,并且会带来严重的不良反应[12-13]。尽管有可用的治疗方案,但前列腺癌仍然无法治愈,因此有必要寻找新的具有成本效益且不良反应小和疗效更高的前列腺癌治疗方法。
姜黄素通过与多种免疫介质相互作用发挥其免疫调节能力,能够通过改变细胞的基因表达影响和调节多种分子靶标[14]。姜黄素具有多靶向特性,能够调节多种转录因子、炎性细胞因子、酶、激酶、生长因子、受体和细胞凋亡蛋白,其类似物可通过调节多种信号通路和抑制细胞增殖、侵袭及迁移和血管生成,抑制肿瘤发生发展[15-18]。研究[19-20]显示:姜黄素在宫颈癌、乳腺癌和肺癌等癌症治疗中发挥抗癌特性。
本研究结果显示: 姜黄素对C4-2 细胞和LNCaP 细胞均产生了明显的增殖抑制作用, 并随着姜黄素浓度的升高,其抑制作用不断增强。姜黄素处理后,细胞中Bcl-2 蛋白表达减少,Bax 蛋白表达增加,cleaved Caspase-3 激活增加,PARP1 蛋白表达增加, 提示线粒体途径的凋亡途径启动。EMT 是上皮细胞获得间充质细胞的特征,使细胞运动性和迁移能力增强[21-22]。在EMT 表型获得过程中,E-cadherin 蛋白表达下调是减少细胞间黏附的关键步骤, 导致上皮结构失去稳定性[23]。本研究结果显示: 姜黄素处理后, 细胞迁移率明显降低, 且E-cadherin 蛋白表达上调, N-cadherin 和Vimentin 蛋白表达下调,提示前列腺癌细胞侵袭行为受到姜黄素药物抑制。
CD147 又称细胞外MMP 诱导因子,其已被证实具有黏附分子的特性,能够介导细胞间或细胞-基质的黏附[24]。研究[25] 显示:CD147 促进成纤维细胞和肿瘤基质细胞产生MMP, MMP 可降解基膜和细胞外基质中的成分,也可能参与癌症转移扩散的晚期,即癌细胞进入、存活和离开血管或淋巴管。CD147 还能够在RNA 和蛋白水平影响血管内皮生长因子的表达,促进肿瘤血管系统的生长[26]。此外,CD147 是一种多功能蛋白,其功能多样性可能与不同的翻译后修饰有关[27]。糖基化的差异修饰可能与细胞类型特异性或恶性肿瘤有关,因此,CD147 的表达可能在前列腺癌的进展中起重要作用,检测其水平有助于预测前列腺癌的预后。
本研究结果显示: 姜黄素作用前列腺癌C4-2和LNCaP 细胞的过程中,可能通过CD147 位点发挥作用,沉默CD147 后,姜黄素药物作用能力减弱,提示在前列腺癌C4-2 细胞和LNCaP 细胞的增殖、凋亡、侵袭和迁移过程中,CD147 蛋白发挥重要的负调控作用。
综上所述,姜黄素可抑制体外前列腺癌细胞的增殖、侵袭和迁移,并诱导细胞凋亡,沉默CD147基因可在一定程度上降低其抑制作用和诱导细胞凋亡能力。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:王馨参与研究设计、实验操作和论文撰写,赵杰瑞参与实验操作,郭玉苗和陈姝彤参与数据收集、整理及分析,侯宗昊参与实验操作,张若文参与论文审校。
[参考文献]
[1] WAHAB N AABD, LAJIS N H, ABAS F, et al.
Mechanism of anti-cancer activity of curcumin on
androgen-dependent and androgen-independent prostate
cancer[J]. Nutrients, 2020, 12(3): 679.
[2] ZHONG W D, HAN Z D, HE H C, et al. CD147,
MMP-1, MMP-2 and MMP-9 protein expression as
significant prognostic factors in human prostate
cancer[J]. Oncology, 2008, 75(3/4): 230-236.
[3] ZHONG W D, LIANG Y X, LIN S X, et al.
Expression of CD147 is associated with prostate cancer
progression[J]. Int J Cancer, 2012, 130(2): 300-308.
[4] PERRONE D, ARDITO F, GIANNATEMPO G, et al.
Biological and therapeutic activities, and anticancer
properties of curcumin[J]. Exp Ther Med, 2015,
10(5): 1615-1623.
[5] COSTEA T, NAGY P, GANEA C, et al. Molecular
mechanisms and bioavailability of polyphenols in prostate
cancer[J]. Int J Mol Sci, 2019, 20(5): 1062.
[6] DUVOIX A, BLASIUS R, DELHALLE S, et al.
Chemopreventive and therapeutic effects of curcumin[J].
Cancer Lett, 2005, 223(2): 181-190.
[7] 程 继,高 丹,付 国,等.姜黄素对前列腺癌PC-3细
胞体外生长的影响[J]. 西部医学, 2022, 34(6):
808-812.
[8] YU B B, ZHANG Y, WU K L, et al. CD147 promotes
progression of head and neck squamous cell carcinoma
via NF-kappa B signaling[J]. J Cell Mol Med, 2019,
23(2): 954-966.
[9] FANG F, LI Q, WU M Y, et al. CD147 promotes
epithelial-mesenchymal transition of prostate cancer cells
via the Wnt/β -catenin pathway[J]. Exp Ther Med,
2020, 20(4): 3154-3160.
[10]TREWARTHA D, CARTER K. Advances in prostate
cancer treatment[J]. Nat Rev Drug Discov, 2013,
12(11): 823-824.
[11]MELLMAN I, COUKOS G, DRANOFF G. Cancer
immunotherapy comes of age[J]. Nature, 2011,
480(7378): 480-489.
[12]CHEN J J, ZHANG D Q, YAN W Y, et al.
Translational bioinformatics for diagnostic and prognostic
prediction of prostate cancer in the next-generation
sequencing era [J]. Biomed Res Int, 2013, 2013:
901578.
[13]SEIDENFELD J, SAMSON D J, HASSELBLAD V,
et al. Single-therapy androgen suppression in men with
advanced prostate cancer: a systematic review and metaanalysis
[J]. Ann Intern Med, 2000, 132(7): 566-577.
[14]TERMINI D, DEN HARTOGH D J, JAGLANIAN A,
et al. Curcumin against prostate cancer: current
evidence[J]. Biomolecules, 2020, 10(11): 1536.
[15]VIEGAS F P D, GONTIJO V S, DE FREITAS
SILVA M, et al. Curcumin, resveratrol and cannabidiol
as natural key prototypes in drug design for
neuroprotective agents[J]. Curr Neuropharmacol, 2022,
20(7): 1297-1328.
[16]CHEN M, DU Z Y, ZHENG X, et al. Use of curcumin
in diagnosis, prevention, and treatment of Alzheimer’s
disease[J]. Neural Regen Res, 2018, 13(4): 742-752.
[17]HUANG M T , WANG Z Y , GEORGIADIS C A ,
et al. Inhibitory effects of curcumin on tumor initiation
by benzo [a] pyrene and 7, 12-dimethylbenz [a]
anthracene[J]. Carcinogenesis, 1992, 13(11): 2183-2186.
[18]RAVINDRAN J, PRASAD S, AGGARWAL B B.
Curcumin and cancer cells: how many ways can curry
kill tumor cells selectively?[J]. AAPS J, 2009, 11(3):
495-510.
[19]ANAND P, SUNDARAM C, JHURANI S, et al.
Curcumin and cancer: an“ old-age” disease with an“ ageold”
solution[J]. Cancer Lett, 2008, 267(1): 133-164.
[20]MOMTAZI-BOROJENI A A, HAFTCHESHMEH S M,
ESMAEILI S A, et al. Curcumin: a natural modulator
of immune cells in systemic lupus erythematosus[J].
Autoimmun Rev, 2018, 17(2): 125-135.
[21]BUYUK B, JIN S, YE K M. Epithelial-tomesenchymal
transition signaling pathways responsible
for breast cancer metastasis[J]. Cell Mol Bioeng, 2022,
15(1): 1-13.
[22]TAN T S, SHI P F, ABBAS M N, et al. Epigenetic
modification regulates tumor progression and metastasis
through EMT (Review)[J]. Int J Oncol, 2022,
60(6): 70.
[23]ZHANG N, HÄRING M, WOLF F, et al. Dynamics
and functions of E-cadherin complexes in epithelial cell
and tissue morphogenesis[J]. Mar Life Sci Technol,
2023, 5(4): 585-601.
[24]YE Y, LI S L, WANG Y, et al. The role of CD147
expression in prostate cancer: a systematic review and
meta-analysis[J]. Drug Des Devel Ther, 2016, 10:
2435-2442.
[25]NYALALI A M K, LEONARD A U, XU Y X, et al.
CD147: an integral and potential molecule to abrogate
hallmarks of cancer [J]. Front Oncol, 2023, 13:
1238051.
[26]JIA L, WANG H X, QU S X, et al. CD147 regulates
vascular endothelial growth factor-a expression,
tumorigenicity, and chemosensitivity to curcumin in
hepatocellular carcinoma[J]. IUBMB Life, 2008,
60(1): 57-63.
[27]KANEKURA T. CD147/basigin is involved in the
development of malignant tumors and T-cell-mediated
immunological disorders via regulation of glycolysis[J].
Int J Mol Sci, 2023, 24(24): 17344.

