人参皂苷Rh1 通过激活Nrf2/HO-1 信号通路对糖尿病小鼠肾脏损伤的改善作用

[摘 要] 目的:探讨人参皂苷Rh1对糖尿病 (DM) 小鼠肾损伤的保护作用,并阐明其作用机制。方法:应用高脂高糖饲养佐以腹腔注射链脲佐菌素(STZ)法制备糖尿病肾脏疾病(DKD)模型。将48只C57/BL6 成模小鼠随机分为模型组、核因子红细胞2 相关因子2 (Nrf2) 抑制剂ML385 组(ML385 组)(30 mg·kg-1 ML385)、人参皂苷Rh1 组(G-Rh1 组)(30 mg·kg-1 人参皂苷Rh1) 和G-Rh1+ML385 组(30 mg·kg- 1 人参皂苷Rh1+30 mg·kg-1 ML385),每组12 只,另外12 只C57/BL6 小鼠作为对照组。作用8 周后,全自动分析仪检测各组小鼠血清中空腹血糖(FBG)、尿素氮(BUN) 和血肌酐(Scr)水平及尿液中24 h 尿蛋白(24 h UP) 水平,并计算肾脏指数。试剂盒检测各组小鼠肾组织中超氧化物歧化酶(SOD) 和乳酸脱氢酶(LDH) 活性及丙二醛(MDA) 水平,Western blotting 法检测各组小鼠肾组织中Nrf2和血红素加氧酶1(HO-1)蛋白表达水平。结果:与对照组比较,模型组、ML385组和G-Rh1+ML385组小鼠血清中FBG 水平和肾脏指数均明显升高(Plt;0. 01),G-Rh1 组小鼠血清中FBG水平明显升高(Plt;0. 01);与模型组比较,ML385 组小鼠肾脏指数明显升高(Plt;0. 05),G-Rh1 组小鼠FBG 水平和肾脏指数均明显降低(Plt;0. 05 或Plt;0. 01);与G-Rh1 组比较,G-Rh1+ML385 组小鼠FBG 水平和肾脏指数均明显升高(Plt;0. 01)。与对照组比较,模型组、ML385 组、G-Rh1 组和G-Rh1+ML385 组小鼠血清中BUN 和Scr 水平及尿液中24 h UP 水平均明显升高(Plt;0. 01);与模型组比较,ML385 组小鼠血清中BUN 水平及尿液中24 h UP 水平均明显升高(Plt;0. 05),G-Rh1 组小鼠血清中BUN 和Scr 水平及尿液中24 h UP 水平均明显降低(Plt;0. 01); 与G-Rh1 组比较, G-Rh1+ML385 组小鼠血清中BUN 和Scr 水平及尿液中24 h UP 水平均明显升高(Plt;0. 01)。与对照组比较,模型组、ML385 组、G-Rh1 组和G-Rh1+ML385 组小鼠肾组织中SOD 活性均明显降低(Plt;0. 01),MDA 水平和LDH 活性均明显升高(Plt;0. 01);与模型组比较,ML385 组小鼠肾组织中SOD 活性明显降低(Plt;0. 05),MDA 水平明显升高(Plt;0. 05),G-Rh1 组小鼠肾组织中SOD 活性明显升高(Plt;0. 01),MDA 水平和LDH 活性均明显降低(Plt;0. 01);与G-Rh1 组比较,G-Rh1+ML385 组小鼠肾组织中SOD 活性明显降低(Plt;0. 01),MDA 水平和LDH 活性均明显升高(Plt;0. 01)。与对照组比较,模型组、ML385 组、G-Rh1 组和G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01);与模型组比较,ML385 组和G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1蛋白表达水平均明显降低(Plt;0. 05),G-Rh1 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显升高(Plt;0. 01);与G-Rh1 组比较,G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 01)。结论:人参皂苷Rh1可降低氧化应激,改善肾功能,对DM小鼠肾脏损伤具有保护作用,其作用机制可能与激活Nrf2/HO-1 信号通路有关。
[关键词] 人参皂苷Rh1; 糖尿病; 肾损伤; 核因子红细胞2 相关因子2; 氧化应激
[中图分类号] R285. 5 [文献标志码] A
糖尿病肾脏疾病(diabetic kidney disease,DKD) 是临床上常见的一种慢性肾病, 其起病隐匿,形成机制涉及糖脂代谢紊乱、氧化应激、炎症和自噬凋亡等多方面因素,目前尚无特异性的治疗措施,部分患者因难以控制的病情最终发展至肾衰竭,严重危害生命健康[1-2]。因此,探讨DKD 的发病机制及其有效治疗手段是目前临床亟待解决的问题。研究[3] 显示:氧化应激功能障碍是DKD 的一个关键触发因素。核因子红细胞2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2) 是调节和维持组织细胞内氧化还原稳态的关键转录因子,其通过调控下游抗氧化基因谷胱甘肽过氧化物酶4 (glutathione peroxidase 4, GPX4) 和血红素加氧酶1 (heme oxygenase-l,HO-1) 等转录,调节细胞氧化应激,保护细胞免受过氧化损害。作为经典抗氧化通路, Nrf2/HO-1 通路与DKD 有密切关联。Nrf2 敲除的糖尿病(diabetes mellitus,DM)小鼠, HO-1 表达下调, 肾脏组织氧化损伤加重,而激活Nrf2 可以抑制氧化应激进而减轻DKD 的肾脏损伤[4-5]。目前, Nrf2/HO-1 信号通路已被作为防治DKD 的途径之一,靶向氧化应激成为DKD 潜在治疗策略。在DKD 治疗方面,中医药表现出多组分、多靶点和不良反应少的优势,可通过调节转化生长因子β1 (transforming growth factor- β1,TGF-β1) 和Nrf2 等多种信号通路,发挥改善糖脂代谢紊乱、减轻氧化应激和炎症损伤、抗纤维化及调节自噬凋亡等多重作用[6-7]。同时,人参及其有效成分在防治DM 及其慢性并发症的研究[8-10] 日益增多。本课题组前期研究[11-13] 显示: 发酵红参总皂苷能够抑制高糖诱导的大鼠肾小管上皮细胞间质转化,改善肾纤维化;人参皂苷Rh2 能够降低DM大鼠组织氧化应激水平和减少间质纤维化,保护心肌和肾脏。但目前关于人参皂苷Rh1 对DKD 肾脏损伤防治作用的相关研究较少。本研究构建DKD模型小鼠,探讨人参皂苷Rh1 对DKD 的改善作用,并基于Nrf2/HO-1 信号通路进一步阐明其作用机制,以期为DKD 的防治提供实验依据和新的思路。
1 材料与方法
1. 1 实验动物、主要试剂和仪器 60只SPF级6周龄雄性C57/BL6 小鼠,体质量20~24 g,购自长春亿斯实验动物技术有限责任公司, 动物生产许可证 号: SCXK (吉) 2018-0007。 链 脲 佐 菌 素(streptozotocin,STZ) 购自美国Sigma 公司,Nrf2抑制剂ML385 购自美国CSNpharm 公司, 人参皂苷Rh1 (纯度为98%) 由吉林大学药学院提供,血肌酐(serum creatinine,Scr)、尿素氮(blood ureanitrogen, BUN)、尿蛋白(urine protein, UP)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA) 和乳酸脱氢酶(lactate dehydrogenase, LDH) 检测试剂盒均购自南京建成生物工程研究所,兔抗Nrf2 和HO-1 抗体和羊抗兔二抗及ECL 超敏试剂盒均购自美国Proteintech 公司。蛋白电泳仪购自美国Bio-Rad 公司,全自动酶标仪购自瑞士Tecan 公司,凝胶成像系统购自德国Analytikjena 公司。
1. 2 DKD 模型小鼠制备、分组和给药 将 60 只C57/BL6 小鼠适应性喂养1 周后,随机选取其中的10 只小鼠作为对照组(给予普通饲料喂养),剩余50 只用于造模的小鼠给予高脂高糖饲料(常规饲料中加入10% 猪油、20% 蔗糖、2. 5% 胆固醇和1% 胆酸钠) 喂养。喂养4周后,造模小鼠禁食不禁水12 h,按照50 mg·kg-1 腹腔注射STZ, 连续注射5 d, 而对照组小鼠仅注射等体积柠檬酸盐缓冲液。在末次注射后的第7 天尾静脉采血检测空腹血糖(fastingblood glucose, FBG)水平, FBG≥16. 7 mmol·L-1者确定为DM 模型。除去2 只未成模小鼠(纳入对照组), 剩余DM 模型小鼠高脂高糖饲料继续喂养4 周, 收集24 h 尿液, UP≥30 mg·dL-1 即为DKD模型小鼠。将48只DKD模型小鼠随机分为模型组、ML385 组、人参皂苷Rh1组(G-Rh1组) 和G-Rh1+ML385组,每组12只,其中ML385 组、G-Rh1 组和G-Rh1+ML385组小鼠每日1次分别给予30 mg·kg- 1ML385 腹腔注射、30 mg·kg-1 人参皂苷Rh1 灌服和30 mg·kg- 1 人参皂苷Rh1 灌服+30 mg·kg-1ML385 腹腔注射,连续8 周,实验期间对照组和模型组小鼠仅灌服和注射等量生理盐水。
1. 3 全自动分析仪检测各组小鼠血清中 FBG、BUN和Scr水平及尿液中24 h UP水平并计算肾脏指数 实验结束前 1 d,将各组小鼠称质量后放置于代谢笼内收集24 h 尿液,在留尿期间小鼠禁食但不禁水, 留取离心后去除沉渣的尿液用于UP 检测。各组小鼠在实验结束时采用麻醉后眼球采血法收集血液,离心后留取血清于EP 管,-20 ℃保存以用于FBG、BUN 和Scr 水平的检测。按照试剂说明书方法,应用全自动分析仪测定FBG、BUN、Scr和24 h UP 水平。将摘取的肾脏称质量后,计算肾脏指数。肾脏指数=肾脏质量(mg)/体质量(g)×100%。
1. 4 试剂盒检测各组小鼠肾组织中 SOD 和 LDH活性及MDA水平 取各组小鼠肾组织用匀浆器制备成组织匀浆,2 000 r·min-1 离心20 min 后吸取上清液,严格按照相应试剂盒说明书方法进行操作,测定各组小鼠肾脏组织中SOD 和LDH 活性及MDA 水平。
1. 5 Western blotting 法检测各组小鼠肾组织中Nrf2和HO-1蛋白表达水平 低温条件下提取各组小鼠肾组织蛋白后采用BCA 法进行定量。各组取含有50 μg 总蛋白待测样品上样电泳分离后,于冰水浴中100 V 电压恒压转膜,通过共孵育用5% 脱脂牛奶封闭PVDF 转膜上的非目的蛋白结合位点后,加入一抗,Nrf2 (1∶1 000) 和HO-1 (1∶1 000),4 ℃摇床孵育过夜,采用PBST 溶液振荡洗膜后加入相应的二抗,ECL 法显色后凝胶成像拍照,采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1. 6 统计学分析 采用 SPSS 19. 0统计软件进行统计学分析。各组小鼠肾脏指数, 血清中FBG、BUN 和Scr 水平及尿液中24 h UP 水平,各组小鼠肾组织中SOD 和LDH 活性及MDA 水平,肾组织中Nrf2 和HO-1 蛋白表达水平均符合正态分布,以x±s 表示,多组间样本均数比较采用单因素方差分析, 组间样本均数两两比较采用SNK-q 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
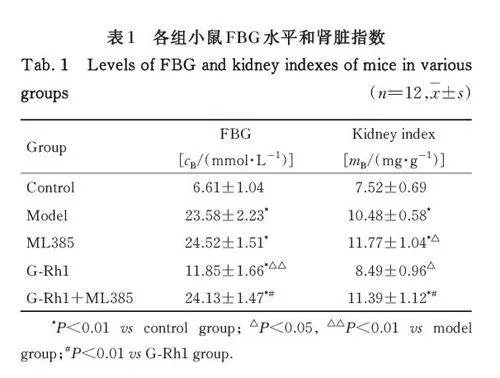
2. 1 各组小鼠血清中FBG水平和肾脏指数 与对照组比较,模型组、ML385 组和G-Rh1+ML385 组小鼠血清中FBG 水平和肾脏指数均明显升高(Plt;0. 01),G-Rh1组小鼠血清中FBG水平明显升高(Plt;0. 01)。与模型组比较,ML385 组小鼠肾脏指数明显升高(Plt;0. 05),血清中FBG 水平差异无统计学意义(Pgt;0. 05), G-Rh1 组小鼠血清中FBG 水平和肾脏指数均明显降低(Plt;0. 05或Plt;0. 01)。与G-Rh1 组比较,G-Rh1+ML385 组小鼠血清中FBG水平和肾脏指数均明显升高(Plt;0. 01)。见表1。
2. 2 各组小鼠血清中 BUN 和 Scr 水平及尿液中24 h UP水平 与对照组比较,模型组、ML385组、G-Rh1 组和G-Rh1+ML385 组小鼠血清中BUN 和Scr 水平及尿液中24 h UP 水平均明显升高(Plt;0. 01)。与模型组比较,ML385 组小鼠血清中BUN水平和尿液中24 h UP 水平均明显升高(Plt;0. 05),血清中Scr 水平差异无统计学意义(Pgt;0. 05),G-Rh1 组小鼠血清中BUN 和Scr 水平及尿液中24 h UP 水平均明显降低(Plt;0. 01)。与G-Rh1 组比较, G-Rh1+ML385 组小鼠血清中BUN 和Scr水平及尿液中24 h UP 水平均明显升高(Plt;0. 01)。见表2。
2. 3 各组小鼠肾组织中SOD和LDH活性及MDA水平 与对照组比较,模型组、ML385组、G-Rh1组和G-Rh1+ML385 组小鼠肾组织中SOD 活性均明显降低(Plt;0. 01), MDA 水平和LDH 活性均明显升高(Plt;0. 01)。与模型组比较, ML385 组小鼠肾组织中SOD 活性明显降低(Plt;0. 05),MDA水平明显升高(Plt;0. 05), LDH 活性差异无统计学意义(Pgt;0. 05),G-Rh1 组小鼠肾组织中SOD 活性明显升高(Plt;0. 01),MDA 水平和LDH 活性均明显降低(Plt;0. 01)。与G-Rh1 组比较,G-Rh1+ML385 组小鼠肾组织中SOD 活性明显降低(Plt;0. 01), MDA 水平和LDH 活性均明显升高(Plt;0. 01)。见表3。
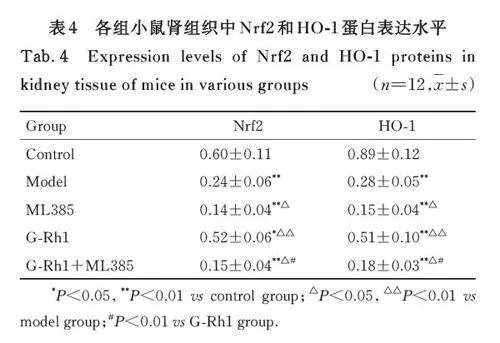
2. 4 各组小鼠肾组织中 Nrf2 和 HO-1 蛋白表达水平 与对照组比较,模型组、ML385组、G-Rh1组和G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 05 或Plt;0. 01)。与模型组比较, ML385 组和G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 05),G-Rh1 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显升高(Plt;0. 01)。与G-Rh1 组比较, G-Rh1+ML385 组小鼠肾组织中Nrf2 和HO-1 蛋白表达水平均明显降低(Plt;0. 01)。见图1 和表4。
3 讨 论
随着DM 的日益增多, 由DKD 所导致的终末期肾衰竭已成为临床迫切需要解决的问题。研究[1,6,14] 显示:高糖环境下的肾组织细胞增殖和分化,造成肾脏纤维化和功能紊乱,临床上主要表现为进行性肾功能障碍,早期以持续性蛋白尿为主,晚期则出现血清中Scr 和BUN 水平升高为主的肾功能衰竭表现。高糖环境下活性氧(reactiveoxygen species, ROS) 水平升高所引发的氧化应激损伤是导致和加重DKD 的重要因素[15]。氧化应激是指机体在内外环境刺激下, 机体内产生的ROS 引起的组织细胞反应, 是机体内氧化与抗氧化作用失衡的一种状态,可直接或间接造成DNA、蛋白质和脂质的氧化损伤,被认为是机体衰老和各种疾病的危险因素。在正常情况下,机体内氧化代谢所产生的少量自由基可被自身抗氧化系统及时清除,而在持续高糖环境中,超氧阴离子、羟自由基和过氧化氢等ROS 自由基大量产生,通过在肾组织中积累进一步破坏氧化平衡和抗氧化系统,导致肾组织氧化损伤[16-17]。本研究结果显示:与对照组比较,模型组DKD 小鼠血清中FBG 水平和肾脏指数明显升高,肾组织中LDH 活性和脂质代谢过氧化最终产物MDA 水平明显升高,而抗氧化酶SOD活性明显降低,血清中Scr 和BUN 及24 h UTP 水平明显升高,提示DKD 小鼠肾脏出现明显氧化应激损伤和肾功能障碍。
人参皂苷Rh1 为四环三萜达玛烷型皂苷,是一种极性较小的次级皂苷,属于人参三醇型。作为稀有皂苷,人参皂苷Rh1 在人参中含量极少,主要从红参中提取分离, Rg1 和Re 等人参三醇型皂苷在高温或酶解状态下可转化为Rh1。与基础碱性皂苷Rg1 和Re 等比较,Rh1 更易于人体吸收,具有更丰富的生物学活性。研究[18-21] 显示:人参皂苷Rh1 可通过下调TGF-β1/Smad 信号通路减轻肝脏和肾脏纤维化;人参皂苷Rh1 可通过抑制肿瘤细胞C-C 趋化因子配体20 (C-C chemokine lizgand 20,CCL20)和异黏蛋白基因的表达, 调控乳腺癌细胞外渗侵袭,通过Wnt 通路抑制肺腺癌细胞增殖;人参皂苷Rh1 通过调节5'- 磷酸腺苷(adenosine 5'-monophosphate, AMP) 活化蛋白激酶(AMPactivatedprotein kinase,AMPK) /磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K) /蛋白激酶B(protein kinase B, Akt) 信号通路而改善DKD,通过抑制c-Jun 氨基末端激酶(c-Jun N-terminalkinase,JNK) /P53 信号通路,减轻顺铂诱导的细胞凋亡。此外,人参皂苷Rh1 可以通过不同途径调节机体免疫活性, 抑制炎症反应。本研究结果显示: 人参皂苷Rh1 干预后, DKD 模型小鼠血清中FBG 水平和肾脏指数明显降低,肾组织中SOD 活性升高,LDH 活性和MDA 水平降低,血清中Scr和BUN 水平及尿液中24 h UP 水平均明显降低,提示人参皂苷Rh1 可降低FBG 水平, 减轻氧化应激损伤,改善肾脏功能,对DKD 小鼠肾损伤具有保护作用。
Nrf2/HO-1 信号通路是氧化还原过程中的重要调控通路。正常生理状态下, 细胞质中的Nrf2 以复合体形式保持在相对稳定的低水平状态,当受到ROS 等刺激后, 胞质内的Nrf2 与Kelch 样ECH 相关蛋白1 (Kelch-liked ECH-associated protein 1,Keap1) 发生解耦联,Nrf2 活化并转入细胞核,通过Maf 蛋白介导与抗氧化反应元件(anti-oxidantresponse element,ARE) 结合,激活下游靶基因转录,诱导机体产生HO-1 和GPX4 等抗氧化酶,以维持机体氧化还原状态平衡,发挥抗氧化损伤作用[22]。由Nrf2 介导的抗氧化通路紊乱是触发组织细胞衰老和氧化损伤的驱动力。研究[23-25] 显示:Nrf2/HO-1 通路与DKD、DM 心肌病(diabeticcardiomyopathy,DCM) 和DM 足溃疡等DM 并发症联系密切,激活Nrf2/HO-1 信号通路可降低氧化应激和炎症因子释放,改善DKD 大鼠肾脏和DCM 小鼠心肌损伤,并可促进血管新生,减轻DM 足溃疡。本研究结果显示:DKD 小鼠肾组织中Nrf2 和HO-1蛋白表达水平明显降低,氧化应激水平和肾功能障碍与Nrf2 抑制剂ML385 组相似,提示DKD 小鼠肾损伤与Nrf2/HO-1 信号通路抑制有关;给予人参皂苷Rh1 干预后,DKD 小鼠肾组织中Nrf2 和HO-1 蛋白表达水平升高,氧化应激水平降低,肾功能障碍改善,而给予Nrf2 抑制剂ML385 后,G-Rh1 的上述保护作用被部分抑制,提示人参皂苷Rh1 可通过激活Nrf2/HO-1 信号通路,减轻DKD 小鼠肾脏损伤。
综上所述,人参皂苷Rh1 能够降低氧化应激水平,有效地改善肾脏功能,对DKD 小鼠肾脏损伤具有保护作用, 其作用机制可能与其激活Nrf2/HO-1 信号通路、提高组织抗氧化水平有关。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:曲萌参与论文选题、数据整理和论文撰写,黄睿参与实验数据收集和整理,鞠欣达和刘雨昕参与实验操作,夏吉辰和黄佳欣参与数据统计学分析,于春艳参与数据核查,董志恒参与实验设计和论文审校。
[参考文献]
[1] BONNER R, ALBAJRAMI O, HUDSPETH J, et al.
Diabetic kidney disease[J]. Prim Care Clin Off Pract,
2020, 47(4): 645-659.
[2] HALMINEN J, SATTAR N, RAWSHANI A, et al.
Range of risk factor levels, risk control, and temporal
trends for nephropathy and end-stage kidney disease in
patients with type 1 and type 2 diabetes[J]. Diabetes
Care, 2022, 45(10): 2326-2335.
[3] WANG J Y, LIU Y, WANG Y Q, et al. The crosslink
between ferroptosis and kidney diseases[J]. Oxid
Med Cell Longev, 2021, 2021: 6654887.
[4] WU H, KONG L L, TAN Y, et al. C66 ameliorates
diabetic nephropathy in mice by both upregulating
NRF2 function via increase in miR-200a and inhibiting
miR-21[J]. Diabetologia, 2016, 59(7): 1558-1568.
[5] LI S W, ZHENG L S, ZHANG J, et al. Inhibition of
ferroptosis by up-regulating Nrf2 delayed the progression
of diabetic nephropathy[J]. Free Radic Biol Med, 2021,
162: 435-449.
[6] 任宇晴, 唐 堂, 李 颖, 等. 降糖丸抑制TGF-β1改善
糖尿病肾病小鼠肾损伤及纤维化[J]. 中国药理学
通报, 2023, 39(10): 1988-1993.
[7] 张雪辰, 王 镁. 中药药对治疗糖尿病肾病的药理作用
及临床应用研究进展[J]. 中国实验方剂学杂志, 2019,
25(9): 228-234.
[8] 冀 凯, 杜世豪, 李 新, 等. 人参皂苷Rg3抑制高糖诱
导的人肾小球系膜细胞过度增殖、炎症反应和PTX3
的表达[J]. 烟台大学学报(自然科学与工程版), 2020,
33(1):55-62.
[9] 洪 凌, 杨 振. 人参多糖对高脂饲料联合链脲菌素诱
导糖尿病小鼠的影响[J]. 人参研究, 2023, 4(2):6-8.
[10]郭学军, 陈 苑, 高 欣. 人参皂苷Rg1通过miR-144/
Nrf2/ARE通路对糖尿病大鼠肝损伤的影响[J]. 中国
老年学杂志, 2024, 1(44):116-121.
[11]曲 萌, 郑 鸿, 李 焱, 等. 发酵红参总皂苷对高糖
诱导大鼠肾小管上皮细胞间充质转化的抑制作用及
其机制[J]. 吉林大学学报(医学版), 2022, 48(5):
1182-1189.
[12]曲 萌, 王 宁, 董志恒. 人参皂苷Rh2对糖尿病大鼠
心肌氧化应激的影响[J]. 北华大学学报(自然科学
版), 2015, 16(6): 741-747.
[13]曲 萌, 姜雨竹, 黄 睿, 等. 人参皂苷Rh2对糖尿病肾
病变大鼠肾损伤的保护作用及其机制[J]. 吉林大学
学报(医学版), 2023, 49(5): 1168-1173.
[14]CHEN Y Y, PENG X F, LIU G Y, et al. Protein
arginine methyltranferase-1 induces ER stress and
epithelial-mesenchymal transition in renal tubular
epithelial cells and contributes to diabetic
nephropathy[J]. Biochim Biophys Acta Mol Basis Dis,
2019, 1865(10): 2563-2575.
[15]JHA J C, BANAL C, CHOW B S M, et al. Diabetes
and kidney disease: role of oxidative stress[J]. Antioxid
Redox Signal, 2016, 25(12): 657-684.
[16]HONG Y A, LIM J H, KIM M Y, et al. Extracellular
superoxide dismutase attenuates renal oxidative stress
through the activation of adenosine monophosphateactivated
protein kinase in diabetic nephropathy [J].
Antioxid Redox Signal, 2018, 28(17): 1543-1561.
[17]SAGOO M K, GNUDI L. Diabetic nephropathy: is
there a role for oxidative stress?[J]. Free Radic Biol
Med, 2018, 116: 50-63.
[18]郑维维, 张 珊, 唐 彧, 等. 基于CCL20/CCR6探讨
人参皂苷Rh1 调控乳腺癌细胞外渗的作用机制[J].
中国药理学与毒理学杂志, 2021, 35(10): 756-757.
[19]谭 晖, 李恩孝, 李 毅, 等. 人参皂苷Rh1通过Wnt通
路抑制肺腺癌A549细胞增殖的机制探讨[J]. 现代肿瘤
医学, 2020, 28(18): 3134-3137.
[20]SU W Y, LI Y, CHEN X, et al. Ginsenoside Rh1
improves type 2 diabetic nephropathy through AMPK/
PI3K/akt-mediated inflammation and apoptosis signaling
pathway[J]. Am J Chin Med, 2021, 49(5): 1215-1233.
[21]YANG Q, QIAN L, ZHANG S. Ginsenoside Rh1
alleviates HK-2 apoptosis by inhibiting ROS and the
JNK/p53 pathways [J]. Evid Based Complement
Alternat Med, 2020, 2020: 3401067.
[22]钱 斌, 尹小川, 李小军, 等. 基于Nrf2/ARE信号通路
探讨辛伐他汀减轻脂多糖诱导的大鼠急性肺损伤的
作用[J]. 中国免疫学杂志, 2021, 37(18): 2206-2211.
[23]SU L Y, CAO P, WANG H Y. Tetrandrine mediates
renal function and redox homeostasis in a streptozotocininduced
diabetic nephropathy rat model through
Nrf2/HO-1 reactivation[J]. Ann Transl Med, 2020,
8(16): 990.
[24]ZHAO C H, ZHANG Y, LIU H Y, et al. Fortunellin
protects against high fructose-induced diabetic heart
injury in mice by suppressing inflammation and oxidative
stress via AMPK/Nrf-2 pathway regulation[J]. Biochem
Biophys Res Commun, 2017, 490(2): 552-559.
[25]WANG S H, SHI M, ZHOU J, et al. Circulating
exosomal miR-181b-5p promoted cell senescence and
inhibited angiogenesis to impair diabetic foot ulcer via the
nuclear factor erythroid 2-related factor 2/heme
oxygenase-1 pathway[J]. Front Cardiovasc Med, 2022,
9: 844047.

