提升甜菜红色素光热稳定性的微乳液包封制备的研究


摘 要:本文采用助表面活性剂浓度法制备微乳液并将甜菜色素包封在W/O型微乳液体系内,以提升甜菜色素的光、热稳定性。结果发现,在pH3~7条件下色素比较稳定。通过条件优化得到甜菜色素微乳液的最佳制备工艺配方并得出以下数据:微乳体系中的水相占比为14.2%,葵花籽油占比为42.9%,混合乳化剂占比为42.9%,甜菜色素最大承载量约为1.42%。此外,制备的甜菜色素微乳液经鉴定为W/O型乳液,具有良好的体系稳定性,稳定性试验结果表明,微乳化对甜菜色素的光、热稳定性具有一定的提升效果。研究结果为甜菜色素的加工及其产品开发提供了理论基础。
关键词:甜菜色素;油包水;微乳液;稳定性
中图分类号: TS 201 文献标志码:A
颜色是评价食品的一项重要指标,色素可分为天然色素和人工合成色素。甜菜色素作为一种生物碱类天然色素,它不仅可以作为食品添加剂提供染色效果,而且还能作为一种生物活性物质提供保健功能。而甜菜色素的油不溶性和本身稳定性较低是制约其应用的最主要因素[1]。将甜菜色素制备成W/O型乳液后,不仅可以提升其本身的呈色稳定性,而且可以促进人们肠道吸收,能较大程度地发挥甜菜色素的保健作用。为了最大化乳液中的色素含量和提高乳液体系的稳定性,通过制作甜菜色素微乳液的方式研究微乳液体系的临界增溶水相条件,以获得甜菜色素含量高且体系稳定的甜菜色素乳液。本文对甜菜色素在不同pH体系下的呈色稳定性进行测定,以确定最适的水相pH范围,以此为基础展开甜菜色素微乳液制作方法的单因素试验,得出甜菜色素微乳液的最佳制备工艺,并通过对比甜菜色素微乳液与水溶液在光照、加热条件下的色素保留率,探究微乳液对甜菜色素稳定性的保护效果及甜菜色素微乳液体系的稳定性。研究结果可为甜菜色素的加工及其产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
甜菜色素粉末,上海百灵威化学技术有限公司;葵花籽油,中国上海佳格食品有限公司;司班80、吐温80、柠檬酸、磷酸氢二钠、甘氨酸、氢氧化钠、丙三醇、无水乙醇(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
AL 104电子天平、PL 2002电子天平、Five Easy实验室pH计,梅特勒-托利多(上海)有限公司;RHdigital型磁力搅拌器、VORTEX GENIUS 3 型旋涡振荡器、ULTRA-TURRAX T 18 basic 型高速分散器,德国IKA公司;SPECTRA MAX 190型全波长酶标仪,美国Molecular Devices公司;Centrifuge 5424离心机,德国Eppendorf公司;CU-420型电热恒温水槽,上海一恒科学仪器有限公司;GZP-150N光照培养箱,上海森信实验仪器有限公司;Smart-S2-30DH型实验室级超纯水机,南京易普易达科技发展有限公司。
1.3 方法
1.3.1 甜菜色素在不同pH下的呈色稳定性
用去离子水分别配置pH为3、5、7的磷酸二氢钠-柠檬酸缓冲溶液(0.05mol/L)、pH为9的甘氨酸-氢氧化钠缓冲溶液(0.05mol/L)、pH为11的磷酸氢二钠-氢氧化钠缓冲溶液(0.05mol/L)。用不同pH的缓冲溶液精确配置0.1%的甜菜色素溶液。配置完成后在室温下避光放置60min,观察不同pH下色素溶液的颜色变化。用全波长酶标仪对不同pH的色素溶液进行200nm~700nm的全波长扫描,加样量200μm,温度为常温,波长取10nm,记录全波长扫描图谱。
1.3.2 甜菜色素微乳液制备方法的确定
甜菜色素微乳液制备方法如下。1)混合乳化剂的复配。参照文献[2]~文献[4]进行乳化剂的选择和复配,选择亲油的司班80(HLB值为4.3)与亲水的吐温80(HLB值为15)进行复配,以获得较大的HLB值范围。调整司班80与吐温80的比例分别为9∶1、8∶2、7∶3、6∶4、5∶5,计算得混合乳化剂的HLB值分别为5.37、6.44、7.51、8.58、9.65。2)甜菜色素微乳液的制备。微乳液的加料顺序采用助乳化剂浓度法[5],先固定助乳化剂与水相的比例,并按照比例将助乳化剂溶于初始水相配置成新水相,混合乳化剂和葵花籽油组成油相,再逐滴将新水相滴加油相中制备微乳液,滴加过程中磁力搅拌(800rad/min)。3)拟三元相图的绘制。固定油相的总质量为10g,葵花籽油和混合乳化剂的比例为9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9,混合乳化剂中司班80与吐温80的比例分别为9∶1、8∶2、7∶3、6∶4、5∶5,选择50%的丙三醇作为助表面活性剂,初始水相是pH为5的磷酸二氢钠-柠檬酸缓冲溶液(0.05mol/L)。按照上述比例称取相应的葵花籽油、司班80和吐温80混合均匀作为油相,在pH为5的缓冲溶液中以质量比5∶5加入丙三醇作为新水相,然后按照1.3.2(2)中的方法制备微乳液。根据到达临界增溶水时(乳液由澄清透明变浑浊),乳液中葵花籽油、混合乳化剂、新水相的百分比来确定该点在相图中的位置,将每个临界点连成曲线即得到该体系的拟三元相图。4)助表面活性剂的选择。在根据三元相图确定油相中各组分的含量后,研究无水乙醇和丙三醇对临界增溶水相的影响。5)助表面活性剂浓度的确定。根据1.3.2(4)的结果研究助表面活性剂浓度为30%、40%、50%、60%(w/w)时对临界增溶水相的影响。6)甜菜色素最大添加量的确定。根据1.3.2其余步骤的结果,测定甜菜色素粉末在含有50%丙三醇的pH5磷酸二氢钠-柠檬酸缓冲液中的最大溶解度,以接近最大溶解度的溶液作为水相制备微乳液,计算临界点的最大增溶水相和色素含量。
1.3.3 甜菜色素微乳液的表征
在确定甜菜色素微乳液各组分含量后,按照制备方法制备甜菜色素含量为1.0%的微乳液并对其进行表征。1)微乳液类型的鉴定。采用染色法[6]对甜菜色素微乳液的类型进行鉴定。取一定量的微乳液置于培养皿中,在微乳液的中心滴入一滴亚甲基蓝染剂,如果乳液为O/W型,那么染剂会快速从中心扩散至整个乳液,反之乳液为W/O型。滴入染剂后常温静置30min,观察染色状态。2)微乳液的离心稳定性。取适量的甜菜色素微乳液,在3000r/min下离心30min观察离心前后的乳液状态。3)微乳液的储藏稳定性。取适量的甜菜色素乳液在室温下避光保存9d,保存期间每天观察乳液的状态。
1.3.4 微乳液对甜菜色素稳定性的影响
参照文献[7]采用测定吸光值的方法测定微乳液水相中甜菜色素的含量,当pH为5时,甜菜色素乳液的最大吸收波长在530nm左右,因此以530nm处的吸光值表示甜菜色素的含量。1)标准曲线的绘制。用磷酸二氢钠-柠檬酸缓冲溶液(0.05mol/L,pH5)分别配置质量分数为1.0%、0.8%、0.6%、0.4%、0.2%(w/w)的甜菜色素水溶液和微乳液。在530nm处测定吸光值,根据测定结果绘制甜菜色素微乳液与水溶液的标准曲线。2)光照稳定性。移取5组质量分数为1.0%(w/w)的甜菜色素水溶液和微乳液,每个样品5g,其中1组避光保存,其余4组放入恒温光照培养箱中,光照强度15000lx,设定温度为28℃,分别在第4h、8h、12h、16h取出1组样品并避光保存。样品全部取出后,用全波长酶标仪测定全部样品在530nm处的吸光值,并根据各自的标准曲线计算甜菜色素的保留率。对比水溶液和微乳液中色素的保留率,判断微乳液对甜菜色素光照稳定性的影响。3)热稳定性。移取5组质量分数为1.0%(w/w)的甜菜色素水溶液和微乳液,每个样品5g,其中1组常温避光保存,其余4组放入电热恒温水槽中,设定温度为60℃,分别在第30min、60min、90min、120min取出1组样品并冷却至常温,用全波长酶标仪测定样品在530nm处的吸光值,微乳液对色素热稳定性的判断方法同1.3.4(2)。
1.4 数据分析
所有试验均重复3次并设置对照组,结果以平均值±标准偏差表示。数据结果采用Statistix 9.0软件进行单因素方差分析,并采用最小显著性差异法分析平均值之间的差异。
2 结果与分析
2.1 甜菜色素在不同pH下的呈色稳定性
分别用pH为3、5、7、9、11的缓冲溶液配置0.1%的甜菜色素溶液,室温下避光放置60min后使用全波长酶标仪测定全波长扫描图谱,得到的结果如图1所示。
由图1可知,当pH为3~7时,甜菜色素溶液的最大吸光值随着pH的增大而增大,颜色由粉红色变为深红色,且吸光值下降可能是生成了新甜菜苷或异甜菜苷。当pH为5~7时,颜色和最大吸收的波长基本保持不变,说明甜菜色素在弱酸性下较稳定在530nm~540nm左右,这与张琳等[7]的测定结果一致。当pH为7~11时,甜菜色素溶液的最大吸光值随着pH增大而减小,颜色由红色转变为紫红色甚至紫色,可能是因为在碱性环境下甜菜红素的稳定性较差,使甜菜红素的总量减少,溶液呈现紫色[8],而最大吸收波长随着pH增大而增加,这与曹机良等[9]的测定结果相似。
综上所述,pH为5时是甜菜色素溶液的最适pH。
2.2 甜菜色素微乳液制备方法的确定
2.2.1 混合乳化剂中司班80和吐温80比例的确定
当司班80和吐温80的比例为9∶1、8∶2、7∶3(HLB值为5.37~7.51)时,能够形成微乳液的区域面积很小,无论葵花籽油和混合乳化剂的比例是多少,增溶的水相都没有明显的变化。当司班80和吐温80的比例为6∶4(HLB值为8.58)时,有较大面积的微乳区域出现,且在混合乳化剂用量<5g时,增溶水量随着混合乳化剂用量的增加而增加。当司班80和吐温80的比例到达5∶5(HLB值为9.65)时,微乳区域面积最大为16.2%,对应的葵花籽油和混合乳化剂的比例为5∶5。因此,选取司班80和吐温80比例为5∶5进行后续单因素试验。
2.2.2 助表面活性剂的选择
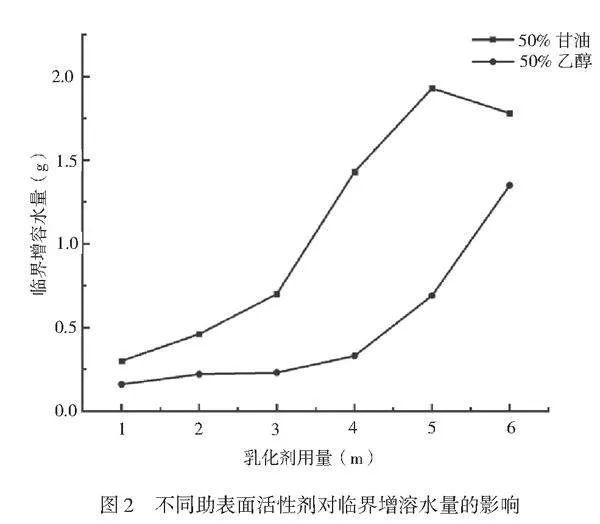
根据上述结果,固定油相总质量为10g,司班80和吐温80的比例为5∶5,分别设置无水乙醇和丙三醇两种助表面活性剂的浓度为50%(w/w)。醇类的助表面活性剂能够和乳化剂形成混合界面膜,同时提高界面膜的柔顺性,使体系更容易形成微乳液并包裹更多的水相[10]。根据食品体系的原则,只研究葵花籽油与混合乳化剂的比例为9∶1、8∶2、7∶3、6∶4、5∶5、4∶6的结果,2种助表面活性剂对临界增溶水量影响的结果如图2所示。
结果表明,当用无水乙醇作为助表面活性剂且混合乳化剂用量>5g时,其对临界增溶水量有提高的趋势,推测其在混合乳化剂含量更高的体系中能有更好的表现,但这不符合食品体系选取的原则;用丙三醇作为助表面活性剂,当混合乳化剂用量≤5g时,临界增溶水量随着混合表面活性剂用量的增加而增加,当混合乳化剂用量>5g时,临界增溶水量开始有下降的趋势。2种助表面活性剂展示出的不同趋势表明不同的助表面活性剂对相同体系的助乳化效果不同。根据食品体系的原则,选择在混合乳化剂含量较低时增溶效果最明显的丙三醇作为最佳的助表面活性剂。
2.2.3 助表面活性剂浓度的确定
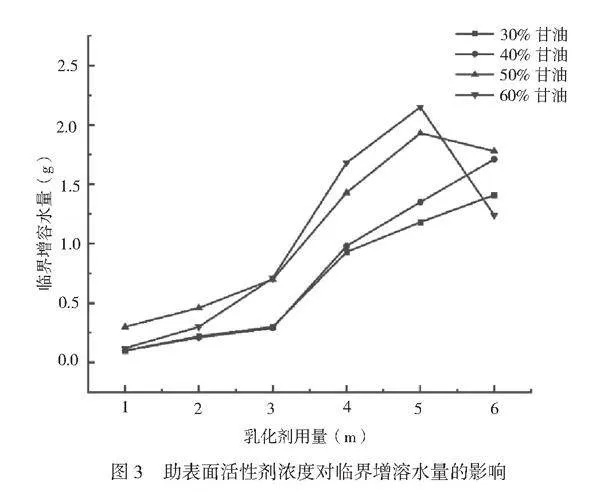
根据上述结果,固定油相总质量为10g,司班80和吐温80的比例为5∶5,助表面活性剂为丙三醇,设置丙三醇在水相中的浓度分别为30%、40%、50%、60%(w/w)。不同浓度的丙三醇对临界增溶水量的影响如图3所示。
当丙三醇浓度低(30%、40%)时,临界增溶水量随着混合乳化剂用量的增加始终保持上升趋势;当丙三醇浓度高(50%、60%)时,混合乳化剂用量>5g后,临界增溶水量随浓度的升高出现明显下降的趋势。按照临界增溶水质量分析可以得出,当混合乳化剂<5g时,助乳化效果为60%>50%>40%>30%;当混合乳化剂用量>5g时,助乳化效果为50%>40%>30%>60%。
在混合乳化剂与葵花籽油的比例为5∶5时,60%丙三醇的临界增溶水相为2.15g,增溶水相中初始水相占比为总乳液的6.95%,而50%丙三醇的临界增溶水相为1.93g,增溶水相中初始水相占比为总乳液的8.07%。研究目的是为了获得能承载更多甜菜色素的乳液,而甜菜色素是溶于初始水相中,因此选取初始水相占比更大的50%丙三醇作为最佳助表面活性剂浓度。
2.2.4 甜菜色素最大添加量的确定
经测定,甜菜色素粉末在含有50%丙三醇的pH5磷酸二氢钠-柠檬酸缓冲液中的最大溶解度约为20%(w/w)。根据上述结果,固定油相总质量为10g,司班80和吐温80的比例为5∶5,助表面活性剂为50%的丙三醇,最大色素溶解度下的临界增溶水质量为1.65g。此时微乳体系中水相占比14.2%,葵花籽油占比42.9%,混合乳化剂占比42.9%,最大色素含量约为1.42%。
2.3 甜菜色素微乳液的表征
由上述结果得出的甜菜色素微乳液最佳配方如下:混合乳化剂中司班80和吐温80的比例用5∶5,葵花籽油和混合乳化剂的比例用5∶5,助表面活性剂选用50%丙三醇。以此配方配置1.0%(w/w)的甜菜色素乳液并用于后续甜菜色素微乳液的表征。
2.3.1 微乳液类型的鉴定
根据1.3.3中(1)的方法进行测定,亚甲基蓝染剂在微乳液中因重力有些许移动、没有扩散,可以认为制得的微乳液是W/O型乳液。
2.3.2 微乳液的离心稳定性
根据1.3.3中(2)的方法进行离心,通过离心前后对比可以得出,微乳液的外观几乎没有任何变化,在经过高强度的离心后仍然保持澄清透明,无沉淀、无聚集、无浑浊、无分层,反映此微乳液体系的稳定性良好。
2.3.3 微乳液的储藏稳定性
根据1.3.3中(3)的方法进行测定,微乳液在储藏期间内始终保持澄清透明,无沉淀、无聚集、无浑浊、无分层,说明甜菜色素微乳液体系的储藏稳定性良好。
2.4 微乳化对甜菜色素稳定性的影响
2.4.1 标准曲线的绘制
根据上述结果确定的最优微乳液配方,分别配置质量分数为1.0%、0.8%、0.6%、0.4%、0.2%(w/w)的甜菜色素微乳液和水溶液。在530nm处测定吸光值,根据测定结果绘制出甜菜色素微乳液与水溶液的标准曲线,结果如图4所示。
使用Excel 2013对测定的数据进行拟合,甜菜色素微乳液和水溶液拟合的标准曲线R2均大于0.99,说明拟合效果好,微乳液和水溶液中甜菜色素含量与吸光值呈一定的线性关系。后续试验可以使用此标准曲线将530nm处测得的吸光值换算为样品中的甜菜色素的含量。
2.4.2 光照稳定性
将分别光照了0h(对照样)、4h、8h、12h、16h的甜菜色素微乳液和水溶液在530nm处测定吸光值,之后通过2.4.1的标准曲线计算甜菜色素含量并换算成保留率。甜菜色素水溶液在经过16h自然光照射后,溶液的红色略有变淡,甜菜色素的保留率在83%左右,这与其他学者研究得出的结果相似[10]。而甜菜色素微乳液在经过16h自然光照射后,色泽基本没有发生变化,且仍然保持澄清透明,甜菜色素的保留率在90%以上,说明制成微乳液对甜菜色素的光照稳定性有一定的提升效果。
2.4.3 热稳定性
将在60℃电热恒温水槽中保温了0min(对照样)、30min、60min、90min、120min的甜菜色素微乳液和水溶液在530nm处测定吸光值,并对数据做与2.4.2相同的处理。
甜菜色素水溶液在经过120min的保温后,色泽发生明显的变化,红色变淡,甜菜色素保留率仅在61%左右。经过120min保温的微乳液颜色也有明显的变淡,但整体体系仍然保持澄清透明,甜菜色素保留率在77%左右,说明制成微乳液对甜菜色素的热稳定性也有明显提升。这与其他学者研究微乳化对花青素热稳定性的提升有一定的相似性[11]。
3 结语
本文采用助表面活性剂浓度法制备微乳液并将甜菜色素包封在W/O型微乳液体系内,研究微乳液体系对甜菜色素稳定性的影响。结果表明,甜菜色素稳定性最佳的pH为5;甜菜色素微乳液的最佳制备配方为混合乳化剂中司班80、吐温80的质量比为5∶5(HLB值为9.65),葵花籽油和混合乳化剂的质量比为5∶5,助表面活性剂选用50%的丙三醇溶液,初始水相使用pH为5的磷酸二氢钠-柠檬酸缓冲溶液(0.05mol/L,pH5)。最终微乳体系中的水相占比14.2%,葵花籽油占比42.9%,混合乳化剂占比42.9%,最大承载的甜菜色素量约为1.42%。经鉴定甜菜色素微乳液为W/O型乳液,且具有良好的体系稳定性和光热稳定性,研究结果为甜菜色素的稳定性方法的开发和应用提供了理论依据。
参考文献
[1]吕思润.甜菜红素的提取纯化及其生物活性研究[D].哈尔滨:哈尔滨工业大学,2016.
[2]马雪松,吕晓玲.油包水型紫甘薯色素微乳液的制备[J].食品工业,2015,36(10):141-145.
[3]朱式业.杜仲籽油微乳液的制备及其理化性质研究[D].张家界:吉首大学,2020.
[4]付婷婷.番茄红素微乳的制备及特性研究[D].无锡:江南大学,2012.
[5]黄芬,唐年初,郭贯新,等.食品级大豆油W/O微乳的制备研究[J].食品工业科技,2010,31(2):280-282,285.
[6]张婷,赵苏安,王贺.食品级微乳液的制备及其稳定性研究进展[J].农产品加工,2019(16):67-70.
[7]张琳,祖元刚,王春丽,等.食品添加剂对红甜菜色素稳定性的影响[J].食品工业科技,2011,32(7):346-348.
[8]宋苗苗.酯类化合物/短链醇/水绿色无表面活性剂微乳液的构建与性能研究[D].济南:山东师范大学,2020.
[9]曹机良,曹毅,张成玉,等.甜菜红色素的稳定性探讨[J].染整技术,2014,36(3):28-31.
[10]王萍,闫明哲.红甜菜色素稳定性影响因素研究进展[J].食品与生物技术学报,2021,40(7):19-29.
[11]滕弘霓,陈宗淇.醇对非离子表面活性剂所形成微乳液的影响[J].吉林化工学院学报,1996(4):8-12.

