不同抗性枣种质响应植原体侵染的差异研究





摘要 为揭示抗病性枣种质响应植原体侵染的关键生物学途径,通过嫁接侵染法对324 份枣种质进行枣疯病抗性鉴定。以筛选到的抗病种质‘QS10’‘UU12’‘EQ15’和易感种质‘中阳木枣’‘壶瓶枣’‘鲁枣5 号’为材料,分别测定侵染后90、120 d 时保存的叶片组织的植原体含量,并通过转录组测序揭示响应差异。结果显示,嫁接感染后抗病种质的植原体浓度水平低且逐渐下降,易感种质的植原体浓度高且逐渐上升。抗病和易感种质的差异表达基因(differentially expressed genes,DEG)都显著富集在植物病原体互作、植物激素信号转导、次生代谢产物的生物合成等通路中,并在过氧化物酶体、光合作用途径和类黄酮生物合成途径中存在表达差异。WGCNA分析发现,脂质磷酸酶、RNA 编辑因子 MORF 3、LysM 结构域受体样激酶、丝氨酸/苏氨酸蛋白激酶sty13 样等核心基因和抗病种质相关。研究表明,应对植原体入侵时,植物病原体互作、次生代谢产物的合成、植物激素信号转导、MAPK 信号途径的基因差异表达可能是抗病种质和易感种质响应差异的原因;抗病种质中过氧化物酶体相关的基因上调表达,光合作用的基因受植原体入侵的影响较小,可能有助于能量代谢的正常进行和氧化还原的平衡,增强其抗病性,黄酮类、萜类等次级代谢产物可能在消除活性氧的危害方面发挥作用。
关键词 枣树; 枣疯病; 植原体互作; 次生代谢物; WGCNA
中图分类号 S436.65 文献标识码 A 文章编号 1000-2421(2024)06-0240-13
枣(Ziziphus jujuba Mill.)是鼠李科(Rhamnaceae)枣属(Ziziphus)植物,具有悠久的栽培历史。枣果既可以鲜食也可制干,是食品工业重要的原料[1]。枣疯病是由植原体引起的一种严重的病害,树体染病后出现花柄伸长、花变叶、丛枝化、矮化和黄化等症状,逐渐失去结果能力;进而衰退甚至死亡[2]。植原体主要通过叶蝉等媒介昆虫传播,并且在枣树中有潜伏期,枣园一旦发现有植株感染,病情往往已传播开来。植原体尚无法人工培养,严重影响致病机理和防治方法的研究。因缺乏有效的根治方法,枣疯病对枣产业发展、枣种质保存及利用威胁严重[3]。
筛选抗枣疯病种质资源,并挖掘抗病相关基因,可为防治和控制枣疯病的有效措施开发奠定基础。通过嫁接的方式侵染待鉴定的材料,是非常有效的鉴定方法[4],利用这种方法,研究人员筛选出若干具有一定枣疯病抗性的种质,如在北京市的古枣树群体中筛选得到的抗病种质[5],以及枣树种质‘ 星光’[6]、‘T13’[7]等。但研究人员也发现各种质应对植原体的表现并不稳定[8]。河北沧县国家枣树良种基地等各种质库保存了大量的枣种质,但目前尚缺乏大规模的种质抗病性鉴定。
随着测序技术的发展,转录组测序在发掘植物与病原体相互作用的重要基因上起到了重要作用,一些响应枣疯病侵染的基因被发现,如编码丝氨酸/苏氨酸蛋白激酶家族成员 ZjMAPKKKs 的基因[9],AP2/ERF 转录因子家族中的ZjAP2*9、ZjERF49和 ZjERF91 等基因[10]。此外,Ye 等[11]利用iTRAQ蛋白质组学和转录组分析了枣树应对植原体侵染的多重调控水平。枣树感染植原体后,光合作用相关途径和碳水化合物的代谢通路发生改变[12]。通过对健康和感病‘木枣’转录组测序发现,各样品的差异表达基因(differentially expressed genes, DEG)显著富集在黄酮类化合物、苯丙烷类化合物和不饱和脂肪酸生物合成途径[13];感病后枣树发育畸形可能和保护酶和激素的代谢紊乱有关[14]。目前研究多针对枣疯病的侵染后响应,对抗病枣种质应对植原体侵染的分子机制的研究相对较少。
本研究对324 份枣种质进行嫁接侵染、筛选抗病种质,然后以2 组不同抗病性的种质为材料对不同感染时期的叶片进行转录组对比分析,以揭示抗病性枣种质响应植原体侵染的关键生物学途径,为枣疯病抗性育种提供依据。
1 材料与方法
1.1 材料
2022 年4 月5 日采集河北沧县国家枣树良种基地资源圃中保存的324 份种质的健康穗条,封蜡处理后置于冷库保存。5 月25 日将所有的接穗嫁接到患枣疯病2 a 以上的的金丝小枣植株上。以插皮接的方式每株嫁接2~4 个接穗,每个种质至少嫁接2 个接穗作为重复。
转录组材料为通过嫁接筛选得到的具有一定抗病性的种质‘QS10’‘UU12’‘EQ15’和易感种质‘中阳木枣’‘壶瓶枣’‘鲁枣5 号’。通过观察,抗病种质感染植原体后表现稳定,没有明显枣疯病的症状,所选易感种质在嫁接90 d 后,枣疯病症状变化明显,取保存90、120 d 时的6 个种质的叶片材料,进行转录组测序。
1.2 接穗的发病情况观察和筛选
对嫁接后各种质每30 d 的花变叶、丛枝、小叶等表型进行观察、分级和统计,将其发病级别分为5 级:0 级,无明显症状;1 级,新发枝花梗明显延长,或顶梢叶变小、变淡,小叶比率低于整枝的10%;2 级,新梢小叶、节间缩短、腋芽明显伸长或花变叶比率为1%~20%;3 级,丛枝小叶比率达21%~50%;4 级,从枝小叶比率达51%~90%;5 级,从枝小叶比率达91%~100% ,分级标准参照文献[15]。嫁接侵染后60 d,采集尚未表现枣疯病症状的种质枝叶液氮处理后保存。根据嫁接后第 3、4 个月的观察,取该期间仍然未表现枣疯病症状的种质为具有一定枣疯病抗性的种质,取该期间接穗症状由正常转变为严重的易感种质为相应的易感种质。
1.3 植原体浓度检测
通过荧光定量PCR 对所选抗病和易感种质90、120 d 时的样品进行植原体含量检测,取各个种质的叶片1~2 g,加入液氮充分研磨后,取0.2 g 粉末进行总DNA 提取,其DNA 浓度均一化后,以此DNA 为模板检测植原体浓度,检测方法参照文献[16]。
1.4 转录组测序和数据分析
采集样品经过RNA 抽提、纯化、建库后,对这些文库进行双末端(paired-end,PE)测序,转录组测序在北京诺禾致源科技股份有限公司完成。对获得的Raw reads 通过trim_galore 软件去除接头,去掉未知核苷酸数量超过10% 的reads、低质量reads 进行数据过滤和质量控制。使用hisat2 软件建立包含剪切位点和exon 信息的基因组索引,然后将过滤后的cleanreads 和冬枣参考基因组比对[17],得到下游分析文件,转换文件格式并校验文件的完整性后,使用软件featureCounts 对基因表达量定量,获得表达量矩阵后,去除矩阵中表达量FPKM 值低于5 的基因。
1.5 转录组数据分析
在进行转录组分析时,各使用3 份抗病种质和3份易感种质作为抗病组和易感组的重复。使用DESeq2(https://github.com/mikelove/DESeq2)对抗病组(RG)和易感组(SG)2 个时期的基因进行差异表达分析,3 种抗病种质和3 种易感种质分别作为抗病组(RG)和易感组(SG)的重复,分别计算抗病组(RG)和易感组(SG)3 个种质的后期对比前期的基因变化情况,以|log2FoldChange|gt;1(FoldChange 为差异倍数) 、padj 值lt;0.05 为标准筛选差异基因。将获得的DEG 映射到GO 数据库(http://geneontology.org/)分析生物学功能,同时进行KEGG(https://www.kegg.jp/)富集分析代谢途径或信号转导通路。具体方法参照文献[18]。
使用rstudio 软件中的WGCNA 程序包进行加权基因共表达网络构建,将过滤后标准化的转录组表达量矩阵作为输入,得到无尺度化邻接矩阵后,将邻接矩阵转化为拓扑重叠矩阵( topological overlap matrix,TOM),采用动态剪切算法进行基因聚类及模块划分,使用WGCNA 自动网络构建函数blockwise‐Modules 构建网络,相似模块的合并阈值为0.25,分别计算模块的特征向量与抗病和感病种质之间的相关系数r 和P 值,选择|r|gt;0.70 且Plt;0.01 的模块为特异性模块[19]。选择模块内连接度最高的前10 个基因作为该模块的核心基因,对这些基因及其关联基因使用Cytoscape 软件进行可视化绘图[20]。同时使用NCBI 数据库(https://www.ncbi.nlm.nih.gov/)获得核心基因的功能注释信息。
2 结果与分析
2.1 种质抗病性鉴定
经过4 个月的嫁接侵染和表型筛选,发现312 个种质在嫁接后1 个月内表现出丛枝、花变叶、小叶等枣疯病症状。其中‘金丝小枣’‘冬枣’等272 个种质病情发展迅速,表现出严重的枣疯病症状,发病级别为5 级,这些为极易感种质。60 d 后,大部分种质发病严重,第90 天仅有11 个种质仍有处于没有明显丛枝、叶片颜色正常的较低发病水平的接穗。120 d 后,发病较低的种质缩减为5 个。60 d 后对病症不明显的接穗持续观察并取样保存,将120 d 仍未表现明显发病症状的‘QS10’‘UU12’‘EQ15’确定为抗病种质,将120 d 发病严重的‘中阳木枣’‘壶瓶枣’‘鲁枣5号’确定为易感种质,90 d 后,这3 份种质仍有接穗从只有轻微发病逐渐发展成严重发病(图1)。
2.2 嫁接侵染后不同抗性种质植原体浓度变化
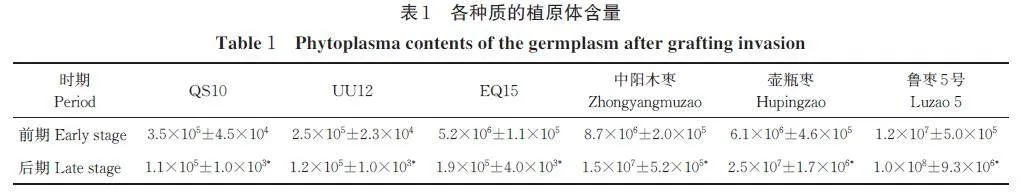
植原体浓度测定结果表明,2 个时期的6 份种质样品均含有植原体,相同时期对比,不论在90 d 时还是在120 d 时,抗病种质植原体含量都比易感种质的植原体含量低,抗病种质植原体含量数量级在105~106 个/μL,易感种质的植原体含量的数量级在106~108 个/μL。抗病种质中,后期与前期相比,植原体含量显著下降。易感种质中,后期植原体含量相较于前期显著上升(表1)。
2.3 差异表达基因分析
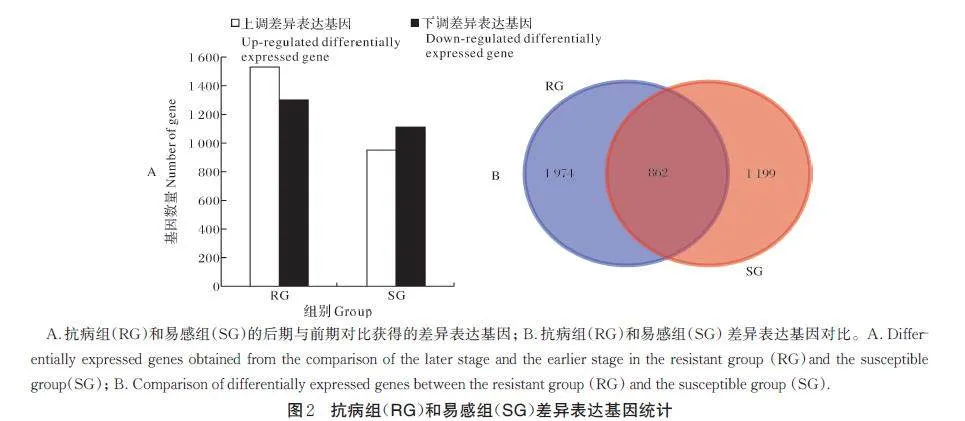
使用DESeq2 软件对2 个时期的抗病组(RG)和易感组(SG) 各自3 个样品的基因表达量对比筛选,抗病组(RG)获得DEG 2 836 个,上调1 534 个、下调1 302 个;易感组(SG)获得DEG 2 061 个,上调951个、下调1 110 个(图2A)。其中,只在抗病组(RG)鉴定到的DEG 数为1 974 个,只在易感组(SG)鉴定到的DEG 数为1 199 个(图2B)。
2.4 GO富集结果
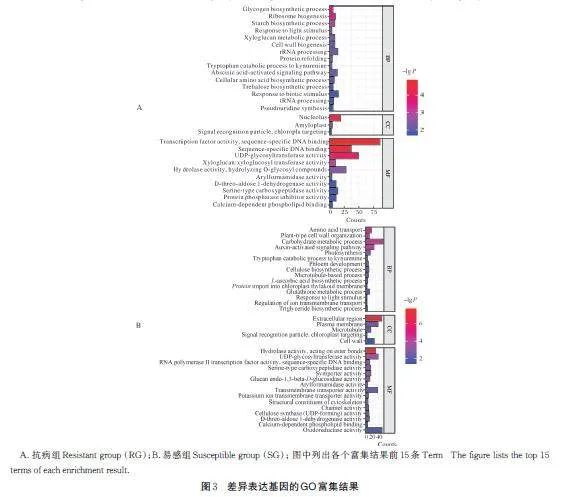
为了分析抗病种质和易感种质应对植原体侵染的生物学功能,分别从生物过程、细胞组件和分子功能三方面对抗病组(RG)和易感组(SG)获得的DEG进行GO 富集分析,在抗病组(RG)中883 个DEG 注释到64 个GO Term 中,显著性高(Plt;0.05)的Term为转录因子活性、序列特异性DNA 结合、UDP 糖基转移酶活性、水解酶活性(图3A)。在易感组(SG)中有1 579 个DEG 注释到67 个GO Term 中,其中显著性较高(Plt;0.05)的Term 分别为碳水化合物代谢过程、胞外区、作用于酯键水解酶活性(图3B)。GO 富集结果表明,植原体对抗病种质和易感种质侵染主要影响了信号转导、细胞代谢过程、能量代谢等方面。
2.5 差异表达基因KEGG富集的关键通路
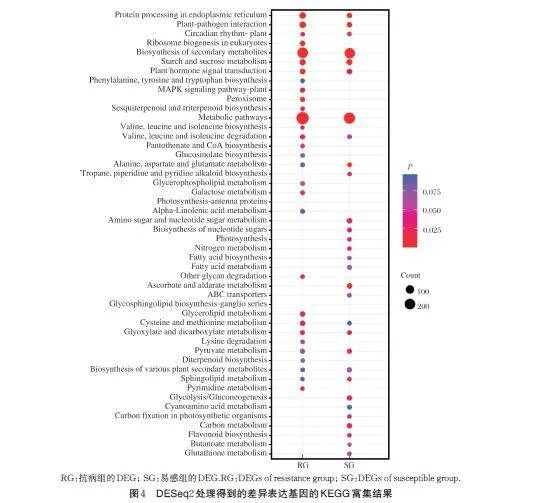
为了揭示枣感染植原体后的代谢通路的变化,对2 组差异表达基因进行KEGG 富集分析(图4),结果显示,抗病组(RG)中765 个差异基因富集在19 个通路中,易感组(SG)622 个差异基因富集在24 个通路中。对2 对DEG 得到的通路进行对比后发现,抗病和易感种质在应对植原体侵染时,在能量代谢、合成次生代谢产物、代谢途径、激素信号转导等方面的基因表达均会发生改变。值得注意的是,真核生物中核糖体的发生,苯丙氨酸、酪氨酸和色氨酸的生物合成,MAPK 信号通路、过氧化物酶体、倍半萜和三萜生物合成和半乳糖代谢通路在抗病种质中单独地富集到;易感种质中,氨基糖和核苷酸糖代谢、核苷酸糖的生物合成、光合作用、氮代谢、脂肪酸生物合成和降解、碳代谢被单独地富集到。表明对病原体的反应、激素合成和信号转导、氧化还原相关过程、能量代谢可能与抗病和易感种质应对植原体侵染有关。
2.6 代谢通路中差异表达基因分析
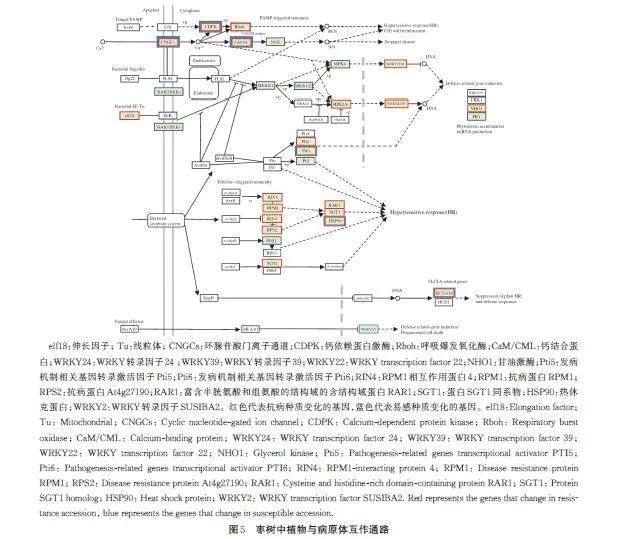
1)应对病原体侵染相关通路分析。为解析抗病种质和易感种质被植原体侵染时的表现差异,对植物病原体互作通路进行分析。图5 结果显示,抗病种质中,PTI 中过敏反应和防御相关基因诱导相关的编码环腺苷酸门离子通道 (CNGCs,LOC107414602、LOC107414559、LOC112490923、LOC107423657、LOC107431294) 基因、钙依赖蛋白激酶 (CDPK,LOC1074243669)基因、呼吸爆发氧化酶 (Rboh,LOC107424617)基因、钙结合蛋白 (CaM/CML,LOC107434111、LOC107421107、LOC107416249、LOC107431392、LOC107409684、LOC107422102、LOC107425895、LOC107432911、LOC107427870、LOC107418972、LOC107404544)基因、WRKY 转录因子24(WRKY24,LOC107411616)、WRKY 转录因子39 (WRKY39, LOC107431286) 、WRKY22(LOC107432881)、甘油激酶(LOC107407412)、发病机制相关基因转录激活因子( Pti5,LOC107411165)和(Pti6,LOC107411595)基因,以及ETI 中编码和植物过敏反应(HR)相关的互作蛋白RIN4、RPM1、RPS2、RAR1、SGT1、HSP90、SGT1 相关的10 个基因均在前期上调表达,后期表达量下降。在易感种质中,编码环腺苷酸门离子通道(CNGCs,LOC107431294、LOC107414559、LOC112490923、LOC107414573、LOC107414597)基因、钙结合蛋白(CaM/CML, LOC107424823、LOC107422810、LOC107432911)基因、发病机制相关基因转录激活因子(Pti6,LOC107411595)基因、热休克蛋白HSP90(HSP90,LOC107420419)基因和WRKY 转录因子2(LOC107412508)基因在后期下调表达。
分析植物病原体互作通路中的MAPK 信号转导途径中参与H2O2、乙烯、茉莉酸、脱落酸和植物对损伤的反应等途径的12 个差异基因,这些基因包括丝氨酸/苏氨酸蛋白激酶OX1、MAPK3、WRKY22、MAPK9、乙烯响应转录因子ERF1、转录因子MYC2、脱落酸受体PYL4、钙结合蛋白CaM 和呼吸爆发氧化酶同源蛋白RbohD。在抗病种质中,这些差异基因均在前期高表达。在易感种质中,前期编码丝氨酸/苏氨酸蛋白激酶OXI1 的基因表达量低,编码WRKY22、MAPK9 的基因在后期下调表达。易感种质中编码转录因子MYC2 的基因在前后时期差别不明显。脱落酸受体PYL4 在易感种质后期下调表达,钙结合蛋白CaM 和呼吸爆发氧化酶同源蛋白RbohD 的基因变化不明显(图6A)。
在茉莉酸的合成和信号转导方面,合成途径的烯氧化物环化酶AOC、12-氧植二烯酸还原酶OPDR、4-香豆酰-CoA 连接酶OPCL1 在抗病和易感种质中均在前期上调表达,抗病种质的表达量更高。茉莉酸o-甲基转移酶JMT 在抗病种质中前期高表达,后期下调表达,而在易感种质中前后2 个时期表达量均低(图6B) 。
2) 过氧化物酶体、光合作用和类黄酮生物合成通路DEG 分析。对单独在抗病种质中富集到的过氧化物酶体与单独在易感种质中富集到的光合作用和类黄酮合成通路的DEG 进行分析。结果显示,抗病种质中的PXMP2、ACAA1、ACSL、PIPOX、HMGCL、IDH、HAO 和SOD 等过氧化物酶体相关的10 个基因后期上调表达。主要涉及脂肪酸氧化、氨基酸代谢和抗氧化系统。编码光系统Ⅱ中的PsbQ、PsbY,光系统Ⅰ中的PsaK、PsaL、PsaE、PsaG、PsaH、PsaO,光合电子传递链中的PetE、PetF 的10 个基因在抗病种质中后期下调表达,在易感种质后期显著下调。类黄酮生物合成途径中,与易感种质相比,编码CHS、CHI、F3H、FLS 的基因在抗病种质的前期高表达。表明抗病种质和易感种质应对植原体侵染的过程中,活性氧的生成和平衡的维持、黄酮类的合成方面表现出差异,易感种质的光合作用受到很大的影响,可能与抗病和易感种质的抗病性的差异有关(图7)。
2.7 WGCNA分析
数据分析获得16 293 个基因的表达数据,过滤掉表达量低的基因后,根据基因的FPKM 值进行相关度分析并聚类,相关度高的基因被分配至1 个模块中,共划分了26 个模块(图8A),WGCNA 分析展示了26 个模块与抗病和易感种质的相关性和显著性。相关性系数的绝对值高且显著性值低(|r|gt;0.70 且Plt;0.01)的模块与性状高度相关。鉴定到与抗病种质显著正相关的模块为grey60 模块(r=0.75,P=0.005)和darkgrey 模块(r=0.87,Plt;0.001)(图8B)。对grey60 和darkgrey 模块可视化分析(图8C),在grey60 模块中连接度最高的前3 个基因为脂质磷酸酶γ 样(LPPG)、泛素样蛋白5(UBL5)和RNA 编辑因子 MORF 3;在darkgrey 模块中连接度最高的前3 个基因分别为LysM 结构域受体样激酶3(LYK3)、丝氨酸/苏氨酸蛋白激酶sty13 样(STK13)和胱硫氨酸-合成酶1(CGS1),在这2 个和抗病种质相关性高的模块中,和植物免疫相关的基因有编码泛素样蛋白5、RNA 编辑因子 MORF 3、DEAD-box 依赖atp 的RNA 解旋酶50 样、抗病蛋白at4g27190 样、抗病样蛋白DSC1、LysM 结构域受体样激酶3、丝氨酸/苏氨酸蛋白激酶sty13 样、E3 泛素蛋白连接酶BRE1 样2 等的基因。2 个模块的核心基因和注释信息见表2。
3 讨论
前人研究表明,枣疯病的病症表现和植原体的浓度有一定的相关性[21],经过嫁接侵染和发病症状观察,本研究发现,抗病种质中植原体浓度水平较低且是逐渐下降的,而易感种质中的植原体浓度有大幅度上升,同时病症变得越来越严重,植原体在枣树中的大量繁殖可能破坏了枣树正常的生长代谢,将来,通过各种组学手段揭示导致这些差异出现的原因将有助于揭示枣疯病抗性机制。
枣树感染植原体后,受侵染枣树的免疫反应和生理生化活动变化会对植物的正常生长产生影响[22]。转录组分析结果表明,抗病种质和易感种质在应对植原体侵染时,模式触发免疫(PTI)和效应子触发免疫(ETI)过程都产生了积极响应,PTI 和 ETI是植物病原互作的重要途径[23]。抗病种质中PTI 过程的编码CNGCs、CDPK、Rboh、CaM/CML 和ETI过程中编码互作蛋白的基因前期高表达,后期下调表达。易感种质中,编码CNGC、CaM/CML 的基因后期下调表达,编码CDPK 和Rboh 的基因表达没有差异。推测抗病种质PTI 和ETI 过程差异基因后期下调可能和植原体浓度降低有关。随着植原体入侵,易感种质的PTI 和ETI 过程前后时期差异基因较少,基因的变化趋势不明显,这和已有研究[24]的结果相同。
丝裂原活化蛋白激酶(MAPK)级联是受体下游关键信号模块,在植物免疫、环境应激反应和正常生长发育中起重要的作用[25]。在本研究中,MAPK 信号通路中的12 个DEG 在抗病种质中均在前期高表达,在后期下调表达。在易感种质的H2O2信号通路中,编码OXI1 基因的上调表达是由H2O2 引起且OXI1 的活性能被H2O2诱导并向下游传递信号,影响细胞死亡、H2O2 生成和活性氧的内稳态[26],H2O2 作为防御信号分子,诱导核基因表达。OXI1 能使MAPK3 完全活化,但是编码MAPK3 的基因后期相对前期轻微下调表达,下游WRKY22 基因下调表达,可能会影响H2O2的生成及其介导的信号传递。茉莉酸合成途径中的AOC、OPDR、OPCL1,抗病和易感种质均在前期高表达,后期下调表达,而和茉莉酸甲酯合成有关的JMT,在易感种质中2 个时期表达量低。茉莉酸信号通路中,编码JAZ 的基因在两种质中后期下调表达,易感种质合成MYC2 的基因后期轻微上调表达,JAZ 作为JA 信号的转录抑制因子,能够抑制MYC2 的活性。MYC2 在不同的植物体内可能发挥不同的作用,在拟南芥中,MYC2 对病原体基因具有负调节作用,但番茄SlMYC2 抗灰霉病的过程中,SlMYC2 对病原体反应基因有正调节作用[27]。抗病种质中编码MYC2 的基因下调表达,可能有助于后续防御反应。
转录组分析发现,抗病种质的过氧化物酶体的基因在后期上调表达,抗病种质受植原体入侵的影响,光合作用相关的基因轻微下调表达,易感种质则大幅度下调表达。易感种质中高浓度的植原体可能破坏了光合作用,对后续氧化还原信号的传递,活性氧产生和清除的动态平衡产生影响[28]。有研究表明,过氧化物酶体产生的H2O2可以提高植物对胁迫的耐受力,而叶绿体产生的H2O2主要和植物的过敏反应相关[29]。在感染前期,虽然抗病种质的植原体浓度较低,但类黄酮生物合成途径中合成CHS、CHI、F3H、FLS 的基因的表达量与易感种质相比较高,这些基因的表达会影响异黄酮、黄酮和黄酮醇以及花青苷的合成,使抗病性种质更好地应对活性氧暴发,异黄酮可以作为植物的植保素发挥作用[30]。抗病种质中还富集到了倍半萜和三萜的合成途径,表明萜类物质可能作为植保素发挥作用。
综上,应对植原体入侵时,植物病原体互作、次生代谢产物的合成、植物激素信号转导、MAPK 信号途径的基因差异表达可能是抗病种质和易感种质响应差异的原因;抗病种质中过氧化物酶体相关的基因上调表达,光合作用的基因受植原体入侵的影响较小,可能有助于能量代谢的正常进行和氧化还原的平衡,增强其抗病性,黄酮类、萜类等次级代谢产物可能在消除活性氧的危害方面发挥作用。本研究揭示了抗病性枣种质响应植原体侵染的关键生物学途径,可为枣疯病抗性育种提供依据。
参考文献References
[1] 高京草.中国枣资源研究与利用[D]. 杨凌:西北农林科技大学,2005.GAO J C.Research and utilization of jujube resourcesin China[D].Yangling:Northwest A amp; F University,2005( inChinese with English abstract).
[2] 王海妮,吴云锋,安凤秋,等. 枣疯病和酸枣丛枝病植原体16S rDNA 和tuf 基因的序列同源性分析[J]. 中国农业科学,2007,40(10):2200-2205.WANG H N,WU Y F,AN F Q,etal.The homology analysis for sequences of 16S rDNA and tufgene of Phytoplasma from jujube witches’ broom and wild jujubewitches’ broom[J]. Scientia agricultura sinica,2007,40(10):2200-2205( in Chinese with English abstract).
[3] 郭建民,杨俊强,薛新平,等. 枣疯病研究进展[J]. 山西农业科学,2017,45(8):1389-1392.GUO J M, YANG J Q, XUEX P, et al.Research progress on jujube witches’ broom disease[J]. Journal of Shanxi Agricultural Sciences,2017,45(8):1389-1392( in Chinese with English abstract).
[4] 温秀军,郭晓军,田国忠,等. 几个枣树品种和婆枣单株对枣疯病抗性的鉴定[J]. 林业科学,2005,41(3):88-96.WEN XJ, GUO X J, TIAN G Z, et al.Identification of resistances ofseveral jujube cultivars and selected pozao single trees againstjujube witches-broom disease[J].Scientia silvae sinicae,2005,41(3):88-96( in Chinese with English abstract).
[5] 王合,任争光,潘彦平,等. 北京市区古枣树单株种源抗枣疯病测定与抗病品种(系)筛选[J]. 林业科学,2018,54(8):124-132.WANG H,REN Z G,PAN Y P,et al.Determinationof individual jujube trees against jujube witches’-broom diseaseand screening of resistant varieties from the ancient individualjujube trees growing in Beijing[J]. Scientia silvae sinicae,2018,54(8):124-132( in Chinese with English abstract).
[6] 刘孟军,周俊义,赵锦,等. 极抗枣疯病枣新品种‘星光’[J].园艺学报,2006,33(3):687.LIU M J,ZHOU J Y,ZHAO J,et al.An excellent new cultivar of Chinese jujube with high resistanceto jujube witches broom disease‘ Xingguang’[J].Actahorticulturae sinica,2006,33(3):687( in Chinese with Englishabstract) .
[7] WANG L X,LIU S Y,GAO M J,et al.The crosstalk of thesalicylic acid and jasmonic acid signaling pathways contributedto different resistance to Phytoplasma infection between thetwo genotypes in Chinese jujube[J/OL].Frontiers in microbiology,2022,13:800762 [2024-03-28]. https://doi. org/10.3389/fmicb.2022.800762.
[8] 田国忠,李志清,赵俊芳,等. 我国部分枣树品种(系)对枣疯病的抗性研究: 第三届中国森林保护学术大会论文摘要集[C]. 北京:中国林学会, 2010: 25. TIAN G Z, LI Z Q,ZHAO J F, et al. Some Chinese jujube varieties (strains) onthe resistance of JWB:Third China Forest Protection AcademicConference Abstract Book[C]. Beijing: Chinese Academyof Forestry ,2010: 25(in Chinese).
[9] LIU Z G,WANG L X,XUE C L,et al.Genome-wide identificationof MAPKKK genes and their responses to phytoplasmainfection in Chinese jujube (Ziziphus jujuba Mill.)[J/OL].BMC genomics,2020,21(1):142[2024-03-28]. https://doi.org/10.1186/s12864-020-6548-6.
[10] 李继东,倪静,叶霞,等. 枣AP2/ERF 转录因子鉴定及其响应枣疯病植原体表达分析[J]. 园艺学报,2020,47(8):1463-1474.LI J D,NI J,YE X,et al.Genomic identification of jujubeAP2/ERF transcription factors and their expression patternduring jujube witches′ broom pathogenesis process[J]. Actahorticulturae sinica,2020,47(8):1463-1474 (in Chinese withEnglish abstract).
[11] YE X,WANG H Y,CHEN P,et al.Combination of iTRAQproteomics and RNA-seq transcriptomics reveals multiple levelsof regulation in phytoplasma-infected Ziziphus jujuba Mill[J]. Horticulture research,2017,4:17080 [2024-03-28].https://doi.org/10.1038/hortres.2017.80.
[12] 刘伟,霍辰思,王国平,等.枣疯病导致的花异常发育相关基因鉴定及表达分析[J]. 山西农业大学学报(自然科学版),2021,41(6):57-66.LIU W,HUO C S,WANG G P,et al.Identificationand expression analysis of genes related to abnormal flowerdevelopment induced by jujube madness disease[J].Journalof Shanxi Agricultural University (natural science edition),2021,41(6):57-66( in Chinese with English abstract).
[13] 李玲,闫旭宇,张昊,等. 基于高通量测序的枣疯病转录组分析[J]. 分子植物育种,2020,18(11):3537-3543.LI L,YANX Y,ZHANG H,et al.Transcriptome data analysis of witches’broom disease in Ziziphus jujube based on high-throughput sequencing[J]. Molecular plant breeding,2020,18(11):3537-3543( in Chinese with English abstract).
[14] 张舒怡,张钟,张春梅,等. 基于转录组水平的枣疯病发病机理研究[J]. 园艺学报,2017,44(7):1287-1298.ZHANG S Y,ZHANG Z,ZHANG C M,et al. Transcriptomic analysis onpathogenesis of witches’ broom disease in Ziziphus jujuba[J].Acta horticulturae sinica,2017,44(7):1287-1298 (in Chinesewith English abstract).
[15] 田国忠,李志清,胡佳续,等. 我国部分枣树品种(系)的枣疯病抗性鉴定[J]. 林业科技开发,2013,27(3):19-25.TIAN GZ,LI Z Q,HU J X,et al.Resistance evaluation of a collectionof Chinese jujube cultivars (line) against jujube witches’broom phytoplasma in China[J]. China forestry science andtechnology,2013,27(3):19-25 (in Chinese with English abstract).
[16] 任争光,王合,林彩丽,等. 实时荧光定量PCR(SYBR GreenⅠ)检测不同抗枣疯病枣树品种嫁接接穗中的植原体浓度[J]. 植物病理学报,2015,45(5):520-529.REN Z G,WANGH,LIN C L,et al.A real-time (SYBR Green Ⅰ) PCR assayfor detection and quantification of jujube witches’-broom phytoplasmain the grafted jujube cultivar scions with different resistance[J]. Acta phytopathologica sinica,2015,45(5):520-529( in Chinese with English abstract).
[17] HUANG J,ZHANG C M,ZHAO X,et al.The jujube genomeprovides insights into genome evolution and the domesticationof sweetness/acidity taste in fruit trees[J/OL].PLoS genetics,2016,12(12):e1006433[2024-03-28]. https://doi. org/10.1371/journal.pgen.1006433.
[18] XU Y,WANG C,KONG D, et al. Identification of high toleranceto jujube witches’ broom in indian jujube (Ziziphus mau⁃ritiana Lam.) and mining differentially expressed genes relatedto the tolerance through transcriptome analysis [J/OL]. Plants,2023,12(11):2082[2024-03-28]. https://doi.org/10.3390/plants12112082.
[19] 张毅,吴万亿,刘霞宇,等.利用WGCNA鉴定甘薯耐盐相关共表达网络及核心基因[J]. 河南农业科学,2021,50(6):16-27.ZHANG Y, WU W Y, LIU X Y, et al.Identification of salttolerance co-expression modules and hub genes in Ipomoeabatatas by WGCNA[J].Journal of Henan agricultural sciences,2021,50(6):16-27( in Chinese with English abstract).
[20] KOHL M,WIESE S,WARSCHEID B.Cytoscape:softwarefor visualization and analysis of biological networks[J].Methodsin molecular biology,2011,696:291-303.
[21] 赵锦,刘孟军,周俊义,等.枣疯植原体的分布特点及周年消长规律[J]. 林业科学,2006,42(8):144-146.ZHAO J, LIU M J,ZHOU J Y, et al. Distribution and YearRound concentrationvariation of jujube witches’ broom (JWB) Phytoplasma in theplant of Chinese jujube[J].Scientia silvae sinicae,2006,42(8):144-146( in Chinese with English abstract).
[22] KARASOV T L,CHAE E,HERMAN J J,et al.Mechanismsto mitigate the trade-off between growth and defense[J].Theplant cell,2017,29(4):666-680.
[23] ZHANG S Y,LI C,SI J P,et al.Action mechanisms of effectorsin plant-pathogen interaction[J/OL].International journalof molecular sciences,2022,23(12):6758[2024-03-28].https://doi.org/10.3390/ijms23126758.
[24] 王会鱼. 枣响应植原体侵染及恢复的转录组和蛋白组分析[D]. 郑州:河南农业大学,2018.WANG H Y.Transcriptomeand proteome analysis of jujube in response to phytoplasma infectionand recovery[D].Zhengzhou:Henan Agricultural University,2018( in Chinese with English abstract).
[25] ZHANG M M, ZHANG S Q. Mitogen-activated protein kinasecascades in plant signaling[J].Journal of integrative plantbiology,2022,64(2):301-341.
[26] RENTEL M C,LECOURIEUX D,OUAKED F,et al.OXI1kinase is necessary for oxidative burst-mediated signalling inArabidopsis[J].Nature,2004,427(6977):858-861.
[27] DU M M,ZHAO J H,TZENG D T W,et al.MYC2 orchestratesa hierarchical transcriptional cascade that regulates jasmonate-mediated plant immunity in tomato[J].The plant cell,2017,29(8):1883-1906.
[28] XUE C L,LIU Z G,WANG L H,et al. The antioxidant defensesystem in Chinese jujube is triggered to cope with phytoplasmainvasion[J].Tree physiology,2020,40(10):1437-1449.
[29] SEWELAM N,JASPERT N,VAN DER KELEN K,et al.Spatial H2O2 signaling specificity:H2O2 from chloroplasts andperoxisomes modulates the plant transcriptome differentially[J].Molecular plant,2014,7(7):1191-1210.
[30] 郭艳玲,张鹏英,郭默然,等.次生代谢产物与植物抗病防御反应[J]. 植物生理学报,2012,48(5):429-434.GUO Y L,ZHANGP Y,GUO M R,et al.Secondary metabolites and plant defenceagainst pathogenic disease[J].China industrial economics,2012,48(5):429-434( in Chinese with English abstract).
(责任编辑:边书京)
基金项目:国家重点研发计划项目(2022YFD2200404);雄安新区科技创新专项(2022XACX1100);河北省院士合作重点单位枣疯病病原菌、根际微生物与宿主枣的互作和致病机制项目

