一种新发大豆根腐病的病原鉴定及防治药剂筛选




摘要 为明确在广东新发现的一种大豆根腐病的病原菌种类,了解其生物学特性,筛选防治该病的有效杀菌剂,采用组织分离法对罹病大豆植株的根部和茎基部的病原真菌进行分离,并通过形态学和3 个基因(rDNA⁃ITS, TEF⁃1α, RPB2)的联合系统发育分析对病原真菌进行鉴定,再将该病原真菌接种到原发病大豆品种桂夏2 号的根部和茎基部,测定其致病性和不同培养基、温度、碳氮源、pH、光照、杀菌剂对菌丝生长的影响以及病原菌分生孢子的致死温度。结果显示,分离到2 株具有不同特征的真菌,分别鉴定为新孢镰刀菌(Fusarium neocos⁃mosporiellum)和镰状镰刀菌(F. falciforme),后者是在我国广东大豆上的首次报道;接种试验显示,这2 株真菌单独或混合接种均可引起与田间自然发生的大豆根腐病相似的症状;新孢镰刀菌(F. neocosmosporiellum)在28 ℃、pH 7 条件下生长最快,可以有效利用多种碳氮源,乳糖和蛋白胨为最佳碳氮源,分生孢子致死温度为51 ℃(水浴10 min);镰状镰刀菌(F. falciforme)在25 ℃、pH 7 条件下生长最快,碳氮源利用能力强,以乳糖、蔗糖和麦芽糖为最佳碳源,最佳氮源为蛋白胨,孢子致死温度为54 ℃(水浴10 min);不同光照处理对2 个菌株的菌丝生长无影响;杀菌剂咪鲜胺对2 个菌株的抑制作用最强。综上,引起广东新发大豆根腐病的病原真菌为新孢镰刀菌(F. neocosmosporiellum)和镰状镰刀菌(F. falciforme),而这2 种真菌适应环境的能力强,对咪鲜胺敏感,该药剂可作为防治新发大豆根腐病的首选药剂。
关键词 大豆根腐病; 镰刀菌; 病原鉴定; 生物学特征; 多基因系统发育分析; 杀菌剂筛选
中图分类号 S435.651 文献标识码 A 文章编号 1000-2421(2024)06-0229-11
大豆[ Glycine max( Linn.) Merr]是植物优质蛋白质、食用油和动物饲料的来源,是我国非常重要的作物之一[1-2],在东北、华南、黄淮海以及长江流域地区广泛种植。大豆除了富含油脂和蛋白质外,还含有多种独特生理功能的次生代谢产物,如大豆异黄酮,能够预防及治疗癌症、糖尿病、心血管疾病和骨质疏松等疾病[3]。
大豆在生产过程中经常会遭受到许多病原真菌(或卵菌)的侵害,如平头炭疽菌(Colletotrichumtruncatum)[4]、大豆疫霉(Phytophthora sojae)[5]、立枯丝核菌(Rhizoctonia solani)[6]和尖孢镰刀菌(Fusari⁃um oxysporum)[7]等,引起大豆多种真菌(卵菌)病害,这些病害通常会导致大豆的品质和产量下降[8]。
2020 年9 月,在华南农业大学增城教学科研基地(广州增城宁西)种植的桂夏2 号大豆品种上发现了一种新发生的根部病害,病情非常严重,大豆植株发病后很快就干枯死亡,对大豆生产和种子繁育造成了重大的经济损失,但具体病因不明。世界各地报道和研究较多的大豆根部病害的病原菌主要是镰刀菌属(Fusarium spp.)的一些种[8],这些镰刀菌种类能够侵染大豆根茎部皮层及维管组织,引起大豆根腐病和枯萎病,导致根茎部腐烂和枯萎症状。此次在广东发现的大豆新病害的症状与美洲大豆猝死综合症(sudden death syndrome,简称SDS)的症状极为相似[9]。据报道,SDS 主要由逗号镰刀菌(F. virguli⁃forme)(北美大豆SDS)和图库曼镰刀菌(F. tucuma⁃niae)(南美大豆SDS)引起[10],它们侵染大豆后,造成叶片叶脉间的叶肉焦黄坏死,根部及茎基部变褐腐烂,但我国目前尚无SDS 的报道,SDS 是我国对外植物检疫对象[9]。因此,有必要确认广东省新发大豆根腐病的病原种类,筛选出有效的防治药剂,以便最终能够更有效地防治该病害。
1 材料与方法
1.1 病样采集、病原菌的分离纯化
2020 年9 月,从华南农业大学增城教学科研基地(广州增城宁西)采集具有典型的大豆新病害症状特征的罹病植株,带回实验室检查、拍照并采用常规组织分离法分离病原菌。首先冲洗干净大豆茎基部泥土,擦干,在病健交界处切取大小为0.5 cm×0.5 cm的小块组织,在75% 乙醇中浸泡消毒30 s,然后移入5% 次氯酸钠溶液消毒2~3 min,再用无菌水漂洗3次,把消毒后的病健组织块放置于无菌滤纸上吸干和风干水分,最后移植于PDA 培养基中,置于28 ℃培养箱中培养,等待菌落长出后,挑取菌落边缘菌丝进行纯化培养,2 次纯化后置于PDA 斜面培养基保存备用。
1.2 病原菌的形态学鉴定
将分离得到的病原菌接种到PDA 培养基平板中培养7 d,记录菌落颜色和形态特征并拍照。用无菌水洗下PDA 培养基平板中的分生孢子,制备孢子悬浮液,吸取少量孢子悬浮液于干净载玻片上,在光学显微镜下观察病原菌的形态特征并测量分生孢子大小。参照文献[11]判定病原菌的种类。
1.3 病原菌的分子生物学鉴定
用灭菌移液枪头刮取在PDA 培养基平板中培养7 d 的病原菌菌丝体,使用真菌基因组DNA 提取试剂盒(D3390-01, Bio-tek)从菌丝中提取基因组DNA。对核糖体RNA 内转录间隔区(internal transcribedspacer,rDNA⁃ITS)、翻译延伸因子基因(translationelongation factor 1-alpha,TEF⁃1α)、RNA 聚合酶Ⅱ第二大亚基基因(RNA polymerase Ⅱ second largestsubunit,RPB2)进行PCR 扩增,各序列扩增引物信息见表1。
PCR(polymerase chain reaction)反应总体系为25 μL[DNA 模板1 μL,正向和反向引物各1 μL,2×M5 Taq HiFi PCR mix(北京聚合美生物科技有限公司)12.5 μL,ddH2O 9.5 μL]。反应程序为94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,4 ℃保存、备用。用1% 琼脂糖凝胶电泳检测,将得到目的条带的产物送至上海生工生物工程有限公司进行测序。将得到的测序结果与GenBank 数据库中的已有数据进行Blast 比对分析,并查找文献,下载不同病原镰刀菌的基因序列,见表2。使用 MEGA X 软件进行对齐和剪切,PhyloSuite v1.2.2 将各菌株按照rDNA ⁃ ITSTEF1α-RPB2 的顺序首尾串联拼接,使用MEGA X软件中的Maximum likelihood(ML)方法构建系统发育树,Bootstrap 值重复1 000 次。
1.4 病原菌的致病性测定
病原菌的致病性测定采用伤根浸根法[15]。选用生长一致的两叶期大豆苗,将大豆苗的根部冲洗后吸干水分,用消毒的剪刀剪去一些须根,用无菌水洗下PDA 培养基平板上的病原菌的分生孢子,制备成孢子悬浮液,将大豆幼苗根部浸泡在浓度为1×106个/mL 的孢子悬浮液中1 h,最后移栽到无菌土壤基质,以R1、R2 单菌株接种以及R1 和R2 菌株混合接种为处理组,以无菌水接种作为对照组,每组3 次重复,接种后的大豆苗放置于人工气候培养箱内30 ℃保湿培养。
1.5 病原菌的生物学特性测定
1)培养基对病原菌菌丝生长的影响。供试培养基为玉米粉琼脂(CAM)培养基(海博生物技术有限公司)、察氏(Czapek)培养基(海博生物技术有限公司)、燕麦片琼脂(OA)培养基(广东环凯微生物科技有限公司)、马铃薯葡萄糖琼脂(PDA)培养基(广东环凯微生物科技有限公司)、自配番茄琼脂(TomA)培养基(番茄200 g,琼脂粉18 g,蒸馏水1 000 mL),山药汁琼脂(YA)培养基(山药200 g,琼脂粉18 g,蒸馏水1 000 mL)和水琼脂(WA)培养基(琼脂粉18 g,蒸馏水1 000 mL)。
用打孔器在PDA 平板上生长7 d 的病原菌菌落边缘打下直径为5 mm 的菌饼,分别接种于以上培养基的培养皿上,每处理3 次重复;接菌培养皿在28 ℃恒温黑暗培养7 d 后,用十字交叉法测量菌落直径。
2) 温度、光照、pH 对病原菌菌丝生长的影响。培养温度梯度设置为5、10、15、20、25、28、30 和35 ℃;光照条件设置为完全光照、完全黑暗和12 h 光暗交替3 种模式;pH 值设置4~11 共8 个酸碱度处理,用1% HCl 或1% NaOH 溶液调节高温灭菌后冷却至50 ℃左右的PDA 培养基;接种与测量方法同本文“1.5 1)”,每处理设3 个重复。
3) 碳、氮源对病原菌菌丝生长的影响。以察氏(Czapek)培养基为基础培养基,参照周而勋等[16]的方法,将培养基中的碳源(蔗糖)以等量碳原子的麦芽糖、甘露醇、葡萄糖、乳糖、山梨醇和肌醇替代;将培养基中的氮源(硝酸钠)以等量氮原子的甘氨酸、酵母粉、DL-苏氨酸、硝酸钾、蛋白胨和氯化铵替代。每处理3 次重复,接种与测量方法同本文“ 1.5 1)”。
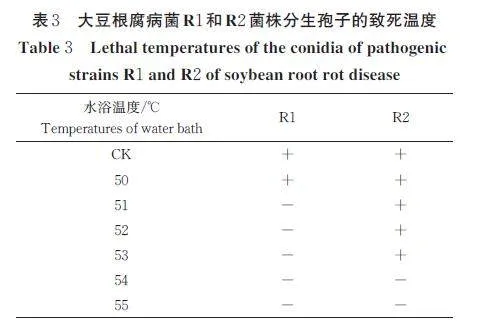
4) 病原菌分生孢子致死温度的测定。将1×106个/mL 的孢子悬浮液1 mL 加入1.5 mL 的薄壁灭菌离心管中,调节水浴锅温度分别为40、45、50、55 和60 ℃。以室温处理为对照,持续处理10 min,取出各处理的离心管并快速冷却至室温,涂布在PDA 培养基平板上,28 ℃恒温黑暗培养。每处理3 次重复,3 d后观察是否长出菌落,从而判断孢子是否死亡,得到分生孢子粗略的致死温度范围。再以粗略的致死温度为中心温度,以1 ℃为间隔,设置5 个温度梯度,重复之前步骤,确定精确的致死温度。
1.6 杀菌剂的室内筛选
采用含药平板菌丝生长速率法,测定各杀菌剂对病原菌的抑制效果。供试菌剂为吡唑醚菌酯乳油(25%,北京中保绿农科技集团有限公司)、甲基硫菌灵可湿性粉剂(70%,允发化工(上海)有限公司)、代森锰锌可湿性粉剂(80%,四川润尔科技有限公司)、咪鲜胺水乳剂(450 g/L,山东鑫星农药有限公司)。将各杀菌剂用无菌水配制成使用浓度100 倍的母液(5 个梯度的浓度),取1 mL 各杀菌剂各浓度的母液分别加入到高温灭菌后冷却到50 ℃左右的100 mL定量PDA 培养基中,充分混匀,制成含药平板。以添加无菌水的混合溶液的PDA 培养基为对照。接种方法与本文“1.5 1)”一致,每处理3 次重复,28 ℃恒温黑暗培养7 d,十字交叉测量菌落直径,按照公式(1)计算抑菌率。
E =A - B/A - 0.5 × 100% (1)
式(1)中,A 为添加无菌水对照组菌落直径;B 为添加杀菌剂的处理组菌落直径,E 为菌落生长抑制率。
以杀菌剂浓度的对数值作为自变量(X),抑制率对应的几率值作为因变量(Y),建立毒力回归方程,并计算各杀菌剂对病原菌的有效中浓度(median effectconcentration,EC50)。
1.7 数据处理
采用Excel 计算试验数据和构建三维柱状图,运用SPSS17.0 中的Duncan’ s 新复极差分析法进行单因素ANOVA 分析,并以小写字母为统计学差异进行标注。
2 结果与分析
2.1 大豆新病害症状
田间大豆叶片上初期出现圆形或不规则形的黄色斑点,斑点逐渐扩大或愈合形成萎黄斑,叶肉焦黄坏死,仅有叶脉保持一点绿色组织,部分叶片卷曲皱缩,后期从叶柄上脱落;枝条发育不全,结荚少、豆粒小;茎基部和根部变褐腐烂,病斑可沿茎向上扩展10~20 cm,髓部明显变为棕褐色(图1)。
2.2 病原菌的形态特征观察
对采集到的大豆新病害的罹病根部和茎基部进行病原菌分离纯化,共获得2 种菌落形态的真菌菌株,分别命名为R1 和R2。
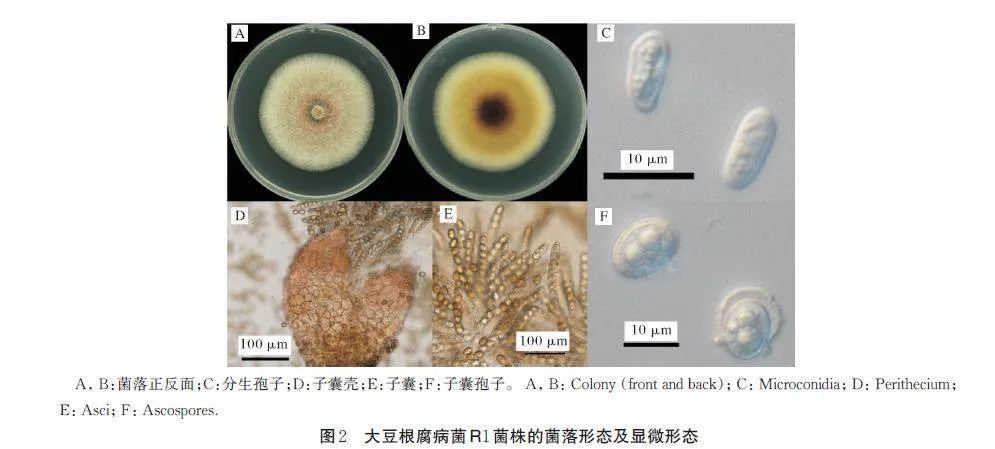
在PDA 培养基,28 ℃黑暗条件下培养,菌株R1菌落初为白色,后为红棕色,气生菌丝旺盛,菌落边缘较整齐,菌落背面为红棕色(图2 A,B);分生孢子无色,卵圆形或肾形,具有0~1 个隔膜,大小为(8.68~11.08) μm×(3.23~4.79) μm(图2C);培养后期产生子囊壳,子囊壳深棕色,水滴状,具有孔口和喙,子囊棒状丛生,每个子囊内含8 个单排子囊孢子(图2D,E),子囊孢子豆粒状,大小为(9.92~12.9)μm×(6.28~8.68) μm(图2F);在PDA 培养基上未发现大型分生孢子。
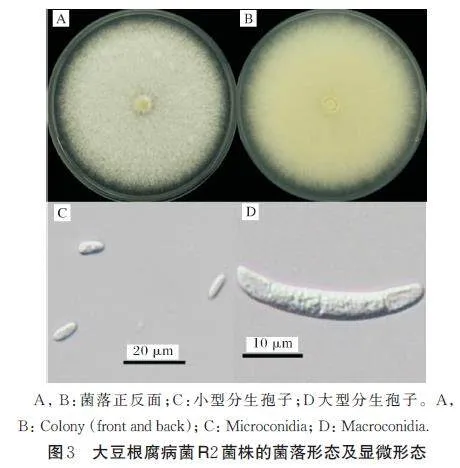
在同样培养条件下,R2 菌株菌落白色,菌落边缘不整齐,气生菌丝旺盛(图3A,B);小型分生孢子无色,单胞,长椭圆形或卵形,具有0~1 隔膜,大小为(8.52~11.94) μm×(3.19~5.11) μm(图3C);大型分生孢子无色,镰刀状,具有3~4 隔膜,大小为(25.17~33.55) μm×(4.34~6.14) μm(图3D);暂未发现有性态(teleomorph)。
根据上述的形态特征,R1 和R2 菌株均符合镰刀菌属的特征描述[11],将它们初步鉴定为镰刀菌的2个种。
2.3 病原菌的分子生物学鉴定
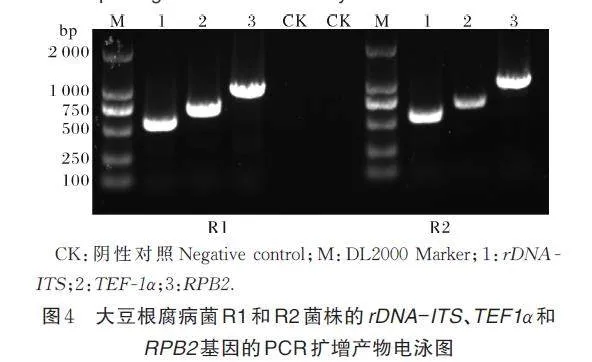
利用3 个基因的引物对ITS1/ITS4、EF1Ha/EF2Tb 和RPB2-5F2 /RPB2-7cR,对R1 和R2 菌株的3 个基因rDNA-ITS、TEF-1α 和RPB2 进行PCR扩增,分别得到约550、750和1 000 bp的条带(图4)。
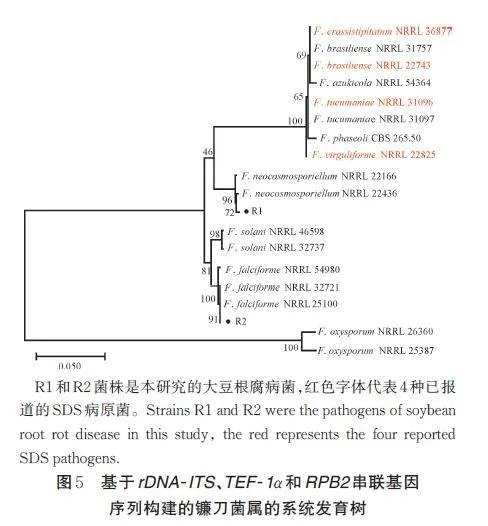
将PCR 产物送至公司测序,测序结果上传至NCBI。分别对2 个菌株的3 个基因rDNA ⁃ ITS、TEF1α 和RPB2 在NCBI 进行Blast 分析,发现R1 菌株与新孢镰刀菌(F. neocosmosporiellum)的相似性在99% 以上,R2 菌株与镰状镰刀菌(F. falciforme)的相似性也在99% 以上。基于多基因联合系统发育分析,构建了ITS-TEF1α-RPB2 多基因系统发育树(图5)。从图5 可看出,R1 菌株与新孢镰刀菌(F. neocos⁃mosporiellum)聚为一支,而R2 菌株与镰状镰刀菌(F.falciforme)聚为一支。结合形态学和分子生物学的鉴定结果,确定R1 菌株为新孢镰刀菌(F. neocosmos⁃poriellum),而R2菌株为镰状镰刀菌(F. falciforme)。
2.4 致病性测定
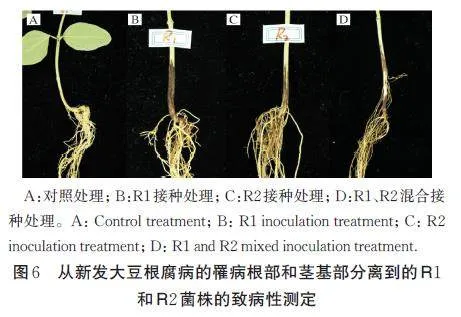
R1 和R2 菌株单独接种及两者混合接种的结果显示,在接种4 周后,3 种接种处理的大豆茎基部都表现出变色、腐烂症状,与田间症状一致,而对照处理无发病症状(图6)。通过对比发现R1 菌株主要影响茎基部,而R2 菌株主要影响根系。而R1 和R2 菌株混合接种同样出现相似的症状,显示出复合侵染现象。从发病植株再次分离纯化病原菌可获得与R1和R2 菌株具有相同菌落和孢子形态的菌株。因此,根据科赫氏法则,可以确定新孢镰刀菌和镰状镰刀菌均为引起大豆新发根腐病的病原菌,可分别和复合侵染引起大豆根腐病。
2.5 病原菌的生物学特性
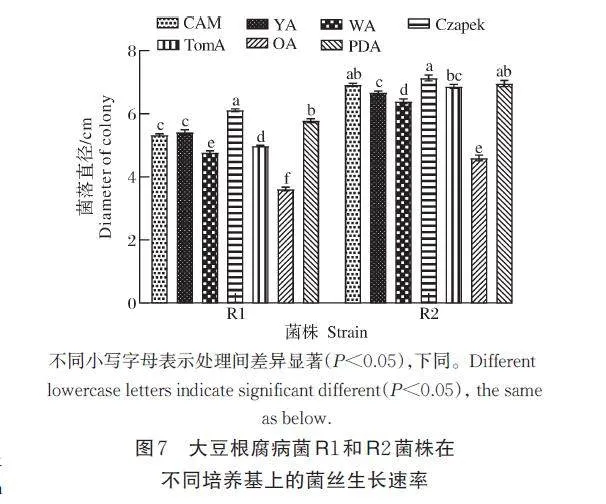
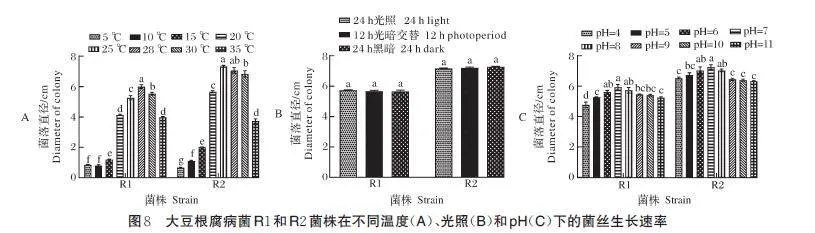
1)培养基对病原菌菌丝生长的影响。结果如图7 所示。R1 菌株在Czapek 培养基上生长最快,菌落直径达到6.11 cm;在PDA、YA、CAM 培养基上次之,菌落直径分别为5.78、5.41 和5.33 cm;在OA 培养基上生长最慢,菌落直径仅为3.61 cm。R2 菌株在Czapek 培养基上生长最快,菌落直径达到7.13 cm;在CAM、PDA 和TomA 培养基上次之,菌落直径分别为6.92、6.96 和6.87 cm;而在OA 培养基上生长最慢,菌落直径仅为4.6 cm。
2)温度、光照、pH 对病原菌菌丝生长的影响。结果如图8 所示。R1 和R2 菌株在10~30 ℃范围内均可以生长;在5~28 ℃区间内,菌落直径随温度升高而增大,20~30 ℃生长良好,R1 菌株在28 ℃生长最快,菌落直径为6.00 cm;R2 菌株在25 ℃生长最快,菌落直径为7.33 cm;随后菌落直径随温度升高而减小(图8A)。光照对R1和R2菌株生长影响不大,菌落直径分别为5.662 5~5.737 5 cm 和7.175 0~7.287 5cm,在α=0.05 水平下差异不显著(图8B)。在pH4~11,R1 与R2 菌株均能正常生长;在pH 7 时,R1 与R2 菌株生长最好,菌落直径最大,分别为5.93 cm 和7.26 cm;在pH 4~7,菌落直径随pH 增大而增大,随后随pH 增大而减小(图8C)。
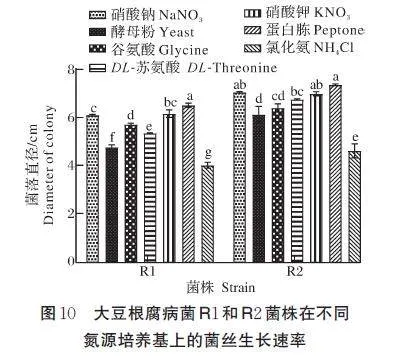
3) 碳、氮源对病原菌菌丝生长的影响。结果如图9、图10 所示。R1 菌株以乳糖为碳源时,菌丝生长最快,菌落直径达到6.46 cm,以麦芽糖为碳源次之,菌落直径为6.07 cm,以山梨醇为碳源时生长最慢,菌落直径为5.28 cm;以蛋白胨为氮源时,菌丝生长最快,菌落直径达到6.55 cm,其次为硝酸钠和硝酸钾,菌落直径分别为6.20、6.13 cm,而以氯化铵为氮源时,菌丝生长最慢,菌落直径为4.05 cm。R2菌株在以乳糖、麦芽糖、蔗糖为碳源时生长速率最快,菌落直径为6.43~6.47 cm,三者处理在α=0.05 水平下无显著差异,以甘露醇、山梨醇、肌醇为碳源时生长速率最慢,菌落直径为5.91~6.03 cm;以蛋白胨为氮源时,菌丝生长最快,菌落直径为7.4 cm,其次为硝酸钠和硝酸钾,以氯化铵为氮源时,菌丝生长最慢,菌落直径为4.65 cm。
4)病原菌分生孢子致死温度的测定。由表3 可知,R1 和R2 菌株的分生孢子对温度的敏感度不同,R1 菌株的分生孢子在经过51 ℃水浴10 min 处理后,分生孢子丧失活力,不能萌发,不能长出菌落;而R2菌株的分生孢子比R1 菌株的分生孢子对温度更不敏感,R2 菌株的分生孢子在经过54 ℃水浴10 min 处理后,分生孢子才丧失活力。
2.6 室内杀菌剂筛选
对R1 和R2 菌株进行杀菌剂室内毒力测定,结果显示(表4),在所选用的4 种杀菌剂中,2 个菌株对咪鲜胺表现最敏感,其次为吡唑醚菌酯,代森锰锌对两菌株的抑制作用最差。因而,咪鲜胺可作为防治新发大豆根腐病的药剂。
3 讨论
本研究报道了在广东省内新发现的一种大豆根部病害,并将引起该病害的病原菌鉴定为新孢镰刀菌(F. neocosmosporiellum)和镰状镰刀菌(F. falci⁃forme)。两菌株均侵染大豆,即能复合侵染大豆,造成大豆茎基部和根部变色腐烂。通过对比发现,新孢镰刀菌主要侵染大豆茎基部,镰状镰刀菌主要侵染大豆根部。叶片上出现的叶肉细胞焦黄坏死症状,可能是因为镰刀菌侵染后会分泌一些毒素,这些毒素通过植物的输导组织运输至植物叶片从而造成这种症状的发生。美洲大豆SDS[17]症状与本次所研究的大豆新病害症状有许多相似之处[9],但也存在一些不同之处。首先是病原菌的不同,美洲大豆SDS病原菌为逗号镰刀菌(F. virguliforme)(北美大豆SDS)和图库曼镰刀菌(F. tucumaniae)(南美大豆SDS),而本研究的大豆新病害病原菌并非SDS 病原菌,而是另外2 种镰刀菌;其次是在病程后期,SDS 在处于高温高湿条件下茎基部会产生蓝色的菌丝体,病原菌在PDA 培养基上也会产生蓝色菌落[18],侵染大豆茎的皮层及维管组织造成褐变腐烂,但髓部不受影响,依然保持白色[9];而本研究的大豆新病害在茎基部没有产生蓝色菌丝体,2 个菌株在PDA 培养基上也不产生蓝色菌落,侵染大豆输导组织并且引起根系和茎干髓部(维管束)褐变甚至黑化。结合以上特点,确定本研究新发现的大豆根腐病并非美洲大豆SDS。
此前,盖云鹏等[19]与潘汝谦等[20]报道了大豆新赤壳菌(Neocosmospora vasinfecta,现改名为新孢镰刀菌F. neocosmosporiellum),可引起大豆和花生的茎基部腐烂;何弯弯等[21]也在花生果实上分离到可引起花生果实和种子腐烂的新孢镰刀菌。镰状镰刀菌(F. falciforme)属于腐皮镰刀菌复合种[ Fusariumsolani species complex( FSSC)] 中的一员,该病原菌寄主范围非常广泛,曾被报道在印度番木瓜上引起根部褐变和腐烂,发病率高达40%~50%[22];在墨西哥,该菌也引起番茄叶片黄化、根茎腐烂[23];该菌还能侵染西瓜,造成西瓜果实表面呈现黄至棕色的凹陷病斑,果实内部腐烂[24]。但在大豆上尚未见到报道。本研究首次发现大豆是镰状镰刀菌(F. falci⁃forme)的寄主之一。因此,这是在中国广东省首次报道镰状镰刀菌(F. falciforme)为害大豆,引起根腐病。此次分离的镰状镰刀菌在自然条件下以无性态存在,并未观察到有性态,其原因可能是该菌的有性生殖需要性亲和的菌丝融合。
为了有效地防治该病害,笔者随后对新孢镰刀菌与镰状镰刀菌2 个菌株的生物学特性和杀菌剂室内筛选进行了探究。结果表明,2 个菌株的适合生长温度均为20~30 ℃,适应酸碱的能力强,这与何弯弯等[21]的研究结果一致,碳氮源的适应范围广,在所选用的7 种碳氮源上均能生长,但在供试氮源试验中,以氯化铵为氮源时,2 个菌株的菌落生长速率能够与其他氮源形成显著差异,这点与韩凤英等[25]所得出的铵态氮能够显著降低胡萝卜茄病镰刀菌菌丝生长的试验结果一致。因此,在大豆的生产过程中,在氮肥使用上,推荐以施用铵态氮肥为主,这样可以降低大豆根腐病菌的生长,从而减少大豆根腐病的发生。
华南地区气候温暖湿润,土壤条件复杂,而病原菌能适应多样的环境,有利于病原菌的生长与繁殖,农事操作或农田管理不当有利于病原菌的传播。药剂敏感性试验表明,当地菌株对所选用杀真菌剂已具有一定的抗性,咪鲜胺可用于大豆根腐病的防治。
综上,本研究对广东大豆新发根腐病的病原菌种类进行了鉴定,其中一种是未报到过的病原菌—镰状镰刀菌,并且阐明了病原菌的生物学特征,筛选了大豆新发根腐病的有效杀菌剂,可为进一步研究该病害的发生和防控提供参考依据。
参考文献References
[1] 黄新阳,周延争,王桂莲,等. 国家大豆产业技术体系济宁综合试验站服务区大豆生产现状及“十四五”期间技术需求调研报告[J]. 大豆科技, 2022 (5):1-7.HUANG X Y, ZHOUY Z, WANG G L, et al.Research report on the current situationof soybean production in the service area of Jinan comprehensivetest station of national soybean industry technologysystem and the technical demand during the 14th Five-YearPlan period[J].Soybean science amp; technology, 2022 (5):1-7(in Chinese).
[2] 邹文秀,韩晓增,张谦,等. 国家大豆产业技术体系海伦综合试验站服务区大豆生产现状及“十四五”期间技术需求调研报告[J]. 大豆科技, 2022(2): 29-41.ZOU W X, HAN XZ, ZHANG Q.Research report on the current situation of soybeanproduction in the service area of Hailun comprehensivetest station of national soybean industry technology system andthe technical demand during the 14th Five-Year Plan period[J].Soybean science amp; technology, 2022(2): 29-41 (in Chinese).
[3] 刘璐璐,李建飞,舒跃,等. 我国大豆生产消费现状及提升自给率策略[J]. 中国油料作物学报, 2022, 44(2): 242-248.LIU L L, LI J F, SHU Y, et al.Current situation of soybeanproduction and consumption in China and strategies to improveself-sufficiency rate[J]. Chinese journal of oil crop sciences,2022, 44(2): 242-248(in Chinese with English abstract).
[4] 李月,舒灿伟,饶军华,等. 热带亚热带高产优质大豆种质资源抗炭疽病鉴定[C]//中国植物病理学会. 植物病理科技创新与绿色防控:中国植物病理学会2021 年学术年会论文集.北京:中国农业科学技术出版社, 2021:401.LI Y, SHU CW, RAO J H, et al. Identification of anti-anthracnose germplasmresources with high yield and high quality soybean intropical and subtropical region[C]// Chinese Society of PlantPathology. Plant pathology science and technology innovationand green prevention and control: Proceedings of the 2021 AcademicAnnual Conference of the Chinese Plant Pathology Society.Beijing: China Agricultural Science and TechnologyPress ,2021:40(in Chinese).
[5] 杨瑾,汪孝璊,叶文武,等.黄淮海地区大豆种质资源对疫霉根腐病的抗性鉴定[J]. 大豆科学,2020,39(1):12-22.YANG J,WANG X M,YE W W,et al.Identification of soybeanresistance to Phytophthora sojae in the germplasm resourcesfrom Huanghuaihai Region of China[J].Soybean science,2020,39(1):12-22( in Chinese with English abstract).
[6] 魏崃,李馨园,唐晓飞,等.大豆品种对立枯丝核菌的抗性研究[J].大豆科学,2012,31(3):457-461.WEI L,LI X Y,TANG X F,et al.Screening on soybean germplasm resistantto Rhizoctonia solani[J].Soybean science,2012,31(3):457-461( in Chinese with English abstract).
[7] 王爽,李新民,刘春来,等. 引起黑龙江省大豆根腐病的镰刀菌种类鉴定及致病分析[J]. 植物病理学报, 2023,53(1):126-128. WANG S, LI X M, LIU C L, et al. Identificationand pathogenicity of Fusarium species causing soybean rootrot in Heilongjiang Province[J].Acta phytopathologica sinica,2023,53(1):126-128(in Chinese with English abstract).
[8] 叶文武,刘万才,王源超. 中国大豆病虫害发生现状及全程绿色防控技术研究进展[J]. 植物保护学报, 2023,50(2): 265-273. YE W W, LIU W C, WANG Y C. Occurrence statusand whole-process green control technologies for soybean diseasesand pests in China[J].Journal of plant protection, 2023,50(2): 265-273(in Chinese with English abstract).
[9] 杜琦,李启新. 大豆猝死综合症[J]. 植物检疫, 1998, 12(5):31-32. DU Q, LI Q X. Soybean sudden death syndrome[J].Plant quarantine, 1998, 12(5):31-32( in Chinese).
[10] 吴品珊,严进,RUPE J C,等. 大豆猝死综合症病菌检测技术研究[J]. 植物病理学报, 2005, 35(6): 28-34. WU P S,YAN J, RUPE J C, et al.The detection techniques for suddendeath syndrome pathogens of soybean[J].Acta phytopathologicasinica, 2005, 35(6): 28-34(in Chinese with English abstract).
[11] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979. WEI J C. Handbook of fungal identification[M].Shanghai:Shanghai Scientific amp; Technical Publishers,1979(in Chinese).
[12] WHITE T J,BRUNS T,LEE S,et al.Amplification and directsequencing of fungal ribosomal RNA genes for phylogenetics[M]//INNIS M A,GELFAND D H, SNINSKY J J,WHITE T J. PCR Protocols. New York:Academic Press,1990:315-322.
[13] O’DONNELL K,KISTLER H C,CIGELNIK E,et al.Multipleevolutionary origins of the fungus causing Panama diseaseof banana:concordant evidence from nuclear and mitochondrialgene genealogies[J].PNAS,1998,95(5):2044-2049.
[14] O’DONNELL K,SUTTON D A,RINALDI M G,et al.Internet-accessible DNA sequence database for identifying fusariafrom human and animal infections[J].Journal of clinical microbiology,2010,48(10):3708-3718.
[15] 徐艳辉,李烨,许向阳. 番茄枯萎病的研究进展[J]. 东北农业大学学报, 2008, 39(11): 128-134.XU Y H, LI Y, XU XY.Progress in research on Fusarium wilt of tomato[J].Journalof Northeast Agricultural University, 2008, 39(11): 128-134(in Chinese with English abstract).
[16] 周而勋,杨媚,张华,等. 菜心炭疽病菌菌丝生长、产孢和孢子萌发的影响因素[J]. 南京农业大学学报, 2002, 25(2): 47-51.ZHOU E X, YANG M, ZHANG H, et al.Factors affectingthe mycelial growth, sporulation and conidial germinationof Colletotrichum higginsianum Sacc.[J]. Journal of NanjingAgricultural University, 2002, 25(2): 47-51(in Chinese withEnglish abstract).
[17] O’DONNELL K,SINK S,SCANDIANI M M,et al.Soybeansudden death syndrome species diversity within north andSouth America revealed by multilocus genotyping[J].Phytopathology,2010,100(1):58-71.
[18] 秦国勋,吴品珊,张睿. 大豆猝死综合症病菌研究进展[J]. 检验检疫科学, 2006(S1): 125-128. QIN G X, WU P S,ZHANG R.Research progress of sudden death syndrome [J].Inspection and quarantine science, 2006(S1): 125-128(inChinese).
[19] 盖云鹏,潘汝谦,徐大高,等. 大豆新赤壳菌茎腐病的鉴定[C] //中国植物病理学会. 中国植物病理学会2011 年学术年会论文集. 北京:中国农业科学技术出版社, 2011:65.GAI YP, PAN R Q, XU D G, et al.Identification of Neocosmosproastem rot of soybean [C]// Chinese Society of Plant Pathology.Proceedings of the 2011 Academic Annual Conference ofthe Chinese Plant Pathology Society. Beijing: China AgriculturalScience and Technology Press,2011:65( in Chinese).
[20] 潘汝谦,邓巧文,邓铭光,等. 花生基腐病(Neocosmosporavasinfecta)在中国大陆的首次报道[C] //中国植物病理学会. 中国植物病理学会2011 年学术年会论文集. 北京: 中国农业科学技术出版社, 2011:91, et al.PAN R Q, DENG QW, DENG M G, et al.The first report of peanut rot (Neocos⁃mospora vasinfecta) in mainland China [C]// Chinese Societyof Plant Pathology.Proceedings of the 2011 Academic AnnualConference of the Chinese Plant Pathology Society. Beijing:China Agricultural Science and Technology Press,2011:65(in Chinese).
[21] 何弯弯,冯丽娜,李振云,等.引起花生果腐病的新孢镰刀菌及其生物学特性[J].植物病理学报,2022,52(3):493-498.HE W W,FENG L N,LI Z Y,et al. Fusarium neocosmos⁃poriellum causing peanut pod rot and its biological characteristics[J]. Acta phytopathologica sinica,2022,52(3):493-498( in Chinese with English abstract).
[22] GUPTA A K,CHOUDHARY R,BASHYAL B M,et al.First report of root and stem rot disease on papaya caused byFusarium falciforme in India[J/OL].Plant disease,2019,103(10):2676[2023-08-29]. https://doi. org/10.1094/PDIS-11-18-2118-PDN.
[23] VEGA-GUTIÉRREZ T A,LÓPEZ-URQUÍDEZ G A,ALLENDE-MOLAR R,et al.Aggressiveness and molecular characterizationof Fusarium spp.associated with foot rot and wiltin tomato in Sinaloa,Mexico[J/OL]. Biotech,2019,9(7):276 [2023-08-29]. https://doi. org/10.1007/s13205-019-1808-3.
[24] BALASUBRAMANIAM J,GOH K S,SANI S F,et al.Fu⁃sarium falciforme and F. oxysporum causing postharvest fruitrot of watermelon( Citrullus lanatus) in Malaysia:a first report[J/OL].Crop protection,2023,163:106115[2023-08-29].https://doi.org/10.1016/j.cropro.2022.106115.
[25] 韩凤英,高婧,王勇,等.胡萝卜茄病镰刀菌生物学特性及药剂敏感性研究[J].北方农业学报,2020,48(3):117-122.HAN F Y,GAO J,WANG Y,et al.Research on biologicalcharacteristics and fungicides sensitivity of Fusarium solani oncarrot[J].Journal of northern agriculture,2020,48(3):117-122( in Chinese with English abstract).
(责任编辑:边书京)
基金项目:广东省重点领域研发计划项目(2020B020220008)

