北京城市绿地节肢动物多样性与微环境因子关系



摘要 为厘清节肢动物多样性与绿地微环境因子间关系,进而促进城市绿地生物多样性,利用截获器法采集了北京市三环内6 个中小型公园的节肢动物种群,应用Pearson 相关性分析方法、回归分析、主成分分析探究节肢动物及其天敌多样性与绿地微环境因子间的关系。结果显示:节肢动物中蚜科为优势科,占总多度的52.12%;食蚜天敌昆虫中菜蚜茧蜂Semidalis rapae、广重粉蛉Diaeretiella aleyrodiformis 为优势种,分别占总多度的27.73% 和23.92%;天敌多度、丰度、香农-维纳指数在不同样地间差异显著。相关分析表明花期植物面积、丰度和香农-维纳指数与节肢动物多度(Plt;0.001)、食蚜天敌昆虫丰度(Plt;0.001)及多度(Plt;0.001)呈显著正相关,与节肢动物香农-维纳指数呈显著负相关(Plt;0.001),施药频次和施药剂量比与节肢动物多度呈显著正相关(Plt;0.001)。主成分分析结果显示施药剂量比、花期植物面积、施药频次、花期植物均匀度、花期植物香农-维纳多样性和花期植物丰度是影响绿地节肢动物科多样性的主要微环境因子。RDA 分析结果显示花期植物面积、均匀度、香农-维纳多样性和丰度与节肢动物及食蚜天敌昆虫的多度显著正相关,与节肢动物多样性显著负相关。
关键词 城市绿地; 节肢动物; 天敌昆虫; 生物多样性; 微环境
中图分类号 S757.2;Q16;Q948.3 文献标识码 A 文章编号 1000-2421(2024)06-0161-10
城市绿地是城市人居环境的重要物质基础,也是城市动物的食物资源库和栖息地,更是城市生态系统服务功能和生物多样性的重要载体[1]。城市生物多样性及其生态服务功能与城市的和谐共生体现着一个城市的活力、发达程度和可持续发展力[2],因而研究城市生物多样性意义重大。节肢动物的快速繁殖能力、多样性生殖方式与多变身体结构使其部分种类能够适应多变的城市环境[3],成为城市绿地中种类最多和数量最大的动物类群,在城市绿地中扮演着消费者、传粉者、捕食者和分解者等多种角色[4],其生物多样性是城市绿地生物多样性的重要组成部分,也是绿地生态系统稳定性和可持续发展的重要保障[5]。同时,一些对城市绿地环境质量较为敏感的节肢动物,成为城市绿地环境质量的指示性物种。因此,城市绿地生物和非生物因子对城市节肢动物组成和生物多样性的影响成为城市生物多样性的研究热点之一。
国内外研究表明,城市绿地节肢动物生物多样性是城市生物和非生物因子耦合效应的结果[6],生物因子包括植物群落景观格局[7]、植物群落结构[8]、植物多样性[9]、花期植物多度、丰度和多样性[10]、景观破碎[11]、绿地斑块面积[12]、外来植物入侵[13]以及人为干扰[14]等,非生物因子包括气候变暖[15]、城市热岛效应[16]、环境污染[17]、水陆面积比例[18]等。其中,城市化是最主要因子之一,造成城市节肢动物组成结构的变化,蚜虫、木虱、蓟马和叶螨等物种成为城市优势节肢动物种类,特别是蚜虫种群常暴发成灾[19],其天敌昆虫数量也相应增加,成为绿地天敌昆虫主要类群,而鞘翅目、鳞翅目和直翅目等其余昆虫目及其天敌的多度和丰度急剧减少[20]。尽管国内外对影响城市节肢动物生物多样性的生物和非生物因子的研究报道较多,但多数研究中所涉及的影响因子仅为少数几种[21],或仅涉及鞘翅目、鳞翅目和蜘蛛目等某一类群节肢动物[22],涉及多种城市生物和非生物影响因子对节肢动物多样性影响的研究报道极少;涉及城市、区域和景观格局等尺度对节肢动物影响的研究报道较多[23],涉及与微尺度城市环境因子的研究报道较少。
城市公园作为城市绿地的重要组成部分,具有多样性的绿地格局、丰富的植物群落结构和植物多样性、不同的人为干扰强度等,形成了多样性的城市生物和非生物因子,是研究城市绿地与节肢动物多样性关系的理想场所。油松(Pinus tabulaeformis)、栾树(Koelreuteria paniculata)和国槐(Sophora ja⁃ponica)是北京城市绿化骨干树种,以3 种植物为建群种的植物群落在公园中普遍存在。同时,截获器收集法方便在公园绿地中使用,采集的节肢动物数据能够较真实反映实际节肢动物数据。
本研究选择在北京市三环内10 hm2以下的面积和立地条件相似的中小型公园开展微环境因子与节肢动物群落关系研究,以消减过多城市化因子对数据离散程度的影响。同时,本研究采用截获器收集方法调查北京城市公园中以上述3 种植物为建群种植物群落中的节肢动物种类及其数量,应用Pearson相关性分析方法、回归分析、主成分分析方法分析其与城市公园生物因子和非生物因子之间的关系,旨在明确影响公园绿地节肢动物多样性的微环境因子及其影响力,促进城市绿地生物多样性保护。
1 材料与方法
1.1 研究地概况
北京位于华北大平原北端(39°38′~41°05′N,115°24′~117°30′E),属暖温带半湿润季风大陆性气候区,年平均降水量为600 mm,年平均气温11.8 ℃,四季分明,夏季高温多雨,冬季寒冷干燥,地带性植被为暖温带阔叶林和针阔混交林。
1.2 研究方法
1)样地设置。根据《城市绿地分类标准》(CJJ/T85—2017),选择北京市三环内面积相似的10 hm2以下的人定湖公园、双秀公园、东单公园、南馆公园、宣武艺园和翠芳园等6 个中小型规模的公园作为研究样地(图1)。选择以北京市骨干树种国槐、栾树、油松[24]为建群种的植物群落为调查对象,在各公园采用典型取样法进行样地设置。
2)节肢动物调查。在各样地中随机选取4 株建群种植物作为调查样树,在样树树冠外缘距地面高约2.5 m 处各随机选取1 根粗2.0~3.0 cm 的枝条,于2022 年3 月30 日开始在供试枝条下方悬挂1 个昆虫飞行截获器,截获器下方安装1 个装有20 mL 乙二醇的节肢动物收集瓶,1 周后收集节肢动物收集瓶并编号,并重新安装1 个装有20 mL 乙二醇的节肢动物收集瓶,开始下次试验。昆虫飞行截获器由上、中、下3部分组成,上部为直径15 cm 的圆形顶盖;中部为2块透明PVC 截获面板十字交叉组成,面板长×宽为20 cm×15 cm;下部为透明PVC 材质漏斗并连接收集瓶,漏斗上底直径15 cm,下底直径2.5 cm,高6cm,收集瓶外径2.5 cm(如图2 所示)。试验共进行12 次,即于早春、初夏、盛夏、晚秋各3 次进行了节肢动物收集瓶的收集。将采集的节肢动物收集瓶带回实验室,在体视显微镜下进行种类鉴定和数量统计,参照BugGuide(https://bugguide. net/node/view/15740)分类标准,以蚜虫为主要猎物的天敌昆虫成虫鉴定到种或属,其他节肢动物和食蚜天敌昆虫幼虫或若虫鉴定至科。
3)植物群落调查。在每个样地内设置20 m×20 m 植物群落调查样方,在大样方内部进行十字分割,设置10 m×10 m 乔木调查样方4 个,在大样方的四角分别设置1 个5 m×5 m 灌木调查样方,并随机设置1 个1 m×1 m 的草本调查样方。分别按照乔木、灌木和草本样方的调查方法进行植物群落调查,其中乔木记录植物种名、树高、胸径和冠幅,灌木和草本记录种名、多度、高度和盖度。在收集节肢动物收集瓶的同时,进行20 m×20 m 植物群落调查样方中花期植物的调查,记录花期植物种名和花期植物垂直投影面积。
4)公园农药施用调查。收集并记录各公园从第1 次施药时间至试验结束时间之间的农药名称、施药剂量和施药时间。
1.3 数据处理与分析
1)多样性指数。采用物种丰度、Shannon-Wiener多样性指数和Pielou 均匀度指数表征样地植物和节肢动物的多样性水平。各指数计算公式:(1)科或物种丰度(R):R=S;(2)Shannon-Wiener 多样性指数(H’):H'=-Σi = 1s Pi lnPi;(3)Pielou 均匀度指数(J):J=H’/lnS。其中,S 为物种数或科数,在植物群落和食蚜天敌昆虫群落计算中S 为物种数,在节肢动物多样性计算中S 为科数;Pi=Ni/N,在节肢动物群落计算中Ni为第i 科的多度(即第i 科的数量),N 为所有节肢动物的多度之和,在植物群落计算中Pi 为第i 种的相对重要值(I),乔木层重要值I 乔=(相对频度+相对高度+相对优势度)/3;灌木层和草本层重要值I 灌和I 草=(相对频度+相对高度+相对盖度+相对优势度)/4,其中相对频度、相对高度、相对优势度和相对盖度为样地中某个植物物种的频度、高度、优势度或盖度与样地中所有植物物种的频度、高度、优势度或盖度之和的比值。
2)农药数据处理。公园防治有害生物时施用的农药种类和剂量差异较大,为方便分析农药施用对节肢动物生物多样性的影响,本研究采用农药施用频次以及农药实际施用剂量与推荐施用剂量的比值即施药剂量比作为定量数据进行数据分析。
3)分析方法。对节肢动物群落和植被群落中的Shannon-Wiener 多样性指数、Simpson 优势度指数、Pielou 均匀度指数进行正态性及方差齐次性检验,对呈正态分布的检测指标进行Pearson 相关性检验,采用Pearson 相关系数判断各环境因子与各节肢动物多样性指数之间的单因素相关性,然后以环境因子为自变量,节肢动物多样性指数为因变量进行线性关系拟合曲线分析,对非正态分布的检测指标进行Spearman 非参数法相关性检验,并计算显著性。
对节肢动物群落与微环境因子之间的关系采用SPSS26.0 进行激进型相关性分析,并选取相关性显著的因子进行Bartlett 球形检验及KMO 抽样适合性检验,以判断数据是否适合主成分分析。然后对经检验的微环境因子与节肢动物及其天敌种类、数量和多样性进行主成分分析,得到主成分相关系数的方差贡献率,然后通过RDA 排序以评估影响节肢动物及其天敌的相对主要微环境变量。采用Origin2022 进行制图。
2 结果与分析
2.1 微环境特征分析
各样地微环境特征参数的T 检验结果显示,国槐、栾树和油松样地乔木层丰度(P=0.010,Plt;0.001和P=0.010),以及国槐和栾树的草本层丰度、辛普森指数、香农-维纳指数、均匀度指数均存在显著差异(P=0.010,P=0.010,P=0.010,P=0.010;Plt;0.001,Plt;0.001,Plt;0.001,Plt;0.001),各样地间花期植物多样性均存在显著差异( 均Plt;0.001)(表1)。
2.2 节肢动物群落组成
试验共采集节肢动物17 659 头,隶属16 目179科。在多度上,蚜科Aphididae 为优势类群,占总多度的52.12%;蓟马科Thripidae、木虱科Psyllidae、隐食甲科Cryptophagidae、叶螨科Tetranychidae、盲蝽科Miridae、摇蚊科Chironomidea、蚁科Formicidae、粉蛉科Coniopterygidae、茧蜂科Braconidae、隐翅虫科Staphylinidae 为常见科,分别占总多度的5.93%、4.59%、3.48%、3.41%、3.02%、2.64%、1.87%、1.42%、1.29% 和1.14%;其余类群为稀有类群,占总多度的19.09%。
其中,食蚜天敌昆虫967 头,隶属5 目9 科。菜蚜茧蜂Diaeretiella rapae、广重粉蛉Semidalis aleyrodi⁃formis 为食蚜天敌昆虫优势种,分别占总多度的27.73%、23.92%;微小花蝽Orius minutus、棉蚜蚜小蜂Aphelinus gossypii、杨腺溶蚜茧蜂Adialytus salica⁃phis、杨三叉蚜茧蜂Trioxys populi、毛蚜蚜小蜂Aph⁃elinus fulvus、异色瓢虫Harmonia axyridis、日本通草蛉Chrysoperla carnea、洋槐三叉蚜茧蜂Trioxys rob⁃iniae、大灰优食蚜蝇Eupeodes corollae、云杉益蛉Sympherobius piceaticus 为食蚜天敌昆虫常见种,分别占总多度的6.08%、5.46%、5.05%、4.85%、3.30%、2.89%、2.27%、1.44%、1.24%、1.03%。
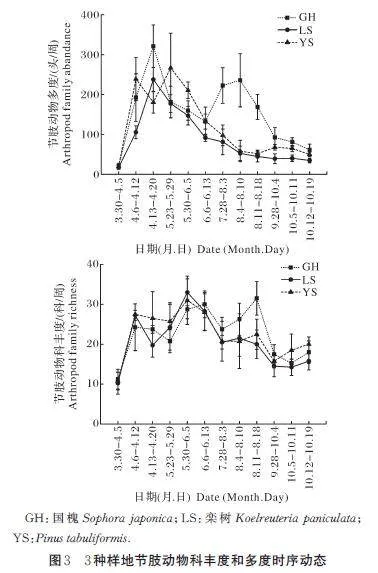
此外,节肢动物在丰度和多度上全年分布不均,6 月节肢动物的科丰度显著高于其他时间段(图3A),4 月和5 月的节肢动物多度显著高于其他时间段(图3B)。7—8 月国槐群落中的节肢动物多度和科丰度显著高于油松和栾树(图3)。
2.3 节肢动物及其食蚜天敌昆虫多样性
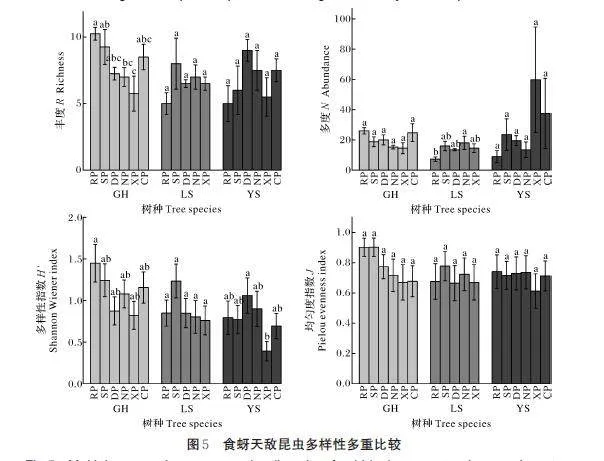
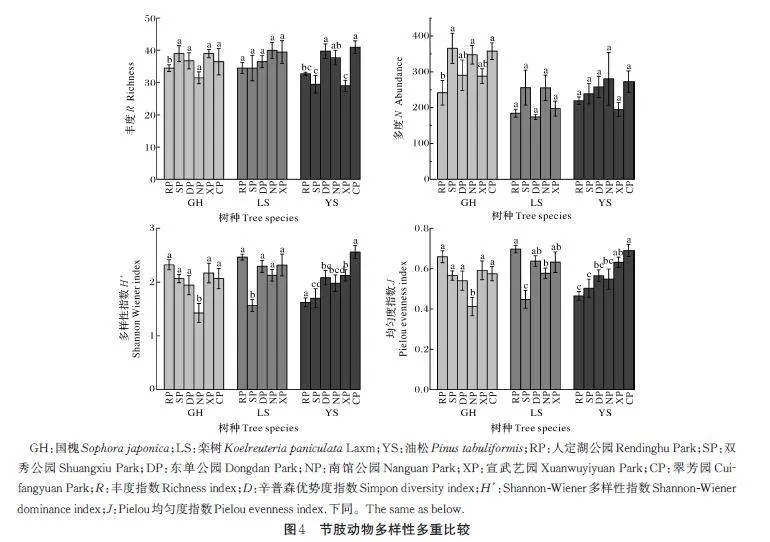
节肢动物的差异性检验及多重比较结果显示,南馆公园国槐样地节肢动物多样性指数(P=0.009)和均匀度指数显著低于其他样地(P=0.015)(图4C),其余样地丰度、多度、多样性指数和均匀度指数间均无显著差异。食蚜天敌昆虫的差异性检验及多重比较结果显示,国槐样地各公园间食蚜天敌昆虫丰度存在显著差异(P=0.037)(图5A),双秀公园国槐样地食蚜天敌昆虫丰度显著高于其余样地(P=0.009)(图5D),其余样地丰度、多度、多样性指数和均匀度指数间均无显著差异。
2.4 微环境因子对节肢动物群落的影响
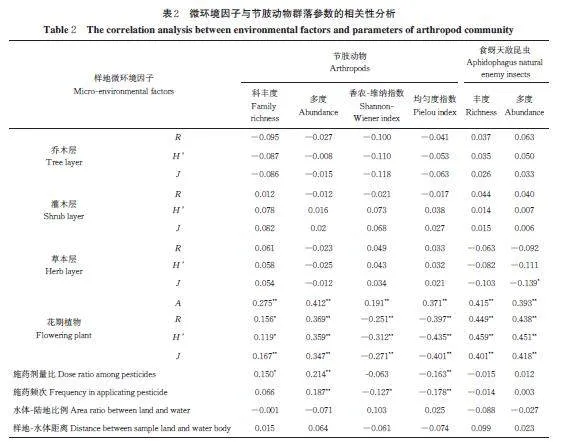
环境因子与节肢动物群落的相关性分析结果显示,花期植物丰度、香农-维纳指数、均匀度指数与节肢动物科丰度(Plt;0.001)和多度(Plt;0.001)、食蚜天敌昆虫丰度(Plt;0.001)和多度(Plt;0.001)呈显著正相关,与节肢动物香农-维纳指数(Plt;0.001)和均匀度指数(Plt;0.001)呈显著负相关;施药频次与节肢动物科丰度(P=0.036)和多度(P=0.002)呈显著正相关,与节肢动物均匀度指数(P=0.003)呈显著负相关;施药剂量比与节肢动物多度(P=0.002)呈显著正相关,与节肢动物香农-维纳指数(P=0.036)和均匀度指数(P=0.003)呈显著负相关(表2)。
6 个对节肢动物群落参数影响较大因子的主成分分析结果显示,2 个主成分的特征根分别是3.137和1.759,方差解释率分别是52.28% 和29.32%,累积方差解释率为81.60%(表3)。综合排序结果显示,影响力最大的前 3 位因子是施药剂量比、花期植物面积、施药频次(表3)。
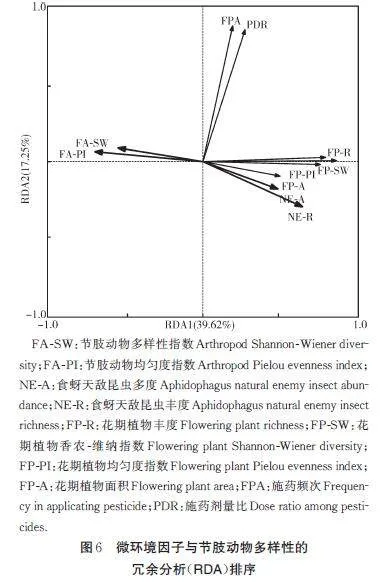
微环境因子与节肢动物多样性的RDA 排序图结果显示,节肢动物及食蚜天敌昆虫的多度、丰度与花期植物面积、丰度、香农-维纳指数和均匀度指数之间均显著正相关,节肢动物香农-维纳指数和均匀度指数与花期植物面积、丰度、多样性和均匀度指数均显著负相关,节肢动物多度、丰度和香农-维纳指数,以及食蚜天敌昆虫的多度和丰度与施药频次和施药剂量均不相关(图6)。
3 讨论
农药施用对节肢动物种群产生严重威胁[25-26],常导致天敌种群数量及多样性大幅度下降,有害生物种群数量上涨。如叶面喷施吡虫啉1~2 a 后,药剂在短期内显著降低了柑橘园中印巴黄蚜小蜂Aphytis melinus 等4 种天敌的种群数量,导致肾圆盾蚧Aonidiella aurantii 等3 种害虫的种群数量呈暴发状态[27];高效氯氟氰菊酯在亚致死剂量下可显著增加大豆蚜Aphis glycines 的内禀增长率,从而诱导其种群再次暴发[28]。本研究结果显示,北京公园绿地中频繁施用吡虫啉、阿维菌素苯甲酸盐、高效氯氟氰菊酯等3 种化学药剂后,一方面,节肢动物香农-维纳多样性指数随农药施用频次增高和施药剂量比加大而降低,这与前人研究结果一致;另一方面,节肢动物群落多度随农药施用频次增高而增加,这主要与药剂大量使用导致节肢动物群落中刺吸类害虫整体多度占有较大比例有关。如蚜虫多度与施药剂量比(P=0.002)和施药频次(P=0.006)呈显著正相关,且多度占节肢动物多度的52.12%。由此说明,城市绿地的频繁、大量用药并不能从根本上解决虫害发生,反而有可能导致城市绿地有害生物陷入“打药越多,虫害发生越严重”的恶性循环之中。因此,科学合理施用农药尤为重要,包括在化学农药选择时,选择高效、低毒、低残留和高选择性的农药;在施药时间上,依据防治对象生活史和监测结果选择最佳的施药时间,而非盲目用药;在施药部位上,针对寄主植物有害生物重点发生部位进行用药;在防治方法选择上,当有害生物虫口密度较高但不成灾时,可优先使用性诱剂、昆虫天敌等控制其虫口数量,尽量不施用化学农药。
部分花期植物可诱集节肢动物种群包括节肢动物天敌和传粉节肢动物等,高水平的花期植物多样性对节肢动物具有正向作用[29-30],特别是对节肢动物天敌的种群数量和多样性具有积极影响[31]。本研究与前人相一致的研究结果为花期植物丰度和多样性与节肢动物及节肢动物天敌的多度呈正相关关系,与天敌香农-维纳指数及均匀度指数呈正相关(表2)。与前人结果不同的为花期植物丰度和多样性与节肢动物香农-维纳指数及均匀度指数呈负相关关系(表2),其主要原因是北京地区花期植物多样性高水平时段与农药施用高频阶段相重合,均在4 月中旬至5 月下旬达峰值,尽管一定程度上花期植物吸引了众多节肢动物前来补充营养,但同期农药的大量、频繁施用极大降低了有害生物以外的节肢动物的多度和丰度,并显著增加了蚜虫多度,进而造成上述结果的发生。因此,除农药科学施用外,花期植物尤其是具有天敌昆虫诱集作用的蜜粉源植物在城市绿地中的科学应用应得到重视。
多数研究表明,乔木和灌木层的多度、丰度、多样性等对节肢动物及其天敌的多度、丰度和多样性具有显著影响[32],然而在本研究中这种影响均不显著。这主要是因为同一样地的乔木层、灌木层的各项指标均未有时序动态,但花期植物各项指标、节肢动物种群各项指标均具有明显的时序动态,造成了上述结果的发生。在未来的工作中,研究团队将进一步分析不同时间段中乔木与灌木层各项指标对节肢动物种群的影响,以确定乔木和灌木层对节肢动物种群的影响程度。
城市化进程中土地利用类型的巨大变化与人为干扰造成了生物生境破碎和消失。本研究以城市化严重的北京地区三环内中小型公园为研究对象,在城市化梯度、破碎化程度、斑块规模等大尺度环境因子相似的情况下,揭示同等城市化水平下节肢动物种群特征及其微环境影响因素,以此明确施药等人工干扰和以蜜粉源植物为主体的花期植物是影响节肢动物种群分布规律的最主要的微环境影响因子,对于既定场地下节肢动物种群调控、节肢动物天敌保育和植食性节肢动物可持续控制具有积极意义。在下一步工作中,研究团队将研究区域扩大至四环或五环,对城市城区大型绿地节肢动物群落分布特征及其影响因素进行研究;并结合城市化梯度、绿地类型、绿地规模、绿地形状等开展大尺度因子影响下的节肢动物群落分布特征研究,共同为城市绿地的科学规划、设计提供依据。
参考文献 References
[1] MA B,ZHOU T T,LEI S,et al.Effects of urban green spaceson residents’ well-being[J]. Environment,development andsustainability,2019,21(6):2793-2809.
[2] MCKINNEY M L. Urbanization,biodiversity,and conservation:the impacts of urbanization on native species are poorlystudied,but educating a highly urbanized human populationabout these impacts can greatly improve species conservationin all ecosystems[J].Bioscience,2002,52(10):883-890.
[3] MILES L S,AYOUB N A,GARB J E,et al. Ovarian transcriptomicanalyses in the urban human health pest,the westernblack widow spider[J/OL].Genes,2020,11(1):87[2024-03-13].https://doi.org/10.3390/genes11010087.
[4] MCDOUGALL R,KRISTIANSEN P,LATTY T,et al.Pollinationservice delivery is complex:Urban garden crop yieldsare best explained by local canopy cover and garden scale plantspecies richness[J].Journal of applied ecology,2022,59(5):1248-1257.
[5] 王沫,刘畅,李晓璐,等. 近自然社区公园的生物多样性特征:以北京市中心城区为例[J]. 生态学报,2022,42(20):8254-8264.WANG M,LIU C,LI X L,et al.Biodiversity characteristicsin near-natural community parks:a case study in the centralarea of Beijing[J]. Acta ecologica sinica,2022,42(20):8254-8264(in Chinese with English abstract).
[6] 淮露梅,栾涛,裴洪淑. 延吉城市绿地节肢动物群落特征及其环境影响因子研究[J]. 延边大学农学学报,2021,43(3):75-83.HUAI L M,LUAN T,PEI H S.Study on arthropod communitycharacteristics and environmental influencing factors ofurban green space[J].Agricultural Science Journal of YanbianUniversity,2021,43(3):75-83(in Chinese with English abstract)
[7] NIGHSWANDER G P,SINCLAIR J S,DALE A G,et al.Importance of plant diversity and structure for urban gardenpest resistance[J/OL]. Landscape and urban planning,2021,215:104211[2024-03-13].https://doi.org/10.1016/j.landurbplan.2021.104211.
[8] HERRMANN J,BUCHHOLZ S,THEODOROU P.The degreeof urbanisation reduces wild bee and butterfly diversityand alters the patterns of flower-visitation in urban dry grasslands[J/OL].Scientific reports,2023,13(1):2702[2024-03-13].https://doi.org/10.1038/s41598-023-29275-8.
[9] ELLIS E E,WILKINSON T L.Moth assemblages within urbandomestic gardens respond positively to habitat complexity,but only at a scale that extends beyond the garden boundary[J].Urban ecosystems,2021,24(3):469-479.
[10] WARZECHA D,DIEKÖTTER T,WOLTERS V,et al.Attractivenessof wildflower mixtures for wild bees and hoverfliesdepends on some key plant species[J].Insect conservationand diversity,2018,11(1):32-41.
[11] MONTES M,BATTÁN HORENSTEIN M,SILVETTI LF,et al.Landscape characteristics effects on Diptera assemblagesand their relation with seasonal variations in urban greenpatches[J].Austral ecology,2022,47(5):1049-1061.
[12] MAJEWSKA A A,ALTIZER S.Planting gardens to supportinsect pollinators[J]. Conservation biology,2020,34(1):15-25.
[13] FRANK S D,BACKE K M,MCDANIEL C,et al.Exotic urbantrees conserve similar natural enemy communities to nativecongeners but have fewer pests[J/OL]. PeerJ,2019,7:e6531[2024-03-13].https://doi.org/10.7717/peerj.6531.
[14] WENZEL A,GRASS I,NÖLKE N,et al. Wild bees benefitfrom low urbanization levels and suffer from pesticides in atropical megacity[J/OL].Agriculture,ecosystems amp; environment,2022,336:108019[2024-03-13]. https://doi. org/10.1016/j.agee.2022.108019.
[15] FRANK S D.Review of the direct and indirect effects of warmingand drought on scale insect pests of forest systems[J].Forestry,2021,94(2):167-180.
[16] PIANO E,BONA F,ISAIA M.Urbanization drivers differentiallyaffect ground arthropod assemblages in the city of Turin(NW-Italy)[J].Urban ecosystems,2020,23(3):617-629.
[17] TÓTH Z,DOMBOS M,HORNUNG E. Urban soil qualitydeteriorates even with low heavy metal levels:an arthropodbasedmulti-indices approach[J/OL].Ecological applications,2023,33(4):e2848[2024-03-13]. https://doi. org/10.1002/eap.2848.
[18] JACKSON J K,RESH V H. Distribution and abundance ofadult aquatic insects in the forest adjacent to a northern Californiastream[J]. Environmental entomology,1989,18(2):278-283.
[19] KORÁNYI D,SZIGETI V,MEZŐFI L,et al. Urbanizationalters the abundance and composition of predator communitiesand leads to aphid outbreaks on urban trees[J].Urban ecosystems,2021,24(3):571-586.
[20] ŻELAZNA E,BŁAŻEJEWICZ-ZAWADZIŃSKA M. Speciesdiversity of carabids (Coleoptera,Carabidae) in differenttypes of Bydgoszcz urban green belts and suburban environments[J].Folia biologica,2005,53(4):179-186.
[21] PHILPOTT S M,ALBUQUERQUE S,BICHIER P,et al.Local and landscape drivers of carabid activity,species richness,and traits in urban gardens in coastal California[J/OL].Insects,2019,10(4):112[2024-03-13]. https://doi. org/10.3390/insects10040112.
[22] LIAO W F,VENN S,NIEMELÄ J.Environmental determinantsof diving beetle assemblages (Coleoptera:Dytiscidae) inan urban landscape[J].Biodiversity and conservation,2020,29(7):2343-2359.
[23] JANVIER A J,ULYSHEN M D,BRAMAN C A,et al.Scale-dependent effects of landscape context on urban bee diversity[J]. Journal of insect conservation,2022,26(4):697-709.
[24] 北京市园林绿化局. 北京市园林绿化普查资料汇编[M]. 北京:北京出版社,2011.Beijing Municipal Forestry and ParksBureau,2011.Compilation of census data on urban landscapingin Beijing[M].Beijing:Beijing Publishing House,2010(in Chinese).
[25] WOODCOCK B A,ISAAC N J B,BULLOCK J M,et al.Impactsof neonicotinoid use on long-term population changes inwild bees in England[J/OL].Nature communications,2016,7:12459[2024-03-13].https://doi.org/10.1038/ncomms12459.
[26] SPONSLER D B,GROZINGER C M,HITAJ C,et al.Pesticidesand pollinators:a socioecological synthesis[J].Science ofthe total environment,2019,662:1012-1027.
[27] GRAFTON-CARDWELL E E,LEE J E,ROBILLARD SM,et al.Role of imidacloprid in integrated pest management ofCalifornia Citrus[J]. Journal of economic entomology,2008,101(2):451-460.
[28] ANWAR R. Population dynamics of the cotton aphid,Aphisgossypii Glover(Homoptera:Aphididae),and its fungal pathogen,Neozygites fresenii(Nowakoski) Batko(Entomopthorales:Neozygitaceae) in South Carolina[D]. Clemson:ClemsonUniversity,2008.
[29] QU Y Y,XIAO D,LIU J J,et al.Sublethal and hormesis effectsof beta-cypermethrin on the biology,life table parametersand reproductive potential of soybean aphid Aphis glycines[J].Ecotoxicology,2017,26(7):1002-1009.
[30] KURYLO J S,THRELFALL C G,PARRIS K M,et al.Butterflyrichness and abundance along a gradient of imperviousnessand the importance of matrix quality[J/OL]. Ecologicalapplications,2020,30(7):e02144[2024-03-13].https://doi.org/10.1002/eap.2144.
[31] BRAATZ E Y,GEZON Z J,ROSSETTI K,et al. Bloomevenness modulates the influence of bloom abundance on insectcommunity structure in suburban gardens[J/OL].PeerJ,2021,9:e11132 [2024-03-13]. https://doi. org/10.7717/peerj.11132.
[32] WANG J H,REN B B,SHAO J L,et al.Impact of plant communitystructure and its diversity on richness and abundance ofarthropod aphidophagous natural enemy community[J/OL].Urban forestry amp; urban greening,2023,81:127850[2024-03-13].https://doi.org/10.1016/j.ufug.2023.127850.
(责任编辑:陆文昌)
基金项目:国家自然科学基金项目(3180060;32171848);新疆生产建设兵团财政科技计划项目(KC015214);国家林草局科技推广项目(京[2022]TG06);北京市园林绿化科学研究院开放课题(STZD202403)

