利用紫薯粉基质ARTP诱变选育富硒酵母菌株


摘要:旨在通过ARTP诱变技术选育出能够高效利用紫薯粉为营养源并富集硒的酿酒酵母菌株,以期开发出新型的富硒紫薯酵母产品,推动紫薯原料的高值化多元利用。以酿酒酵母CICC-1015为出发菌株,ARTP诱变结合硒耐受性梯度驯化筛选,选育出能够在含有紫薯粉的培养基中生长,并能够耐受较高浓度亚硒酸钠且进行高效生物转化为有机硒的酵母突变菌株。结果表明:以培养16 h的菌株作为诱变的出发菌株,ARTP处理时间110 s,致死率达到94.2%,既能够较好的保持高突变频率,又利于筛选有益突变菌株。筛选最高耐受200 mg·L−1亚硒酸钠的突变菌株FJH-010,该突变株能在以10%紫薯分为原料的环境下生长良好,生物量达到20.6 g·L−1(干重),硒含量达到4 245μg·g−1,其中有机硒占比95.3%,硒的转化率达到95.8%,而且遗传稳定性良好,显示了较强的硒富集与转化能力,为进一步开发含有机硒的富硒紫薯酵母产品提供了新途径。关键词:ARTP诱变;富硒;紫薯;酵母.
中图分类号:Q939.97文献标志码:A文章编号:0253−2301(2024)08−0061−06
DOI:10.13651/j.cnki.fjnykj.2024.08.008
梁玲,雷娟娟,黄铭珊,等.利用紫薯粉基质ARTP诱变选育富硒酵母菌株[J].福建农业科技,2024,55(8):61−66.
Breeding of Selenium-enriched Yeast Strain by ARTP Mutagenesis in Purple Sweet Potato Matrix
LIANG Ling1,LEI Juan-juan1,HUANG Ming-shan1,HUANG Qin-geng2,3*
(1.Fujian Health College,Fuzhou,Fujian 350101,China;2.Qingyuan One Alive Institute of Biological Research Co.,Ltd.,Qingyuan,Guangdong 511500,China;3.Guangdong Rongda Biological Co.,Ltd.,Qingyuan,Guangdong 511500,China)
Abstract:This study aimed to breed the saccharomyces cerevisiae strain that could efficiently use the purple sweet potato powder as the nutrient source and enrich the selenium by ARTP mutagenesis technology,in order to develop the new selenium-enriched purple sweet potato yeast products and promote the high-value and diversified utilization of purple sweet potato raw materials.By taking the saccharomyces cerevisiae CICC-1015 as the original strain,and using the ARTP mutagenesis combined with the selenium tolerance gradient acclimation screening,the yeast mutant strain was selected which could grow in the medium containing purple sweet potato powder,and could tolerate the higher concentrations of sodium selenite and efficiently biotransform into the organic selenium.The results showed that the strain cultured for 16 h was used as the original strain formutagenesis.The ARTP treatment time was 110 s, and the lethality reached 94.2%,which could not only maintain the high mutation frequency,but also help to screen the beneficial mutant strains.The mutant strain FJH-010 with the highest tolerance to 200 mg·L−1 sodium selenite was screened.The mutant strain could grow well in the environment with 10%purple sweet potato powder as the raw material,with the biomass reaching 20.6 g·L−1(dry weight),and the selenium content reaching 4245μg·g−1.Among them,the proportion of organic selenium was 95.3%,the transformation rate of selenium reached 95.8%,and the genetic stability was good,showing the strong selenium enrichment and transformation ability,which would provide a new approach for the further development of the selenium-enriched purple sweet potato yeast products containing the organic selenium.
Key words:ARTP mutagenesis;Selenium-enriched;Purple sweet potato;Yeast
硒作为一种人与动物不可或缺的微量元素,具备抗氧化、强化心血管、保护肝脏、抗癌及提升免疫力等多重功效。研究已证实,硒的缺乏与包括克山病、大骨节病及能量缺乏性营养不良等在内的超过40种疾病存在紧密联系[1−3]。因此,科学合理地补充硒元素,对于维护并促进人体健康具有至关重要的意义。在硒的补充策略上,有机硒相较于无机硒展现出明显的优势性。无机硒虽可用作补充来源,但其存在的蓄积性毒性风险以及吸收利用率低等问题;而有机硒则以其高生物活性、无毒副作用、易于肠道吸收及高生物利用率等特点,成为更为理想的补硒选择[4]。当前,利用酵母作为生物转化平台,将无机硒转化为有机硒,是补硒领域的主要方法[5]。此方法通过向酵母菌培养基中添加无机硒源,借助微生物强大的代谢机制,促使硒元素与菌体内蛋白质等大分子有机结合,这一过程有效规避了无机硒的潜在毒性,极大地提升了硒元素的安全性、吸收效率及生物利用度[6]。因此,富硒酵母被视为补硒元素的最佳途径。在富硒酵母产品的生产过程中,酵母菌株的筛选与培育尤为关键。具体而言,菌株对无机硒的高耐受能力以及对有机硒的高效转化能力,直接决定了产品的品质与生产效率。因此,不断优化菌株特性,提升其对硒的转化效率与稳定性,将是推动富硒酵母产业持续发展的重要方向。紫薯富含矿物质、维生素、硒、铁及花青素等有益成分,紫薯中的硒元素,被誉为“抗癌卫士”,高效吸收后留存于血清,不仅助力心肌修复,还显著增强免疫力,有效清除体内自由基,从根源上抑制癌细胞的DNA复制与分裂,可预防胃癌、肝癌等癌症的发生[7−8]。获得能够利用紫薯为原料生产富硒酵母的菌株,可实现硒与紫薯营养成分的有机结合,同时还能够避免普通硒酵母所具有的浓厚酵母味道,实现硒酵母产品的优化。
为了获得能够利用紫薯的酵母菌株,传统选育方法有物理诱变及化学诱变,存在操作繁琐,安全性低,且长期重复使用易致突变效率低、突变谱窄、抗性饱和等问题。常压室温等离子体(Atmospheric and room temperature plasma,ARTP)诱变系统能够在常温常压下形成微生物细胞有效的DNA多样性损伤,具有操作简便、安全性高、产生突变的多样性大等特点,是非常安全高效的诱变系统[9−10]。因此,本研究以酿酒酵母(Saccharo-myces cerevisiae)CICC1015为出发菌株,采用ARTP诱变育种技术,旨在选育能够以紫薯粉为原料进行细胞代谢与繁殖,同时具有高浓度亚硒酸钠耐受性的变株,借助酵母领域相对成熟的深层发酵工艺与技术,实现该酵母菌株在紫薯营养素环境中将无机硒高效转化为有机硒的生物合成过程,为富硒紫薯酵母的生产提供优良的菌株。
1材料与方法
1.1试验材料
1.1.1出发菌种酿酒酵母(Saccharomyces cerevisiae)CICC1015,购于中国工业微生物菌种保藏管理中心。紫薯粉购于市场的新鲜紫薯洗净,切成薄片,45℃真空干燥12 h,粉碎后过60目筛,装入密封袋,4℃保存备用;
1.1.2培养基YPD(yeast extract peptone dextrose)培养基:蛋白胨20 g·L−1,葡萄糖20 g·L−1,酵母浸出粉10 g·L−1,pH 7.0,121℃灭菌20 min。YPD斜面培养基及固体平板培养基:蛋白胨20 g·L−1,葡萄糖20 g·L−1,酵母浸出粉10 g·L−1,琼脂20 g·L−1,pH 7.0,121℃灭菌20 min。紫薯固体培养基:紫薯粉200 g·L−1,琼脂20 g·L−1,pH自然,121℃灭菌20 min。紫薯液体培养基:紫薯粉100 g·L−1,pH自然,121℃灭菌20 min。
1.1.3主要试剂与仪器(1)主要试剂:亚硒酸钠(Na2SeO3):上海国药集团化学试剂有限公司;YPD培养基原料:上海国药集团化学试剂有限公司;亚硒酸钠(Na2SeO3)母液:称取1 g Na2SeO3溶于10 mL水中,用0.22μm的针头式过滤器过滤除菌,−4℃保藏。(2)主要仪器:ARTP-IIS型ARTP诱变仪:无锡源清天木生物科技有限公司;UV-2 100型紫外可见分光光度计:尤尼柯(上海)仪器有限公司;Mettler pH计:瑞士梅特勒-托利多集团;DNP-9 052电热恒温培养箱:上海精宏实验设备有限公司;SKY-211C恒温振荡器:上海苏坤实业有限公司。
1.2试验方法
1.2.1菌悬液的制备取一环保藏于−80℃冰箱的酿酒酵母菌株CICC1015,接种至YPD斜面,30℃恒温培养24 h后,用5 mL无菌水将菌苔洗脱,混匀,吸取1 mL菌悬液转接至装有30 mL液体YPD培养基的250 mL三角瓶中,30℃,180 r·min−1振荡培养至对数生长期,得到活化的菌液,置于离心机中4 000 r·min−1,10 min离心收集菌体,采用生理盐水重悬,洗涤,重复离心洗涤3遍,以适量的生理盐水调整菌液浓度为1.0×107个·mL−1,作为ARTP诱变的菌悬液。
1.2.2生长曲线的绘制将上述活化后的菌液按照10%的接种量转接至50 mL的YPD液体培养基中,30℃、180 r·min−1振荡培养,设置三组重复,每隔4 h取样,采用分光光度计测定600 nm下的吸光值OD600,以时间为横坐标,OD600为纵坐标,绘制酵母菌株生长曲线。
1.2.3出发菌株对亚硒酸钠的耐受性试验在摇瓶中活化8h的菌液,加入亚硒酸钠母液,使培养基中亚硒酸钠的终浓度分别为0、100、200、300、400、500、600μg·mL−1,继续培养至24 h,测定OD600,计算致死率,确定出发菌株对亚硒酸钠的耐受浓度,据此确定诱变筛选平板亚硒酸钠的初始浓度。
1.2.4 ARTP诱变将制备好的诱变菌悬液加入终浓度为5%的甘油作为保护剂,取10μL菌悬液均匀涂于载片,参照ARTP诱变育种仪操作流程,将载片转入操作仓,以氦气作为工作载气,通气量选择10 L·min−1,功率选择110 W,距离2 mm。处理时间设置为0、20、40、60、80、100、120、140、160和180 s,诱变结束后将载片转入990μL无菌生理盐水中,涡旋振荡1 min,确保将菌体全部洗脱下来,然后稀释涂布至紫薯筛选平板,30℃培养2 d至长出单菌落,筛选能以紫薯为原料生长的酿酒酵母菌株。平板菌落计数,以处理0 s的样品为对照,计算致死率并绘制致死率曲线,选择致死率为90%~95%的处理时间对菌株进行诱变。
1.2.5酵母菌株的驯化筛选经过ARTP诱变,在紫薯培养基上生长的菌落,采用点植法将菌落点植于出发菌株最大耐受亚硒酸钠浓度500μg·L−1的紫薯培养基平板进行30℃恒温培养,长出菌落后,进一步点植于更高浓度的亚硒酸钠的紫薯培养基平板,采用这种梯度驯化与选择的方式,逐步获得能够在更高亚硒酸钠浓度生长的酿酒酵母变株。
将这些菌株接种含高浓度亚硒酸钠的紫薯斜面培养基,30℃恒温培养24 h,再经传代两次,获得斜面菌株。用5 mL无菌生理盐水将斜面菌株洗脱下来,制备菌悬液(调整菌液浓度为107个·mL−1)。取菌悬液按照10%的接种量接入30 mL的紫薯液体培养基中(含200 mg·L−1的亚硒酸),30℃、200 r·min−1振荡培养16 h作为种子培养液,然后取种子培养液按移种量20%接种于30 mL含200 mg·L−1亚硒酸钠的紫薯液体培养基中,30℃、200 r·min−1发酵36 h。培养结束后,6 000 r·min−1离心收获细胞,60℃烘干至水分为8%,测定细胞的生物量(干重),测定硒含量及有机硒含量。
1.2.6硒的测定与转化率计算硒含量、有机硒含量检测参照文献[11]。
硒转化率(富硒效率)=(液体培养细胞干重中的硒含量/紫薯液体培养基中总的硒含量)×100%。1.2.7遗传稳定性研究将摇瓶液体培养筛选得到的富硒酵母菌株连续传代多次,每一代测定发酵产物硒含量、有机硒含量以及细胞的生物量(干重),考察其遗传稳定性。
2结果与分析
2.1出发菌株的生长曲线测定
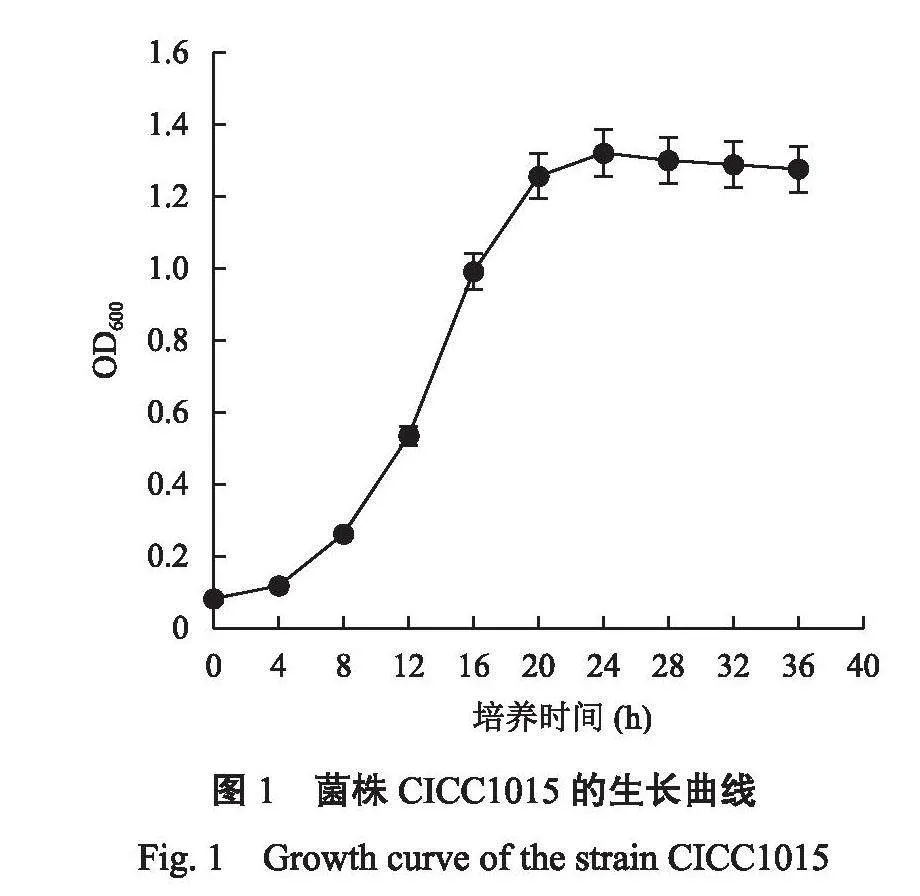
菌株的生长状态对菌株的诱变效果有很大影响,处于对数生长期的酵母菌活力强、代谢旺盛、对环境变化更为敏感,此时对酵母菌进行诱变,有利于获得损伤修复程度高、多样化突变的诱变菌株库。由图1可知,活化后的酵母菌在YPD液体培养基中生长,在0~4 h酵母菌处于适应阶段,生长速度缓慢;4~20h是菌株的快速生长阶段,处于对数生长期;20~36h菌体数量变化不大,为稳定期。选择对数生长期中后期,即培养16 h的酵母菌作为诱变的出发菌株。
2.2出发菌株对亚硒酸钠的耐受性
培养基中高浓度的亚硒酸钠有利于有机硒的富集,却对菌体生长具有抑制作用。筛选耐受较高浓度亚硒酸钠的出发菌株有利于提高富硒量。由图2可知,随着培养基中亚硒酸钠浓度不断升高,菌体浓度不断下降,在亚硒酸钠浓度为500μg·L−1时,菌体已基本无法生长。当诱变后的菌株能在含500μg·L−1亚硒酸钠的平板上长出,说明该菌株基因可能产生了突变,使其能耐受高浓度的亚硒酸钠。
2.3 ARTP诱变时间的选择
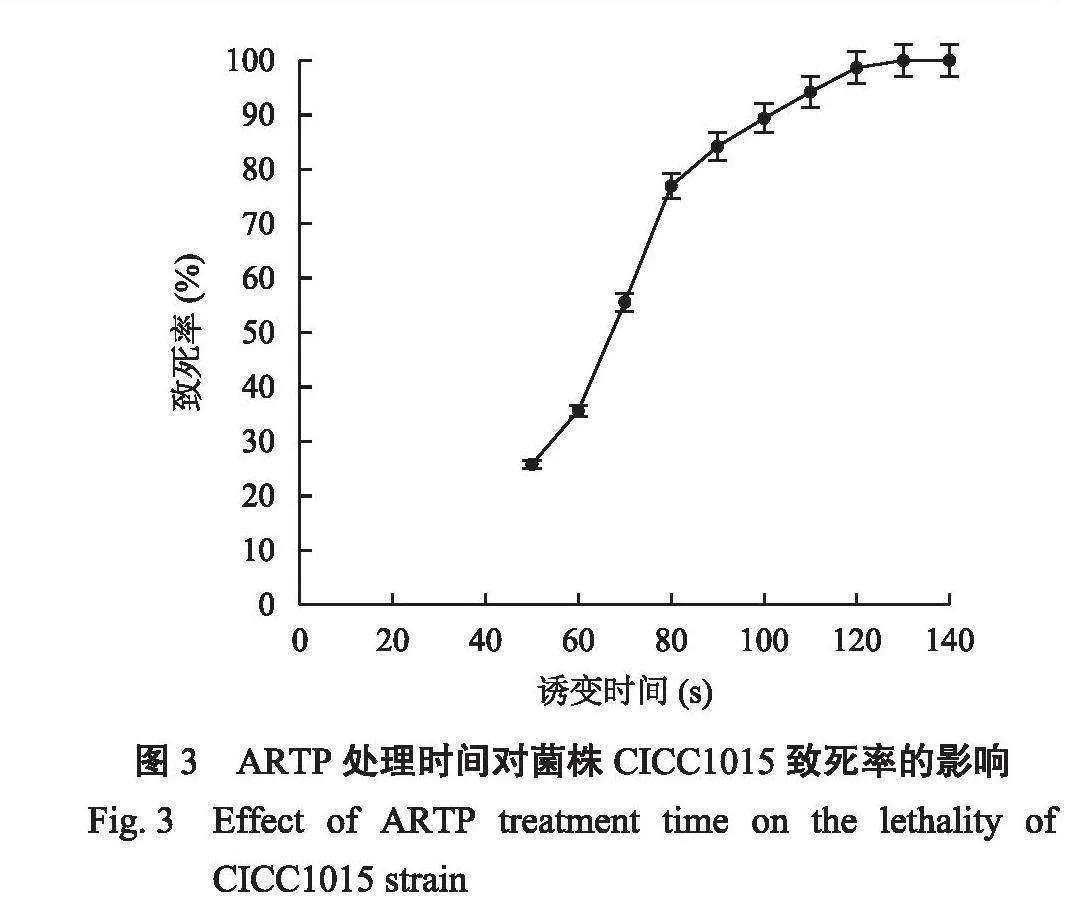
根据ARTP诱变不同的时长后涂布紫薯平板的菌落数,以未经诱变的菌落数为对照,计算不同处理时间的致死率,绘制致死率曲线。由图3可知,ARTP处理70 s,致死率已经达到了55.6%,处理110 s时,致死率达到94.2%,而处理120 s,致死率达到98.7%。为得到诱变损伤较多的菌株,且有足够的菌株生长,选择致死率为94.2%,处理时间为110 s作为酵母菌株诱变的时间。
2.4耐受亚硒酸钠酵母菌株的驯化
以CICC1015为出发菌株,采用110 s的诱变时间进行ARTP诱变处理,涂布含500μg·L−1亚硒酸钠的紫薯培养基平板,30℃培养至长出单菌落,挑取菌落点植于含600μg·L−1亚硒酸钠的紫薯培养基平板,培养至长出单菌落后,继续挑取长势较好的菌落点植更高亚硒酸钠浓度的平板,采用这种梯度驯化与选择的方式,逐步获得能够在200 mg·L−1亚硒酸钠紫薯平板上生长的酿酒酵母变株。
2.5富硒酵母菌株的筛选
为验证和筛选富硒能力强的菌株,选取在平板上生长良好的菌落进行摇瓶发酵验证,测定细胞的生物量(干重)、硒含量。由图4可知,从硒含量看,经过高浓度亚硒酸钠的训化,摇瓶筛选的菌株硒含量均高于出发菌株,最高为FJH-010,硒含量达到4 245μg·g−1,较CICC1015提高7.1倍,其次是FJH-024,硒含量达到4 093μg·g−1,较CICC1015提高6.9倍;从生物量看,经过诱变及高浓度硒训化后,诱变菌株的生物量均低于出发菌株,其中硒含量最高的FJH-010生物量为20.6 g·L−1,为出发菌株的92.8%,FJH-024的生物量为18.7 g·L−1,为出发菌株的84.2%,生物量最高的AYFX022为出发菌株的97.7%,但硒含量仅为3 435μg·g−1,由此可见诱变的损伤具有多样性。
由表1可见,诱变筛选菌株FJH-010的有机硒占比达到95.3%,硒的转化率达到97.3%,而出发菌株的有机硒占比仅为90.6%,硒的转化率为91.8%,诱变菌株展现了较强的富硒能力,并且有机硒的含量也明显优于出发菌株。
2.6富硒酵母菌株的遗传稳定性分析
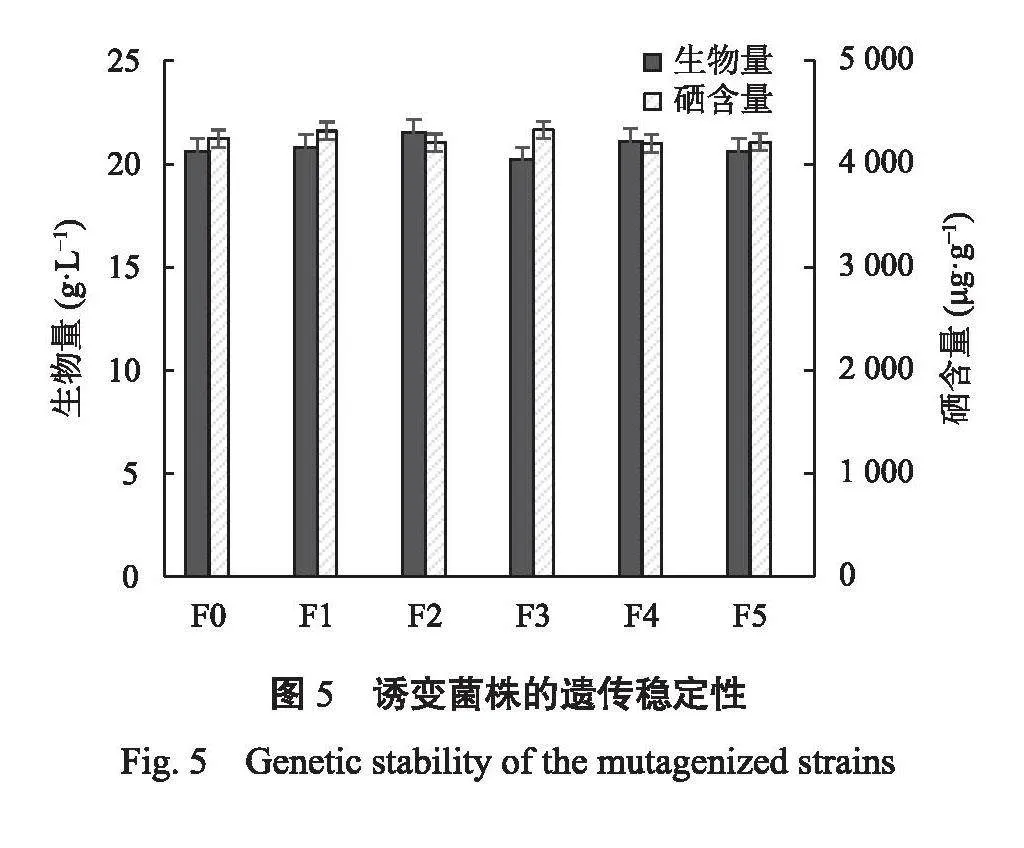
遗传稳定性是诱变菌株优劣的一个重要指标,将诱变株FJH-010在含Na2SeO3的紫薯培养基中进行连续5代摇瓶发酵,测定硒含量,由图5可知,从菌株形态特征看,FJH-010在传代过程中稳定性良好,菌落形态及显微形态都没有变化,而且硒含量变化幅度在3%以内,体现了较好的遗传稳定性。
3讨论与结论
在富硒酵母菌株的选育方面,孙朝阳等[12]利用NaN3诱变结合H2O2选择压力,实现了硒含量的显著提升。李颖[13]则通过紫外诱变与抗性平板筛选,获得了高硒含量且高生物量的MY-02菌株。而利用紫薯作为原料培养富硒酵母及运用ARTP诱变选育富硒酵母菌株未见相关报道。
本研究通过ARTP诱变技术,成功选育出了能够高效利用紫薯粉生长并富集硒的突变株FJH-010。与原始菌株相比,FJH-010的硒富集能力提升了7.1倍,达到4 245μg·g−1,且有机硒占比高达95.3%,硒转化效率也达到了95.8%,同时展现出良好的遗传稳定性。这一成果不仅为富硒酵母产品的生产提供了新的菌株资源,也为紫薯资源的综合利用开辟了新的途径。ARTP诱变技术以其常温常压下的高效DNA损伤能力,为微生物育种构建了庞大的突变库,极大地促进了优良菌株的筛选进程[14−15]。
在本研究中,通过合理的诱变时间选择和梯度驯化策略,成功地从大量突变体中筛选出了性能优异的FJH-010菌株。这一成果不仅丰富了富硒酵母菌株的种质资源,也为后续的菌株改良和工业化应用奠定了坚实基础。后续研究中将深入研究FJH-010的代谢机制,优化其发酵工艺条件,以期实现更高的硒富集效率和更大的生物量产出。同时,还将积极探索将FJH-010应用于实际生产中的可能性,包括开发功能性食品、保健品以及农业饲料添加剂等,以满足市场对高质量富硒产品的需求。鉴于ARTP诱变技术诱发的突变多样性,计划在后续研究中实施优势菌株的融合改组策略,以期融合多个优良突变株的遗传特性,培育出生物量与硒产量均优的菌株。此外,随着生物技术的不断发展,本课题组还将关注其他新型诱变技术在菌株选育中的应用,以期获得更多具有优良性状的酵母菌株,推动富硒酵母产业的持续发展。
参考文献:
[1]RAYMAN M P.Selenium and human health.Lancet[J].Lancet,2012,379(9822):1256−1268.
[2]SELENIUS M,RUNDLÖF A K,OLM E,et al.Selenium and the selenoprotein hioredoxin reductase in the prevention,treatment and diagnostics of cancer[J].Antioxidants&Redox Signaling,2010,12(7):867−880.
[3]陈析羽,张浩,汤虎,等.富硒食品的研究进展与展望[J].中国食物与营养,2018,24(6):4
[4]DUNTAS L H,BENVENGA S.Selenium:an element for life[J].Endocrine,2015,48(3):756−775.
[5]王茜,方荣,邓娟娟,等.富硒酵母功能作用研究进展及法规现状[J].中国食品添加剂,2023,34(2):327−335.
[6]KIELISZEK M,BŁAŻEJAK S,GIENTKA I,et al.Accumulation and metabolism of selenium by yeast cells[J].Applied Microbiology&Biotechnology,2015,99(13):5373−5382.
[7]张婷,毛建卫,陈小伟,等.紫薯功能性与其食品开发研究进展[J].食品工业科技,2018(13):315−319.
[8]张梦潇,周文化,周虹,等.不同品种紫薯营养主成分及聚类分析[J].中国粮油学报,2020,35(1):27−33.
[9]褚帅北,胡文婷,惠丰立.ARTP-DES复合诱变结合前体耐受性选育达托霉素高产菌株[J].精细化工,2023,40(9):1969−1975.
[10]ZHU Z,CHEN W,ZHOU H,et al.ARTP and NTG compound mutations improved Cry protein production and virulence of Bacillus thuringiensis X023[J].Applied Microbiology and Biotechnology,2022(11):106.
[11]王莹,铁梅,康平利,等.ICP-MS等三种测定蛹虫草硒含量方法的比较[J].光谱学与光谱分析,2009,29(3):815−818.
[12]孙朝阳,张玉英,潘利华,等.高富硒酵母菌株的筛选及其富硒特性分析[J].中国酿造,2020,39(9):116−120.
[13]李颖.高生物量富硒酵母的制备和性能改善研究[D].无锡:江南大学,2021.
[14]唐晨旻,张劲松,刘艳芳,等.常压室温等离子体诱变育种与微生物液滴培养筛选技术应用进展[J].微生物学通报,2022,49(3):1177−1194.
[15]耿海波,郑辉,张丽媛,等.常压室温等离子体诱变选育耐酸酿酒酵母菌株[J].中国酿造,2022,41(2):144−148.
(责任编辑:柯文辉)

