芽孢杆菌应用方式降低烟叶烟草特有亚硝胺含量的研究

摘要: 【目的】研究短小芽孢杆菌05-5402 和高地芽孢杆菌J54 应用方式对烟叶中烟草特有亚硝胺(tobaccospecificnitrosamines,TSNAs) 含量的影响。【方法】将TSNAs 降解菌种施加于生长中的白肋烟和旱烟,采收成熟的烟叶,晾制后检测烟叶中的TSNAs 含量;利用菌种发酵烘烤后的烟叶,分析不同发酵方式对烤烟烟叶中TSNAs 含量的影响。【结果】(1) 在晾晒烟的生长过程中,施加芽孢杆菌菌液能极显著降低烟叶TSNAs 的含量,其中,05-5402 对白肋烟TSNAs 的降解效率较高,为54.75%~60.78%;而J54 对旱烟TSNAs 的降解效率较高,为53.23%~63.18%。(2) 与固态发酵相比,液态发酵模式下菌株降解TSNAs 的效果更好,05-5402 和J54 分别能显著降低烟叶中31.99% 和35.86% 的TSNAs。【结论】短小芽孢杆菌05-5402 和高地芽孢杆菌J54 能有效降低烟叶的TSNAs 含量,并且在多种处理方式下均有较好的效果。
关键词: 芽孢杆菌;烟草特有亚硝胺;烟草;发酵
中图分类号: S572.01 文献标志码: A 文章编号: 1004–390X (2024) 05−0048−07
烟草特有亚硝胺(tobacco-specific nitrosamines,TSNAs) 是一类特有的生物碱,对人体健康构成重大威胁,烟叶原料中TSNAs 含量过高还会限制烟叶的可用性。目前,针对TSNAs 的研究主要集中于其4 种类型:N-亚硝基降烟碱(N′-Nitrosonornicotine,NNN)、4-N-亚硝基甲基氨-1-吡啶基丁酮[4-(N-nitrosomethylamino)-1-(3-pyridyl)-1-butanone,NNK]、N-亚硝基新烟草碱(N ′ -nitrosoanabasine,NAT) 和N-亚硝基假木贼碱(N-nitrosoanabasine,NAB)[1],其中,NNN 和NNK 被列为I 类致癌物[2]。因此,降低烟叶的TSNAs 含量具有重要意义。研究表明:可以通过调整农业栽培措施[3-5]和利用化工原理[6]来降低烟叶中的TSNAs 含量,而利用微生物降低TSNAs 含量的方式具有操作简单、成本低、无污染等优势。
关于微生物降解烟叶中TSNAs 含量的研究已有大量报道。单宏英等[7]将荧光假单胞菌(Pseudomonas fluorescens) AS97 施用于烟丝,其TSNAs 含量降低了45.47%;张玉芹等[8]将反硝化细菌(Agrobacterium radiobacter) B88 和B237 作用于白肋烟烟丝, 分别使TSNAs 含量下降了24.30% 和23.00%;KATSUYA 等[9]利用反硝化细菌LG77, 使白肋烟中的TSNAs 含量下降了26.61%;汪安云等[10]从白肋烟品种TRM 叶片中分离到1 株可降低TSNAs 含量的内生芽孢杆菌,其TSNAs 的降解率为81.3%。以上研究结果表明:利用微生物降低烟叶中的TSNAs 含量是可行且有效的。
目前,降解TSNAs 的研究主要集中在烟叶的调制期,而通过降低TSNAs 的前体物来抑制其生成也是可行的。周迪等[2]和周炎等[11]研究表明:TSNAs 的含量与其前体物有较强的相关性。TSNAs 的2 类前体物分别是含氮化合物和亚硝酸盐衍生物。CUI 等[12]研究表明:在烟株生长过程中几乎不积累亚硝酸盐;而烟叶中2 种主要含氮物质(烟碱和蛋白质) 却会在烟株生长过程中持续积累[13]。已有研究表明芽孢杆菌等微生物能够降解烟叶中的蛋白质[14-15]。此外,张玉玲等[16]研究表明:在烟株生长过程中,喷施菌液可以降低烟叶的TSNAs 含量。因此,在烟株生长过程中利用微生物来降低TSNAs 也是可行的。
白肋烟是卷烟工业常用的晾烟品种。旱烟又称土烟、叶子烟,属于晒烟的一种,直接通过晒制工艺加工而成,是云南省优质地方性晾晒烟之一。晾晒烟具有独特的风格特色,是卷烟产品原料配方的重要部分,可以极大地改善卷烟的感官质量,但其TSNAs 含量较高,影响后续的产品应用。硃砂烟属于烤烟的尼古丁转化株,能够将大部分尼古丁转化为降烟碱,其TSNAs 含量通常显著高于常规烤烟品种。因此,降低烟叶中的TSNAs 含量对卷烟生产应用具有重要意义。已有研究表明:短小芽孢杆菌(Bacillus pumilus) 05-5402 和高地芽孢杆菌(B. altitudinis) J54 能够通过发酵方式降低白肋烟中的TSNAs 含量[17-18]。然而,尚未开展其在大田期降低TSNAs 含量的应用及发酵工艺优化的研究。基于此,本研究拟在前人研究的基础上,从田间施用方式和发酵工艺优化入手,深入研究这2 株芽孢杆菌降低TSNAs含量的应用范围和能力,为烟叶TSNAs 含量调控技术研发提供有效的技术支撑。
1 材料与方法
1.1 材料
1.1.1 烟株和烟叶
田间试验所用材料为白肋烟和旱烟,2022 年种植于云南省玉溪市九溪镇;发酵试验所用材料为2022 年种植于云南省玉溪市研和镇的硃砂烟,在成熟时采摘其中部烟叶并烘烤后作为发酵烟叶原料。
1.1.2 培养基
使用LB 培养基培养芽孢杆菌,其配方为:酵母粉5 g/L、蛋白胨10 g/L、NaCl 10g/L,固体培养基再添加15% 琼脂;烤烟原料的发酵以无机盐培养基为基础,其配方为:K2HPO4 0.200 g/L,KH2PO4 0.800 g/L,MgSO4 0.200 g/L,CaSO4·H2O0.100 g/L,Na2MoO4 0.003 g/L,FeSO4·7H2O 0.005 g/L。所用培养基均于115 ℃ 高压蒸汽灭菌20 min。
1.2 方法
1.2.1 菌液制备
挑选活化后的单菌落于5 mL LB 液体培养基中,置于28 ℃、160 r/min 的恒温振荡培养箱中培养12~18 h,作为一级种子液;按照1% 的接种量将一级种子液接种至50 mL LB 培养基中培养24 h,收集培养后的菌体,用无机盐基础培养基洗涤菌体并调节菌液OD600 至1.8~2.0,制成二级种子液。
1.2.2 田间试验
在烟株旺长期,将二级种子液分别施于烟株叶面和根部。白肋烟的处理包括:(1) 以未施加菌液的烟株为对照组(CK);(2) 烟叶表面喷施菌液5 mL (处理A);(3) 烟株根部灌注菌液15 mL(处理B);(4) 烟叶表面喷施菌液5 mL 并根部灌注15 mL (处理C)。旱烟的处理包括:(1) 以不加菌液的烟株为对照组(CK);(2) 烟叶表面喷施菌液 125 mL (处理X);(3) 烟株根部灌注菌液65 mL(处理Y);(4) 烟叶表面喷施菌液125 mL 并根部灌注65 mL (处理Z)。待烟株生长至成熟期即采摘中部烟叶,按当地常规工艺进行晾制,收集晾制后的烟叶样品。以上所有处理均设置15 个重复,采样后随机合并为3 个重复进行后续检测。
1.2.3 烤烟原料发酵试验
将烘烤后的烟叶研磨成粉后进行发酵。固态发酵的处理包括:(1) 50% 含水量的发酵体系:称量烟叶粉末15 g,添加无机盐培养基13 mL,高压蒸汽灭菌后冷却至室温,接种二级种子液2 mL;(2) 70% 含水量的发酵体系:称量烟叶粉末15 g,添加无机盐培养基33 mL,高压蒸汽灭菌后冷却至室温,接种二级种子液2 mL。液态发酵体系为:称量烟叶粉末5 g,添加无机盐培养基45 mL,高压蒸汽灭菌后冷却至室温,接种二级种子液2 mL。对照组则添加等量的无机盐基础培养基代替种子液,每个处理设置3 个重复。固态发酵体系将发酵瓶置于28 ℃ 恒温恒湿培养箱中发酵7 d;液态发酵体系置于28 ℃ 恒温振荡培养箱中,以160 r/min 的转速发酵7 d。发酵完成后12 000 r/min离心收集烟叶样品,置于65 ℃ 烘干,收集烘干的样品进行TSNAs 含量的测定。
1.2.4 烟叶中TSNAs 含量的测定
TSNAs 含量采用超高效液相色谱法测定。首先,使用萃取液萃取烟叶样品,萃取液配方为:乙酸胺7.708 g, 10 ng/mL 内标(NNN、NNK、NAT 和NAB) 10 mL,定容至1 L。称量烘干后的烟叶样品1.000 g 至100 mL 萃取液中,置于220 r/min 的振荡器中室温萃取45 min,取2 mL上清液,经0.2 μm 水相滤膜过滤后用UPLC-MS/MS 检测NNN、NNK、NAT 和NAB 的含量[19]。
1.2.5 烟叶常规化学成分含量的测定
按照行业标准测定烟叶中的常规化学成分,包括总糖、还原糖、总氮、烟碱和蛋白质。其中,总糖和还原糖含量的测定参照YC/T 159—2002;总氮含量的测定参照YC/T 161—2002;烟碱含量的测定参照YC/T 160—2002;蛋白质含量的测定参照YC/T 166—2003。
1.3 数据处理与统计分析
使用GraphPad Prism 9.0 和Excel 2016 对数据进行统计分析和制图;数据以3 个重复的“平均值±标准差”表示;各处理组与对照组之间的差异采用t 检验进行分析。
2 结果与分析
2.1 芽孢杆菌对白肋烟常规化学成分和TSNAs含量的影响
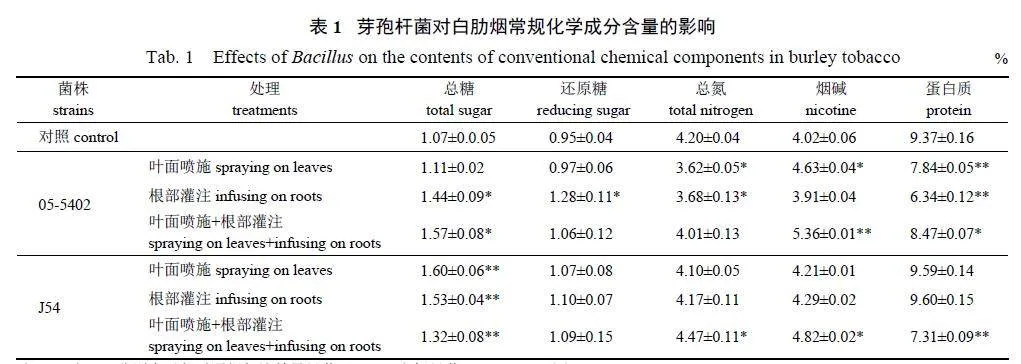
由表1 可知:短小芽孢杆菌05-5402 主要影响白肋烟烟叶的总糖、总氮和蛋白质含量。除叶面喷施外,其他处理的总糖含量均显著增加;还原糖含量也呈增加趋势,只有根部灌注处理的还原糖含量显著升高;总氮含量呈下降趋势;蛋白质含量呈显著或极显著下降趋势;叶面喷施和叶面喷施联合根部灌注可以显著或极显著提高烟碱含量,分别较对照提高了15.17% 和33.33%。高地芽孢杆菌J54 对白肋烟烟叶常规化学成分的影响相对较小,其中,总糖含量极显著提高;其他主要化学成分的整体差异不大,仅叶面喷施联合根部灌注显著提高了总氮和烟碱含量,蛋白质含量则极显著下降22.00%。
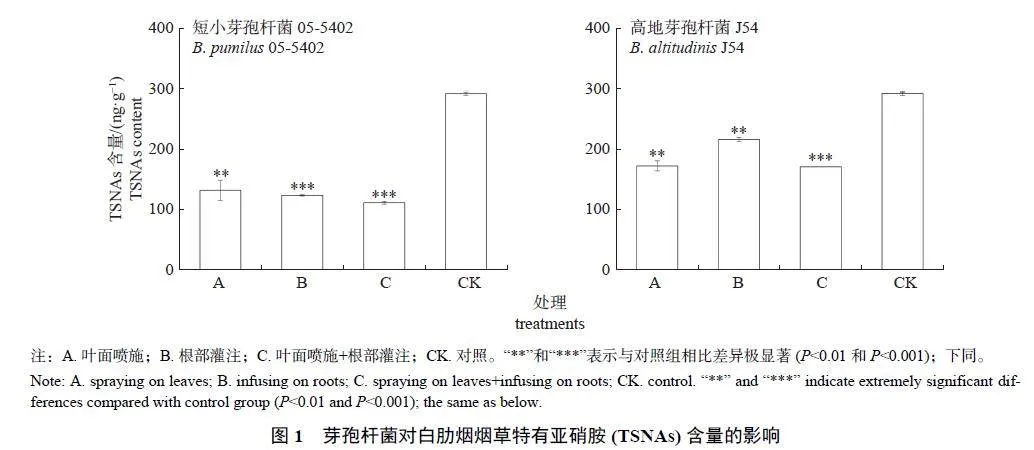
由图1 可知:短小芽孢杆菌05-5402 和高地芽孢杆菌J54 均能极显著降低白肋烟烟叶中的TSNAs 含量。其中,叶面喷施和根部灌注05-5402 可以使TSNAs 含量分别下降54.75% 和57.61%,两者联合施用可以使TSNAs 含量下降60.78%;而叶面喷施和根部灌注J54 可以使TSNAs含量分别下降40.93% 和26.00%,两者联合施用使TSNAs 含量下降41.42%。
2.2 芽孢杆菌对旱烟常规化学成分和TSNAs 含量的影响
由表2 可知:05-5402 菌液作用于旱烟时,3 种处理均能显著或极显著降低烟叶中总糖、还原糖和蛋白质的含量;仅根部灌注处理可显著提高总氮含量;3 种处理均能极显著提高烟碱含量,其中,叶面喷施处理的烟碱含量增幅最高(51.39%),叶面喷施联合根部灌注处理的烟碱含量增幅最小(33.49%)。使用J54 菌液作用于烟株时,3 种处理方式均能显著或极显著降低总糖和还原糖含量;均能显著或极显著提高烟碱含量,其中,叶面喷施联合根部灌注处理的增幅最小(21.40%),与05-5402 的影响趋势相似;对总氮含量的影响总体表现为增加趋势,其中叶面喷施联合根部灌注菌液可显著提高总氮含量;而对蛋白质含量的影响总体表现为降低趋势,且叶面喷施和根部灌注均可显著降低蛋白质含量。
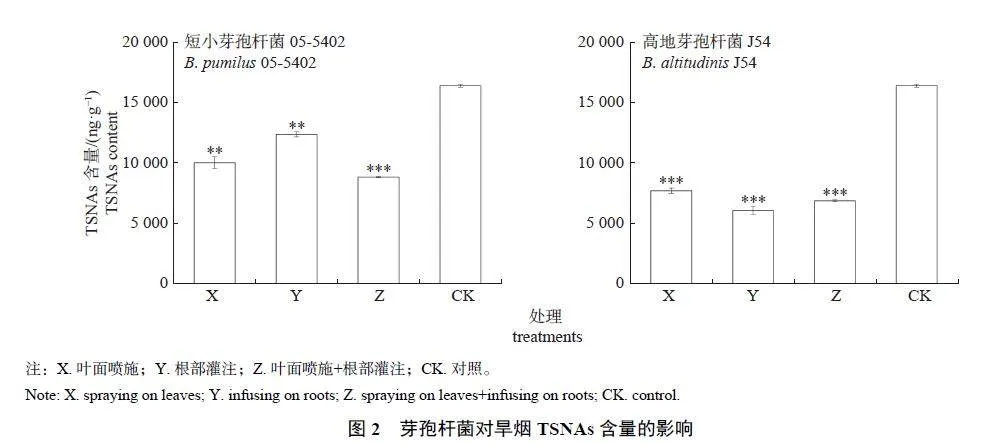
由图2 可知:在旱烟生长过程中,施加芽孢杆菌菌液可极显著降低晾制后烟叶的TSNAs含量。其中, 施用05-5402 于叶面和根部时,TSNAs 含量分别下降39.02% 和26.35%,联合使用可以使TSNAs 含量下降46.28%;施用J54菌液于叶面和根部时, TSNAs 含量分别下降53.23% 和63.18%,联合使用可以使TSNAs 含量下降56.27%。
2.3 芽孢杆菌发酵模式对烟叶TSNAs 含量的影响
2.3.1 固态发酵模式
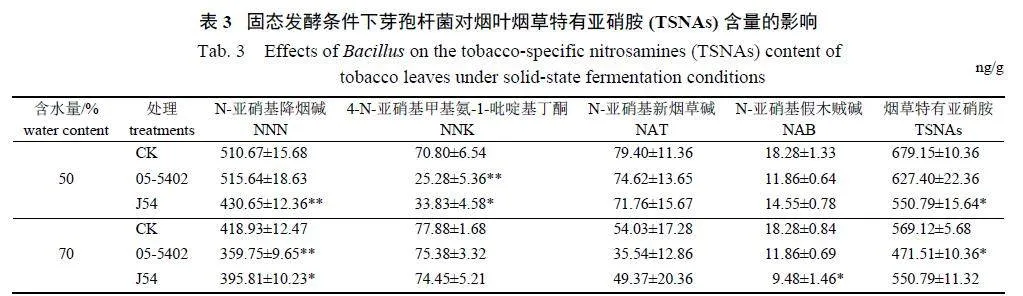
由表3 可知:固态发酵体系的含水量为50%时,05-5402 和J54 均能降低烤烟烟叶中的TSNAs含量;但05-5402 仅能降低7.62% 的TSNAs,主要降低了烟叶中的NNK 和NAB 含量,降解效果不显著;而J54 能显著降低18.9% 的TSNAs,且主要显著或极显著降低了NNN 和NNK 的含量。当固态发酵体系的含水量为70% 时,05-5402 能显著或极显著降低烟叶中的NNN 和TSNAs 含量,降幅分别为14.13% 和17.15%;J54 能显著降低烟叶中5.52% 的NNN 和48.14% 的NAB,虽然NNK、NAT 和TSNAs 含量也有所下降,但未达到显著差异水平。
2.3.2 液态发酵模式
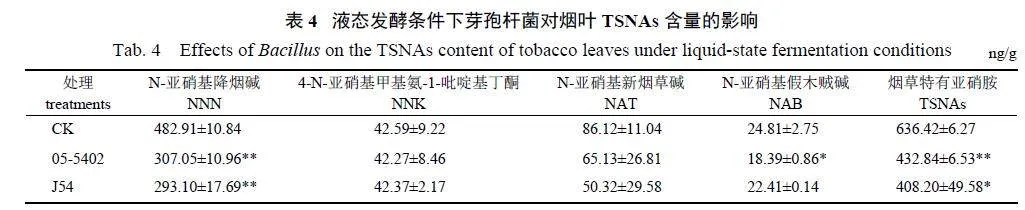
由表4 可知:在液态发酵模式条件下,施用05-5402 后,烟叶中的NNN 和NAB 含量均显著或极显著下降,降幅分别为36.42% 和25.88%,整体上可以降低烟叶31.99% 的TSNAs,作用效果显著;J54 则能显著降低35.86% 的TSNAs,且对NNN 的作用效果明显,能够极显著降低39.31%的NNN。
3 讨论
含氮化合物是TSNAs 形成的重要前体,其含量的下降能够直接减少TSNAs 生成[20],因此,烟草次级生物碱含量减少可直接降低 TSNAs含量。汪安云[21]的研究表明:细菌能够在晾晒烟的晾制后期显著降低其NNN 含量,从而使TSNAs 含量降低, 同时证明了微生物对降低TSNAs 具有一定效果。史宏志等[22]证实了烟叶中次级生物碱的转化率与NNN 及总TSNAs 含量呈极显著正相关。这些结果与本研究一致,05-5402 和J54 可以降低烟叶中的TSNAs,且主要是NNN 含量的下降,再次证明了利用细菌降低烟叶的TSNAs 含量是可行的。
本研究表明:芽孢杆菌05-5402 和J54 均能提高白肋烟的总糖和还原糖含量,而对总氮含量则整体表现为下降趋势,对蛋白质含量的影响也以下降为主;在旱烟中,也表现出较强的降低蛋白质含量的能力。这些结果与前人研究一致。冯志珍等[14]的研究导致烟叶中蛋白质的含量下降24.46%;李梅云等[15]将细菌S8 作用于烤烟K326,导致蛋白质含量下降5.17%,表明芽孢杆菌可有效降低烟叶的蛋白质和总氮含量。芽孢杆菌对旱烟中含氮化合物的影响主要表现为提高烟叶中的烟碱含量,对其总氮含量的作用效果则受到菌液施用方式的影响。TSNAs 也是烟叶中的含氮化合物,芽孢杆菌对降低旱烟中的TSNAs 含量仍具有积极作用。此外,施用芽孢杆菌后,烟叶的总糖含量普遍上升,在白肋烟中的还原糖含量呈上升趋势,而在旱烟中则主要表现为下降。倪涵等[23]的研究表明:将芽孢杆菌作用于烟叶能够影响其还原糖、纤维素等糖类成分的含量,与本研究结果一致。
目前关于细菌影响烟叶化学成分和TSNAs含量的调控机制的研究较少,仅有少量文献进行了解释。叶长文等[24]研究表明:细菌降低TSNAs含量与其pncB、nadD、nadC、nirB、nirD、nirC、cysI 等基因相关,它们是降低烟叶中硝酸盐和亚硝酸盐的关键基因,而硝酸盐和亚硝酸盐作为合成TSNAs 的重要前体, 其含量降低会导致TSNAs 含量减少。邹玲[25]的研究表明:芽孢杆菌降低烟叶TSNAs 含量与细菌胞内的糖酵解、碳代谢、淀粉和蔗糖代谢相关。总之,利用芽孢杆菌05-5402 和J54 降低烟叶TSNAs 含量是可行的,但其降解调控机制仍有待进一步深入研究。
本研究还表明:芽孢杆菌对烟叶中TSNAs含量的影响与发酵方式及发酵体系的含水量相关。在液态发酵体系中,05-5402 和J54 分别降低了烟叶中31.99% 和35.86% 的TSNAs,远高于含水量为50% 和70% 的固态发酵体系。孙榅淑等[26]和丁睿[27]的研究也表明:含水率显著影响TSNAs 含量。因此,推测液态发酵的方式有助于芽孢杆菌的定殖,提高菌株活性,从而达到更佳的效果。
4 结论
短小芽孢杆菌05-5402 和高地芽孢杆菌J54均能有效降低烟叶中的TSNAs 含量,但相关作用机制仍需进一步深入研究。相对于较低含水量的固态发酵体系,提高发酵体系的含水量能更有效地降低烟叶中的TSNAs 含量。通过田间喷施或直接发酵烟叶均可有效降低烟叶中的TSNAs 含量。研究结果为低TSNAs 烟叶的生产提供了重要的技术支持,拓宽了微生物降低烟叶TSNAs 含量的应用范围。
[ 参考文献 ]
[1]EDWARDS S H, ROSSITER L M, TAYLOR K M, et al.Tobacco-specific nitrosamines in the tobacco and mainstreamsmoke of U.S. commercial cigarettes[J]. ChemicalResearch in Toxicology, 2017, 30(2): 540. DOI: 10.1021/acs.chemrestox.6b00268.
[2]周迪, 孙雨琦, 史宏志, 等. 16个雪茄烟品种的烟碱转化率及与发酵后烟叶TSNAs含量的关系[J]. 中国烟草学报, 2020, 26(4): 18. DOI: 10.16472/j.chinatobacco.2019.330.
[3]李宗平, 覃光炯, 陈茂胜, 等. 不同调制方法对烟草烟碱转化及TSNA的影响[J]. 中国生态农业学报, 2015,23(10): 1268. DOI: 10.13930/j.cnki.cjea.150293.
[4]彭丽丽, 韩富根, 解莹莹, 等. 氮用量对烤烟叶片TSNA前体物含量及硝酸还原酶活性的影响[J]. 中国烟草学报, 2009, 15(3): 35. DOI: 10.3969/j.issn.1004-5708.2009.03.007.
[5]陈翔, 高艾飞, 李晓清, 等. 栽培措施对白肋烟TSNAs及质量的影响[J]. 核农学报, 2017, 31(6): 1226. DOI: 10.11869/j.issn.100-8551.2017.06.1226.
[6]雷新有, 张建斌, 白小华, 等. 烟草特有亚硝胺降解技术研究进展[J]. 山东化工, 2011, 40(9): 33. DOI: 10.19319/j.cnki.issn.1008-021x.2011.09.010.
[7]单宏英, 陈德鑫, 李晶, 等. 一株源于醇化烟叶表面高效降解TSNA菌株AS97的分离筛选、鉴定及应用[J]. 微生物学报, 2011, 51(10): 1326. DOI: 10.13343/j.cnki.wsxb.2011.10.004.
[8]张玉芹, 宫玮, 刘开启, 等. 反硝化细菌对烟草特有亚硝胺的降解作用[J]. 仲恺农业技术学院学报, 2007, 20(1):5. DOI: 10.3969/j.issn.1674-5663.2007.01.002.
[9]KATSUYA S, KOGA K, SAITO H, 等. 利用细菌降低白肋烟叶TSNA[J]. 中国烟草学报, 2007, 13(6): 50.
[10]汪安云, 黄琼. 一株降低烟草中特有亚硝胺细菌的分离鉴定及特性研究[J]. 环境科学学报, 2006, 26(11): 1914.DOI: 10.13671/j.hjkxxb.2006.11.028.
[11]周炎, 史宏志, 季辉华, 等. 中美部分品牌烟草制品TSNA及其前体物的含量和关系[J]. 中国烟草学报,2022, 28(2): 42. DOI: 10.16472/j.chinatobacco.2020.347.
[12]CUI M W, BURTON H R, BUSH L P, et al. Effect ofmaleic hydrazide application on accumulation of tobaccospecificnitrosamines in air-cured burley tobacco[J]. Journalof Agricultural and Food Chemistry, 1994, 42(12):2912. DOI: 10.1021/jf00048a050.
[13]刘荣森, 李建娥, 刘进社, 等. 烟叶主要含氮化合物含量变化规律研究[J]. 安徽农业科学, 2010, 38(12): 6179.DOI: 10.13989/j.cnki.0517-6611.2010.12.105.
[14]冯志珍, 陈太春, 胡喜怀, 等. 烟叶表面高效降解蛋白质芽孢杆菌的分离筛选及其鉴定[J]. 中国烟草学报, 2012,18(1): 101. DOI: 10.3969/j.issn.1004-5708.2012.01.017.
[15]李梅云, 高家合, 王革, 等. 微生物对烟叶蛋白质含量的影响[J]. 生物技术通报, 2006(增刊1): 376. DOI: 10.3969/j.issn.1002-5464.2006.z1.083.
[16]张玉玲, 汪安云, 黄琼云, 等. 施用细菌菌株(WB5)对烟草特有亚硝胺含量变化的初步研究[J]. 中国烟草学报,2004, 10(6): 37. DOI: 10.3321/j.issn:1004-5708.2004.06.007.
[17]雷丽萍, 吴玉萍, 莫笑晗, 等. TSNAs降解菌05-5402的筛选及其降解特性研究[J]. 中国烟草学报, 2017, 23(5):87. DOI: 10.16472/j.chinatobacco.2016.432.
[18]云南省烟草农业科学研究院 . 一种高地芽孢杆菌J54及其应用:CN201911143373.3[P]. 2022-03-29[2022-07-25].
[19]范多青, 刘秀明, 朱保昆, 等. 超高效液相色谱串联质谱快速检测卷烟主流烟气及烟丝中的TSNAs[J]. 中国烟草学报, 2012, 18(6): 10. DOI: 10.3969/j.issn.1004-5708.2012.06.003.
[20]冯新维, 黄莺, 陈东, 等. 烤烟氮代谢研究进展[J]. 分子植物育种, 2024, 22(14): 4722. DOI: 10.13271/j.mpb.022.004722.
[21]汪安云. 细菌对白肋烟叶片硝酸盐、亚硝酸盐和烟草特有亚硝胺含量的影响[J]. 中国烟草学报, 2007, 13(4):45. DOI: 10.3321/j.issn:1004-5708.2007.04.009.
[22]史宏志, 徐发华, 杨兴有, 等. 不同产地和品种白肋烟烟草特有亚硝胺与前体物关系[J]. 中国烟草学报, 2012,18(5): 9. DOI: 10.3969/j.issn.1004-5708.2012.05.002.
[23]倪涵, 马永凯, 林连兵, 等. 玉溪醇化烟叶表面细菌酶制剂对烟叶中淀粉和纤维素的降解作用[J]. 农业生物技术学报, 2012, 20(3): 268. DOI: 10.3969/j.issn.1674-7968.2012.03.006.
[24]叶长文, 董欣雨, 崔中月, 等. 抑制雪茄烟叶TSNAs生成的弯曲芽孢杆菌Ni3菌株的分离筛选及其关键基因挖掘[J]. 烟草科技, 2024, 57(8): 32. DOI: 10.16135/j.issn1002-0861.2023.0542.
[25]邹玲. 基于转录组学和蛋白质组学分析短小芽孢杆菌05-5402降解TSNAs的机理[D]. 昆明: 昆明理工大学,2023.
[26]孙榅淑, 王俊, 许东亚, 等. 白肋烟烟叶含水率与高温贮藏过程中TSNA形成的关系[J]. 中国烟草学报, 2016,22(4): 38. DOI: 10.16472/j.chinatobacco.2015.298.
[27]丁睿. 我国主要晒红烟产区烟叶烟草特有亚硝胺(TSNAs)的研究[D]. 北京: 中国农业科学院, 2014.
责任编辑:何承刚
基金项目:云南省烟草化学重点实验室开放课题(2020539200340214);云南中烟技术中心科技项目(11300295)。

