微塑料对双酚A在鲤鱼肠道中累积及生长生理的影响

摘要:为探明微塑料(MPs)对双酚A(BPA)在鱼类肠道中累积特征及鱼类生长生理的影响,本研究以黄河鲤鱼为模型生物,分析了0.5 um聚苯乙烯微塑料(PS-MPs)与BPA联合作用下鲤鱼肠道中微塑料及BPA的累积特征、鲤鱼生长及其抗氧化酶活性,以及它们之间的响应关系。结果表明:联合处理下鲤鱼肠道中的PS-MPs含量随时间呈线性增加,且随投加的微塑料浓度增加而增加,而PS-MPs累积速率随时间呈先增加后减小趋势,其中在BPA+PS(L)处理(1 mg·L-1 BPA+20 ug·L-1 PS-MPs)下,0.25 d时鲤鱼肠道中PS-MPs累积速率达到峰值(373.81 ug·g-1·d-1),BPA+PS(H)处理(1mg·L-1 BPA+100 ug·L-1 PS-MPs)下,则是在0.125 d达到最高(644.00 ug·g-1·d-1)。与单一BPA暴露相比,联合暴露下鲤鱼肠道中BPA累积量增加,与BPA(1 mg·L-1 BPA)处理相比,BPA+PS(L)和BPA+PS(H)处理下鲤鱼肠道中BPA含量分别提高了6.13%和9.74%,BPA累积速率分别增加了190.01%、373.80%。相较于对照处理,BPA处理和MPs与BPA联合处理均引起鲤鱼肠组织中超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、还原型谷胱甘肽(GSH)含量、丙二醛(MDA)含量增加,使体质量下降幅度减缓,其中BPA、BPA+PS(L)和BPA+PS(H)处理下鲤鱼体质量(21 d)较对照处理分别下降1.22%、3.90%、4.33%。当微塑料投加量达到100 ug·mL-1时,联合处理会增加鲤鱼肠道中SOD活性、CAT活性和GSH含量,抑制MDA产生,从而缓解MPs和BPA联合作用对鲤鱼造成的氧化损伤,并且减缓鲤鱼体质量下降。研究表明,微塑料的存在会增加双酚A在鲤鱼肠道中的累积,且两者联合作用对鲤鱼产生了协同毒理效应,导致鲤鱼生长速率减缓,体质量下降。
关键词:微塑料;双酚A;肠组织;抗氧化酶活性;生物标志物响应
中图分类号:X505;X503.225 文献标志码:A 文章编号:1672-2043(2024)02-0262-09 doi:10.11654/jaes.2023-0244
塑料因具有耐冲击性、耐磨性和绝缘性以及加工成本低等优点而在全球得到广泛应用。预计到2050年,全球塑料生产总量将达到330亿t。但随着塑料制品的广泛使用,大量塑料废弃物最终被排放并累积在环境中,对土壤或水体环境造成污染。塑料经过长期的物理、化学和生物降解作用转变成粒径更小、比表面积更大的颗粒或碎片,其中粒径lt;5 mm的塑料碎片、纤维或颗粒称为微塑料(MPs)。近年来,MPs在世界各地的海洋、湖泊、沉积物、生物体甚至两极地区中不断被检出。如我国鄱阳湖和乌梁素海表层水体中均存在大量的MPs,其中鄱阳湖表层水体MPs丰度每立方米达到5 000-34 000个,乌梁素海表层水体中,在各个采样点都发现大量MPs的存在。Lefebvre等在研究地中海野生沙丁鱼和鯷鱼样品时发现,在81%的沙丁鱼和89%的凤尾鱼中均鉴定出MPs聚合物,该研究证实了MPs在地中海无处不在,并且在鱼类消化道中出现率很高。同时在陆地生物(如蚯蚓)的肠道中也发现了MPs的存在。这些累积在消化道中的MPs对肠道系统产生大量机械性损伤,比如饮食器官和消化道梗阻、假性饱腹感和由此引发的摄食效率降低、肠道功能紊乱、营养不良、生长缓慢、行为异常、受伤甚至死亡。尽管研究表明大部分被生物摄入的MPs能够通过排泄过程排出体外,但仍有部分MPs存在于肠道中,甚至穿过肠道壁进入其他脏器,进一步产生更强的毒性效应。此外,MPs颗粒小、疏水性强,对有机污染物有较强的吸附能力,可作为有机污染物载体,在环境中造成流动性污染,甚至可与环境中有机污染物发生相互作用,产生复合毒性影响。Rainieri等以斑马鱼为对象,研究了MPs与多氯联苯、溴化阻燃剂、全氟化碳和甲基汞对鱼类的单独和联合作用,研究发现,与其他处理相比,以吸附污染物的MPs为饲料喂养的鱼,其肝脏中呈现出高度的气泡化且cyplal、pdxJ和gstpJ基因过表达,表明MPs和污染物的组合比单独使用MPs或污染物造成的影响更大。Zhang等研究了聚苯乙烯微塑料(PS-MPs)与罗红霉素对淡水红罗非鱼的联合作用,结果表明,罗红霉素(ROX)和PS-MPs联合处理可以显著降低鱼肝脏中的丙二醛(MDA)含量,并且提高超氧化物歧化酶(SOD)活性,尽管乙酰胆碱酯酶(AChE)的活性被抑制,但其仍高于单独使用ROX处理的效果,说明MPs的存在减轻了肝脏的氧化损伤且可能会减轻ROX对胆碱能系统的神经毒性。侯晨丽等研究发现单一双酚A(BPA)或MPs与BPA联合作用均会引起黄河鲤鱼鳃、肝、肠、脑组织出现不同程度炎症细胞浸润,并诱导各组织中的SOD、过氧化氢酶(CAT)、谷胱甘肽活性及MDA含量增加。因此,进一步摸清MPs与有机物在鱼类消化系统内的分布情况及其两者联合毒性效应,对推进生态环境治理和渔业发展至关重要。
近年来,BPA在许多包装材料中作为增塑剂被广泛使用,这些废弃物被排入湖泊后将持续存在于地表水和沉积物中,经过长时间的光照和微生物分解后,这些废弃物中所含的增塑剂可能会被释放,继而被MPs所吸附,并通过食物链的传递在水生物体内进行富集,损害生物体的生理功能,影响其繁殖、发育与摄食行为,甚至可能威胁到人类健康。目前针对MPs与有机污染物联合作用下毒性效应的研究大多集中于磺胺嘧啶、罗红霉素等抗生素类有机污染物,但有关MPs与BPA联合作用下鱼类消化系统中MPs与BPA分布情况,以及与鱼类的生长和生理的响应关系研究较少。此外,MPs与有机污染物对生物体的复合毒性作用依据研究对象以及污染物种类的不同而存在差异。因此,本研究选用黄河鲤鱼为模型生物,通过研究MPs对有机污染物在鱼类肠道中累积特征及与鱼类的生长及生理的响应关系,以加深对水环境中MPs和其他有机污染物的污染风险认识,并为建立水体中这些污染物的监管框架提供理论支持。
1材料与方法
1.1实验材料
实验所使用的绿色聚苯乙烯荧光微球粒径为0.5 um(激发波长:488 nm,发射波长:525 nm),购自天津倍思乐技术开发中心。将MPs原液超声振荡10 min摇匀,取1 mL原液(原液浓度为10 000 mg·L-1)用纯水稀释,配制成100 mg·L-1的MPs储备液备用。BPA分析纯(纯度99.9%)从上海麦克林生化科技有限公司购得。甲醇、乙酸等(色谱纯)购自上海阿拉丁试剂有限公司。黄河鲤鱼购自本地黄河鲤鱼育种场,平均体长为(12.31±0.97)cm,体质量为(25.5±1.5)g。选取体格均匀、健康灵活、无病无伤的黄河鲤鱼放入鱼缸中驯养7d,驯养用水为曝气了24 h以上的自来水。驯养期间保证溶解氧浓度大于5.6 mg·L-1,pH为6.8-7.2,温度为(25±1)℃,光暗比为14 h:10 h,每天定时投喂市售干饲料1次,喂食量约为体质量的2%。
1.2实验设置与方法
1.2.1实验设置
根据预实验结果确定BPA的染毒水平。对黄河鲤鱼分别投加5个浓度的BPA (3.8、4.6、5.4、6.0、6.8 mg·L-1),每个浓度设置3个平行,并设置空白对照组,共18组。在每组中放入11尾健康的黄河鲤鱼,并在完全静水停食的条件下,对用药后8h内的黄河鲤鱼的活动状况进行连续观察,及时捞出死亡的鱼。每过2h记录1次死亡数,并计算96 h死亡率。为保证实验结果的准确性,在96 h的实验过程中,每天对实验液的溶解氧、pH值和温度进行检测,确保溶解氧浓度大于5.6 mg·L-1,pH值在6.8-7.2之间,温度为(25±1)℃,光暗比为14 h:10 h。以浓度的常用对数作为横坐标,死亡率的概率单位作为纵坐标,计算得出96h半致死浓度(96 h LCso),根据实验结果,将BPA的染毒水平设定为1/5的96 h LCso,即1 mg·L-1。武芳竹等对MPs污染与鱼的生态毒理效应研究发现不同粒径和浓度的MPs会对鱼类产生不同的生态毒理效应。基于此,本实验共设置4个处理,分别为对照处理、BPA处理(1 mg·L-1 BPA)、BPA+PS(L)处理(1 mg·L-1 BPA+20 ug·L-1 PS-MPs)、BPA+PS(H)处理(1 mg·L-1 BPA+100 ug·L-1 PS-MPs)。每个实验处理均设置3个平行,共12个鱼缸。本次对黄河鲤鱼的暴露染毒实验采用静态水体暴露方式,黄河鲤鱼在驯养7d后,随机选取健康活泼的个体用于亚慢性暴露实验。亚慢性暴露实验参考Lu等的方法进行实验设置。每个玻璃鱼缸中装30 L自来水,随机选取健康活泼的鲤鱼投放到每个玻璃鱼缸中,每个鱼缸装有10条鱼。按实验设置分别在水中加入不同浓度的荧光PS-MPs和BPA或BPA的原液制备测试溶液。所有鲤鱼驯养7d后,开始暴露实验。实验期间,每天换1次水,每次更换全部的水,更换水前用玻璃移液管从每个鱼缸中取10 mL溶液,以确定所有实验处理中PS-MPs和BPA的实际暴露浓度,并补充对应体积的BPA和PS-MPs混合溶液确保暴露浓度稳定。暴露期间的其他条件与驯养条件完全一致。静态暴露期间分别在0.125、0.25、0.5、1、4、7、14 d和21d进行采样,从实验组的鱼缸中随机选取1条黄河鲤鱼,用超纯水反复冲洗去除皮肤上的颗粒,低温麻醉《4℃)后迅速解剖,取出鱼的肠组织,用0.15 mol·L-1 KC1快速清洗后用吸水纸将其表面溶液吸干,再用锡箔纸包好,编号,称质量并置于-80℃超低温冰箱中冷冻保存,用于PS-MPs和BPA的检测。
1.2.2肠道中PS-MPs含量检测
本实验采用KOH消解法对匀浆液样品进行消化处理。对解剖得到的鲤鱼组织准确称量并记录,置于2 mL玻璃研磨器中,加入2 mL KOH溶液研磨均匀,将获取的肠组织液定容至30 mL,转移至50 mL三角瓶中,60℃下消解72 h,得到澄清透明的组织消解液。取200 uL消解液,用酶标仪测定荧光强度,定量消解液中的PS-MPs,检测重复进行3次,并计算其回收率和误差。每次检测的回收率均在80%-120%之间,酶标法3次测定结果的相对标准偏差为0.05%,分光光度法的标准偏差为0.82%。
1.2.3BPA含量检测
称取湿质量约0.2 g的肠组织样本,加入1 mL甲醇冰浴匀浆,冰浴超声20 min,12 000 r·min-1 4℃离心10 min,取上清液氮吹至干,加入1 mL 50%甲醇复溶,复溶液过C18萃取小柱(3 mL甲醇、3 mL超纯水活化),用3 mL 50%甲醇水淋洗,再用3 mL甲醇洗脱,收集洗脱液氮吹至干,加入500 uL甲醇复溶,取复溶的上清液过0.22 um滤膜,上机检测。
采用岛津LC-20AT高效液相色谱仪(日本)进行液相色谱检测。荧光检测器、C18反相色谱柱(150mmx4.6 mm,5 um);流动相A为甲醇,B为乙酸水溶液,A:B=35:65,等度洗脱;进样量10 uL,流速1 mL·min-1,柱温30℃。
1.2.4鲤鱼体质量检测
在实验暴露期间,分别于1、3、5、7、14、21d时,从3个平行实验组的每个鱼缸中随机取1尾黄河鲤鱼,对取出的黄河鲤鱼进行低温麻醉后用吸水纸将鱼体表面的水分擦干,并用分析天平(精度:0.001 g)进行黄河鲤鱼体质量测量和记录。
1.2.5氧化损伤检测
组织匀浆上清液的制备:将黄河鲤鱼4℃冷水麻醉后,快速解剖,分离出的肠组织用生理盐水反复冲洗后用吸水纸吸干水分。称取约0.2 g(湿质量)组织,加入1 mL预冷的生理盐水进行冰浴匀浆,12 000r·min-1 4℃下离心10 min,收集上清液到新的EP管,-80℃冻存备用。将制备好的匀浆液,参照南京建成生物工程研究所说明书的步骤对SOD、CAT活性和MDA、还原型谷胱甘肽(GSH)含量进行测定。
1.2.6生物标志物响应指数
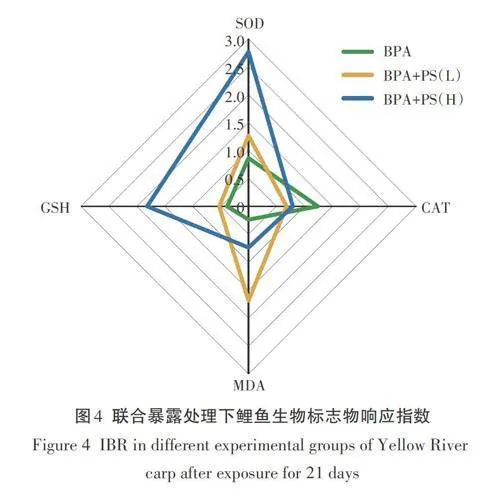
生物标志物响应指数(IBR)是一种综合运用多种生物标志物定性评估环境压力的工具,可用于定量评价某种污染物不同剂量对生物体的毒理效应。Li等采用IBR指数比较了不同浓度维拉帕米对虹鳟鱼幼鱼血液循环系统的污染胁迫,发现IBR指数是一个简单有效的工具,可以较好地描述生物的健康状况。较高的IBR值代表较高的氧化应激。本研究以SOD、CAT、MDA、GSH作为生物标志物,通过综合IBR指数对不同实验组下氧化酶对生物体的毒理效应进行评价。首先计算每种生物标志物在各站位的平均值(X1)以及所有站位该种生物标志物的总平均值(m)和标准差(s);然后将该标志物X1值进行标准化处理:Y1=X1/s,其中,Y1为标准化处理后的值。各站位每种标志物的得分为A1=Z+|min|,其中,若标志物与污染物呈正相关,则令Z=Y1,反之则令Z=-Y1,|min|为Z值中最小值的绝对值;最终通过将获得的每个生物标志物的A1得分与下一个生物标志物的得分相乘来计算星图面积,将每个乘积除以2,并将所有值相加。所得出的相应的IBR值为:A1xA2/2+A2xA3/2+……+Ax-1XAn/2+Ax×A1/2
1.3数据处理及分析
采用Microsoft Excel 2018和Origin 2022进行数据处理和图表绘制。使用SPSS 24.0软件对实验数据进行统计分析,差异性分析通过单因素ANOVA检验确定,当Plt;0.05时,判定数据结果存在显著性差异。
2结果与分析
2.1黄河鲤鱼肠道中PS-MPs和BPA的累积特征
2.1.1黄河鲤鱼肠道中PS-MPs的累积特征
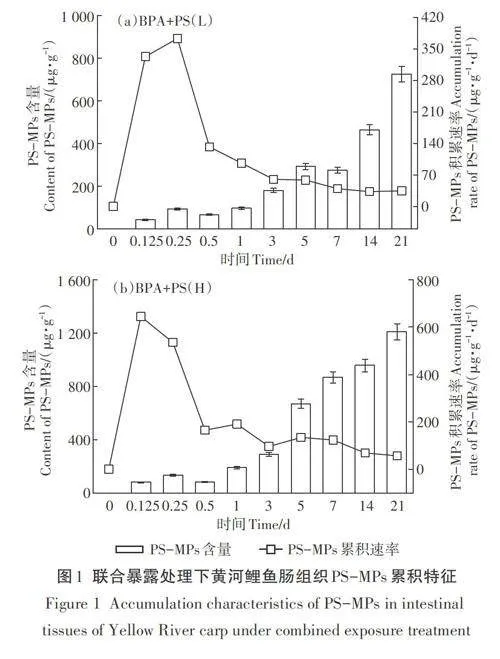
PS-MPs和BPA联合暴露处理下鱼肠道PS-MPs含量随时间的变化趋势如图1所示。由图可知,在BPA+PS(L)处理下,黄河鲤鱼肠道中的PS-MPs含量随时间增加总体呈逐渐增长趋势。其中,在0.5 d和7d时黄河鲤鱼肠道中的PS-MPs含量降低,分别为66.35 ug·g-1和292.12 ug·g-1,在21d时,黄河鲤鱼肠组织中的PS-MPs含量达到最高值(724.64 ug·g-1),在0.25 d时,累积速率达到最高值(373.81 ug·g-1·d-1),之后呈下降趋势。值得注意的是,累积速率在5d和21d时出现了轻微上升趋势。在BPA+PS(H)处理中,黄河鲤鱼肠组织中的PS-MPs含量在21d时达到最高(1 209.22 ug·g-1),总体呈现增长趋势,在0.5 d时出现下降(82.33 ug·g-1),累积速率在0.125 d时达到最高(644 ug·g-1·d-1),在1、3、Sd时波动较为明显。与低MPs浓度暴露条件相比,更高的MPs浓度下黄河鲤鱼肠组织中的PS-MPs含量以及PS-MPs在肠道中的增长速率显著高于低MPs浓度条件下的联合暴露组。以上结果表明,BPA+PS(H)处理对黄河鲤鱼肠组织中PS-MPs的累积影响更为明显。
2.1.2黄河鲤鱼肠道中BPA的累积特征
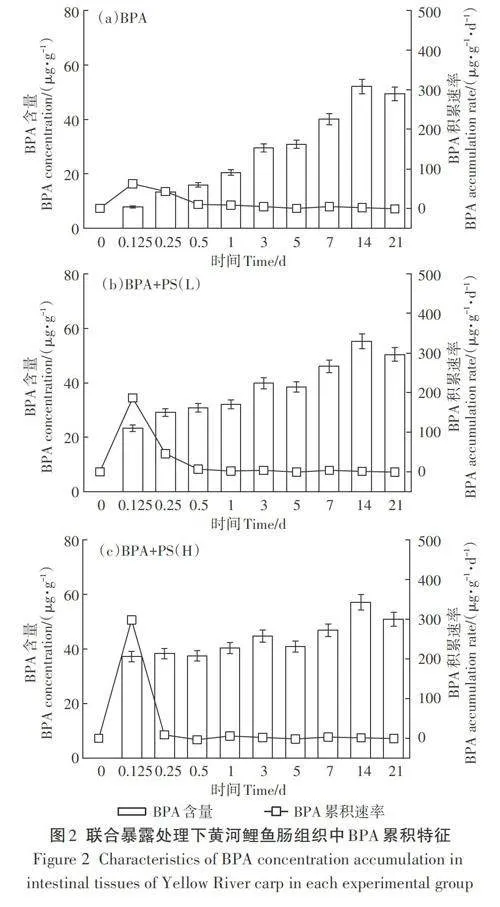
BPA处理、BPA+PS(L)处理、BPA+PS (H)处理下黄河鲤鱼肠组织BPA含量随时间的变化趋势如图2所示。3个实验组的BPA累积速率均在0.125 d达到最高,分别为62.86、186.36、297.83 ug·g-1·d-1,BPA累积速率随着时间增加呈逐渐下降趋势。在暴露前期BPA+PS(H)、BPA+PS(L)处理下的BPA累积速率远大于BPA处理,0.125 d时BPA累积速率表现为BPA+PS(H)处理gt;BPA+PS(L)处理gt;BPA处理,说明MPs和BPA联合作用会导致黄河鲤鱼肠组织中BPA累积速率增加。随着时间的增加,3个实验组的BPA含量也在不断增加,并在14 d时达到峰值后逐渐降低。BPA含量表现为BPA+PS(H)处理gt;BPA+PS(L)处理gt;BPA处理,说明MPs的存在会导致BPA更容易在黄河鲤鱼的肠道中累积。
2.2PS-MPs与BPA联合暴露对黄河鲤鱼生长的影响
表1为21d暴露期间黄河鲤鱼的体质量变化。可以看出在暴露期间各实验组黄河鲤鱼平均体质量总体呈增长趋势,暴露期间均未出现死亡或异常现象。在对照处理与BPA处理下,黄河鲤鱼体质量随着时间增加不断增长,BPA+PS(L)处理下黄河鲤鱼体质量在7d出现负增长,BPA+PS(H)处理在14 d出现负增长,说明PS-MPs的存在会对黄河鲤鱼的生长产生负面影响。前14 d各实验组之间黄河鲤鱼体质量变化无显著差异。在21d时,BPA处理与对照处理下鲤鱼平均体质量差异不显著(Pgt;0.05),BPA+PS(L)处理与BPA处理之间的平均体质量无显著差异(Pgt;0.05)。BPA+PS(H)处理与BPA处理相比,平均体质量表现出显著差异(Plt;0.05);BPA处理鲤鱼体质量增长速率在3d时显著高于其他3个处理。21d时增长速率的差异性与体质量差异基本一致。与对照处理相比,其他3组暴露21d后黄河鲤鱼体质量增长速率均出现不同程度的下降,BPA处理、BPA+PS(L)处理下对黄河鲤鱼体质量增长速率的影响不明显,而BPA+PS(H)处理会对黄河鲤鱼平均体质量增长速率产生显著影响。
2.3PS-MPs与BPA联合暴露下黄河鲤鱼的毒理效应
2.3.1联合暴露对黄河鲤鱼抗氧化酶活性的影响
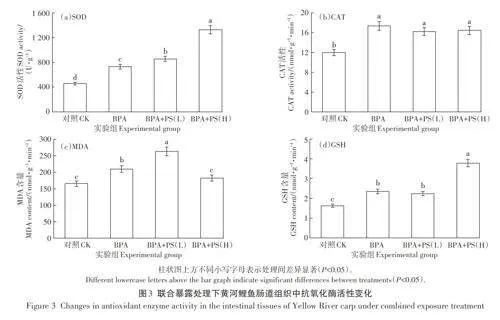
暴露于BPA和PS-MPs的黄河鲤鱼肠组织中SOD、CAT活性及MDA、GSH含量的变化如图3所示。在图3(a)中,与对照处理相比,BPA处理、BPA+PS(L)处理、BPA+PS(H)处理下黄河鲤鱼肠组织SOD活性显著提升(Plt;0.05),肠组织中SOD活性分别为458.63、730.12、856.34、1 325.91 U·g-1。在PS-MPs与BPA联合处理下SOD活性随着PS-MPs浓度增大而不断加强,说明PS-MPs与BPA两种污染物对黄河鲤鱼肠组织中SOD活性的影响可能呈现出协同作用。在图3(b)中,与对照组相比,BPA单独暴露、BPA+PS(L)处理、BPA+PS(H)处理下黄河鲤鱼肠组织中CAT活性显著提升(Plt;0.05),肠组织中CAT活性分别为11.98、17.40、16.23、16.47 nmol·g-1·min-1,BPA处理、BPA+PS(L)处理、BPA+PS (H)处理之间无显著差异(Pgt;0.05)。在图3(c)中,对照处理、BPA+PS(H)处理与BPA处理、BPA+PS (L)处理之间存在显著差异(Plt;0.05),肠组织中MDA含量分别为165.34、209.43、263.08、182.06 nmol·g-1·min-1,在不同处理下MDA含量从高到低依次为BPA+PS(L)处理gt;BPA处理gt;BPA+PS(H)处理gt;对照处理。在图3(d)中,BPA+PS(H)处理组中GSH含量与BPA处理组GSH含量呈现出显著差异性(Plt;0.05),这可能是高浓度的PS-MPs导致黄河鲤鱼肠道中PS-MPs大量累积,从而对肠道功能造成了一定程度的损害,导致GSH含量显著增高。而在BPA+PS(L)处理组中GSH含量较BPA处理有略微下降,可能是因为肠道中部分BPA被PS-MPs吸附,并随PS-MPs排出体外从而降低了对肠道的损害。
2.3.2综合生物标志物响应
本研究将不同的生物标志物(SOD、CAT、MDA和GSH)与黄河鲤鱼接触21d后的IBR值进行整合,并以星形图表示(图4)。在不同的处理组中,不同生物标志物的IBR值在星形图中产生了不同的模式。在BPA+PS(L)和BPA+PS(H)处理下的SOD、GSH活性IBR值较BPA处理组高,且随PS-MPs浓度增加而增加,说明SOD、CSH活性对PS-MPs的敏感性较强,推测PS-MPs可能对这两个酶的活性影响占主导地位。另外,MDA含量在BPA+PS(L)处理下更为敏感,表明BPA与PS-MPs联合作用能够引起更大的氧化应激反应。
2.4鲤鱼生长及生理指标与PS-MPs和BPA含量的响应关系
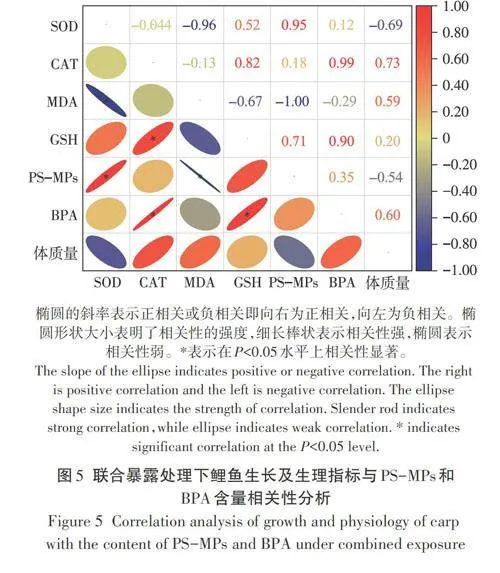
联合暴露处理下鲤鱼生长及生理指标与PS-MPs和BPA含量的响应关系如图5所示。由图5可知,鲤鱼体质量与肠道中PS-MPs含量和SOD活性呈负相关,与CAT活性、MAD含量及BPA含量呈正相关关系,但整体相关性不显著(Plt;0.05)。鲤鱼肠道中PS-MPs含量与SOD活性呈显著正相关关系(Plt;0.05),相关系数为0.95;而PS-MPs含量与MDA含量呈显著负相关(Plt;0.05)。鲤鱼肠道中BPA含量与CAT活性和GSH含量呈显著正相关关系(Plt;0.05),相关系数≥0.90。综上所述,联合暴露下鲤鱼肠道中PS-MPs和BPA含量的累积会引起鲤鱼的氧化损害,并通过增加SOD、CAT活性和GSH含量以及抑制MDA产生来缓解MPs和BPA对鲤鱼的影响,而这种适应措施会导致黄河鲤鱼的生长缓慢。
3讨论
3.1联合暴露对黄河鲤鱼肠道中PS-MPs与BPA累积特征的影响
本研究发现,随着暴露时间的增加黄河鲤鱼肠组织中的MPs含量也在不断增加,这种现象在BPA+PS(H)处理下更为明显。而韩旭的研究发现,随着暴露时间的延长,斑马鱼对MPs(20 um)的清除量增加,累积量降低。本研究与韩旭研究所得出的结论不同,这可能是由于本研究所使用的MPs粒径(0.5 um)较小,与大粒径的MPs相比,较小粒径的MPs更容易在生物体内长期累积。此外,MPs作为一种高分子聚合物,难以被生物体代谢或降解,本研究中黄河鲤鱼肠组织中BPA含量表现为BPA+PS(H)处理gt;BPA+PS(L)处理gt;BPA处理,造成此现象的原因可能是随着MPs含量的升高,黄河鲤鱼摄入了更多小粒径MPs,由于MPs具有较大的比表面积,可以吸附疏水性物质在其表面形成局部的聚集。Diego等的研究表明,聚对苯二甲酸乙酯微塑料的外表面具有显著的亲核性,可以促进BPA在MPs结构中的传质和在粒子内扩散。在分子间距离较短的情况下,BPA和聚对苯二甲酸乙酯微塑料能够通过内部或外部吸附作用形成稳定的复合物,而随着摄入量的增加,大量MPs在肠道聚集,导致暴露前期肠道中BPA含量不断增加,表明摄入携带BPA的MPs可能是导致BPA在鱼类肠道中生物积累的额外暴露途径。Zhang等研究了PS-MPs与ROX对淡水红罗非鱼的联合作用,结果表明,MPs可以作为红罗非鱼ROX的载体,在这种情况下,PS-MPs的存在可以显著促进ROX在红罗非鱼各组织中的生物富集,这与本研究得到的结果基本一致。此外,本研究发现黄河鲤鱼肠组织中BPA含量在第14天达到峰值后开始衰减,这可能是由于随着暴露时间的延长,黄河鲤鱼对BPA的吸收能力降低,导致其肠组织中BPA的清除量增加、累积量降低。此外,部分BPA可能会吸附在MPs表面,并随着MPs被排出体外。
3.2PS-MPs对黄河鲤鱼生长生理的影响
MPs粒径小且具有较强吸附性,其进入生物体内会使生物体的吸收和代谢过程受到干扰,还可能会对生物体造成机械物理损伤和复合毒性引起的化学损伤,从而对生物的生长生理造成一定影响。本研究发现,与对照组相比,其他3组暴露21d后黄河鲤鱼体质量均出现不同程度下降,其中BPA+PS(H)处理与对照处理差异最为显著(Plt;0.05),出现此现象的原因可能是由于联合暴露处理下PS-MPs和BPA会在鲤鱼的肠道内大量累积,鲤鱼肠道菌群紊乱,扰乱了调节代谢,造成鲤鱼营养不良、生长缓慢,体质量下降。Tang等在对蚯蚓肠道的研究中也得到相似结论,研究发现土壤中PS-MPs的存在会显著降低拟杆菌门的相对丰度,影响蚯蚓的脂质代谢,从而进一步增加了蚯蚓的肠道通透性,扰乱了渗透调节代谢。另外也可能是由于MPs机械物理损伤和复合毒性引起肠组织黏膜层杯状数量显著减少,部分黏膜层隐窝结构消失,从而引起炎症细胞及纤维组织增生,对黄河鲤鱼肠道消化功能产生较大影响,导致鲤鱼体质量显著下降。本研究发现在BPA+PS(L)和BPA+PS(H)处理下的SOD、GSH活性的IBR值较BPA处理组高,且随PS-MPs浓度增加而增加,表明MPs的存在会由于吸附作用而增强BPA对黄河鲤鱼的神经毒性,影响中枢神经系统和多巴胺系统,并对各种生物标志物产生显著影响,从而造成氧化应激。此外,研究发现,与对照处理相比,其他3组中SOD、CAT活性均显著增加,随着MPs浓度增加SOD活性逐渐升高,出现该现象的原因可能是由于PS-MPs在斑马鱼体内的积累引起肝脏炎症和脂质积累,诱导黄河鲤鱼肝脏代谢途径以及脂质和能量代谢发生改变,从而对黄河鲤鱼造成不可逆的氧化损伤。在联合处理下,肠道中的SOD、GSH活性均高于BPA单独暴露组,BPA+PS(H)联合处理下肠道中MDA含量低于BPA单独暴露组,表明当PS-MPs浓度达到100 ug·mL-1时,联合暴露会诱导鱼体内的抗氧化系统,从而降低氧化损伤。
4结论
(l)MPs颗粒可作为BPA在黄河鲤鱼肠道内的承载体,PS-MPs的存在可显著促进BPA在黄河鲤鱼肠道内的富集。
(2)MPs的存在会促进BPA在鲤鱼肠道中的累积,且两者联合对鲤鱼的毒理效应为协同作用,联合暴露导致鲤鱼生长速率减缓,体质量下降。
(3)当MPs投加量达到100 ug·mL-1时,联合暴露会诱导肠道中SOD活性、CAT活性和GSH含量增加,抑制MDA的产生,从而缓解MPs和BPA联合作用对鲤鱼的氧化损伤。