芍药根腐病拮抗内生细菌筛选及拮抗机制分析






关键词:芍药;根腐病;内生细菌;贝莱斯芽孢杆菌;拮抗机制
中图分类号:S685.99 文献标志码:A 文章编号:1003—8981(2024)03—0226—10
芍药Paeonia lactiflora 是我国传统名花,为芍药科Paeoniaceae 芍药属Paeonia 多年生宿根花卉,其花大色艳,花型丰富,是园林与切花中常见的花卉,具有较高的观赏价值,并且芍药根可入药,具有较高的药用价值,能够创造良好的经济效益。随着芍药种植面积的扩大,在种植过程中,芍药根部逐渐出现病害,如根腐病、白绢病等,其中根腐病危害最大。芍药根腐病又称“烂根病”,为土传病害。该病危害芍药根部,须根、主根及根颈部皆可发病,发病时根部组织变黑,影响其吸收功能,从而造成植株地上部长势衰弱,叶片变黄,严重时枝条和叶片萎蔫,甚至导致地上部死亡[1]。有研究结果表明,引起芍药根腐病的病原菌主要为茄腐皮镰刀菌Fusarium solani[1-2] 与尖孢镰刀菌F. oxysporum[3]。由于关于芍药根腐病的研究报道较少,且芍药与牡丹为同属植物,可以借鉴牡丹的相关研究结果。引起牡丹根腐病的主要病原菌是茄腐皮镰刀菌,但植物根腐病的发生一般为多种菌混合侵染引起的,土壤习居菌(尖孢镰刀菌、立枯丝核菌Rhizoctoniasolani 等)往往与茄腐皮镰刀菌混合侵染,使得牡丹根腐病发病原因复杂[4-5]。
关于芍药根腐病防治主要采用化学防治方法。化学药剂的重复使用及滥用使致病菌抗性增强,并且导致农药残留,造成环境污染,引起一系列的生态环境问题。因为芍药栽培多为连作,根腐病难以被从根本上解决。目前生物防治是病害绿色防治的研究热点,具有安全长效的优点,尤其是内生拮抗菌株容易占据宿主体内的生态位点,抑制病原菌的生长与繁殖,且可以改良土壤和宿主根际微生物环境,可从根本上解决连作造成的根腐病。芽孢杆菌被广泛应用于植物病害的防治中,其中2005 年被首次报道的贝莱斯芽孢杆菌Bacillus velezensis 是一种新型生防菌种[6],目前已发现其对多种植物病菌有较好的拮抗效果,对病害有显著的生防效果。侯胜铭等[7] 从发病杨树根际土壤中得到1 株贝莱斯芽孢杆菌B42,其对杨树根腐病病原菌尖孢镰刀菌具有显著的拮抗作用,并对茄腐皮镰刀菌等其他6 种病原菌具有广谱抗性。冯宝珍等[8] 从番茄植株体内筛选出1 株对多种植物病原菌有较好抑制作用的内生细菌贝莱斯芽孢杆菌FQ-G3,其对灰葡萄孢菌Botrytiscinerea 的抑制率达80.93%,并可显著抑制灰葡萄孢菌在番茄果实上的扩展。宗英等[9] 从感染赤霉病的麦穗上筛选到1 株高效抑制禾谷镰刀菌F. graminearum 的贝莱斯芽孢杆菌JS25R,在温室条件下该菌株能有效降低小麦赤霉病的发病率、发病程度和病情指数。
目前仅见关于牡丹根腐病生物防治研究的报道。杨瑞先等[10] 从健康牡丹根部组织中获得2 株对牡丹根腐病病原菌有良好拮抗作用的解淀粉芽孢杆菌Bacillus amyloliquefaciens md8 和md9,并推测起拮抗作用的物质为伊枯草菌素。毛咪等[11-12]报道引起湖南牡丹根腐病的病原菌为茄腐皮镰刀菌,并从健康牡丹根颈部筛选到1 株对其有明显拮抗作用的解淀粉芽孢杆菌MRX2-1,并优化了发酵条件。这些研究结果丰富了拮抗茄腐皮镰刀菌的微生物资源。但是关于芍药根腐病生物防治的研究鲜见报道。
本研究中以健康芍药根部组织为材料,从中分离并筛选对芍药根腐病菌有拮抗作用的内生细菌,研究脂肽类物质对病原菌的抑制效果,初步探讨其生防机制,以期为芍药根腐病的生物防治提供微生物资源,为其应用开发提供理论参考。
1 材料与方法
1.1 试验材料
植物材料:健康芍药根部组织于2022 年5—6 月采自洛阳隋唐遗址公园、洛阳国花园芍药种植区,采用五点取样法进行采样。将采集的样品放入无菌袋中,带回实验室,在4 ℃条件下保存备用。
病原菌:芍药根腐病病原菌茄腐皮镰刀菌由本课题组前期分离、鉴定,现保存于洛阳理工学院微生物实验室。
试剂:OMEGA E.Z.N.A® Bacterial RNA Kit 试剂盒(Omega Bio-Tek 公司);PrimeScript ™ RTreagent Kit RNA 反转录试剂盒与Premix Taq ™试剂盒(TaKaRa 公司);细菌基因组DNA 提取试剂盒(离心柱型)(天根生物工程有限公司);引物均由生工生物工程(上海)股份有限公司合成;甲醇、盐酸等试剂均为国产分析纯。
培养基:TSA 培养基、PDA 培养基、NA 培养基、NB 培养基、Landy 培养基,配制方法参考文献[13]。
1.2 试验方法
1.2.1 内生细菌的分离纯化
将健康芍药根部组织清洗干净后,称取2 g,采用表面消毒法和组织研磨法进行内生细菌的分离[14]。
1.2.2 拮抗菌株的筛选
采用平板对峙法筛选芍药根腐病病原菌的内生拮抗菌株,具体方法:在已活化5 d 的腐皮镰刀菌边缘打取5 mm 菌饼反接在PDA 平板中央,分别在距平板边缘1 cm 处十字对称点接内生细菌,以仅接病原菌为对照,在28 ℃条件下倒置培养。7 d 后筛选出对病原菌有明显拮抗作用的菌株,采用牛津杯法进行复筛,具体方法:取1 环拮抗菌株接入NB 培养基中,在30 ℃条件下170 r/min 振荡培养3 d 后,将发酵液用0.22 mm 无菌微孔滤膜过滤除菌,备用;将5 mm 病原菌菌饼反接在PDA 平板中央,分别在距平板边缘1 cm 处放置4个灭菌牛津杯,牛津杯中分别加入150 mL 灭菌发酵液,在28 ℃条件下正置培养。每个菌株重复3次。7 d 后测量抑菌带宽,计算抑菌率(对照组和处理组病原菌菌落直径的差值占处理组病原菌菌落直径的百分比)。
1.2.3 拮抗菌株的鉴定
观察拮抗菌株的形态学特征,通过葡萄糖发酵试验、甲基红试验、V-P 试验、柠檬酸盐利用试验、碳源试验等对拮抗菌株的生理生化特性进行研究[15-16]。
按照细菌基因组DNA 提取试剂盒说明书提取拮抗菌株基因组DNA。16S rRNA 基因扩增采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1429R(5′-CGGCTACCTTGTTACGAC-3′)。反应体系共25 mL,为PCRMix 12.5 mL,模板1 mL,引物各1 mL,ddHO 9.5 mL。扩增程序为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1.5 min,35 个循环;最后72 ℃再延伸10 min,4 ℃保存。采用1% 琼脂糖凝胶电泳检测扩增产物,并送至生工生物工程(上海)公司测序。将测序结果上传至NCBI 数据库,并与数据库中已知序列进行Blastn 比对,并用Mega 7.0软件中的临近法构建系统发育树,确定其分类地位。
1.2.4 拮抗菌株脂肽类物质合成基因的扩增
分别利用脂肽类物质合成功能基因fenA、srfAA和ituD 的引物对拮抗菌株的3 个基因进行扩增,引物序列见表1。PCR 扩增程序:95 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,35 个循环;72 ℃ 10 min,4 ℃保存。采用1% 琼脂糖凝胶电泳检测扩增产物,使用紫外凝胶成像系统观察扩增结果并拍照。将扩增产物送至生工生物工程(上海)公司测序,利用NCBI 数据库的Blastn 程序检索同源序列,并与GenBank 中的数据进行比对分析。
1.2.5 拮抗菌株脂肽类物质提取和分析
1)脂肽类物质的提取 将活化的拮抗菌株以1% 接种量分别接入1 L Landy 培养基中,在30 ℃条件下170 r/min 振荡培养,采用酸沉淀和甲醇抽提的方法提取脂肽类物质[13]。
2)培养时间对脂肽类物质产量的影响 将培养时间设置为2、3、4、5、6、7、8、9 d,分别提取不同培养时间的脂肽类物质,并称量,观察培养时间对菌株脂肽类物质产量的影响。
3)脂肽类物质对芍药根腐病病原菌的拮抗效果 以拮抗菌株培养3 d 后提取的脂肽类物质为材料,采用牛津杯法检测其对芍药根腐病菌的拮抗效果。将所提取脂肽类物质用适量0.2 mol/L 磷酸缓冲液(pH=7.0)溶解,每个牛津杯中加入150 mL脂肽类物质,具体方法同1.2.2 中复筛方法。每组处理重复3 次。在25 ℃条件下培养,7 d 后观察抑菌效果,测量抑菌带宽,计算抑菌率。在光学显微镜下观察对峙组根腐病病原菌菌丝形态变化。
1.2.6 拮抗菌株脂肽类物质合成基因荧光定量PCR分析
1)菌体收集。采用平板对峙法收集拮抗菌株样品。在PDA 平板一侧接种直径5 mm 的病原菌菌饼,另一侧划线接种拮抗菌株,在28 ℃条件下倒置培养,以仅接种拮抗细菌的PDA 平板为对照。分别收集对峙培养2、3、4、5、6、7 d 的拮抗菌株菌体5 mg,在-80 ℃条件下保存备用。以每10个平板为1 次生物学重复,设3 次重复。共收集7组细菌样品。
2)RNA 提取及逆转录聚合酶链式反应。利用OMEGA E.Z.N.A® Bacterial RNA Kit 试剂盒提取细菌样品RNA,利用PrimeScript ™ RT reagentKit RNA 反转录试剂盒将细菌样品RNA 反转录为cDNA,具体方法分别见说明书。样品RNA 的浓度和纯度使用NanoDrop 2000 分光光度计测定,并用RNase-free 水将RNA 稀释到100 mg/L。
3)荧光定量PCR 检测。根据拮抗菌株脂肽类物质合成基因测序获得的序列设计荧光定量PCR 引物,引物序列见表2。以细菌rpsJ 基因作为内参基因,利用ABI7500 实时荧光定量PCR 仪(Applied Biosystems 公司,USA)进行样品定量检测。荧光定量PCR 的反应体系与PCR 的反应程序参照文献[13]。采用2-ΔΔCt 方法进行实时荧光定量结果(C 值)的相对定量[17]。
1.3 数据统计与分析
试验数据采用SPSS 19 和Excel 2010 软件进行分析。
2 结果与分析
2.1 筛选的拮抗细菌
通过表面消毒法和组织研磨法从健康芍药根部组织中共分离出48 株具有不同形态特征的内生细菌,分别命名为H1 ~ H48。采用平板对峙法从中筛选出2 株对芍药根腐病菌具有拮抗效果的菌株H21 与H35,平均抑菌带宽分别为2.8、5.8 mm(图1A)。利用2 个菌株的发酵液进行复筛,结果显示H21 与H35 的发酵液对病原菌的平均抑菌带宽分别为2.0、6.7 mm(图1B),抑菌率分别为24.1% 与62.5%,其中H35 的拮抗效果较好,且发酵液的拮抗效果明显优于菌株的拮抗效果,因此使用菌株H35 进行鉴定分析及后续试验。
2.2 拮抗细菌的鉴定结果
在NA 平板上,菌株H35 的菌落为乳白色,干燥,不透明,边缘不规则,中间有皱褶。革兰氏染色结果显示为阳性,菌体为杆状(图2)。葡萄糖发酵试验和V-P 试验结果显示为阳性,柠檬酸盐利用试验和甲基红试验结果为阴性,菌株H35 能够利用葡萄糖、蔗糖、果糖和甘露醇(表3)。
经测序,菌株H35 的16s RNA 基因扩增产物长度约为1500 bp,上传至GenBank 后获得的登录号为PP213449。Blastn 比对结果显示该序列与贝莱斯芽孢杆菌的序列相似性高达100%,选取与其序列相似度较高的菌株,构建系统发育树(图3)。从系统发育树可以看出,菌株H35 与贝莱斯芽孢杆菌聚为一支。结合形态学特征与分子生物学鉴定结果,可将菌株H35 鉴定为贝莱斯芽孢杆菌。
2.3 拮抗细菌的拮抗机制
2.3.1 合成脂肽类物质功能基因的扩增结果
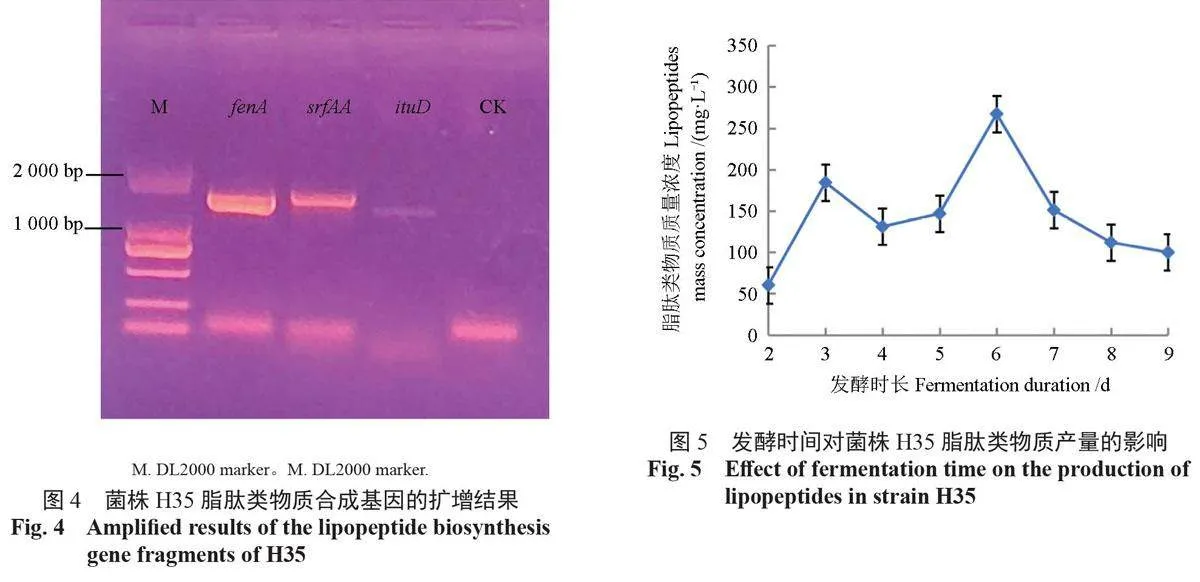
采用3 对引物对菌株H35 脂肽类物质合成基因进行PCR 扩增,扩增结果表明菌株H35 能够扩增出fenA、srfAA、ituD 3 个脂肽类物质合成基因的片段,片段长度分别为1555、1640、1 328 bp(图4)。将扩增产物进行测序,并将测序所得序列在GenBank 中进行Blastn 比对, 结果表明H35 的fenA 基因片段与贝莱斯芽孢杆菌LDSY2(CP030150)的序列同源性达到93%,srfAA 基因片段与贝莱斯芽孢杆菌BA-26(CP046918)的序列同源性达到93%,ituD 基因片段与贝莱斯芽孢杆菌UCMB5140(CP051463)的序列同源性达到90%。Blastx 比对结果表明,菌株H35 的fenA、srfAA 基因片段序列与贝莱斯芽孢杆菌丰原素合成酶蛋白序列、表面活性素合成酶蛋白序列相似性均达到93%,ituD 基因片段序列与伊枯草菌素类杆菌霉素D 合成酶蛋白序列的相似性达到90%,说明将H35 扩增获得的3 个基因片段分别为相应的脂肽类物质合成基因序列,即菌株H35 能够合成具有抑菌性的脂肽类物质。
2.3.2 培养时间对脂肽类物质产量的影响
将拮抗菌株H35 接入1 L Landy 培养基中,分别培养2、3、4、5、6、7、8、9 d 后,所提取脂肽类物质的量不同。如图5 所示:在培养3 d 时,产量达到1 个小高峰,为184.5 mg/L;在培养6 d时,其产量达到最大,为267.5 mg/L。
2.3.3 脂肽类物质对芍药根腐病菌菌丝的影响
采用牛津杯法验证菌株H35 脂肽类粗提物对芍药根腐病病原菌的拮抗作用。每个牛津杯中加入150 mL 质量浓度为92.25 g/L 的脂肽类物质。结果表明,菌株H35 脂肽类粗提物对芍药根腐病病原菌有明显的拮抗作用,平均抑菌带宽为7.70 mm,抑菌率为73.8%(图6)。
显微观察结果表明:对照组病原菌菌丝光滑,内容物分布均匀;对峙组菌丝出现畸形,大量菌丝顶端及中部出现囊泡化,菌丝变粗,部分菌丝折叠扭曲,并且变空。推测可能是脂肽类物质破坏了病原菌细胞膜结构和通透性,导致细胞内容物外泄(图7),表明菌株H35 产生的脂肽类物质影响了病原菌菌丝的正常生长。
2.3.4 脂肽类物质合成基因的荧光定量PCR分析
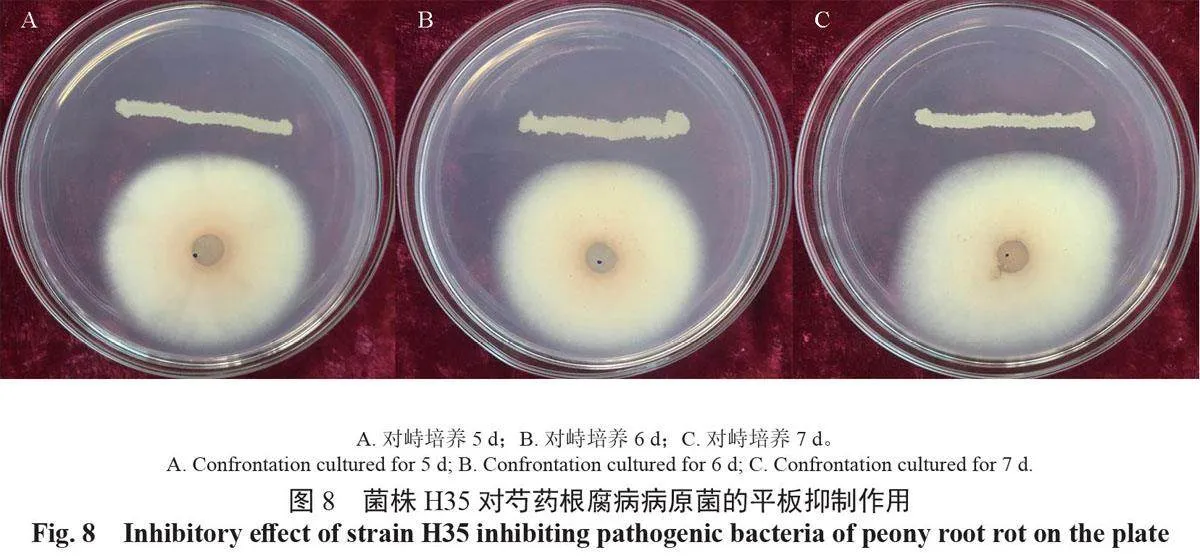
平板对峙试验结果表明,菌株H35 对芍药根腐病病原菌的拮抗效果随培养时间而变化,接种3 d后的抑菌带最宽,平均为10.50 mm,接种4 d 后为8.50 mm,接种5 d 后为7.60 mm,接种6 d 后为7.70 mm,接种7 d 后为7.70 mm,抑菌效果在接种6 ~ 7 d 时趋于稳定(图8)。
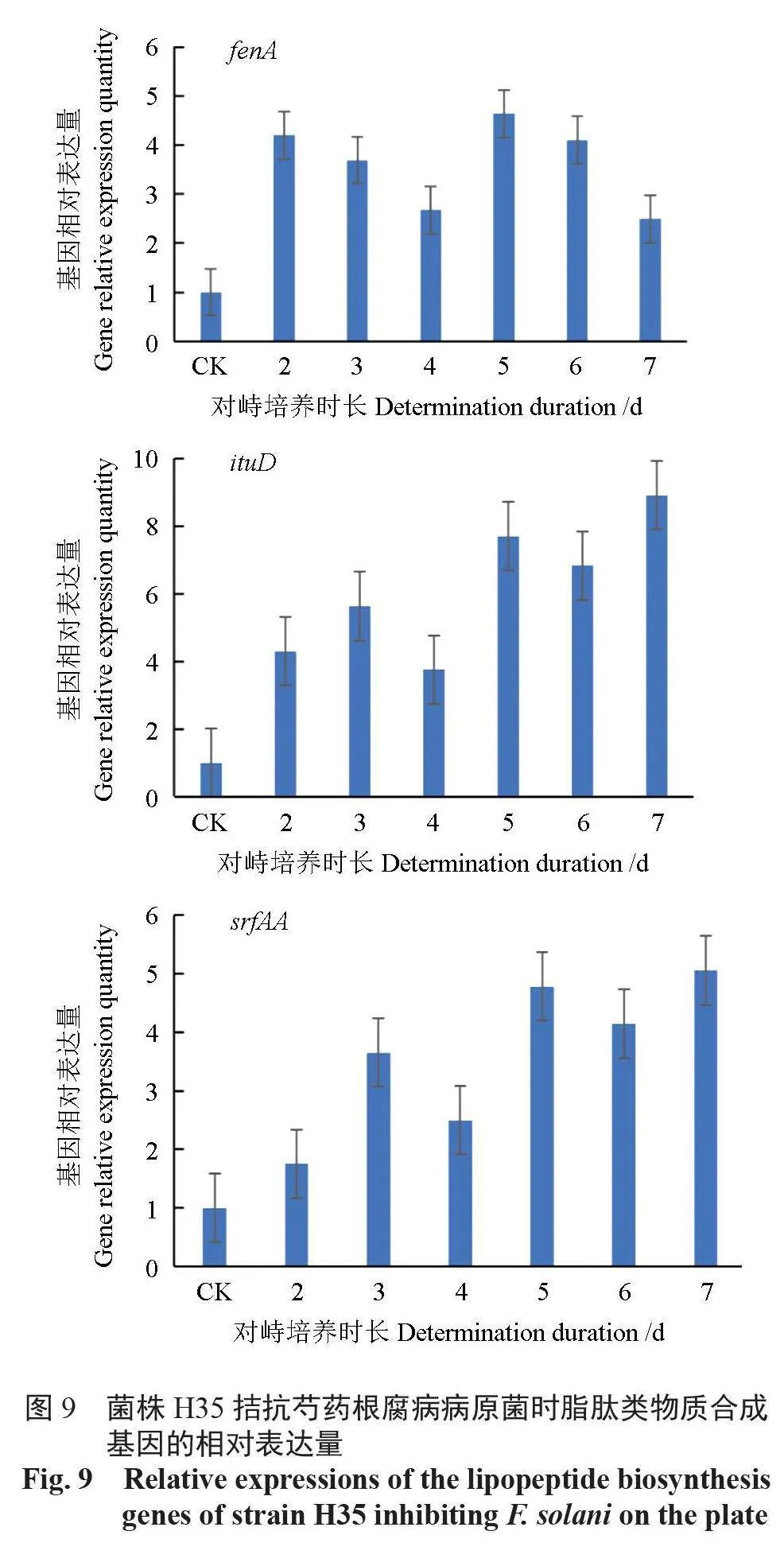
所提取菌株H35 的RNA OD260/280 值为2.01,质量较好, 能够满足后续试验的要求。fenA、srfAA、ituD 脂肽类物质合成基因荧光定量PCR 结果表明,在与病原菌共培养期间,菌株H35 这3个基因的表达量发生了不同程度的变化(图9)。与对照相比,ituD 基因与srfAA 基因的表达量均在对峙培养7 d 时达到最大值,分别为对照的8.9、5.1倍,且ituD 基因在对峙培养的2 ~ 7 d 内稳定保持高表达量,为对照的3.8 ~ 8.9 倍,fenA 基因的表达量在对峙培养5 d 时达到高峰,为对照的4.6 倍,与其他2 个基因相比,其对峙培养7 d 内的表达量相对稳定,基本为对照的2 ~ 4 倍。荧光定量PCR结果表明,与芍药根腐病原菌平板对峙培养期间,菌株H35 的3 个脂肽类物质合成基因均被诱导表达,其中ituD 基因的表达量显著高于对照组,推测在对峙培养期间发挥主要抑制作用的脂肽类物质为伊枯草菌素,表面活性素与丰原素次之,3 种脂肽类物质共同作用抑制了病原菌的生长。
3 结论与讨论
通过研究,从健康芍药根部组织分离筛选出1 株对芍药根腐病病原菌有良好拮抗作用的贝莱斯芽孢杆菌H35,初步探讨了其生防机制,结果表明菌株H35 能够合成非核糖体脂肽类抑菌物质表面活性素、丰原素和伊枯草菌素,脂肽类物质在与病原菌对峙过程中使病原菌菌丝发生了畸变,阻碍了病原菌的生长,在与病原菌对峙过程中3个脂肽类物质合成基因srfAA、fenA、ituD 的表达量均高于对照,尤其是伊枯草菌素合成基因(ituD)的表达量显著高于对照,推测伊枯草菌素在抑制病原菌生长过程中发挥了主要作用。
根腐病是土传病害,危害多种植物,发病原因复杂,一旦感染难以根治,有“植物癌症”之称,镰刀菌属茄腐皮镰刀菌、尖孢镰刀菌、禾谷镰刀菌等多为此病致病菌。芍药也是深受其害的植物之一,由于物理防治与化学防治具有局限性,研究其生物防治成为当务之急。贝莱斯芽孢杆菌作为优良的生防菌种,能够产生多种抗菌物质,脂肽类物质是其中一类,对镰刀菌属致病菌及其他属致病菌均有良好的抑制作用。脂肽类物质通过非核糖体途径合成,主要包括表面活性素、丰原素和伊枯草菌素。表面活性素主要通过破坏细胞膜,影响膜的稳定性,而达到抑菌目的[18]。表面活性素对真菌的抑制效果不佳,但研究结果表明表面活性素可以增强丰原素与伊枯草菌素对真菌的抑制效果[19]。丰原素主要对病原真菌有较强的抑制作用,使细胞质膜的结构和渗透性发生改变,从而引起胞内物质外泄,导致细胞死亡[20]。伊枯草菌素同样对病原真菌有抑制作用,通过改变细胞膜的通透性,抑制细胞生长或导致细胞死亡[21]。曾欣等[22] 从温郁金根茎内分离筛选出1 株对6 种不同属的病原真菌均有抑制效果的贝莱斯芽孢杆菌B-11,并且在与病原菌的共培养过程中使病原菌菌丝产生畸形,MALDI-TOF-MS 检测结果表明拮抗菌株B-11 能够产生伊枯草菌素、丰原素和表面活性素,其中伊枯草菌素的产量最高。欧婷等[23]经研究发现,贝莱斯芽孢杆菌SWUJ1 对炭疽菌有良好的抑制作用,抑菌率达58.9%,并使部分炭疽菌菌丝扭曲、肿大且内容物聚集,脂肽类粗提物LC-MS 分析结果表明菌株贝莱斯芽孢杆菌SWUJ1可能通过产生脂肽类化合物表面活性素、丰原素和伊枯草菌素抑制病原菌生长。申云鑫等[24] 研究了贝莱斯芽孢杆菌SH-1471 对番茄枯萎病的防治效果,结果表明该菌株有srfA、fenB、ituA、ituD和bymA 等抗生素合成基因,对多种病原菌具有良好的抑制效果,可显著降低番茄枯萎病的发病率。
本研究结果表明,贝莱斯芽孢杆菌及其脂肽类抗生物质对镰刀菌属致病菌有良好的抑制作用。刘雪娇等[25] 发现贝莱斯芽孢杆菌3A3-15 产生的脂肽类抗生素可使尖孢镰刀菌菌丝发生膨大、缠绕等畸形,并在其产生的脂肽类物质中发现了表面活性素。郭蔓等[26] 经研究发现,贝莱斯芽孢杆菌P9 发酵液中脂肽类抗生素粗提物对尖孢镰刀菌有良好的抑制效果。本研究中筛选得到的贝莱斯芽孢杆菌H35 具有srfAA、fenA、ituD 脂肽类物质合成基因,这些脂肽类物质对芍药根腐病菌菌丝有明显的致畸作用,对病原菌的生长有良好的抑制效果。菌株H35 脂肽类物质的产量并非随培养时间的延长而一直提高,这可能与菌株的生长特性、接种量、培养基等因素均有关系。为了确定菌株生长的最佳条件以及提高脂肽类物质产量的条件,为菌株的进一步开发应用提供理论参考,后续将进一步研究菌株的生长特性,研究碳源、氮源、培养基pH、培养温度等因素对菌株的影响,以及接种量、培养基、培养时间对菌株脂肽类物质产量的影响。
荧光定量PCR 技术能够准确定量扩增基因,应用广泛。本研究结果表明,在与病原菌FhQ0SMvbJat+IuXLHdM84TNEALbw8r/jhu3Vwhl5kYA=对峙过程中,拮抗菌株的抗生素合成基因表达量上调。郑臻[27] 的研究结果表明,枯草芽孢杆菌G-7 对香蕉枯萎病菌F. oxysporum 有较强的拮抗作用,与其对峙培养24 h 后,菌株G-7 的ituD-i 基因与iturinA合成所必需的lpa-14基因的表达量均上调。Li 等[28] 的研究结果表明,解淀粉芽孢杆菌SQR9与腐皮镰刀菌和尖孢镰刀菌对峙培养时,脂肽类物质合成基因fenA、bmyD、srfAA 的相对表达量均上调。杨瑞先等[10] 经研究发现,解淀粉芽孢杆菌md8 与dm9 与牡丹根腐病病原菌腐皮镰刀菌共培养时,ituD 和fenA 基因均显著上调表达,共培养前期srfAA 基因的表达量也显著增加,表明srfAA 基因编码的表面活性素在抑菌过程中具有协同增效作用。本研究中菌株H35 与芍药根腐病病原菌对峙培养时,ituD、fenA 和srfAA 基因均显著上调表达,其中ituD 在对峙培养期间保持高表达,其次是srfAA,表明伊枯草菌素为主要抑菌物质,表面活性素与丰原素增强了抑菌效果。脂肽类物质主要有三大类群,每个类群均有多种抑菌物质,本研究中仅探究了srfAA、fenA、ituD 基因在与病原菌对峙过程中的表达量,后续将研究其他脂肽类物质合成基因(如fenB、ituA、ituB 等基因)在对峙过程中表达量的变化情况,及其抑菌作用机制,同时将利用灌菌法研究菌株H35 对盆栽芍药与大田芍药根腐病的生防效果,以期为芍药根腐病生物防治提供微生物资源。

