两种藜麦幼苗对氮铁营养的生理生化响应
摘 要 本研究选取2种优势藜麦品种(红藜和黑藜),分析2个氮水平(N1,4 mmol·L-1;N2,12 mmol·L-1)和3个铁水平(Fe1,10 μmol·L-1;Fe2,100 μmol·L-1和Fe3,300 μmol·L-1)组合下的藜麦幼苗生理生化反应,旨在为滇中苗期藜麦合理补充氮、铁营养提供理论依据。结果表明:(1)红藜麦单株鲜质量大于黑藜麦。叶绿素含量在两藜麦中均为,在N1供应下配施Fe2最高,在N2供应下则配施Fe3最高。(2)MDA含量在两藜麦不同器官中均呈现叶>根。在同一铁供应下,两藜麦MDA含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性均表现为N2>N1。在两种氮供应下,红藜麦配施Fe1时叶片MDA含量较高;黑藜麦则在配施Fe2时最高。对于叶片各抗氧化酶活性,红藜麦在两种氮供应下均配施Fe3时SOD、APX活性最强;黑藜麦在N1供应下CAT、抗坏血酸过氧化物酶(APX)、SOD活性为Fe2>Fe3>Fe1,在N2供应下配施Fe3时CAT、APX活性最高。(3)在同一铁供应下,两藜麦脯氨酸含量、可溶性糖、可溶性蛋白均表现为N2>N1。在两种氮供养下,红藜麦在配施Fe3时根部脯氨酸含量累积较多;黑藜麦则在配施Fe2时最高。可溶性蛋白含量在两种氮供养下,红藜麦在配施Fe1时含量最高,黑藜麦则在Fe3时达到最大值。从以上研究结果得出:红藜麦为缺铁敏感型,黑藜麦则为耐逆型品种。在藜麦苗期合理配施氮铁营养,在N1供应下当配施Fe2较佳,在N2供应下当配施Fe3最宜。
关键词 藜麦;幼苗;氮营养;铁营养;生理生化
藜麦(Chenopodium quinoa)是起源于南美洲安第斯山脉的一种粮食作物[1],其籽实富含蛋白质、氨基酸及钙、铁、锌和维生素E等,尤其是铁的含量远高于传统谷物小麦、水稻等。藜麦还是一种对非生物胁迫耐受性极强的植物,特别是耐寒、耐旱、耐盐碱、耐瘠薄,在多种恶劣气候条件下能良好生长[2]。藜麦已引入中国多年,在中国西南土壤较为瘠薄的地区已有大面积种植[3],据统计藜麦规范化高产高效示范推广面积达1 000 hm2以上。其中,在滇中红土地上藜麦的产量较高,其种子产量约为150~250 kg·hm-2,已获得了良好的经济和社会效益。
铁作为植物生长发育所必需的微量元素,广泛参与植物体内各种生理过程(如叶绿素合成、光合作用和呼吸作用等),并在植物生长发育过程中扮演着重要角色[4]。缺铁已成为各国农业生产中面临的一个普遍问题。土壤缺铁不仅会影响植物生长,引起产量下降,同时植物可食部位(如籽粒)中铁的含量也会显著降低[5-6]。滇中红土地尽管土壤中铁的总含量十分丰富,但其通常以生物有效性较低的氧化物或氢氧化物形态存在,难以满足植物正常生长需求[7]。另外,氮是植物生长发育过程中必不可少的营养元素,参与一系列生理生化反应[8-10],在植物生长发育过程中起重要作用。滇红土中可被植物吸收、利用的氮、铁含量不足,多地出现藜麦幼苗黄化现象,严重影响藜麦苗期生长状况及成熟后的籽实品质。当地农民通常采用追肥等方式补充营养,来维持作物产量。但若不合理施肥,超出植物正常生长范围,反而造成营养胁迫[11],增加了农业生产负担及经济损失,还加剧环境污染,导致农业生态恶化。
合理补充氮、铁营养,提高藜麦产量和品质已成为亟待解决的问题。鉴于藜麦种间养分利用存在差异,本试验选取推广最广泛的红、黑两种藜麦,根据当地农田施肥量状况设计氮、铁浓度营养配置浓度。研究藜麦幼苗生理反应,筛选出藜麦氮、铁优势吸收、高效养分利用组合,以期为不同藜麦品种幼苗生长过程中合理补充氮、铁营养提供理论参考。
1 材料与方法
1.1 试验材料培养及采集
采用盆栽控制试验,在中国科学院西双版纳热带植物园苗圃大棚进行试验。选取商业化大面积栽培的2个藜麦品种(红、黑)为试验材料,采用砂培方法。首先选取籽粒饱满、大小一致的藜麦种子,于2018-03-15在花盆中进行播种。种子播种于营养土中,营养土配比为腐殖质∶蛭石=7∶5。每盆播30粒,待其长3片真叶时,选取长势相对一致的幼苗移栽入洁净石英砂(粒径1.5~4.0 mm)栽培盆中,每盆7株,共36盆。砂培基础营养配方采用1/2 Hoagland双子叶营养配方,每2 d浇营养液1 次,每盆浇200 mL,砂培28 d后进行取样。取样时用去离子水将植株根系上的泥土冲洗干净,然后整株分别装入信封,用干冰封存,及时寄送苏州梦犀生物医药科技有限公司待测。
1.2 试验设计
试验设置藜麦品种、施氮(N)和施铁(Fe)3个因素,采用完全随机试验设计。材料为红、黑2个藜麦品种;氮素设2个水平:N1(4 mmol·L-1)和N2(12 mmol·L-1);铁设 3 个水平:低浓度Fe1(10 μmol·L-1),中浓度Fe2(100 μmol·L-1)和高浓度Fe3(300 μmol·L-1);一共12个处理组合(2×2×3),每个处理组合6次重复。试验分别以Ca(NO3)2为氮源和Fe—EDTA为铁源。
1.3 测定项目与方法
参照植物生理实验指导书[12-13],叶绿色素含量测定采用丙酮法;丙二醛(malondialdehyde,MDA)含量测定方法采用硫代巴比妥酸(thiobarbituric acid,TBA)法;超氧化物歧化酶活性(superoxide dismutase,SOD)测定方法采用氮蓝四唑光化还原法,过氧化氢酶(catalase,CAT)活性测定采用紫外分光光度法,抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性采用紫外分光光度法测定;可溶性糖含量测定采用蒽酮比色法,可溶性蛋白质含量测定采用考马斯亮蓝 G-250法,脯氨酸(proline,Pro)含量测定采用茚三酮比色法。所有数据由苏州梦犀生物医药科技有限公司测定。
1.4 数据分析
运用SPSS 20.0进行多因素方差分析试验数据,并用最小显著差数法LSD(Least-Significant Difference)进行多重比较,采用Sigmaplot 14.0软件绘图。
2 结果与分析
2.1 氮铁配施对藜麦幼苗单株鲜质量和叶片叶绿素含量的影响
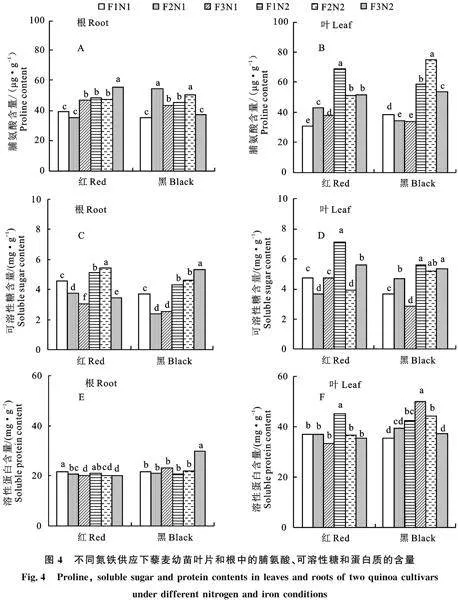
2.1.1 单株鲜质量 藜麦幼苗单株鲜质量中,铁营养和氮营养主效应不显著,但品种、铁营养和氮营养交互效应达到显著水平。在两种藜麦幼苗单株鲜质量中,红藜麦单株鲜质量>黑藜麦。在不同氮、铁营养供应下两藜麦单株鲜质量各处理间均呈现差异不显著(P>0.05)(图1-A)。但铁营养供应影响藜麦幼苗单株鲜质量累积,在两种氮供应下均呈现随着铁供应浓度的升高,藜麦幼苗单株鲜质量略有所增加。
2.1.2 叶片叶绿素含量 叶绿素a,品种、铁营养、氮营养主效应及交互效应显著(P<0.05)。叶绿素b,氮营养具有显著主效应(P<0.05)。总叶绿素含量,铁营养、氮主效应及交互效应均达到显著水平(P<0.05)。在同一铁供应下,两种藜麦叶绿素a(图1-C)、叶绿素b(图1-D)、总叶绿素含量(图1-B)均呈现N2>N1。在N1供应下,两种藜麦均呈现在Fe2时,叶绿素a、叶绿素b、总叶绿素含量高于其他铁营养供应。在N2供应下,两种藜麦叶绿素a、叶绿素b、总叶绿素含量均随着铁供应浓度的升呈现上升。在N2供应下,黑藜麦叶绿素b增加量显著高于相同处理下红藜麦(P<0.05),但叶绿素a/b 值显著降低(P< 0.05)。
2.2 氮铁配施对藜麦幼苗MDA含量和抗氧化酶活性的影响
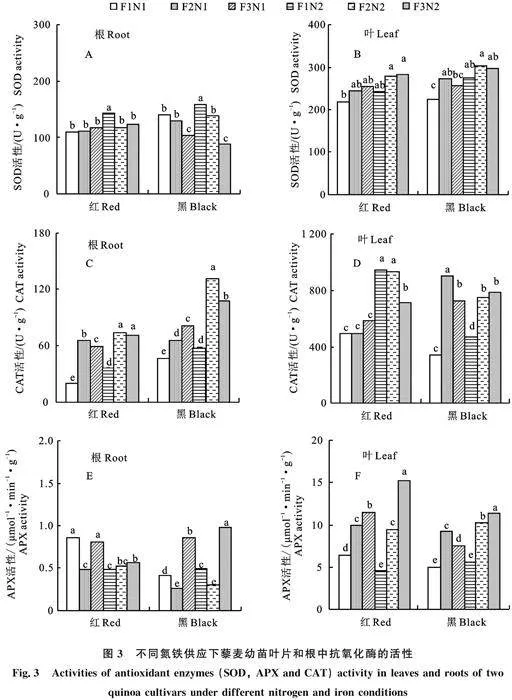
2.2.1 MDA含量 MDA含量在根中,品种、铁营养、氮营养间主效应及交互效应均达到显著水平(P<0.05)。MDA含量在叶中,品种、铁营养和氮营养主效应显著(P<0.05),但品种、铁营养和氮营养交互效应不显著(P>0.05)。MDA含量在两种藜麦各器官中的分布规律为叶>根(图2)。根中,红藜麦在 N1 供应下随着供应铁浓度的升高,MDA含量呈现上升的变化趋势,但差异不显著(P>0.05)。在N2 供应下 ,Fe2配施下MDA含量显著高于Fe1和Fe3(P<0.05)。黑藜麦在两种氮供应下,不同铁供应间MDA含量呈现为Fe2<Fe3<Fe1。叶中,红藜麦在两种氮供应下均显示,随着铁供应浓度的升高MDA含量呈现下降的变化趋势。黑藜麦在两种氮供应下叶中MDA含量与根呈现不同的变化趋势,Fe2>Fe1>Fe3。
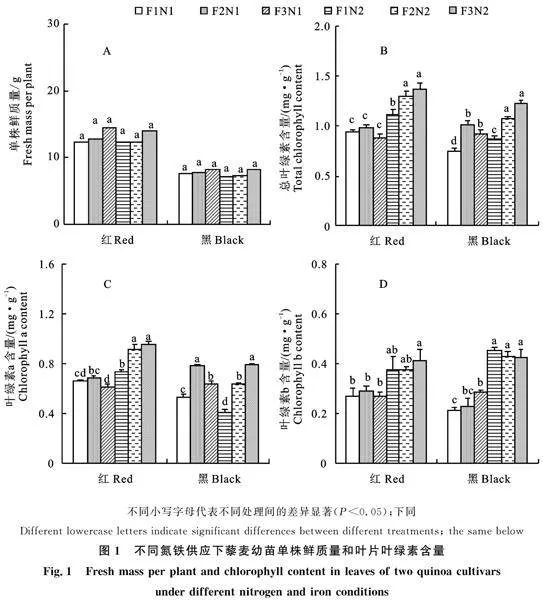
2.2.2 SOD活性 SOD活性在根和叶中,铁营养和氮营养主效应作用显著(P<0.05),但品种、铁营养和氮营养交互效应不显著(P>0.05)。两种藜麦叶的SOD酶活性均比根高(图3-A和B)。根中,红藜在N1供应下随着供应铁浓度的升高呈现稳定上升的变化趋势,但各处理间差异不显著(P>0.05)。在N2供应下,随着铁浓度的升高SOD活性呈现Fe2>Fe3>Fe1的变化趋势。黑藜在两种氮供应下均显示,随着供应铁浓度的升高SOD活性呈现下降的变化趋势。叶中,红藜麦在两种氮供应条件下均呈现随着铁供应浓度的升高SOD活性逐渐增强,但处理组间差异不显著(P>0.05)。黑藜在两种氮供应条件下SOD活性均呈现Fe2>Fe3>Fe1。
2.2.3 CAT活性 CAT活性在根和叶中,品种、铁营养和氮营养交互效应均达到显著水平 (P<0.05)。两种藜麦CAT活性在器官中均呈现:叶>根。根中,红藜在两种氮供应下均显示,随着供应铁浓度的升高CAT活性呈现先升高后下降的变化趋势(图3-C和D)。Fe2供应下CAT活性最高。黑藜在N1供应下随着供应铁浓度的升高呈现显著上升的变化趋势(P<0.05)在N2供应下,随着铁浓度的升高CAT活性呈现Fe2<Fe3<Fe1。叶中,红藜在N1供应下,CAT活性随着铁供应浓度的升高各处理间无显著差异 (P>0.05)。在N2供应下,CAT活性随着供应铁浓度的升高CAT活性呈现下降的变化趋势,在Fe1和Fe2配施下CAT活性差异不显著(P>0.05),Fe3配施显著低于Fe2和Fe1(P<0.05)。黑藜在N1供应下,随着铁供应浓度的升高,各处理间CAT活性差异显著(P<0.05),Fe2供应CAT活性显著高于Fe3和Fe1(P<0.05)。在N2供应下,CAT活性随着铁供应浓度的升高CAT活性呈现上升的变化趋势。
2.2.4 APX活性 APX活性在根中,品种、铁营养和氮营养主效应及交互效应均达到显著水平(P<0.05)。APX活性在叶中,除品种、铁营养和氮营养交互效应未达到显著水平外(P> 0.05),其余主效应和交互效应显著(P<0.05)。两种藜麦APX 活性在器官中均呈现:叶>根。(图3-E和F)。根中,红藜在N1供应下,APX活性随着铁供应浓度的升高呈现Fe2<Fe3<Fe1。在N2供应下,APX活性随着铁供应浓度的升高而升高。黑藜在两种氮供应条件下,APX活性均呈现Fe2<Fe1<Fe3。叶中,红藜在两种氮供应条件下,APX活性均呈现随着配施铁浓度的升高而显著上升的变化趋势(P<0.05)。黑藜在N1供应下,APX活性呈现Fe1<Fe3<Fe2。在N2供应下,APX活性随着配施铁浓度的升高呈现显著上升的变化趋势(P<0.05)。
2.3 氮铁配施对藜麦幼苗渗透调节物质含量的影响
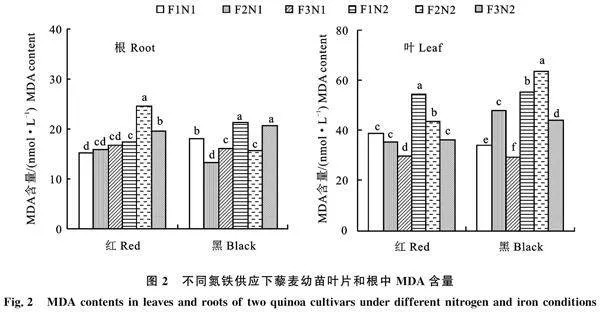
2.3.1 脯氨酸含量 脯氨酸含量在根和叶中,铁营养和氮营养主效应及交互效应显著(P< 0.05)。在两种氮供应下,红藜麦配施Fe3时根的脯氨酸含量均显著高于Fe1和Fe2(图4-A和B)(P<0.05)。黑藜麦则在两种氮供应下脯氨酸含量均为Fe2>Fe1>Fe3。在 N1 供应下,红藜麦随着铁供应浓度的升高,叶脯氨酸含量呈现出Fe2>Fe1>Fe3。在 N2 供应下,最低的铁供应下的脯氨酸含量最高。在N1 供应下,黑藜麦随着铁供应浓度的升高而下降,且Fe1配施下的脯氨酸含量显著高于Fe2和Fe3(P< 0.05)。在 N2 供应下,随着供应铁浓度的升高脯氨酸含量呈现Fe2>Fe1>Fe3。
2.3.2 可溶性糖含量 可溶性糖含量在根和叶中,品种、铁营养和氮营养主效应及交互效应显著(P<0.05)。在同一铁浓度配施下两种藜麦可溶性糖含量均呈现:N2>N1(图4-C和D)。说明氮供应浓度的升高,促进可溶性糖在植物体内累积。根中,红藜在N1供应下,随着铁配施浓度的升高可溶性糖含量呈现显著下降的趋势(P<0.05)。在N2供应下,可溶性糖的含量随着铁配施浓度的升高呈现先升高后下降。黑藜在N1供应下,配施Fe1时可溶性糖含量显著高于Fe2和Fe3(P<0.05)。在N2供应下,随着配施铁浓度的升高可溶性糖含量维持稳定上升。叶中,红藜在两种氮供应下随着配施铁浓度的升高,可溶性糖含量均呈现Fe2<Fe1、Fe3。黑藜在N1供应下,配施Fe2时可溶性糖含量最高。在N2供应下,配施Fe2时可溶性糖含量最低。
2.3.3 可溶性蛋白质含量 可溶性蛋白含量在根和叶中,品种、铁营养和氮营养主效应及交互效应均达到显著水平(P<0.05)。两种藜麦叶的可溶性蛋白含量均比根高(图4-E和F)。根中,红藜在两种氮供应下,可溶性蛋白含量均随着铁配施浓度的升高而下降。黑藜则恰为相反,在两种氮供应下均在配施Fe3时可溶性蛋白含量最高。叶中,红藜在N1供应下配施铁各浓度间差异不显著(P>0.05)。在N2供应下,配施Fe1时,可溶性蛋白含量显著高于Fe2和Fe3供应(P< 0.05)。黑藜在N1供应下,可溶性蛋白含量随着铁配施浓度的升高而升高。在N2供应下则 相反。
3 讨 论
光合色素含量的高低很大程度上可以反映植物叶片的光合能力和生长状况[14]。氮、铁分别作为植物必需的大量和微量营养元素,其含量影响叶绿素合成。有研究表明,较高氮营养提高大豆[15]和小麦[16]、藜麦[3]的光合速率,但过量施氮将抑制大豆和小麦的光合作用[15-16]。本bS9kNSoCRfuJklzGbxzVcQ==研究中,两种藜麦品种在相同铁供应条件下叶绿素a、叶绿素b、总叶绿素含量均呈现N2>N1。这说明氮供应浓度的升高能提高藜麦叶片中的叶绿素含量。铁不仅影响植物叶绿体结构和叶绿素的合成还在植物光合作用过程中参与其生理生化反应。对一串红[17]和几种作物[18]的研究也表明,较高的铁供应下的叶绿素含量均高于低铁处理。本试验中,低氮供应下适量铁Fe2供应时叶绿素含量高于低铁Fe1供应。本结论与前人的研究结论一致[18],但随着铁浓度的增加,叶绿素含量反而有所下降,可能此时藜麦受到高铁胁迫,抑制叶绿素合成。但在较高氮供应条件(N2)下,即使在Fe3供应下,叶绿素含量仍维持较高的水平。说明添加氮肥,将提高铁肥的利用率。叶绿素a/b 值降低常被认为是植物适应低光环境的一种调控方式。不同藜麦品种间对弱光的适应性有所差异。在N2供应下,黑藜叶绿素a/b 值显著低于红藜麦,说明黑藜麦对弱光环境适应能力更强。
植物在不良的生长环境下,活性氧将在植物体内大量积累导致其膜结构和功能受损。MDA作为胁迫指示物质,其值大小表明植物受胁迫的程度[19]。本研究表明,红黑两种藜麦在同一铁供应下MDA含量呈现N2>N1。说明施氮量的增加,将导致活性氧在其体内过量累积,MDA含量显著增加。不同藜麦品种及各器官在生长过程中对氮铁营养需求不同,其体内的细胞膜脂过氧化反应差异较大。MDA含量在两藜麦品种器官中的分布规律为叶>根。说明在氮铁配施营养逆境胁迫过程中叶片较易受到损伤。红藜麦叶中在两种氮供应条件下,MDA累积量均随着铁供应浓度升高呈现下降的变化趋势。说明低铁环境下将抑制红藜麦生长,提高铁营养配施有助于缓解其缺铁胁迫。黑藜麦根中,在两种氮供应下不同铁配施间MDA含量均呈现Fe2供应时根部氧化损伤最轻;叶中,在两种氮供应下配施Fe2时,MDA含量较高。
抗氧化酶(如,SOD、CAT和APX)在清除植物细胞内的活性氧自由基,防御膜脂过氧化,维持细胞代谢平衡及各生理功能正常发挥起重要作用[20]。SOD的主要作用是将超氧阴离子自由基快速歧化为过氧化氢(H2O2)和分子氧(O2),其活性的增加能够有效清除质膜过氧化物对植物造成的伤害[21]。CAT 是催化过氧化氢分解成氧和水的酶,避免细胞因H2O2累积而产生伤害[22]。APX是植物活性氧代谢中重要的抗氧化酶之一,其活性显著升高,则可使超氧阴离子自由基(O2-)产生速率显著下降,脂质过氧化作用减弱[23]。本研究显示,藜麦在不适的养分供应条件下,过多的活性氧在细胞内累积,各抗氧化酶通过协同作用,清除过剩的自由基,增强其抗逆水平。高氮供应提高了两种藜麦根和叶中SOD和CAT的活性,说明增施氮肥能增强藜麦体内抗氧化酶活性。在不同处理下,各抗氧化酶活性在两种藜麦器官中均呈现叶>根,与MDA含量分布相一致。说明藜麦在营养逆境胁迫过程中,协同各抗氧化酶增强活性,有效缓解膜脂过氧化对叶的伤害。不同藜麦品种及各器官对氮铁营养胁迫生理反应差异较大。根中,黑藜在两种氮供应下均呈现,低铁供应下SOD活性较高,有效增强了黑藜在低铁胁迫下的抗逆能力;红藜在N1供应下,不同铁处理间SOD活性差异不显著;在N2供应下,与黑藜结果一致,Fe1供应时SOD活性最高。CAT活性呈现,红藜在两种氮供应下和黑藜在N2供应下,配施Fe2时活性最高。APX活性呈现,红藜在N1供应下和黑藜在两种氮供应条件下,配施Fe1和Fe3时APX活性较高,由此可见,APX酶在低铁和富集铁环境下,减弱膜细胞过氧化伤害发挥了重要作用。对于叶片,黑藜麦在N1下, CAT、APX、SOD活性在中等铁供应下最高。在N2供应下CAT、APX活性在最高铁供应下(Fe3)活性较高。说明合理配施优化调控氮铁营养供应可显著增强黑藜麦体内的抗氧化酶活性,提高藜麦对外界不良环境的适应能力。红藜麦在两种氮供应条件下随着铁供应浓度的升高SOD、APX活性呈现上升的变化趋势。表明红藜麦在高浓度铁供应环境下,SOD、APX抗氧化酶的生理酶活性调控能力更强。
渗透调节是高等植物应对外界环境胁迫的另一种重要方式,在维持细胞正常的渗透压和膜系统的稳定性、提高植株抗逆性上发挥着重要作用[24]。脯氨酸(Pro)是一种重要的有机渗透调节物质。在逆境条件下,植物体内脯氨酸含量在一定程度上反映了植物的抗逆性[25]。红黑两种藜麦在同一铁供应下脯氨酸含量呈现N2>N1。与MDA含量的变化趋势相同。藜麦在不适的氮供应条件下,通过合成脯氨酸,稳定体内生物大分子结构、降低细胞酸性、解氨毒和调节细胞氧化还原反应,维持其正常生理反应。红藜麦根部在Fe3供应时脯氨酸累积较多,有助于红藜耐高铁环境。黑藜麦在Fe2供应时脯氨酸累积较多,黑藜麦最适宜铁配施浓度为100 μmol·L-1。可溶性糖和可溶性蛋白质也是两种重要的渗透调节物质。可溶性糖是植物碳代谢的主要物质之一,也可标识植物体内碳水化合物的变化情况。在同一供铁条件下,高氮均提高红、黑藜麦的可溶性糖含量,说明氮供应的升高可促进可溶性糖在植物体内累积。可溶性蛋白是以小分子状态溶于水或其他溶剂的蛋白,其含量是衡量植物体正常代谢的一个重要生理指标。藜麦品种间可溶性蛋白质的合成差异较大。红藜麦在低铁Fe1供应下可合成较多的可溶性蛋白质含量,并利用其缓解低铁胁迫伤害。黑藜麦则在高浓度铁供应Fe3时,可溶性蛋白累积量较多。在藜麦氮铁营养胁迫渗透调节过程中可溶性蛋白发挥了重要作用。
综上所述,本试验主要针对滇红土中缺铁现状,利用作物氮铁协同吸收,通过增施氮肥,提高铁肥利用率,从而达到藜麦幼苗健壮生长的目的。综合各生理指标得出,N、Fe营养主效应及交互效应显著。在农业生产过程中,氮肥作为大量肥料,合理增施显著增强藜麦幼苗应对外界不良环境的胁迫能力。Fe营养的吸收利用受N供应水平影响,在N1供应下配施Fe2(100 μmol·L-1)较佳,但在N2供应下配施Fe3(300 μmol·L-1)较宜。红藜麦为缺铁敏感型,适量外源铁供应可提高其抗逆性和生长。黑藜麦则较为耐逆型品种且对弱光环境适应能力更强,可在恶劣环境下生长种植。
参考文献 Reference:
[1] BHARGAVA A,SHUKLA S,OHRI D.Chenopodium quinoa-an Indian perspective[J]. Industrial Crops and Products,2006,23(1):73-87.
[2]NOWAK V,DU J,CHARRONDIERE U R. Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.)[J]. Food Chemistry,2016,193(15):47-54.
[3]翟凤强,蔡志全,鲁建美.施氮量对不同藜麦品种幼苗生长的影响[J].应用生态学报,2020,31(4):1139-1145.
ZHAI F Q,CAI ZH Q,LU J M. Effects of nitrogen application rate on seedling growth of different quinoa varieties[J].Chinese Journal of Applied Ecology,2020,31(4):1139-1145.
[4]ROUT G R,SAHOO S. Role of iron in plant growth and metabolism[J].Reviews in Agricultural Science,2015, 3(1):1-24.
[5]叶义全,洪 凯,张家君,等.一氧化氮调控植物缺铁响应的研究进展[J].生态学杂志,2019,38(9):2840-2849.
YE Y Q,HONG K,ZHANG J J,et al. Research progress in nitric oxide regulation of plant iron deficiency response[J]. Journal of Ecology,2019,38(9):2840-2849.
[6]张妮娜,上官周平,陈 娟.植物应答缺铁胁迫的分子生理机制及其调控[J].植物营养与肥料学报,2018,24(5):1365-1377.
ZHANG N N,SHANGGUANG ZH P,CHEN J. The molecular physiological mechanism and regulation of plant response to iron deficiency stress[J]. Journal of Plant Nutrition and Fertilizer,2018,24(5):1365-1377.
[7]叶宇波,马贵芳,潘瑶瑶,等.低氮胁迫对杉木幼苗生长及生理的影响[J].浙江林业科技,2019,39(6):81-86.
YE Y B,MA G F,PAN Y Y,et al. Effects of low nitrogen stress on growth and physiology of Chinese fir seedlings[J]. Zhejiang Forestry Science and Technology,2019,39(6):81-86.
[8]李俊成,于 慧,杨素欣,等.植物对铁元素吸收的分子调控机制研究进展[J].植物生理学报,2016,52(6):835-842.
LI J CH,YU H,YANG S X,et al. Research progress on the molecular regulation mechanism of iron absorption in plants[J]. Acta Phytophysiology,2016,52(6):835-842.
[9]CHEN Q W,MU X H,CHEN F J,et al. Dynamic change of mineral nutrient content in different plant organs during the grain filling stage in maize grown under contrasting nitrogen supply[J]. European Journal of Agronomy,2016,80:(1) 137-153.
[10] 赵泽群,师赵康,王 雯,等.低氮胁迫对玉米幼苗氮素和蔗糖分配及性状的影响[J].植物营养与肥料学报,2020,26(4):783-796.
ZHAO Z Q,SHI ZH K,WANG W,et al. Effects of low nitrogen stress on the distribution and characteristics of nitrogen and sucrose in maize seedlings[J]. Journal of Plant Nutrition and Fertilizer, 2020,26(4):783-796.
[11]曲志伟.植物实用氮磷钾营养胁迫机理的研究[J].吉林农业,2017,(14):70-70.
QU ZH W. Study on the mechanism of plant practical nitrogen,phosphorus and potassium nutrition stress[J].Jilin Agriculture,2017,7(14):70-70.
[12]史树德,孙亚卿,魏 磊.植物生理学实验指导[M].北京:中国林业出版社,2011.
SHI SH D,SUN Y Q,WEI L. Experimental Guide to Plant Physiology[M]. Beijing:China Forestry Publishing House,2011.
[13]高俊凤.植物生理学试验指导[M].北京:高等教育出版社,2006.
GAO J F.Experimental Guide to Plant Physiology[M]. Beijing:Higher Education Press,2006.
[14]马 玲.岷江上游干旱河谷几种主要灌木光合色素比较研究[D].成都:四川师范大学,2018.
MA L.Comparative study on photosynthetic pigments of several main shrubs in arid valley of upper Minjiang River[D]. Chengdu:Sichuan Normal University,2018.
[15]闫艳红,杨文钰,张新全,等.施氮量对套作大豆花后光合特性、干物质积累及产量的影响[J].草业学报,2011,20(3):233-238.
YAN Y H,YANG W Y,ZHANG X Q,et al. Effects of nitrogen application rate on photosynthetic characteristics,dry matter accumulation and yield of intercropped soybean after anthesis[J]. Acta Prataculturae Sinica,2011,20(3):233-238.
[16]蔡瑞国,张 敏,戴忠民,等.施氮水平对优质小麦旗叶光合特性和子粒生长发育的影响[J].植物营养与肥料学报,2006,12(1):49-55.
CAI R G,ZHANG M,DAI ZH M,et al. Effects of nitrogen application level on flag leaf photosynthetic characteristics and grain growth and development of high-quality wheat[J]. Journal of Plant Nutrition and Fertilizer,2006,12(1):49-55.
[17]张 乐.氮铁营养对一串红生长发育的影响研究[D].北京:北京林业大学,2013.
ZHANG L. Effects of nitrogen and iron nutrition on growth and development of Scarlet[D]. Beijing:Beijing Forestry University,2013.
[18]闫登明.氮素形态和铁营养对几种作物同化过程及体内铁分布的影响[D].陕西杨凌:西北农林科技大学,2008.
YAN D M. Effects of nitrogen form and Iron nutrition on assimilation process and Iron distribution in different crops [D].Yangling Shaanxi:Northwest A&F University,2008.
[19]PARVAIZ A,ABEER H,FATHI A. Role of Trichoderma harzianum in mitigating NaCl stress in Indian mustard (Brassica juncea L.) through antioxidative defense system[J]. Frontiers in Plant Science,2015,6(868):209-253.
[20]白丽丽,李玉龙,巩 健,等.枸杞幼苗对盐胁迫的生理响应[J].农产品加工,2019,478(8):50-56.
BAI L L,LI Y L,GONG J,et al. Physiological response of Lycium barbarum L. seedlings to salt stress[J]. Agricultural Products Processing,2019,(8):50-56.
[21]GILL S S,TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[22]崔江慧,李 霄,常金华.PEG模拟干旱胁迫对高粱幼苗生理特性的影响[J].中国农学通报,2011,27(9):160-165.
CUI J H,LI X,CHANG J H. Biochemical characteristics in sorghum seedlings under PEG simulated drought stress [J].Chinese Agricultural Science Bulletin,2011,27(9):160-165.
[23]JARDIM D,CAVERZAN A,RAUBER R. Thylakoidal APX modulates hydrogen peroxide content and stomatal closure in rice (Oryza sativa L.)[J]. Environmental and Experimental Botany,2018,150(3):46-56.
[24]王贺正,于三全,沈思涵,等.脱落酸对PEG胁迫下小麦幼苗渗透调节物质和抗氧化性的影响[J].作物研究,2020,34(4):315-319.
WANG H ZH,YU S Q,SHEN S H,et al. Effects of abscisic acid on osmotic adjustment substances and antioxidant capacity of wheat seedlings under PEG stress[J]. Crop Research,2020,34(4):315-319.
[25]梁 玲,江洁蓓,张腾驹,等.不同色彩珙桐苞片与叶片的生理特性研究[J].植物研究,2020,40(4):505-513.
LIANG L,JIANG J B,ZHANG T G,et al. Physiological characteristics of Davidia involucrata bracts and leaves with different colors[J]. Plant Research,2020,40(4):505-513.
Response of Physiological and Biochemical Traits in Seedlings of Two
Dominant Quinoa Cultivars to Nitrogen and Iron Nutrition
BAI Lili1,2, HU Huawei1,ZHOU Huakun3,4, WANG Shixiong1,4 and WANG Wenying1,5
(1.Qinghai Normal University, Xining 810016, China;2.Xinjiang Acadeny of Forestry Science,Urumqi 830046,China;
3.Academy of Plateau Science and Sustainability,Xining 810016, China; 4.Northwest Institute of Plateau Biology,
Chinese Academy of Sciences, Xining 810008, China; 5.Qinghai Provincial Key Laboratory of Biodiversity
Formation Mechanism and Comprehensive Utilization in Qinghai Tibetan Plateau, Xining 810016, China)
Abstract Two dominant quinoa cultivars (red and black) were selected for this study. Physiological and biochemical traits of quinoa seedlings were analyzed under the combined treatments of two nitrogen levels (N1: 4 mmol·L-1; N2: 12 mmol·L-1) and three iron levels (Fe1: 10 μmol·L-1; Fe2: 100 μmol·L-1 and Fe3: 300 μmol·L-1). The analysis provides theoretical references for the appropriate supplementation of nitrogen and iron in the growth of different quinoa cultivars. The results showed that (1) plant biomass of red quinoa exceeded that of black quinoa. The total chlorophyll content in both quinoa cultivars was the highest in Fe2 under N1 supply conditions, but under N2 supply conditions, it was the highest in Fe3. (2) The content of malondialdehyde (MDA) in leaves was higher than that in roots. The MDA content, superoxide dismutase (SOD) and catalase (CAT) activities in both quinoa cultivars were higher under N2 than N1 conditions with the same iron supply.Under both N conditions, the MDA content of leaves was highest in Fe1 condition in red quinoa, while was highest in Fe2 condition in black quinoa. Regarding antioxidant enzyme activities in leaves, SOD and APX activities of red quinoa were the strongest when treated with Fe3 under both N conditions.For black quinoa,the activities of CAT, ascorbate peroxidase (APX) and SOD were highest under Fe2, followed by Fe3, and then Fe1 under N1 conditions. The activities of CAT and APX were the highest when Fe3 was combined with N2 supply. (3) The content of proline, soluble sugar, and soluble protein of two quinoa were higher under N2 than N1 conditions with the same iron supply.Under the nitrogen conditions,red quinoa accumulated more proline under Fe3 treatment, while black quinoa had the highest accumulation under Fe2. Under both two nitrogen conditions, red quinoa had the highest soluble protein content under Fe1 treatment, while black quinoa had the highest under Fe3 treatment.In conclusion, red quinoa demonstrates sensitivity and black quinoa exhibits resistance to iron deficiency. For optimal growth during the seedling stage, it is recommended to apply Fe2 under N1 supply conditions and Fe3 under N2 supply conditions.
Key words Chenopodium quinoa; Seedlings; Nitrogen nutrition; Iron nutrition; Physiological and biochemical traits
Received 2023-04-09 Returned 2023-07-23
Foundation item 2021 First Batch of Funds for Central Forest and Grassland Ecological Protection and Restoration for Natural Resource Survey and Monitoring Project(No.QHXH-2021-017); 2021 First Batch of Special Fund forBOic1fGUWeIXsHitCOyzoA== Central Government to Guide Local Science and Technology Develoment(No.2021ZY002).
First author BAI Lili, female, doctoral student. Research area:plant resistance physiology. E-mail:2534061194@qq.com
Corresponding author WANG Wenying, female, professor. Research area:grassland ecology. E-mail:wangwy0106@163.com
(责任编辑:成 敏 Responsible editor:CHENG Min)
基金项目:2021年第一批中央林草生态保护恢复资金自然资源调查监测项目(QHXH-2021-017);青海省2021年度第一批中央引导地方科技发展专项资金(2021ZY002)。
第一作者:白丽丽,女,博士研究生,研究方向为植物抗逆生理学。E-mail:2534061194@qq.com
通信作者:王文颖,女,教授,研究方向为草地生态学。E-mail:wangwy0106@163.com

