姜黄素、β-胡萝卜素对太湖猪精液常温保存效果的影响
摘 要:为了探究不同类别的植物源性抗氧化剂对太湖猪精液常温保存效果的影响,选取了姜黄素、β-胡萝卜素两种常见的抗氧化剂,分别以不同浓度(姜黄素:0、3、6、9µg·mL−1;β-胡萝卜素:0、10、20、40µg·mL−1)添加到太湖猪精液稀释液中,采用目测法、低渗肿胀法和瑞氏-吉姆萨染色法检测精子在17℃保存环境中第1、3、5、7d的活力、质膜完整率和顶体完整率。结果表明:添加一定浓度的姜黄素、β-胡萝卜素均能显著提高精子质量,其中姜黄素的最适添加浓度为6µg·mL−1,β-胡萝卜素的最适添加浓度为20µg·mL−1。
关键词:猪精液;常温保存;姜黄素;β-胡萝卜素
中图分类号:S828 文献标志码:A 文章编号:0253−2301(2024)07−0021−05
DOI: 10.13651/j.cnki.fjnykj.2024.07.004
Influence of Curcumin and β-Carotene on the Preservation Effect of Taihu Pig Semenat Room Temperature
QIYa-dong, LIANGJia-wen,HOUZhen-ye,FENGYu-chen,ZHAOXiao-jie,WUYi,WUJie-ge, LIUJing-ge
(College of Animal Science and Food Engineering, Jinling Institute of Technology, Nanjing, Jiangsu 210000, China)
Abstract:InordertoexploretheeffectofdifferenttypesofphytogenicantioxidantsonthepreservationofTaihupigsemenatroomtemperature,thetwocommonlyusedantioxidants,curcuminandβ-carotene,wereselected.Theywereaddedatdifferentconcentrations(curcumin:0,3,6,9µg·mL;β-carotene:0,10,20,40µg·mL)tothesemendiluentofTaihupig.Thespermvitality,plasmamembraneintegrityrateandacrosomeintegrityrateweredetectedbyusingthevisualobservation,hypotonicswellingmethodandWright-Giemsastainingmethodonthe1st,3rd,5thand7thdayofpreservationat17°C.Theresultsshowedthattheadditionofcertainconcentrationsofcurcuminandβ-carotenecouldsignificantlyimprovethespermquality,withtheoptimalconcentrationsbeing6µg·mLforcurcuminand20µg·mLforβ-carotene.
Key words: Pigsemen;Roomtemperaturepreservation;Curcumin;β-carotene
猪精液的保存技术是现代畜牧生产中重要的实用技术之一。现有的猪精液保存技术包括常温保存、低温保存和冷冻保存。其中,常温保存所需的设备简单,生产成本更低,更容易普及和推广。在猪精液的常温保存中,精液质量易受多方面因素的影响,如温度、pH、渗透压、稀释倍数、抗氧化水平、微生物等[1],其中精液中过量的活性氧(ROS)会对精子质量造成很大影响,不但降低精子的活力,还会使精子DNA链断裂,影响其受精能力[2]。因此,在保存过程中抑制氧化应激对维持精子的活力至关重要。在稀释液中添加一定的抗氧化物质有助于提高精液的抗氧化水平,降低因活性氧自由基累积造成的精液品质下降,从而延长精液的保存时间[3]。
植物性提取物具有良好的抗氧化能力,可以降低体外保存过程中精子的氧化应激损伤,抑制精子膜的脂质过氧化,对精子的结构与功能具有保护作用[4−5]。尽管现有的研究结果表明植物源性抗氧化剂普遍能够提升常温保存下猪精液的品质[6−8],但由于不同试验中所采集到的精液品质难免有所差异,难以对不同植物源性抗氧化剂的作用效果进行横向比较。
本试验选取姜黄素和β-胡萝卜素两种不同植物源性的抗氧化剂,分别以不同的浓度加入到太湖猪精液稀释液中,通过检测常温下精子在第1、3、5、7d的活力、质膜完整率和顶体完整率,评价两种植物源性抗氧化剂对猪精液常温保存效果的影响,从而筛选出能够应用到生产实践中更安全、更有效的抗氧化剂,为猪精液常温保存过程中抗氧化剂的选择提供参考。
1 材料与方法
1.1试验材料
1.1.1主要试剂 姜黄素、β-胡萝卜素标准品购于Rhawn公司,以少量DMSO助溶配制为1µg·mL−1母液;低渗液由0.735g柠檬酸钠和1.35g果糖溶解至100mL超纯水配合而成;快速瑞氏-姬姆萨复合染色液购自Phygene公司,商品稀释粉为法国大欧公司产品。
1.1.2猪精液的采集与处理 精液取自南京竹顺生物技术有限公司猪场的8头健康太湖猪,由猪场工作人员用手握法采集,并对其颜色、体积、pH、气味以及活力进行检查。新鲜采集的精子活力大于70%、畸形率小于20%、无异味、色泽为乳白色方为合格[9]。将检测合格的精液分装到干净的EP管中,等温梯度稀释9倍。将处理好的精液放入17℃恒温箱中,每隔12h颠倒混匀1次,以防精子沉积。
1.2试验方法
1.2.1试验设计 试验于2024年1月中旬进行,以不添加抗氧化剂的精液稀释液为对照组,设置6个试验组,使最终精液稀释液中分别含3、6、9
µg·mL的姜黄素和10、20、40µg·mL−1的β-胡萝卜素。每组设置3个重复,并分别在第1、3、5、7d对精子的活力、质膜完整率、顶体完整率进行测定。
1.2.2活力检测 精子的活力采用目测法进行检测。在显微镜下观察精液稀释液中呈直线运动的精子数量,并计算其占总精子数的百分比。
1.2.3质膜完整率 质膜完整率用低渗肿胀法检测。将100μL精液稀释液添加到1mL低渗液中充分混匀,37℃水浴30min。取20μL混合液滴于载玻片上,拉薄,在显微镜下观察清晰视野中弯尾精子的数量,并计算其占总精子数的百分比。
1.2.4顶体完整率 用快速瑞氏-姬姆萨复合染液对经70%乙醇固定的精子进行染色,待干燥后观察头部被染成红色的精子数量,并计算其占总精子数的百分比。
1.2.5数据处理 试验数据使用Excel2021和SPSS27.0进行统计分析。
2 结果与分析
2.1姜黄素对太湖猪精液常温保存效果的作用
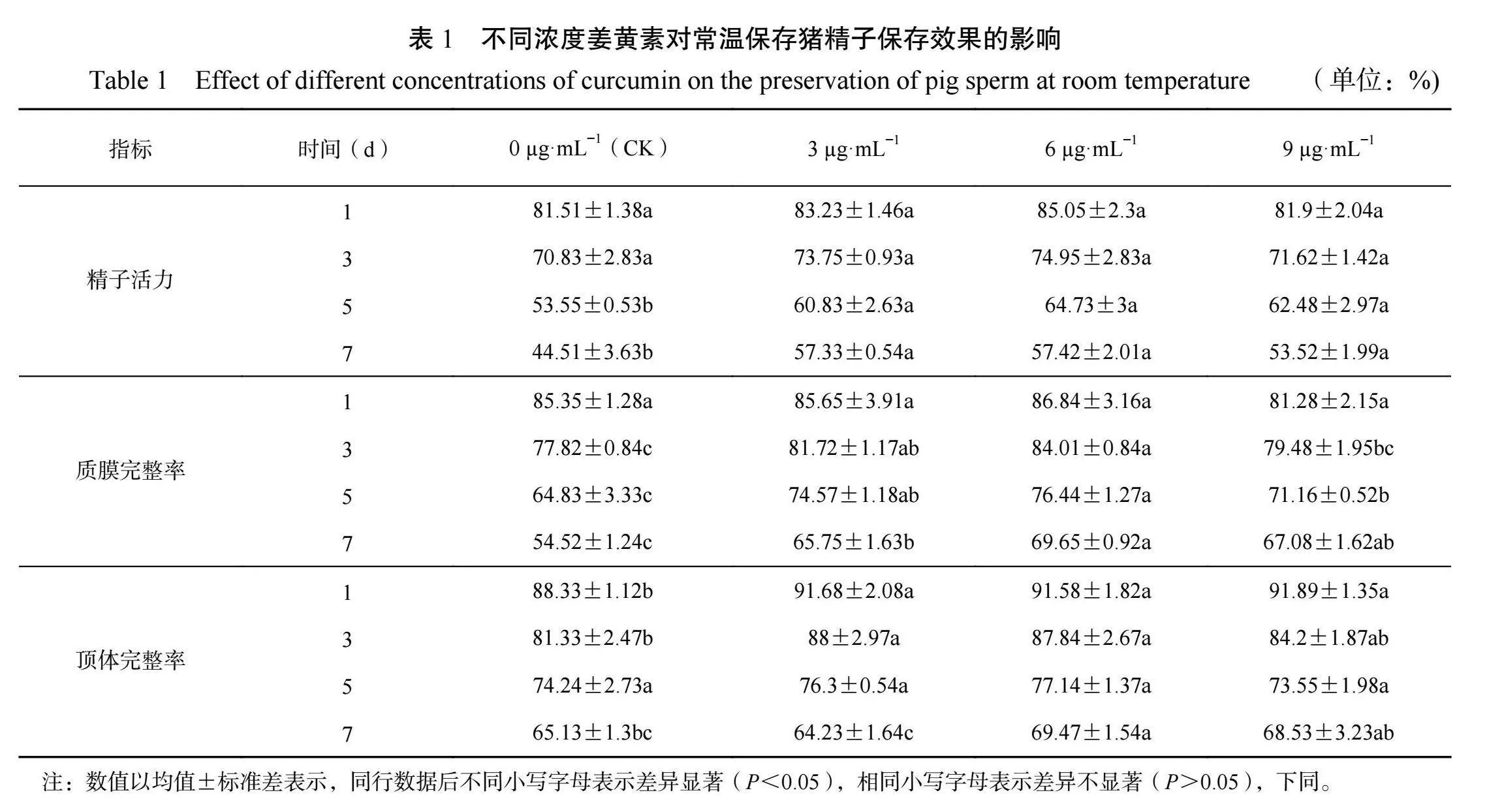
由表1可知,在常温保存第1~3d,3个试验组的精子活力均高于对照组,但差异不显著(P>0.05)。在常温保存第5~7d,3个试验组的精子活力显著高于对照组(P<0.05)。
在常温保存第1d时,3µg·mL−1和6µg·mL−1姜黄素添加组的质膜完整率高于对照组,而9µg·mL姜黄素添加组的质膜完整率低于对照组,但差异均不显著(P>0.05)。在保存第3d时,3个试验组的质膜完整率均高于对照组,其中3µg·mL和6µg·mL−1姜黄素添加组与对照组之间差异显著(P<0.05)。在常温保存第5~7d时,3个试验组的质膜完整率均显著高于对照组(P<0.05),其中6µg·mL−1姜黄素添加组的质膜完整率最高。
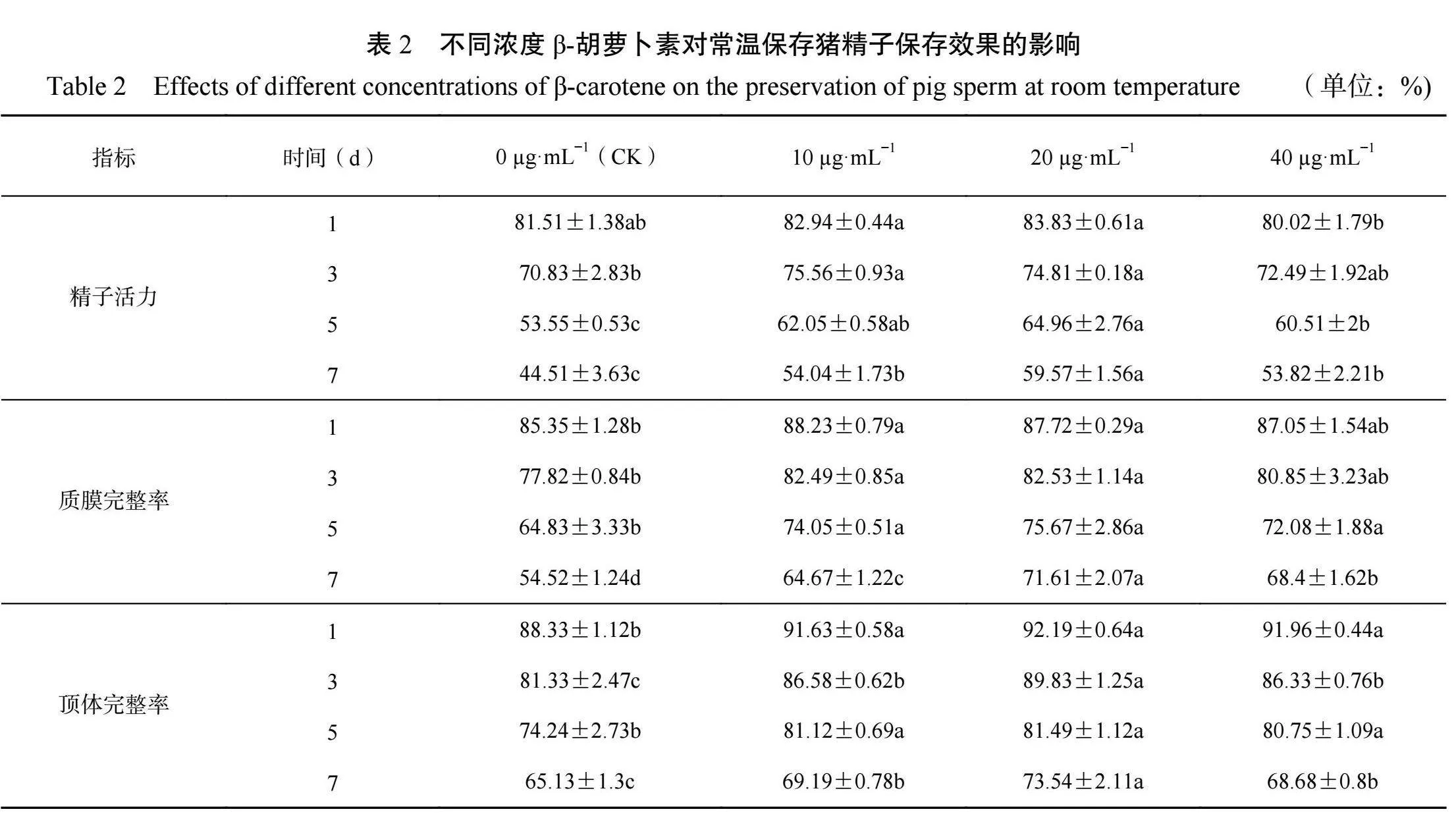
在常温保存第1d时,3个试验组的顶体完整率均显著高于对照组(P<0.05)。在常温保存第3d时,3个试验组的顶体完整率均高于对照组,但9µg·mL姜黄素添加组与对照组相比没有显著差异(P>0.05)。在常温保存第5d时,各组精子的顶体完整率无显著差异(P>0.05)。在保存第7d时,6µg·mL−1姜黄素添加组的顶体完整率高于对照组和3µg·mL−1姜黄素添加组(P<0.05),和9µg·mL姜黄素添加组无显著差异(P>0.05)。2.2β-胡萝卜素对猪精液常温保存效果的影响由表2可知,在常温保存第1 d时,10µg·mL和20µg·mL−1β-胡萝卜素添加组的精子活力高于对照组,但差异不显著(P>0.05)。在常温保存第3d时,10µg·mL−1和20µg·mL−1β-胡萝卜素添加组的精子活力显著高于对照组(P<0.05),但与40µg·mL−1β-胡萝卜素添加组无显著差异(P>0.05)。在常温保存第5 d时,20µg·mLβ-胡萝卜素添加组的精子活力显著高于对照组和40µg·mL−1β-胡萝卜素添加组,但与10µg·mLβ-胡萝卜素添加组无显著差异(P>0.05)。在常温保存第7d时,20µg·mL−1β-胡萝卜素添加组的精子活力显著高于其他各组(P<0.05)。
在常温保存第1~3d时,10µg·mL−1和20µg·mLβ-胡萝卜素添加组的精子质膜完整率显著高于对照组(P<0.05),但与40µg·mL−1β-胡萝卜素添加组无显著差异(P>0.05)。在常温保存第5d时,3个试验组的质膜完整率均显著高于对照组(P<0.05)。在常温保存第7d,20µg·mL−1β-胡萝卜素添加组的精子质膜完整率显著高于其他各组(P<0.05)。
在常温保存第1d和第5d时,3个试验组的顶体完整率均显著高于对照组(P<0.05)。在常温保存第3d和第7d时,20µg·mL−1β-胡萝卜素添加组的顶体完整率显著高于其他各组(P<0.05)。
3 讨论与结论
姜黄素是从郁金、姜黄、菖蒲、莪术等植物根茎中提取出来的一种植物多酚,化学性质活泼,生理活性广泛,具有较好的抗炎、抗菌和抗氧化性能[10]。多年来广泛用于食品、化妆品和医疗行业[11−12]。龚琴琴[13]研究表明:低浓度姜黄素可以降低ROS含量、抗脂质过氧化物的产生,对人精子DNA具有明显的保护作用,而高浓度的姜黄素则会促进ROS形成,从而破坏精子结构。杨金风[14]研究表明,姜黄素能显著降低脂质过氧化,提高睾丸组织抗氧化水平,显著改善环磷酰胺对小鼠睾丸的有害作用。这些结果表明,姜黄素通过清除活性氧和增强内源性抗氧化系统的活性,在体外保护细胞免受氧化应激损伤,并降低细胞氧化应激。牛统娟[15]在研究活性氧对常温保存猪精子的抗凋亡作用的研究中,测定了姜黄素对常温保存猪精子活力的影响,结果表明稀释液中添加15μmol·mL姜黄素和能够显著提高猪精子活力,与本试验结果类似。但本试验中并未出现在高处理浓度中活力远低于对照组的情况,可能的原因是本试验中精液稀释比高于常规猪精液稀释倍数,减轻了高浓度姜黄素对精子产生的不利影响。
β-胡萝卜素是维生素A最重要的来源之一,广泛地存在于各类植物性食品中。哺乳动物不能自主合成类胡萝卜素,需要从食物中摄入。类胡萝卜素对雄性生殖功能和精子发生有诸多重要的影响[16]。Ma等[17]研究表明β-胡萝卜素显著提高了白消安处理后的小鼠精子浓度和活力,提高了精子生成相关的多个基因(如VASA、SYCP3、PGK2等)和蛋
白质PIWIL1的表达水平,提高了睾丸中的抗氧化酶活性(SOD、GPX1、CAT)和总抗氧化能力,从而减少了白消安引起的氧化应激和细胞凋亡。此外,越来越多的试验证实了类胡萝卜素的抗氧化能力同样能对冷冻精液的保存起到积极作用[18−19]。本试验结果表明稀释液中添加一定浓度的β-胡萝卜素能有效延长猪精液的常温保存效果。在常温保存7d时,猪精子的活力、质膜完整率、顶体完整率相较于对照组均有显著提升,其中添加20µg·mL的试验组效果最好,3个指标相比对照组均有显著的提升。
姜黄素的抗氧化能力源于两个邻甲氧基酚性羟基,β-胡萝卜素的抗氧化能力源于其多共轭多烯、多烯链的结构和官能团(特别是共轭碳基)[20]。过量的ROS可以和蛋白质、DNA以及不饱和脂肪酸发生作用,对精子造成多种氧化损伤,如质膜损伤、DNA完整性损伤、精子细胞凋亡、活力及运动能力下降等[21]。将姜黄素和β-胡萝卜素添加到精液稀释液中,去除了冗余的ROS,提升了常温下精液的保存效果。
本研究结果表明,添加一定浓度的姜黄素和β-胡萝卜素均有助于维持精子的活力、质膜完整率和顶体完整率。其中,姜黄素的最适添加浓度为6µg·mL、β-胡萝卜素的最适添加浓度为20µg·mL−1。在保存效果方面,最适浓度下β-胡萝卜素添加组精子的活力和质膜完整率与姜黄素添加组相似,顶体完整率略高于姜黄素添加组,但所需处理的浓度远高于姜黄素组。本试验中所购得的β-胡萝卜素的价格是姜黄素的3倍,综合分析,常温保存的猪精液中添加6µg·mL−1的姜黄素性价比更高。
参考文献:
[1]李井春,李琦,王硕,等.浅析猪精液常温保存技术的研究现状[J].猪业科学,2020,37(6):50−53.
[2] YAMEI H, JIANHONG H, WEIJUN P, et al. Astaxanthin improves preserved semen quality at 17℃ by enhancing sperm antioxidant and motility properties[J]. Reproduction in domestic animals,2022,57(10):1187−1197.
[ 3] CASTRO C D S, COTRIM C F C, SANTOS I R D, et al. Application of natural antioxidants in animal reproduction[ J] . Ciência Animal Brasileira,2022,23:e−73601E.
[ 4] KOWALCZYKA.Theroleofthenaturalantioxidantmechanisminsperm cells[ J] . Reproductive sciences, 2022, 29( 5): 1387−1394.
[ 5]田淑娟,刘欣宇,贾永宏,等.猪精液常温保存抗氧化剂研究进 展[J].畜牧兽医杂志,2021,40(6):138−139,142.
[ 6] 石武.壳聚糖、庆大霉素和维生素 C 对猪精液常温保存效果的研 究[D].杨凌:西北农林科技大学,2020.
[ 7] 张凌蛟.表没食子儿茶素没食子酸酯对猪精液常温保存效果的研 究[D].杨凌:西北农林科技大学,2020.
[ 8] 裴一飞.不同类型抗氧化剂对冷冻保存猪精子的保护作用[D]. 杨凌:西北农林科技大学,2019.
[ 9] 国家市场监督管理总局;国家标准化管理委员会.猪常温精液生产 与保存技术规范:GB/T25172—2020[S].北京:中国标准出版 社,2020.
[ 10] 华正昌,童雨翠,程强,等.姜黄素的生理活性及其在畜禽领域 的研究进展[J].饲料工业,2022,43(03):35−40.
[ 11] JIK,WEIJ,FANZ,etal.Preservative EffectsofCurcuminon SemenofHuSheep[J].Animals,2024,14(6):947.
[ 12] CHANAPIWAT P, KAEOKET K. The effect of Curcuma longa extracted ( curcumin) on the quality of cryopreserved boar semen[J].Animal Science Journal,2015,86(9):863−868.
[ 13] 龚琴琴.姜黄素对活性氧所致精子 DNA 损伤的保护作用[D]. 武汉:湖北中医药大学,2014.
[ 14] 杨金凤.姜黄素抑制环磷酰胺所致小鼠生殖损伤及睾丸氧化应 激[D].南充:川北医学院,2016.
[ 15]牛统娟.常温保存过程活性氧诱导猪精子凋亡的研究[D].杨 凌:西北农林科技大学,2021.
[ 16] PASQUARIELLOR,ANIPCHENKOP,PENNAROSSAG,etal. Carotenoidsinfemaleandmalereproduction[J].Phytochemistry, 2022,204:113459.
[ 17] MA D, HAN P, SONG M, et al. β-carotene Rescues Busulfan Disrupted Spermatogenesis Through Elevation in Testicular Antioxidant Capability[ J] . Frontiers in Pharmacology, 2021, 12:593953.
[ 18] BUCAKMN,ATAMANMB,BASPINARN,etal.Lycopene and resveratrol improve post-thaw bull sperm parameters: sperm motility, mitochondrial activity and DNA integrity[ J] . Andrologia,2015,47(5):545−552.
[ 19] 胡晓辰.α-硫辛酸、β-胡萝卜素及两种维生素对猪精子冷冻保存效 果的影响[D].杨凌:西北农林科技大学,2014.
[ 20] NISHINO A, YASUI H, MAOKA T. Reaction and Scavenging Mechanism of β-Carotene and Zeaxanthin with Reactive Oxygen Species[J].Journal of Oleo Science,2017,66(1):77−84.
[ 21] 刘鹤洁,吉木斯,谢望为,等.活性氧对精子氧化损伤及获能影 响的研究进展[J].黑龙江畜牧兽医,2023(24):31−34,56.
(责任编辑:柯文辉)

