PD-L1高表达伴EGFR与KRAS共突变晚期肺肉瘤样癌1例并文献复习
[摘要]目的探讨程序性死亡配体-1(PD-L1)高表达伴表皮生长因子受体(EGFR)与Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)共突变肺肉瘤样癌(PSC)的诊断和治疗。
方法回顾性分析1例PD-L1高表达伴EGFR与KRAS共突变的晚期PSC病人,结合相关的文献复习,总结其诊治经过及治疗经验。
结果病人经化疗、放疗、免疫治疗和靶向治疗等综合治疗,病情得到有效控制,总生存期已达29个月。
结论晚期PSC具有显著的异质性,综合治疗可为病人带来更好的生存获益,而肿瘤组织的动态基因检测有助于指导治疗药物的选择。基于多重荧光免疫组织化学检测的肿瘤微环境分型对免疫治疗效果的预测作用有待进一步验证。
[关键词]癌,非小细胞肺;B7-H1抗原;ErbB受体;基因,ras;突变;基因检测;治疗结果;病例报告
[中图分类号]R730.26
[文献标志码]B
[文章编号]2096-5532(2024)04-0615-04
doi:10.11712/jms.2096-5532.2024.60.129
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.R.20240919.1017.002;2024-09-1918:00:38
Advanced pulmonary sarcomatoid carcinoma with a high expression level of programmed death-ligand 1 and co-mutation of EGFR and KRAS: A case report and literature review
LIANG Yanan, YU Zhuang, FENG Lingxin, QI Qi, WANG Jing
(Department of Oncology, The Affiliated Hospital of Qingdao University, Qingdao 266000, China)
; [Abstract]ObjectiveTo investigate the diagnosis and treatment of pulmonary sarcomatoid carcinoma (PSC) with a high expression level of programmed death-ligand 1 (PD-L1) and co-mutation of epidermal growth factor receptor (EGFR) and Kirsten Rat Sarcoma Viral Oncogene Homolog (KRAS).
MethodsA retrospective analysis was performed for one patient with advanced PSC with a high expression level of PD-L1 and co-mutation of EGFR and KRAS, and a literature review was performed to summarize the diagnosis and treatment of the patient and related treatment experience.
ResultsThe condition of the patient was effectively controlled after multimodality therapy including chemotherapy, radiotherapy, immunotherapy, and targeted therapy, and the overall survival time had reached 29 months.
ConclusionAdvanced PSC has significant heterogeneity, and multimodality therapy can bring better survival benefits to patients. Dynamic gene detection of tumor tissue can guide the selection of therapeutic agents. Further studies are needed to verify the value of tumor microenvironment typing based on tumor multiple fluorescent immunohistochemical assay in predicting the efficacy of immunotherapy.
[Key words]carcinoma, non-small-cell lung; B7-H1 antigen;ErbB receptors; genes, ras; mutation; genetic testing; treatment outcome; case reports
已知肺肉瘤样癌(PSC)是一种侵袭性非小细胞肺癌(NSCLC),占所有肺部恶性肿瘤的0.1%~0.4%,预后较差[1]。大多数病人确诊时已是晚期,手术机会少,对放化疗也不敏感。延长病人的生存时间已成为一大挑战[2]。程序性死亡配体-1(PD-L1)在PSC中的阳性表达率超过50%,且与免疫治疗的疗效呈正相关[3]。信迪利单抗和替雷利珠单抗是抗程序性细胞死亡蛋白1(PD-1)的单克隆抗体,对PSC有明确疗效[4-5]。PSC存在不同的突变基因,例如表皮生长因子受体(EGFR)、Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)和间充质上皮转化因子(MET)等,其中EGFR-KRAS是最常见的共突变基因,约占NSCLC突变基因的30%[2,6-8]。本文报告1例PD-L1高表达伴EGFR与KRAS突变的晚期PSC病人,该病人经过多线、不同机制的抗肿瘤药物治疗,取得了满意的疗效。
1病例报告
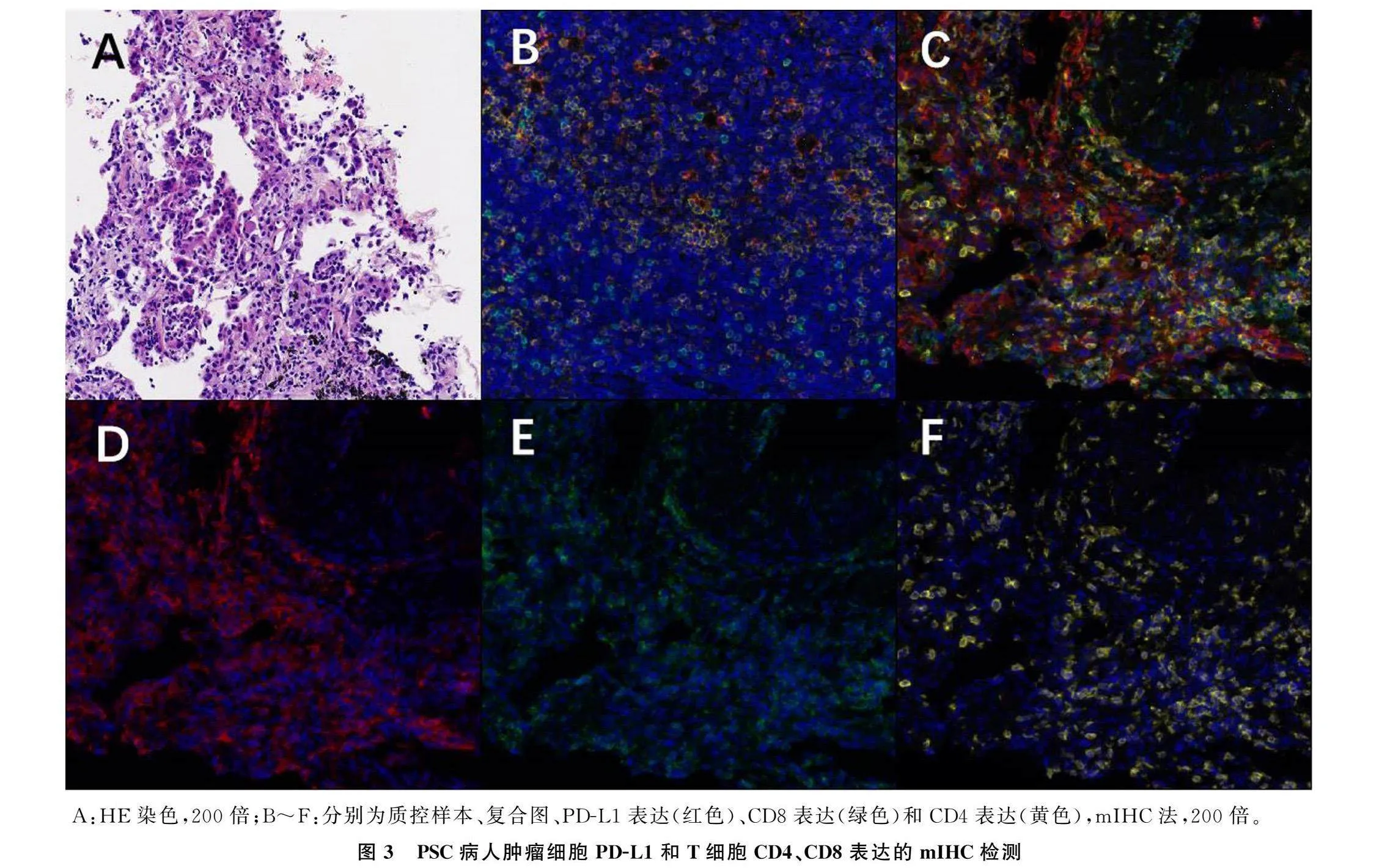
病人,女性,64岁,因“左侧胸痛”于2021年7月1日就诊于青岛大学附属医院肿瘤科。病人疼痛数字评定量表(NRS)评分为2分,美国东部肿瘤协作组(ECOG)体力状况分级为1分,胸部CT显示左肺部近纵隔侧占位性病变(大小71.7 mm×16.4 mm),同侧纵隔淋巴结肿大(图1A~C)。CT引导下肺穿刺活检病理诊断为肉瘤样癌。免疫组化检查:广谱细胞角蛋白(CKpan)(+),钙视网膜蛋白(Calretinin)(-),WT-1(-),CK5/6(-),甲状腺转录因子-1(TTF-1)(-),胃酶样天冬氨酸蛋白酶(NapsinA)(-),P40(-),CD56(-),癌胚抗原(CEA)(-),MOC-31(-),葡萄糖转运蛋白1(GLUT1)(+),婆罗双树样基因4(SALL4)(-),波形蛋白(Vimentin)(+),PD-L1阳性表达率为70%(图2A~F)。完善影像学检查,明确分期为cT4N3M1a,ⅣB期(TNM分期,肺癌AJCC第8版)。病人初诊时未行基因检测。
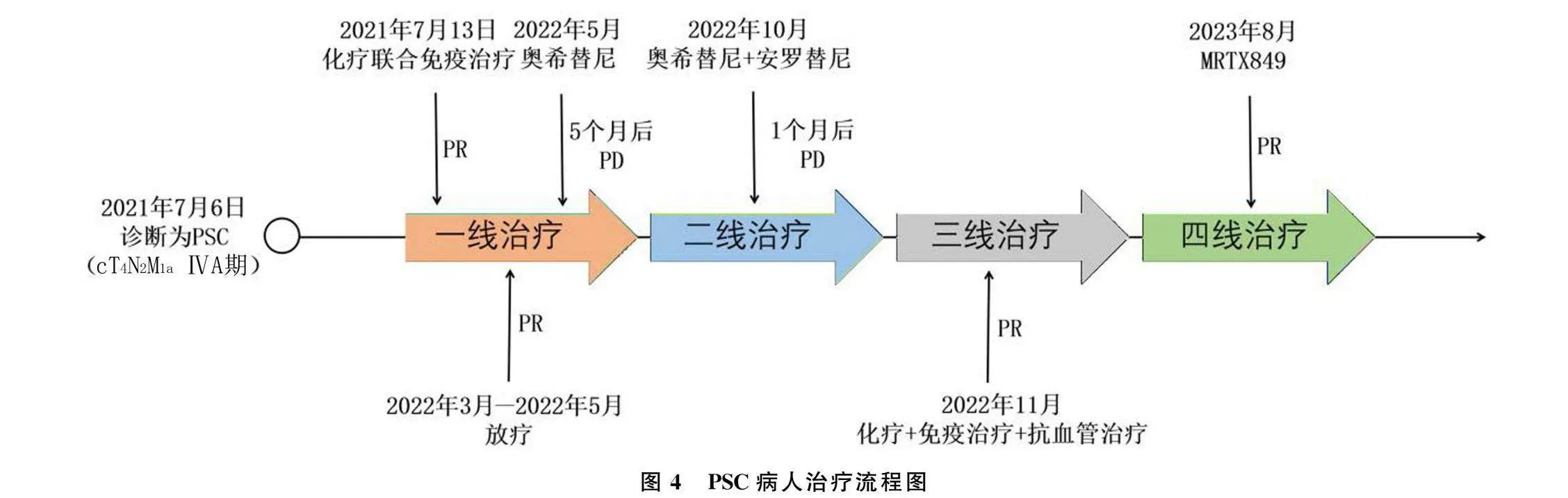
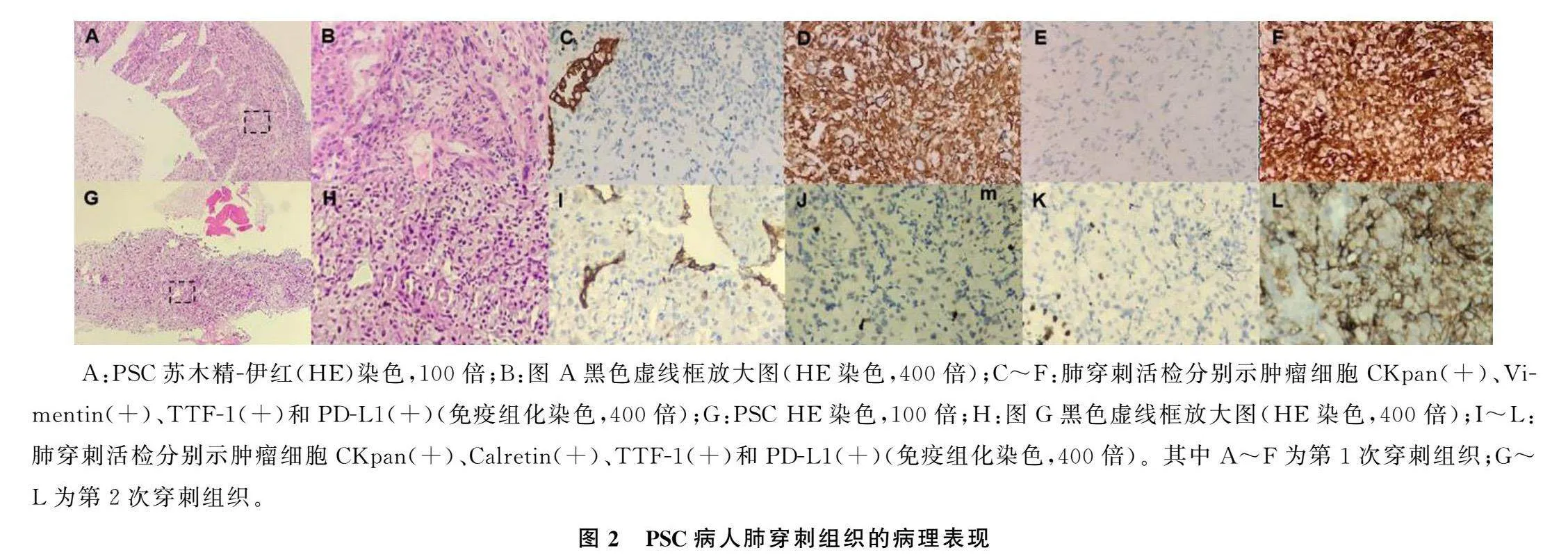
2021年7月13日,病人开始接受顺铂(75 mg/m2,第1天,每3周1次)、白蛋白紫杉醇(240 mg/m2,第1、8天,每3周1次)和信迪利单抗(200 mg,第1天,每3周1次)的一线治疗,6个周期后改为信迪利单抗维持治疗。最佳疗效为部分缓解(PR)(图1D~F)。后因病人出现心悸和甲状腺功能异常等不良反应,停用信迪利单抗。为进一步巩固治疗,2022年2月4日—3月14日,对残余病灶进行了局部放疗(6 MV X线,IMRT),PTV 4760 cGy/28f,PGTV 5880 cGy/28f,常规分割。放疗结束2个月后,即于2022年5月进行了复查,疗效评价仍为PR(图1G~I)。
为了进一步治疗,病人按照医生建议对穿刺的肿瘤组织进行了基因检测,检测结果显示,病人存在EGFR 19Del突变和KRAS Exon2 G12C突变(ARMS-PCR法),并接受了EGFR-TKI药物奥西替尼(80 mg,每日1次)治疗。期间复查病灶稳定。治疗约5个月后,病人于2022年10月17日复查CT,发现双肺上叶出现新发结节,左侧肾上腺出现转移灶(图1J~L),肿瘤疗效评估为疾病进展(PD)。随后行奥希替尼联合安罗替尼治疗(10 mg,每日1次),治疗1个月后复查CT,疗效评价为PD(图1M~O)。
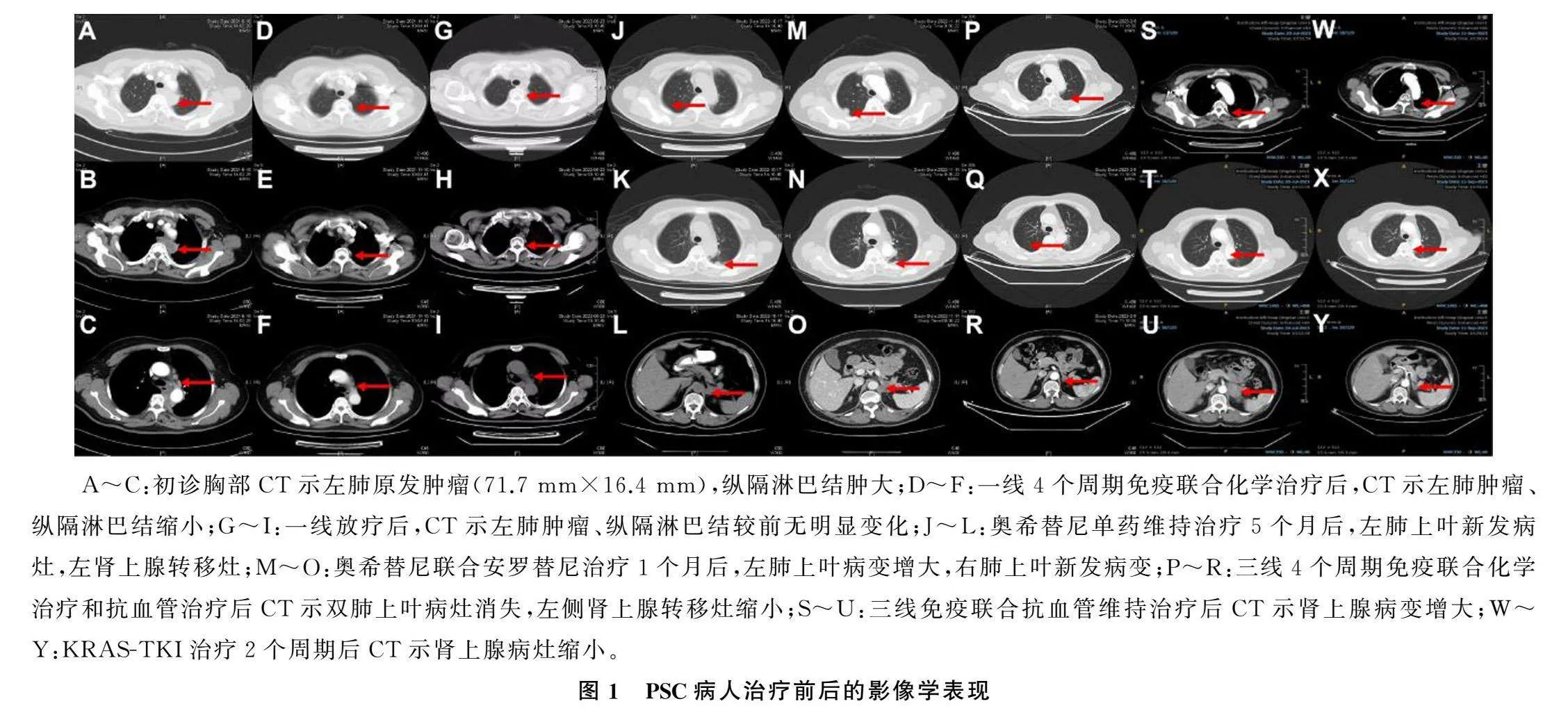
为明确病理类型有无转化和基因改变,对病人右肺上叶病灶进行了第2次活检,病理仍为肉瘤样癌(图2G~L);基因检测结果显示,KRAS Exon2 G12C突变仍然存在,丰度为45.2%,未检测到EGFR基因突变,新增了p53基因突变,肿瘤突变负荷(TMB)为5.67 Muts/Mb(二代测序)。采用多重荧光免疫组织化学(mIHC)技术评估病人肿瘤微环境状态,病人分型为Ⅳ型(PD-L1+肿瘤细胞的阳性率为10.07%,CD8+T细胞浸润率为3.26%,CD4+T细胞浸润率为2.34%)。见图3。
根据上述基因检测和mIHC结果,决定重启免疫治疗并联合应用贝伐珠单抗和单药白蛋白紫杉醇,4个周期后停用白蛋白紫杉醇(图1P~R),继续维持免疫治疗联合抗血管治疗。治疗从2022年11月开始,共持续了10个月,最佳疗效为PR。此后,病人出现腰痛并进行性加重,复查显示肾上腺病灶增大(图1S~U)。
病人于2023年8月1日进入临床试验中,并且开始接受KRAS G12C小分子靶向抑制剂MRTX849(adagrasib)600 mg、每日2次的四线治疗。治疗2个周期,肾上腺病灶缩小了50%,疗效为PR(图1W~Y)。
2023年11月,病人病灶呈持续PR状态,背痛完全缓解,生活状况良好。见图4。
2讨论
PSC是一种罕见的低分化肺部恶性肿瘤,5年生存率仅为24.5%[9]。既往大多数研究显示,PSC对化疗不敏感。与化疗相比,化疗联合免疫治疗可明显延长病人的生存期[10]。本文病人经一线免疫治疗联合化疗也取得了满意疗效。在病情进展后的第2次活检中,虽然PD-L1表达率从70%降至10%,但重启免疫治疗依然有效。另外,放疗对PSC的治疗效果不佳。但LIANG等[11]分析了SEER数据库中1 723例病人的生存相关治疗因素发现,放疗组与未经特殊治疗组的2年总生存率(OS)分别为9.1%和5.4%,提示放疗显著改善了不宜手术的Ⅰ~Ⅲ期PSC病人的OS。本文病人经放疗有效地治疗了原发病灶,并维持了缓解状态。
PSC病人的基因突变并不少见。与其他类型的NSCLC一样,对这类病人应进行基因检测以指导治疗。PSC病人的EGFR突变率为8.8%~25.0%,而KRAS突变率则可高达38.0%[8]。EGFR和KRAS共突变可能影响EGFR-TKI的疗效。有研究表明,在接受EGFR-TKI治疗的NSCLC病
人中,仅有EGFR突变病人的无进展生存期为35个月[12],而EGFR-KRAS共突变病人只有2~3个月[13]。
本文病人的两次基因检测结果显示,EGFR 19Del在奥昔替尼治疗失败后消失,但KRAS G12C仍然存在且丰度增加,表明不同的细胞克隆并存,进一步证实了肉瘤样癌细胞的异质性。研究表明,与接受帕博利珠单抗治疗的KRAS野生型PSC病人相比,KRAS突变型PSC病人的无进展生存期更长[14],KRAS和p53突变可增强免疫治疗的效果。本研究采用mIHC技术评估了病人肿瘤微环境状态,这种检测方法根据肿瘤细胞PD-L1+和T细胞CD4、CD8表达情况将肿瘤微环境分为Ⅰ~Ⅳ型。其中,Ⅱ型肿瘤病人最可能从免疫检查点的药物治疗中获益,其次为Ⅳ型,Ⅰ型最差。mIHC检测结果显示,本文病人为Ⅳ型,提示该病人有可能从免疫检查点抑制剂治疗中获益。然而,PD-L1表达阳性且CD8+T细胞密度较高的病人通常从PD-L1/PD1单抗治疗中获益更大。本文病人在一线治疗后肿瘤细胞PD-L1阳性表达率和CD8+T细胞浸润密度降低,这可能与一线放疗、化疗和免疫治疗引起的肿瘤微环境改变和肿瘤异质性有关。研究表明,贝伐单抗可以改善肿瘤微环境,提高PD-L1/PD1单抗的治疗效果[15]。因此,本研究选择了两种药物联合用于该病人的三线治疗,取得了明显的疗效。
本文病人在三线治疗再次进展后被纳入临床研究,接受MRTX849治疗。该药是一种KRAS G12C抑制剂,于2022年12月首次在美国获批,用于治疗KRAS G12C突变且接受过≥1次全身治疗的局部晚期或转移性成人NSCLC[16]。MRTX849治疗对本文中接受过三线治疗和多种药物治疗的病人疗效显著。然而,迄今为止,对于EGFR和KRAS共突变的病人,目前尚不清楚EGFR-TKI和KRAS抑制剂是应该联合使用还是序贯应用。
综上所述,PSC具有显著的异质性,个体化精准治疗对PSC的治疗非常重要。同时,需要对PSC进行更全面的评估,除了常规的PD-L1检测,基因检测和肿瘤免疫微环境评估同样重要。mIHC等新技术的应用还需要深入研究。
[参考文献]
[1]YENDAMURI S, CATY L, PINE M, et al. Outcomes of sarcomatoid carcinoma of the lung: a Surveillance, Epidemiology, and End Results database analysis[J]. Surgery, 2012,152(3):397-402.
[2]LI X, WU D, LIU H Y, et al. Pulmonary sarcomatoid carcinoma: progress, treatment and expectations[J]. Therapeutic Advances in Medical Oncology, 2020,12:1758835920950207.
[3]LEE J Y, CHOI Y, JUNG H A, et al. Outstanding clinical efficacy of PD-1/PD-L1 inhibitors for pulmonary pleomorphic carcinoma[J]. European Journal of Cancer, 2020,132:150-158.
[4]QIAN X Y, WANG Y, LIU F R, et al. The efficacy and safety analysis of first-line immune checkpoint inhibitors in pulmonary sarcomatoid carcinoma[J]. Frontiers in Immunology, 2022,13:956982.
[5]XU L, TAO N N, LIANG B, et al. Use of PD-1 inhibitor tislelizumab in the treatment of advanced pulmonary sarcomatoid carcinoma: a case report[J]. Thoracic Cancer, 2022,13(3):502-505.
[6]SCHROCK A B, LI S D, FRAMPTON G M, et al. Pulmonary sarcomatoid carcinomas commonly harbor either potentially targetable genomic alterations or high tumor mutational burden as observed by comprehensive genomic profiling[J]. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer, 2017,12(6):932-942.
[7]WANG X M, CAO J, DU W J, et al. Response to gefitinib/crizotinib combination in a pulmonary sarcomatoid carcinoma patient harboring concurrent EGFR mutation and MET amplification[J]. Clinical Case Reports, 2021,9(7):e04487.
[8]ITALIANO A, CORTOT A B, ILIE M, et al. EGFR and KRAS status of primary sarcomatoid carcinomas of the lung: implications for anti-EGFR treatment of a rare lung malignancy[J]. International Journal of Cancer, 2009,125(10):2479-2482.
[9]VENISSAC N, POP D, LASSALLE S, et al. Sarcomatoid lung cancer (spindle/giant cells):an aggressive disease? [J]. The Journal of Thoracic and Cardiovascular Surgery, 2007,134(3):619-623.
[10]PIAO M N, MA X T, TANKERE P, et al. Anlotinib combined with chemotherapy and immunotherapy for advanced pulmonary sarcomatoid cancer: a case report and literature review[J]. Annals of Translational Medicine, 2022,10(18):1030.
[11]LIANG X H, CHENG Y N, YUAN Z J, et al. Clinical, pa-
thological and treatment factors associated with the survival of patients with pulmonary sarcomatoid carcinoma[J]. Oncology Letters, 2020,19(6):4031-4039.
[12]TAMURA Y, FUJIWARA Y, YAMAMOTO N, et al. Retrospective analysis of the efficacy of chemotherapy and molecular targeted therapy for advanced pulmonary pleomorphic carcinoma[J]. BMC Research Notes, 2015,8:800.
[13]FU Y L, WANG A Q, ZHOU J Q, et al. Advanced NSCLC patients with EGFR T790M harboring TP53 R273C or KRAS G12V cannot benefit from osimertinib based on a clinical multicentre study by tissue and liquid biopsy[J]. Frontiers in Oncology, 2021,11:621992.
[14]DONG Z Y, ZHONG W Z, ZHANG X C, et al. Potential predictive value of TP53 and KRAS mutation status for response to PD-1 blockade immunotherapy in lung adenocarcinoma[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2017,23(12):3012-3024.
[15]QUAIL D F, JOYCE J A. Microenvironmental regulation of tumor progression and metastasis[J]. Nature Medicine, 2013,19(11):1423-1437.
[16]DHILLON S. Adagrasib: first approval[J]. Drugs, 2023,83(3):275-285.
(本文编辑牛兆山)

