p53基因突变对胶质母细胞瘤细胞Connexin 45蛋白表达影响
[摘要]目的探究p53基因突变对胶质母细胞瘤细胞连接蛋白45(Connexin 45)表达的影响。方法培养胶质母细胞瘤细胞U87细胞(p53野生型)和U251细胞(p53突变型),用免疫印迹法检测两种细胞P53和Connexin 45蛋白的表达。结果与U87细胞相比,U251细胞中P53蛋白和Connexin 45蛋白的表达均明显降低,差异均有统计学意义(t=6.054、4.199,P<0.05)。结论p53突变可能会引起胶质母细胞瘤细胞Connexin 45蛋白的表达降低。
[关键词]基因,p53;突变;胶质母细胞瘤;细胞;连接蛋白45
[中图分类号]R394.2;R730.264
[文献标志码]A
[文章编号]2096-5532(2024)04-0475-03doi:10.11712/jms.2096-5532.2024.60.049
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.R.20240424.1324.006;2024-04-2514:41:01
Effect of p53 gene mutation on the protein expression of Connexin 45 in glioblastoma cellsLIU Xinran, HUAN Xuejie, DU Xi-xun, CHEN Xi, JIAO Qian, JIANG Hong
(State Key Disciplins: Physiology (Incubation), Department of Physiology, Qing-
dao University, Qingdao 266071, China); [Abstract]ObjectiveTo investigate the effect of p53 gene mutation on the protein expression of Connexin 45 in glioblastoma cells. MethodsGlioblastoma U87 cells (wild-type p53 gene) and U251 cells (mutant p53 gene) were cultured, and then Western blotting was used to measure the protein expression levels of P53 and Connexin 45.ResultsCompared widf8b2a9c11d95f0b1541da0feaaf36e3dbc39a30ecaec66b6713542138c902fcth U87 cells, U251 cells showed significant reductions in the protein expression levels of P53 and Connexin 45 (t=6.054,4.199;P<0.05). ConclusionThe p53 gene mutation may reducethe protein expression level of Connexin 45 in glioblastoma cells.
[Key words]genes, p53; mutation; glioblastoma; cells; Connexin 45
胶质瘤是人颅脑最常见且最具侵袭性的一种原发性肿瘤。近年来随着手术、放疗和化疗等治疗手段不断进步,其治疗效果有所改善,但临床研究显示脑胶质瘤病人确诊后中位生存期仍然只有1年[1]。P53作为一种关键的肿瘤抑制因子,在人类肿瘤中极易发生突变。越来越多的研究证据表明,恶性肿瘤和不良预后常与突变的p53高度相关[2]。缝隙连接是一种由连接蛋白组成的特殊的蛋白质通道,允许离子和小分子在细胞间直接转移,为细胞间直接提供信息交换的通道[3]。研究发现,连接蛋白在非病理性迁移过程中发挥着重要的作用,可以参与癌细胞的迁移和侵袭的调控[4]。其中,连接蛋白45(Connexin 45)是一种缝隙连接蛋白,其编码基因属第二类抑癌基因,RNA印迹显示Connexin 45在许多细胞系中均可表达[5]。既往研究表明,Connexin 45表达异常与多种肿瘤的发生与发展有关[6]。然而,关于p53突变在胶质母细胞瘤中对Connexin 45的调节作用的研究目前尚未有报道。本实验通过检测p53野生型U87细胞与p53突变型U251细胞Connexin 45的表达,旨在研究胶质母细胞瘤细胞p53基因突变对Connexin 45表达的影响。现将结果报告如下。
1材料与方法
1.1实验材料
1.1.1细胞及其来源实验所用人胶质母细胞瘤细胞系U87细胞(p53野生型)和U251细胞(p53突变型),购自中国科学院上海细胞库。
1.1.2主要实验试剂DMEM高糖培养液(以色列BI公司),胎牛血清(美国Gibco公司),青霉素-链霉素混合液(100×,北京索莱宝科技有限公司),P53和Connexin 45抗体(美国Santa Cruz Biotech-nology),GAPDH抗体和羊抗兔IgG-HRP(武汉爱博泰克(ABclonal)生物科技有限公司)。
1.2实验方法
1.2.1细胞培养将U87细胞和U251细胞进行常规复苏后,加入高糖DMEM培养液(含体积分数0.01青霉素-链霉素合剂和体积分数0.10胎牛血清)并置于二氧化碳无菌培养箱中培养。待细胞达到80%~90%融合时,使用PBS清洗细胞加入胰蛋白酶消化后收集于15 mL离心管中,以1 000 r/min离心5 min。用吸管将上清吸除,向离心管中加入新的完全培养液,用吸管轻轻吹打成均匀的单细胞悬液,接种于新的T25培养瓶中培养。
1.2.2免疫印迹法检测P53和Connexin 45蛋白表达取处于对数生长期U87和U251细胞接种于6孔板,培养24 h后用PBS洗涤,加入含有10 g/L磷酸酶抑制剂和20 g/L蛋白酶抑制剂的RIPA裂解液。冰上充分裂解20 min,提取总蛋白,蛋白变性后进行SDS-PAGE凝胶电泳。上样后首先进行恒电压80 V电泳30 min,然后采用120 V电压电泳1 h,恒电流300 mA转膜90 min。将目的蛋白转移至PVDF膜后,以100 g/L的脱脂奶粉室温封闭90 min。根据所需的目的蛋白分子量对PVDF膜进行剪裁,加入GAPDH(1∶10 000)、P53和Connexin 45(1∶1 000)一抗于4 ℃摇床过夜。次日,孵育完成后,用TBST摇洗3次,每次10 min。加入辣根过氧化物酶(HRP)耦联的山羊抗兔IgG二抗(1∶10 000)室温孵育1 h。最后加入ECL超敏发光液(将其试剂盒中的A液与B液1∶1混合)孵育30 s,采用化学发光成像系统扫描密度测定法进行分析。使用Image J软件分析GAPDH以及P53、Connexin 45的条带灰度值。
1.3统计学方法
应用Prism Graph Pad 9.0软件进行统计学处理。计量资料数据以±s表示,两组均数比较采用两独立样本t检验。以P<0.05为差异具有统计学意义。
2结果
2.1U87与U251细胞P53蛋白表达比较
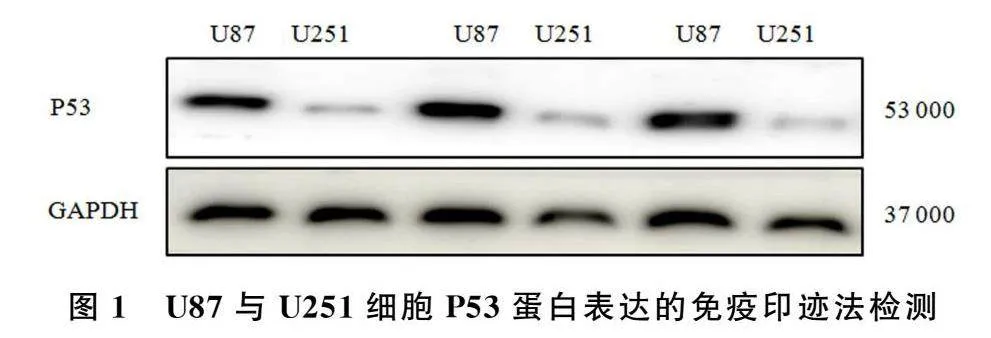
免疫印迹检测的结果显示,P53蛋白在U87和U251细胞的相对表达量分别为1.067±0.115和0.301±0.053(n=6)。与U87细胞相比较,P53蛋白在U251细胞中的表达显著降低,差异具有统计学意义(t=6.054,P<0.001)。见图1。
2.2U87与U251细胞Connexin 45蛋白表达比较
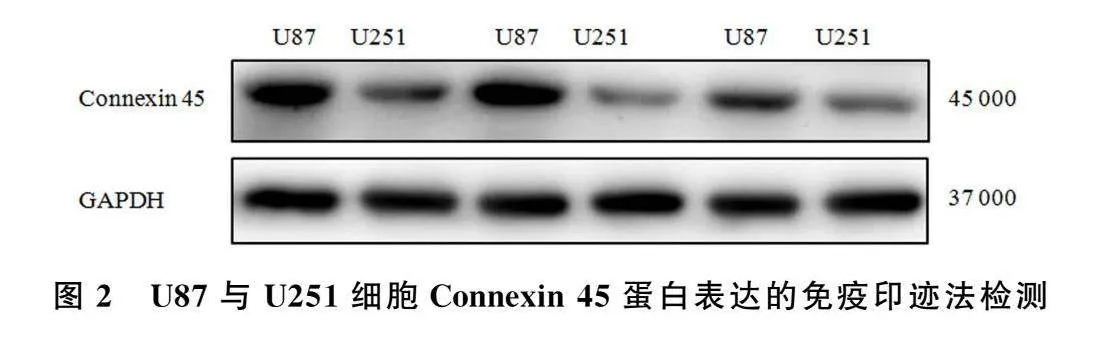
免疫印迹检测结果表明,Connexin 45蛋白在U87和U251细胞的相对表达量分别为0.842±0.079和0.405±0.068(n=6)。与U87细胞相比较,Connexin 45蛋白在U251细胞的表达显著降低,差异具有统计学意义(t=4.199,P<0.01)。见图2。
3讨论
成年人中最常见的恶性原发性颅脑肿瘤为胶质瘤。其中,胶质母细胞瘤是最易复发的恶性实体肿瘤之一,约占所有胶质瘤的57%,约占原发性中枢神经系统恶性肿瘤的48%,且病人中位生存期不足2年[7]。P53是一种肿瘤抑制因子,在应激时被激活,通过诱导细胞周期停滞和凋亡来阻止受损细胞的增殖和维持基因组的稳定性。P53通路的变化被认为是导致低级别胶质瘤发展为高级别胶质瘤的关键因素,在继发性胶质母细胞瘤中观察到p53的突变显著增加[8]。p53基因突变与许多癌症有关,在肿瘤细胞中,p53基因的突变最常发生在其DNA结合域的第102~292位氨基酸残基之间,其中约10%为功能丧失突变,造成P53蛋白的功能丧失及改变[9]。U251细胞存在p53基因的错义点突变,其突变位点为R273H,造成P53蛋白含量明显降低[10]。有研究发现,p53突变的细胞可以诱导致癌小分子RNA的表达,引起高尔基体的囊泡形成,增强囊泡的运输和分泌,从而促进肿瘤转移[11]。此外,p53突变可以增强癌细胞的Warburg效应,增强癌细胞的增殖能力[12]。
缝隙连接具有调节细胞的增殖与分化,维持组织稳态的生理功能。连接蛋白在肿瘤的发生、生长和转移中发挥重要作用。研究已发现,在胶质瘤细胞中,通过改变连接蛋白的表达,显著增强了胶质瘤
细胞的侵袭性[13]。有研究表明,Connexin 45在原发性结直肠癌组织高度甲基化,而在正常结直肠黏膜中则未甲基化,这表明Connexin 45表达的降低或缺失可能发生在肿瘤早期阶段,参与了肿瘤的发生发展[14]。研究显示,在高葡萄糖刺激下,Conne-
xin 45可显著促进肝癌细胞的增殖[15]。此外,有研究显示连接蛋白表达的下调可通过P53依赖的途径促进肿瘤细胞增殖与转移[16]。既往研究发现,U251细胞比U87细胞具有更强的侵袭能力[17]。还有研究显示,在胰腺癌细胞中,突变的P53蛋白通过与P62蛋白相互作用,加速细胞连接蛋白的降解,从而增加癌细胞转移扩散的概率[18]。此外,在非小细胞肺癌中,低氧激活MDM2-P53通路,刺激连接蛋白泛素化,诱导肿瘤细胞增殖与转移[19]。因此,我们猜测在胶质母细胞瘤细胞中,P53通过改变Connexin 45的表达可能会成为胶质母细胞瘤侵袭过程中一个至关重要的因素。本文的实验结果表明,U251细胞中Connexin 45的表达水平显著低于U87细胞,表明胶质母细胞瘤细胞中Connexin 45蛋白的表达降低可能与p53突变有关。因此,阐明突变的p53对Connexin 45表达的调节作用以及促进胶质瘤发展的机制,对靶向胶质瘤提供新的治疗思路具有重要意义。
[参考文献]
[1]CHAI C, SONG L J, HAN S Y, et al. MicroRNA-21 promotes glioma cell proliferation and inhibits senescence and apo-
ptosis by targeting SPRY1 via the PTEN/PI3K/AKT signaling pathway[J]. CNS Neuroscience & Therapeutics, 2018,24(5):369-380.
[2]MANTOVANI F, COLLAVIN L, DEL SAL G. Mutant p53 as a guardian of the cancer cell[J]. Cell Death and Differentiation, 2019,26(2):199-212.
[3]ZHOU M M, ZHENG M Y, ZHOU X Y, et al. The roles of connexins and gap junctions in the progression of cancer[J]. Cell Communication and Signaling, 2023,21(1):8.
[4]DEFAMIE N, CHEPIED A, MESNIL M. Connexins, gap junctions and tissue invasion[J]. FEBS Letters, 2014,588(8):1331-1338.
[5]CHOI E J, PALACIOS-PRADO N, SAEZ J C, et al. Identification of Cx45 as a major component of GJs in HeLa cells[J]. Biomolecules, 2020,10(10):1389.
[6]ZUZUL M, LOZIC M, FILIPOVIC N, et al. The expression of connexin 37, 40, 43, 45 and pannexin 1 in the early human retina and choroid development and tumorigenesis[J]. International Journal of Molecular Sciences, 2022,23(11):5918.
[7]WELLER M, RHUN E L. How did lomustine become standard of care in recurrent glioblastoma?[J]. Cancer Treatment Reviews, 2020,87:102029.
[8]PRATT D, ABDULLAEV Z, PAPANICOLAU-SENGOS A, et al. High-grade glioma with pleomorphic and pseudopapillary features (HPAP): a proposed type of circumscribed glioma in adults harboring frequent TP53 mutations and recurrent monosomy 13[J]. Acta Neuropathologica, 2022,143(3):403-414.
[9]BAUGH E H, KE H, LEVINE A J, et al. Why are there hotspot mutations in the TP53 gene in human cancers?[J]. Cell Death and Differentiation, 2018,25(1):154-160.
[10]BRAZDOVAM, QUANTE, TOGEL L, et al. Modulation of gene expression in U251 glioblastoma cells by binding of mutant p53 R273H to intronic and intergenic sequences[J]. Nucleic Acids Research, 2009,37(5):1486-1500.
[11]CAPACI V, BASCETTA L, FANTUZ M, et al. Mutant p53 induces Golgi tubulo-vesiculation driving a prometastatic secretome[J]. Nature Communications, 2020,11(1):3945.
[12]ZHANG C, LIU J, LIANG Y J, et al. Tumour-associated mutant p53 drives the Warburg effect[J]. Nature Communications, 2013,4:2935.
[13]HONG X T, SIN W C, HARRIS A L, et al. Gap junctions modulate glioma invasion by direct transfer of microRNA[J]. Oncotarget, 2015,6(17):15566-15577.
[14]AHMED D, LOTHE R A, RIVEDAL E, et al. Quantitative validation of GJC1 promoter hypermethylation in benign and malignant colorectal tumors[J]. Endocrine-Related Cancer, 2011,18(6):C31-C34.
[15]CHEN Y, LIU R, CHU Z X, et al. High glucose stimulates proliferative capacity of liver cancer cells possibly via O-GlcNAcylation-dependent transcriptional regulation of GJC1[J]. Journal of Cellular Physiology, 2018,234(1):606-618.
[16]LEROY K, SILVA COSTA C J, PIETERS A, et al. Expression and functionality of connexin-based channels in human li-
ver cancer cell lines[J]. International Journal of Molecular Sciences, 2021,22(22):12187.
[17]XIE C, LU D J, XU M, et al. Knockdown of RAD18 inhibits glioblastoma development[J]. Journal of Cellular Physiology, 2019,234(11):21100-21112.
[18]MUKHERJEE S, MADDALENA M, LUY Q, et al. Cross-talk between mutant p53 and p62/SQSTM1 augments cancer cell migration by promoting the degradation of cell adhesion proteins[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022,119(17):e2119644119.
[19]ZENG S G, LIN X, LIU J C, et al. Hypoxia-induced internalization of connexin 26 and connexin43 in pulmonary epithelial cells is involved in the occurrence of non-small cell lung cancer via the P53/MDM2 signaling pathway[J]. International Journal of Oncology, 2019,55(4):845-859.
(本文编辑于国艺)

