肝癌腹腔镜根治术后PCIA并胸椎旁神经阻滞的效果

[摘要]目的探讨肝癌腹腔镜根治术后静脉自控镇痛(PCIA)并胸椎旁神经阻滞的效果。
方法选取2021年3月—2023年2月河北省沧州中西医结合医院行腹腔镜肝癌根治术治疗的84例病人,随机分为观察组与对照组,每组42例。对照组采用常规阿片类药物静脉镇痛,观察组采用PCIA并胸椎旁神经阻滞镇痛。比较两组术后疼痛程度、Ramsay镇静评分、炎症因子、肝功能及不良反应等指标。
结果观察组术后12、24、72 h静息状态下疼痛评分及Ramsay镇静评分均显著低于对照组(F=2.930~13.850,P<0.05)。观察组术后72 h肿瘤坏死因子-α、白细胞介素-6和降钙素原水平均显著低于对照组(F=6.139~8.961,P<0.05)。观察组术后72 h谷草转氨酶、总胆红素和谷丙转氨酶水平均显著低于对照组(F=3.845~5.216,P<0.05)。观察组不良反应总发生率(7.14%)虽低于对照组(14.29%),但两组差异无统计学意义(χ2=1.120,P>0.05)。
结论肝癌腹腔镜根治术后应用PCIA并胸椎旁神经阻滞能显著提升镇痛和镇静效果,减轻炎症反应,降低肝功能损伤,值得临床推广应用。
[关键词]镇痛,病人控制;神经传导阻滞;癌,肝细胞;腹腔镜检查;肝功能试验;治疗结果
[中图分类号]R459.9;R614.4
[文献标志码]A
[文章编号]2096-5532(2024)04-0565-05doi:10.11712/jms.2096-5532.2024.60.112
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.r.20240829.1805.012;2024-09-0211:39:15
Efficacy of patient-controlled intravenous analgesia combined with thoracic paravertebral nerve block after laparoscopic radical resection for liver cancer
WANG Xiaodong, ZHOU Yi, JIN Tao, WANG Jianhua, LAN Jishan, QI Shaoxia
(Department of 1 Anes-
thesia, Cangzhou Hospital of Integrated Traditional Chinese and Western Medicine, Hebei Province, Cangzhou 061000, China)
; [Abstract]ObjectiveTo investigate the efficacy of patient-controlled intravenous analgesia (PCIA) combined with thoracic paravertebral nerve block after laparoscopic radical resection for liver cancer.
MethodsA total of 84 patients who underwent laparoscopic radical resection for liver cancer in Cangzhou Integrated Traditional Chinese and Western Medical Hospital from March 2021 to February 2023 were enrolled and randomly divided into observation group and control group, with 42 patients in each group. The patients in the control group received routine intravenous opioid analgesia, while those in the observation group received PCIA combined with thoracic paravertebral nerve block. The two groups were compared in terms of postoperative pain, Ramsay sedation score, inflammatory factors, liver function, and adverse reactions.
ResultsCompared with the control group, the observation group had significantly lower pain score and Ramsay sedation score at rest at 12,24, and 72 hours after surgery (F=2.930-13.850,P<0.05). Compared with the control group at 72 hours after surgery, the observation group had significantly lower levels of tumor necrosis factor-α, interleukin-6, and procalcitonin than the control group (F=6.139-8.961,P<0.05), as well as significantly lower levels of aspartate aminotransferase, total bilirubin, and alanine aminotransferase (F=3.845-5.216,P<0.05). Although the observation group had a lower overall incidence rate of adverse reactions than the control group, there was no significant difference between the two groups (7.14% vs 14.29%,χ2=1.120,P>0.05).
ConclusionPCIA combined with thoracic paravertebral nerve block after laparoscopic radical resection for liver cancer can significantly improve analgesic and sedative effects, alleviate inflammatory response, and mitigate liver impairment, and therefore, it holds promise for clinical application.
[Key words]analgesia, patient control; nerve conduction block; cancer, hepatocyte; laparoscopy; liver function test; treatment outcome
原发性肝癌是全球病死率较高的恶性肿瘤之一,虽然临床肝癌筛查和诊治技术有了很大进步,但其发病率与死亡率仍呈逐年上涨趋势,严重威胁公民生命健康[1]。手术切除是肝癌主要治疗方式,尤其是根治性切除术,可有效阻滞癌症进展,延长病人生存期。但该术式复杂,术中腹腔组织与脏器暴露较多,应激反应重且创伤大,术后疼痛严重,影响机体免疫功能,增加肺不张、呼吸道感染等并发症发生风险,不利于病人康复[2-3]。传统的术后自控静脉镇痛(PCIA)已在临床广泛应用,多采用阿片类镇痛药物,虽镇痛效果明确,但术后呕吐、呼吸抑制等不良反应发生率较高,临床效果不够理想[4-6]。研究显示,胸椎旁神经阻滞在胸腹部及盆腔手术中镇痛效果良好[7]。本研究探讨肝癌腹腔镜根治术后PCIA并胸椎旁神经阻滞的效果,旨在为肝癌手术病人镇痛方案的选择提供参考。现将结果报告如下。
1资料与方法
1.1对象选择
根据纳入和排除标准,选取2021年3月—2023年2月在河北省沧州中西医结合医院行腹腔镜肝癌根治术治疗的84例病人为研究对象。随机分为观察组与对照组,每组42例。观察组中男性34例,女性8例;年龄为45.0~67.0岁,平均(56.8±6.4)岁。美国麻醉师协会(ASA)分级:Ⅰ级17例,Ⅱ级25例;肝功能Child-Pugh分级:A级26例,B级16例;巴塞罗那临床肝癌分期(BCLC):A期23例,B期19例。体质量指数(BMI)为20.0~25.0 kg/m2,平均(22.2±1.6)kg/m2。对照组中男性35例,女性7例;年龄为44.0~69.0岁,平均(57.4±6.4)岁。ASA分级:Ⅰ级18例,Ⅱ级24例;Child-Pugh分级:A级25例,B级17例;BCLC肝癌分期:A期26例,B期16例。BMI为20.0~25.0 kg/m2,平均为(22.2±1.5)kg/m2。两组一般资料相关指标比较,差异均无统计学意义(P>0.05)。本研究获得医院伦理委员会批准。
纳入标准:①符合《原发性肝癌规范化病理诊断指南》[8]中肝癌诊断标准,且经病理学、影像学等检查证实;②具有腹腔镜肝癌根治术适应证;③年龄大于18周岁;④术前未接受放疗、化疗等辅助治疗;⑤术前肝功能Child-Pugh分级评估为A级或B级;⑥BCLC分期为A期或B期;⑦临床相关资料均完整。排除标准:①合并除肝癌外其他恶性肿瘤,如胃癌、食管癌等;②合并除肝脏外其他器官功能障碍,如心、肾等;③存在淋巴结转移、远处转移;④合并造血功能异常;⑤对本研究使用药物过敏;⑥既往有消化道溃疡及肝性脑病;⑦长期应用阿片类止痛药物;⑧合并精神疾病及视力、听力、语言障碍;⑨妊娠及哺乳期女性;⑩长期服用免疫制剂药物和具有中枢神经系统疾病。
1.2治疗方法
两组均接受腹腔镜肝癌根治术,术前8 h病人不得进食饮水,进入手术室后行血压、心率、呼吸频率和心电图等常规生命体征监测。
两组病人入手术室后均给予静脉推注0.5 μg/kg舒芬太尼、1.5 mg/kg丙泊酚及1.0 mg/kg罗库溴铵进行诱导麻醉,并行气管插管机械通气。术中给予1.3 μg/kg七氟醚及0.1~0.3 μg/(kg·min)瑞芬太尼进行维持麻醉,并间断静脉推注罗库溴铵0.2 mg/kg以维持镇痛和肌肉松弛,可根据病人具体情况适当调节剂量。观察组病人取侧卧位,麻醉诱导前进行胸椎旁神经阻滞,连接神经刺激器。常规消毒铺巾后,在神经刺激器引导下从T4~T7棘突方向进行穿刺,以术侧旁移2.5 cm作为穿刺点,当穿刺针触及横突并有阻力感时,移动穿刺针进针方向沿椎板外缘或向外移,并调节穿刺针穿刺角度使其跨过横突。在穿刺过程中要时刻关注肋间肌肉的运动情况。回吸无血、无气、无脑脊液后,即可注射5 g/L的盐酸罗哌卡因5 mL,所有病人均成功阻滞。对照组在麻醉诱导前不采取任何措施。手术完成后,两组病人均以芬太尼15 μg/kg(用生理盐水稀释至120 mL)进行PCIA,设置背景输注流量为1 mL/h,时间设定为20 min,负荷量为2 mL,单次自控量为2 mL,持续注射流量为25 mL/h。术后病人根据疼痛视觉模拟量表(VAS)[9]评分调节PCIA泵的设置参数。
1.3观察指标
1.3.1疼痛及Ramsay镇静评分两组病人分别于术后12、24、72 h进行疼痛及Ramsay镇静评分。疼痛评分(静息状态下)采用VAS评估,总分为0~10分,分值越高表示疼痛程度越严重。Ramsay镇静评分方法[10](总分为6分)如下。1分:病人清醒,表现为不安静、焦虑;2分:病人清醒,能配合医护人员工作,定向力良好,安静;3分:病人清醒,但仅对医护人员指令有反应;4分:病人处于睡眠状态,在用强声刺激机轻叩眉间时,反应敏感;5分:病人处于睡眠状态,在用强声刺激机轻叩眉间时,反应迟钝;6分:病人处于睡眠状态,在用强声刺激机轻叩眉间时,无任何反应。
1.3.2炎症因子水平及肝功能检测两组病人分别于术前、术后72 h采集空腹静脉血3~5 mL,以3 000 r/min(离心机半径 10 cm)离心10 min后取上清液。利用酶联免疫吸附试验分别测定肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和降钙素原(PCT)等炎症因子含量,检测试剂盒购于上海将来实业股份有限公司。使用美国BECKMAN CX8型
全自动生化分析仪分别检测病人血清谷草转氨酶(AST)、总胆红素(TBIL)和谷丙转氨酶(ALT)等肝功能指标,具体操作严格按照仪器和试剂盒说明书进行。
1.3.3不良反应记录两组病人术后呕吐、恶心、嗜睡和躁动等不良反应的发生例数。
1.4统计学方法
采用SPSS 24.0软件进行统计学分析。计量资料数据以±s表示,组间均数比较采用重复测量方差分析,组内两两比较采用 SNK-q 检验。计数资料数据以例数和百分数表示,组间比较采用χ2检验。以 P<0.05 为差异有统计学意义。
2结果
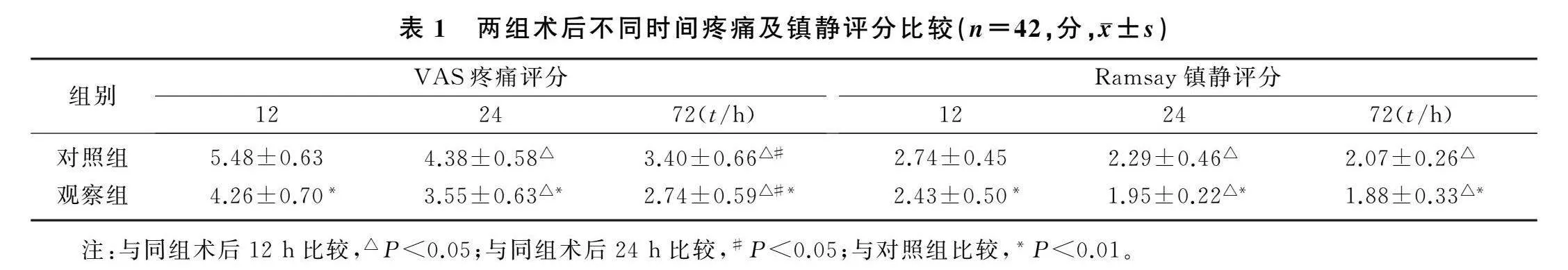
2.1两组疼痛及Ramsay镇静评分比较
重复测量方差分析结果显示,两组病人VAS疼痛评分及Ramsay镇静评分的组别、时间及其交互效应均显著(F组别=22.799、28.321,F时间=6.488、9.809,F交/IE4H1hXfCH3Fiw2ezklOe4roCAgP+wLqBzTnZGko6k=互=1.588、2.665,P<0.05)。与术后12 h相比,两组术后24、72 h静息状态下VAS疼痛评分及Ramsay镇静评分均降低(F=2.836~3.711,P<0.05),且观察组术后12、24、72 h静息状态下VAS疼痛评分及Ramsay镇静评分均显著低于对照组(F=2.930~13.850,P<0.05)。提示联合应用胸椎旁神经阻滞能够提高病人术后镇痛和镇静效果。见表1。
2.2两组术前和术后炎症因子水平比较
重复测量方差分析结果显示,两组病人炎症因子指标TNF-α、IL-6和PCT的组别、时间及其交互效应均显著(F组别=17.364~18.847,F时间=7.824~11.837,F交互=3.283~3.853,P<0.05)。术前两组TNF-α、IL-6和PCT比较差异均无显著意义(P>0.05),术后72 h两组各炎症因子水平均明显升高(F=4.928~5.927,P<0.05),但观察组术后72 h各项炎症因子水平均显著低于对照组(F=6.139~8.961,P<0.05)。提示联合应用胸椎旁神经阻滞有助于降低病人术后的炎症反应。见表2。
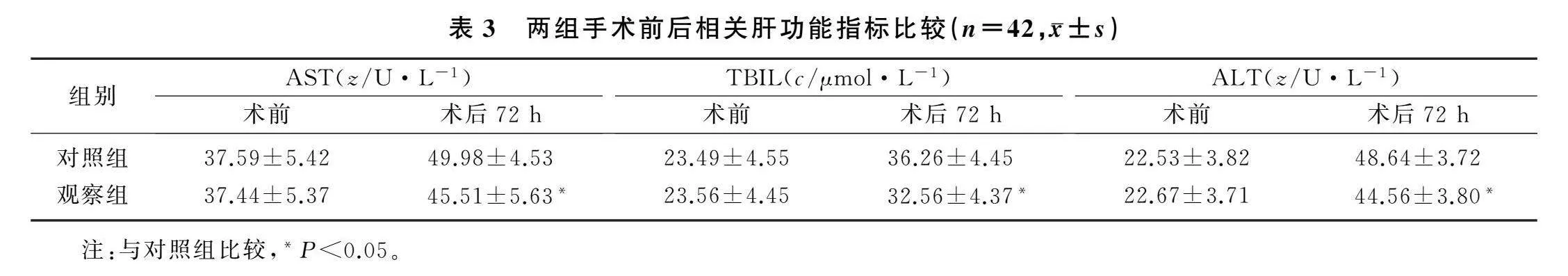
2.3两组术前和术后肝功能指标比较
重复测量方差分析结果显示,两组病人肝功能指标AST、TBIL和ALT的组别、时间及其交互效应均显著(F组别=19.845~21.393,F时间=7.847~10.834,F交互=2.394~3.282,P<0.05)。术前两组病人AST、TBIL和ALT等肝功能指标比较差异均无显著意义(P>0.05),术后72 h两组病人各肝功能指标均显著升高(F=3.973~4.928,P<0.05),但观察组术后72 h各项肝功能指标均显著低于对照组(F=3.845~5.216,P<0.05)。提示联合应用胸椎旁神经阻滞可以明显减轻病人术后肝功能损伤。见表3。
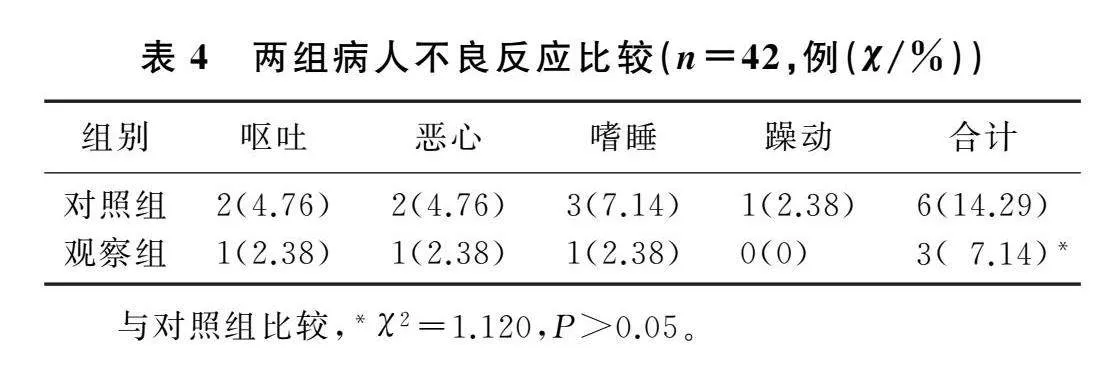
2.4两组不良反应比较
观察组不良反应总发生率为7.14%,虽然低于对照组的14.29%,但两组比较差异无统计学意义(χ2=1.120,P>0.05)。提示联合应用胸椎旁神经阻滞并没有增加病人术后的不良反应。见表4。
3讨论
肝癌仍然是全球性的健康挑战,预计2025年全球患病者将高达100万例,由于其早期症状不明显,易漏诊误诊,因此多数病人在疾病诊断时已处于中晚期,预后较差[11-12]。腹腔镜肝癌根治术已成为临床治疗该病的重要方法,但术后严重疼痛影响着病人的生活质量。已有研究显示,术后疼痛会促进机体活性物质、内源性递质释放,诱发神经内分泌功能紊乱,导致机体处于高代谢状态,抑制免疫功能,升高术后感染甚至脓毒症等并发症发生风险[13]。同时,术后疼痛可以诱导残余肿瘤细胞生长发育,间接影响肿瘤复发及转移[14]。另外,术后疼痛通过影响机体内环境及代谢,还可以导致早期肝功能恢复受阻[15]。因此,术后疼痛对病人早期康复及预后具有重要影响,完善肝癌根治术后镇痛处理是围术期的重要环节之一。
本研究结果显示,观察组术后12、24、72 h静息状态下VAS疼痛评分及Ramsay镇静评分均显著低于对照组,这与文献报道一致[16-17]。阿片类药物是PCIA的经典药物,虽然镇痛效果确切,但不良反应发生风险较高,可进一步增加病人机体的应激反应[18]。本研究观察组采取PCIA联合胸椎旁神经阻滞镇痛,胸椎旁神经阻滞仅需对单个间隙的阻滞操作即可对多条脊神经产生阻滞效果,具有操作次数少、对病人损伤小双赢的优势[19]。椎旁神经阻滞能实时对穿针进行观察,药物可精确有效地注入椎旁间隙,发挥抑制疼痛应激的作用[20]。罗哌卡因属于酰胺类长效局麻药,可有效阻断神经系统的兴奋传导,且低浓度不会对运动神经产生抑制,不会影响运动功能,利于病人及早进行床下运动,促进临床康复[21]。此外,联合椎旁神经阻滞能减少阿片类药物的用量,可以明显降低恶心、呕吐等不良反应[22]。本研究结果显示,与术后12 h相比,两组术后24、72 h静息状态下VAS疼痛评分及Ramsay镇静评分均显著降低,且观察组术后12、24和72 h的评分
均显著低于对照组,说明椎旁神经阻滞能有效缓解
腹腔镜肝癌根治术病人术后的早期疼痛。
本研究结果还显示,尽管两组术后72 h相关炎症因子(TNF-α、IL-6和PCT)及肝功能指标(AST、TBIL和ALT)均显著升高,但观察组的各指标均显著低于对照组,这与既往相关研究报道结果基本相符[23-24]。TNF-α、IL-6和PCT均与炎症反应有关,当机体发生损伤、感染等炎症反应时其水平会明显升高,可以反映机体的炎症反应程度[25-26]。AST、TBIL和ALT是肝功能重要的血清指标,AST和ALT与肝细胞完整性有关,当肝细胞完整性受损时其水平升高,而肝脏排泄及分泌功能受损时血清TBIL出现升高[27-28]。肝癌根治术切除部分肝脏组织,本身对机体而言会升高炎症反应,损害肝功能。若肝癌根治术后疼痛控制欠佳,易进一步引起应激反应,导致代谢产物、炎症因子释放,诱发肝组织出现水肿及缺血低氧,不利于肝组织清除有害物质及自我修复,降低肝功能。同时,多数肝癌病人合并肝储备功能受损及肝硬化,肝细胞再生能力显著降低,术后剧烈的疼痛会激活下丘脑-垂体-肾上腺素皮质轴,导致机体处于高代谢状态,造成较多有害产物积聚于肝脏,这不仅加重炎症因子释放、创面组织水肿及局部炎症反应,还能升高胰岛素抵抗,影响酶及内源性激素系统代谢,进而影响肝细胞能量代谢及其功能[29-30]。PCIA联合胸椎旁神经阻滞可有效提升镇痛效果,降低病人术后疼痛应激,因此在减轻炎症反应、降低肝功能损伤方面的作用更显著。本研究两组术后不良反应发生率的结果显示,观察组不良反应总发生率(7.14%)虽然比对照组(14.29%)低,但两组比较差异无统计学意义。其原因可能与本研究样本量较小有关,今后需扩大研究样本量,完善相关资料,对此进行进一步探讨。
综上所述,肝癌腹腔镜根治术后应用PCIA联合胸椎旁神经阻滞能显著提升镇痛和镇静效果,减轻炎症反应,降低肝功能损伤,值得临床推广应用。
[参考文献]
[1]《中华肝脏病杂志》编辑委员会,中华医学会肝病学分会肝癌学组. 肝细胞癌癌前病变的诊断和治疗多学科专家共识(2020版)[J]. 临床肝胆病杂志, 2020,6(3):514-518.
[2]雷锦瑞,陈颖力. 罗哌卡因持续切口浸润镇痛对开腹肝癌切除术患者术后镇痛、凝血功能的影响[J]. 血栓与止血学, 2021,7(5):815-817.
[3]温婧,严文婵,彭书崚. 加速康复外科理念下胸段硬膜外镇痛与腹横筋膜阻滞对腹腔镜肝癌根治术患者术后综合效果的影响[J]. 广东医学, 2020,41(11):1112-1117.
[4]YOUNG S R, DUBY J J, LOUIE E L, et al. Impact of multimodal analgesia in critically ill burn patients[J]. Journal of Burn Care & Research: Official Publication of the American Burn Association, 2021,42(5):986-990.
[5]EMONS M I, MARING M, STAMER U M, et al. Safety and monitoring of patient-controlled intravenous analgesia: Clinical practice in German hospitals[J]. Der Anaesthesist, 2021,70(6):476-485.
[6]LEE W S, GAO X, TANG J, et al. Postoperative sufentanil intravenous patient-controlled analgesia within the first 24 hours: a retrospective study[J]. Annals of Palliative Medicine, 2020,9(6):3932-3937.
[7]吕帅国,卢锡华,李长生,等. 胸椎旁神经阻滞联合全身麻醉用于腹腔镜根治性肾切除术患者的改良效果[J]. 中华麻醉学杂志, 2020,40(7):817-820.
[8]中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等. 原发性肝癌规范化病理诊断指南(2015年版)[J]. 中华肝胆外科杂志, 2015,21(3):145-151.
[9]王伟民. 视觉模拟评分法(VAS)[J]. 中国微侵袭神经外科杂志, 2004,9(11):483.
[10]陈燕,和优娟,张东东,等. 静脉自控镇痛联合胸椎旁神经阻滞对腹腔镜肝癌根治术患者细胞免疫功能及血清致痛物质水平的影响[J]. 陕西医学杂志, 2022,8(2):186-190.
[11]LLOVET J M, KELLEY R K, VILLANUEVA A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021,7(1):6.
[12]ANWANWAN D, SINGH S K, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2020,1873(1):188314.
[13]任怀敏,王卓英,黄丽霞,等. 硬膜外自控镇痛对剖宫产术后感染和血清内源性神经递质及泌乳素的影响[J]. 中华医院感染学杂志, 2020,30(12):1889-1893.
[14]朱正宁,钱晶. 罗哌卡因复合舒芬太尼用于宫颈癌根治术后镇痛效果及对患者术后免疫功能、肿瘤标志物影响[J]. 中国计划生育学杂志, 2022,8(5):1079-1084.
[15]HIDAKA M, OHYAMA K, HARA T, et al. The feasibility and safety in using acetaminophen with fentanyl for pain control after liver resection with regards to liver function: a prospective single-center pilot study in Japan[J]. Journal of Hepato-Biliary-Pancreatic Sciences, 2021,28(3):297-303.
[16]ZHANG B, LIU D Y. Application of thoracic paravertebral nerve block in video-assisted thoracosopic surgery: a rando-
mized controlled trial[J]. Nan Fang Yi Ke Da Xue Xue Bao=Journal of Southern Medical University, 2016,37(4):460-464.
[17]LIU F, ZHANG J, ZHANG H K, et al. Thoracic paravertebral block in the PACU for immediate postoperative pain relief after video-assisted thoracoscopic surgery[J]. Zhonghua Yi Xue Za Zhi, 2017,97(2):119-122.
[18]ZAYED S, LANG P, MENDEZ L C, et al. Opioid therapy vs. multimodal analgesia in head and neck cancer (OPTIMAL-HN): study protocol for a randomized clinical trial[J]. BMC Palliative Care, 2021,20(1):45.
[19]李辉,徐金东,王庆,等. 超声引导胸椎旁神经阻滞复合丙泊酚在胸腔镜下胸交感神经链切断术中的应用[J]. 实用医学杂志, 2017,33(14):2307-2310.
[20]李水英,张亚,赵卫兵. 胸椎旁神经阻滞对肝脏肿瘤射频消融术患者疼痛和应激反应的影响[J]. 检验医学与临床, 2021,18(6):802-805.
[21]董秋月,陈志良,段亚辉,等. 罗哌卡因复合右美托咪定连续收肌管阻滞对促进膝关节置换快速康复的影响[J]. 河北医药, 2020,42(3):434-436,440.
[22]崔娓,张弛,葛培青,等. 超声引导联合神经刺激仪定位胸椎旁阻滞在肋间神经移位术中的应用[J]. 上海交通大学学报(医学版), 2017,37(1):89-92.
[23]CHEN Y Y K, BODEN K A, SCHREIBER K L. The role of regional anaesthesia and multimodal analgesia in the prevention of chronic postoperative pain: a narrative review[J]. Anaesthesia, 2021,76: 8-17.
[24]马行军,王凤捷,王小锋,等. 胸椎旁神经阻滞联合全身麻醉在胸腔镜肺癌根治术中的应用[J]. 中国医刊, 2022,8(11):1261-1265.
[25]徐璐,苏群豪,王娇,等. IL-6和PCT与Activin-A对急性白血病患者化疗后感染的诊断价值[J]. 中华医院感染学杂志, 2020,30(4):531-535.
[26]陈孝会,谢冰,邱丽霞. 血清miR-155水平与脓毒症患者炎症反应、病情严重程度及短期预后的关系[J]. 标记免疫分析与临床, 2022,8(6):1000-1006.
[27]潘敏,蒋轶岭,夏瑜秦,等. 芬太尼和舒芬太尼对肝癌患者射频消融术后肝功能的影响[J]. 临床麻醉学杂志, 2023,9(1):54-58.
[28]干霞,许涛,杜敏,等. B超引导下肝癌微波消融治疗原发性肝癌的疗效及不良反应[J]. 实用癌症杂志, 2020,35(2):237-240.
[29]何爱梅. 腹横筋膜阻滞对肝癌手术患者术后疼痛及肝肾功能的影响[J]. 医学临床研究, 2021,7(5):709-712,716.
[30]戴云,李富强,卢爱平,等. 罗哌卡因切口浸润联合静脉自控镇痛对肝癌肝切除术患者术后镇痛镇静效果及肝功能的影响[J]. 现代生物医学进展, 2021,21(7):1301-1304.
(本文编辑于国艺)

